人教版高一化学必修一第二章第三节氧化还原反应课件 (共37张PPT)
文档属性
| 名称 | 人教版高一化学必修一第二章第三节氧化还原反应课件 (共37张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 441.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-11-23 15:40:57 | ||
图片预览











文档简介
课件37张PPT。第二章 化学物质及其变化 第三节 氧化还原反应
第一课时
学.科.网zxxkw1、元素化合价的规律:
Na O2 MnO2 SO2 H2SO4 HNO3
KClO3 KMnO4 K2MnO4 H2S H2O2
知识回顾2、原子的核外电子排布规律3、元素化合价的升降与电子得失的关系:元素的一个原子失去几个电子,该元素的化合价就_______几价(填升高或降低)。
元素的一个原子得到几个电子,该元素的化合价就_______几价(填升高或降低)。
练习:Cu Cu2+ , ____(得到或失去) 2个e-
Fe失去2个e-,化合价由______变为_______
CuO中的铜得到2个e-,化合价由____变为___
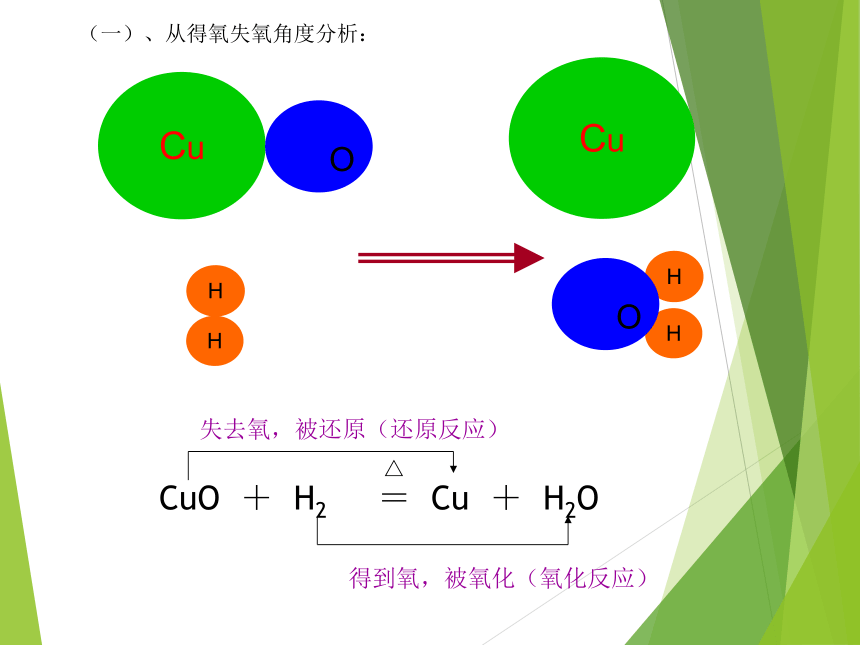
升高降低失去0价+2价0价+2价氧化还原反应得到氧,被氧化(氧化反应)△CuO + H2 = Cu + H2O 失去氧,被还原(还原反应)Cu
OHHCuHH
O(一)、从得氧失氧角度分析:学.科.网从得失氧的角度定义氧化还原反应:
_________________叫氧化反应.
_________________叫还原反应.
物质得到氧的反应物质失去氧的反应讨论:氧化反应和还原反应是独立进行的吗?氧化反应和还原反应是兼于一体的,两者同时存在,同时发生,不可截然分开。氧化反应和还原反应同时发生,这样的反应称为氧化还原反应。zxxkw2CuO + C = 2 Cu + CO2 ↑ CuO + H2 = Cu + H2OΔ高温[思考与交流]以下反应除了包含有得氧失氧的变化之外,还包含有什么变化?H2O + C= H2+ CO高温[结果]还包含有化合价的变化。+200+1化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应)CuO + H2 === Cu + H2O[定义]有元素化合价升降的化学反应称为氧化还原反应。(二)、从化合价升降角度分析:请从化合价升降的角度分析下面这两个反应。上面两个反应虽然没有氧的得失,但从化合价升降的角度可知,它们仍属于氧化还原反应。因此从化合价升降的角度可以将我们学过的化学反应分为两类:有化合价升降的反应和无化合价升降的反应。思考:怎样判断一个反应是否为氧化还原反应依据从化合价升降的角度定义氧化还原反应:
————————————————— 是氧化反应
———————————是还原反应
——————————是氧化还原反应所含元素化合价升高的反应所含元素化合价降低的反应有元素化合价升降的化学反应☆氧化还原反应的特征:元素化合价有升降。小结:氧化还原反应中,化合价有升必有降,且化合价升高总数=化合价降低总数(应用:可以用来判断任一化学反应是否为氧化还原反应。)(特征)
学.科.网[问题]下列反应是否属于氧化还原反应?
2Na+Cl2 === 2NaCl
H2+Cl2 === 2HCl
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
[结论]因为有化合价升降,所以是氧化还原反应。[问题]化合价的升降是什么原因引起的?如何在上述两反应中表达出来?NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+(三)、从电子得失角度分析:学.科.网zxxkw[结论]
本质定义:有电子转移(得失或偏移)的化学反应都是 氧化还原反应。HCl 的形成过程化合价升降的原因:电子的偏移H Cl从电子转移的角度定义氧化还原反应
————————————————— 是氧化反应
———————————是还原反应
—————————— 是氧化还原反应失去电子(或电子对偏离)的反应得到电子(或电子对偏向)的反应(☆)有电子转移(得失或偏移)的反应(本质) 氧化还原反应中,电子转移和化合价升降的关系氧化还原反应◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原
的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
特点:可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的化学反应是氧化还原反应。
特点:揭示氧化还原反应的本质。
小结课堂练习
Ⅰ.分析表格,找出四种基本反应类型与氧化还原反应的关系。[结论] 置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。√×√×√√××学.科.网Ⅱ.下列反应中属于氧化还原反应的是( )
A CaCO3 + 2HCl == CaCl2 + CO2↑ + H2O
B. Na2O + H2O == 2NaOH
C. 2KMnO4 == K2MnO4 + MnO2 + O2↑
D. MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
E. 3Fe + 2O2 == Fe3O4
CuSO4·5H2O == CuSO4 + 5H2O
CDE Ⅲ 、用化合价升降的观点去判断下面的反 应哪些是氧化还原反应?关键: (1)正确判断各反应物、生成物各元素的化合价及其变化;
(2)凡是有化合价升降的化学反应都是氧化还原反应作业课本P38 第4 ,5,6题做在书上
预习下一节课内容,复习第一章及第二章第三节 氧化还原反应
第二课时
[课前小练]判断下列反应属于哪种基本反应类型?是否属于氧化还原反应?1、2 Na +Cl2==2NaCl
2、Fe +CuSO4 ==FeSO4 +Cu
3、2 HgO ==2Hg +O2 ↑
4、CaO +H2O ==CaCO3
6、3 Fe +2O2 ==Fe3O4
7、BaCl2 +H2SO4 ==BaSO4 ↓+2HCl
8、CaCO3 ==CaO +CO2 ↑√√√××√×(四)、氧化剂和还原剂氧化剂: 得到电子(元素化合价降低)的物质,被还原1. 定义说明: (1) 氧化剂和还原剂均是指反应物质,是一种化学试剂, 不是某一种元素。
(2) 氧化剂本身被还原,发生还原反应,得到的产物是还原产 物;
还原剂本身被氧化,发生氧化反应,得到的产物是氧化产物。还原剂: 失去电子(元素化合价升高)的物质,被氧化氧化还原反应中的多组概念 降 低
升 高氧化性
还原性 被还原
被氧化还原
反应
氧化
反应还原产物
氧化产物2. 常见的氧化剂和还原剂氧化剂: O2、Cl2、浓硫酸、HNO3、KMnO4、 FeCl3等还原剂:Al、Zn、Fe、C、H2、CO等3. 氧化性、还原性强弱判断 氧化剂的氧化性 > 氧化产物的氧化性。
还原剂的还原性 > 还原产物的还原性。(1)原子或离子的得电子能力越强,物质氧化性越强一般规律:(2)原子或离子的失电子能力越强,物质还原性越强小结:(1)氧化剂和还原剂分别是不同的物质(2)氧化剂和还原剂都是同一种物质(3)氧化剂和还原剂都是同一种物质,而且被氧化与被还原的元素都是相同价态的同种元素(4)反应物参加反应的总量中仅有一部分为氧化剂,另一部分为反应介质用双线桥应注意的事项: 正确判断各反应物、生成物各元素的化合价及其变化 两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。 电子符号用“e-”来表示 得失电子总数表示:原子个数 × 每个原子得失电子数
注意:反应中失去电子的总数等于得到电子的总数(五)、 氧化还原反应的表示方法1、双线桥法2、单线桥法
单线桥法的线桥从还原剂开始,指向氧化剂,线桥上只标得到电子或失去电子的总数目,不标得或失;它表示电子转移的方向,即箭头的方向就是电子转移的方向。
练习1:用双线桥和单线桥表示下列氧化还原反应,并指出氧化剂和还原剂2. 填空:
(1)Fe→FeCl2 ,需加____剂,例如: 。
(2)CuO→Cu,需加____剂,例如: 。
(3)HCl→Cl2,需加____剂,例如: 。
(4)HCl→H2,需加____剂,例如: 。
(5)Fe3+→Fe,需加____剂,例如: 。①Fe+ H2SO4(稀) = FeSO4 +H2↑
②2KClO3 = 2KCl + 3O2
③Cl2 + 2NaOH = NaCl + NaClO + H2O
④2H2S+SO2 =3S↓+2H2O
(六)、学习氧化还原反应的重要意义 氧化还原反应是一类重要的化学反应。在工农业生产、科学技术和日常生活中都有广泛的应用。例如,食物在人体中被消化,以提供生命活动所需的营养和能量,就离不开氧化还原反应。又如,煤燃烧、酿酒、电镀、金属的冶炼等,也都离不开氧化还原反应。
但是有些氧化还原反应会给人类带来危害,如易燃物的自燃、食物的腐败、钢铁的锈蚀等。我们应该运用化学知识来防止这类氧化还原反应的发生或减慢其进程。拓展训练分析下列氧化还原反应,用双线桥表示电子转移
的方向和数目,并指出氧化剂和还原剂、氧化产
物和还原产物。
(1)KClO3 +6HCl= KCl+3Cl2↑+3H2O
(2)5NH4NO3 4N2↑+2HNO3+9H2O
(3)Cl2+H2O= HCl +HClO KClO3 +6HCl= KCl+3Cl2↑+3H2O
氧化剂:KClO3 还原剂:HCl
氧化产物、还原产物都是Cl2(同种元素的不同价态之间的氧化还原反应,价态的
变化有何规律?)+5-10失5×1e-得1×5e-5NH4NO3 4N2↑+2HNO3+9H2O
氧化剂与还原剂为同种物质:NH4NO3
氧化产物与还原产物为同一种物质:N2(此 氧化还原反应发生在同一种物质中的不同价态元
素之间,称为自身氧化还原反应)-3+50得3×5e-失5×3e-Cl2+H2O= HCl +HClO
氧化剂与还原剂同为Cl2
氧化产物为HClO,还原产物为HCl(此反应电子转移发生在同一物质里同一价态的同一
元素原子上,为自身氧化还原反应的特殊形式,称为
歧化反应)0-1+1失e-得e-
第一课时
学.科.网zxxkw1、元素化合价的规律:
Na O2 MnO2 SO2 H2SO4 HNO3
KClO3 KMnO4 K2MnO4 H2S H2O2
知识回顾2、原子的核外电子排布规律3、元素化合价的升降与电子得失的关系:元素的一个原子失去几个电子,该元素的化合价就_______几价(填升高或降低)。
元素的一个原子得到几个电子,该元素的化合价就_______几价(填升高或降低)。
练习:Cu Cu2+ , ____(得到或失去) 2个e-
Fe失去2个e-,化合价由______变为_______
CuO中的铜得到2个e-,化合价由____变为___
升高降低失去0价+2价0价+2价氧化还原反应得到氧,被氧化(氧化反应)△CuO + H2 = Cu + H2O 失去氧,被还原(还原反应)Cu
OHHCuHH
O(一)、从得氧失氧角度分析:学.科.网从得失氧的角度定义氧化还原反应:
_________________叫氧化反应.
_________________叫还原反应.
物质得到氧的反应物质失去氧的反应讨论:氧化反应和还原反应是独立进行的吗?氧化反应和还原反应是兼于一体的,两者同时存在,同时发生,不可截然分开。氧化反应和还原反应同时发生,这样的反应称为氧化还原反应。zxxkw2CuO + C = 2 Cu + CO2 ↑ CuO + H2 = Cu + H2OΔ高温[思考与交流]以下反应除了包含有得氧失氧的变化之外,还包含有什么变化?H2O + C= H2+ CO高温[结果]还包含有化合价的变化。+200+1化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应)CuO + H2 === Cu + H2O[定义]有元素化合价升降的化学反应称为氧化还原反应。(二)、从化合价升降角度分析:请从化合价升降的角度分析下面这两个反应。上面两个反应虽然没有氧的得失,但从化合价升降的角度可知,它们仍属于氧化还原反应。因此从化合价升降的角度可以将我们学过的化学反应分为两类:有化合价升降的反应和无化合价升降的反应。思考:怎样判断一个反应是否为氧化还原反应依据从化合价升降的角度定义氧化还原反应:
————————————————— 是氧化反应
———————————是还原反应
——————————是氧化还原反应所含元素化合价升高的反应所含元素化合价降低的反应有元素化合价升降的化学反应☆氧化还原反应的特征:元素化合价有升降。小结:氧化还原反应中,化合价有升必有降,且化合价升高总数=化合价降低总数(应用:可以用来判断任一化学反应是否为氧化还原反应。)(特征)
学.科.网[问题]下列反应是否属于氧化还原反应?
2Na+Cl2 === 2NaCl
H2+Cl2 === 2HCl
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
[结论]因为有化合价升降,所以是氧化还原反应。[问题]化合价的升降是什么原因引起的?如何在上述两反应中表达出来?NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+(三)、从电子得失角度分析:学.科.网zxxkw[结论]
本质定义:有电子转移(得失或偏移)的化学反应都是 氧化还原反应。HCl 的形成过程化合价升降的原因:电子的偏移H Cl从电子转移的角度定义氧化还原反应
————————————————— 是氧化反应
———————————是还原反应
—————————— 是氧化还原反应失去电子(或电子对偏离)的反应得到电子(或电子对偏向)的反应(☆)有电子转移(得失或偏移)的反应(本质) 氧化还原反应中,电子转移和化合价升降的关系氧化还原反应◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原
的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
特点:可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的化学反应是氧化还原反应。
特点:揭示氧化还原反应的本质。
小结课堂练习
Ⅰ.分析表格,找出四种基本反应类型与氧化还原反应的关系。[结论] 置换反应全部是氧化还原反应;复分解反应全部是非氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。√×√×√√××学.科.网Ⅱ.下列反应中属于氧化还原反应的是( )
A CaCO3 + 2HCl == CaCl2 + CO2↑ + H2O
B. Na2O + H2O == 2NaOH
C. 2KMnO4 == K2MnO4 + MnO2 + O2↑
D. MnO2 + 4HCl == MnCl2 + 2H2O + Cl2↑
E. 3Fe + 2O2 == Fe3O4
CuSO4·5H2O == CuSO4 + 5H2O
CDE Ⅲ 、用化合价升降的观点去判断下面的反 应哪些是氧化还原反应?关键: (1)正确判断各反应物、生成物各元素的化合价及其变化;
(2)凡是有化合价升降的化学反应都是氧化还原反应作业课本P38 第4 ,5,6题做在书上
预习下一节课内容,复习第一章及第二章第三节 氧化还原反应
第二课时
[课前小练]判断下列反应属于哪种基本反应类型?是否属于氧化还原反应?1、2 Na +Cl2==2NaCl
2、Fe +CuSO4 ==FeSO4 +Cu
3、2 HgO ==2Hg +O2 ↑
4、CaO +H2O ==CaCO3
6、3 Fe +2O2 ==Fe3O4
7、BaCl2 +H2SO4 ==BaSO4 ↓+2HCl
8、CaCO3 ==CaO +CO2 ↑√√√××√×(四)、氧化剂和还原剂氧化剂: 得到电子(元素化合价降低)的物质,被还原1. 定义说明: (1) 氧化剂和还原剂均是指反应物质,是一种化学试剂, 不是某一种元素。
(2) 氧化剂本身被还原,发生还原反应,得到的产物是还原产 物;
还原剂本身被氧化,发生氧化反应,得到的产物是氧化产物。还原剂: 失去电子(元素化合价升高)的物质,被氧化氧化还原反应中的多组概念 降 低
升 高氧化性
还原性 被还原
被氧化还原
反应
氧化
反应还原产物
氧化产物2. 常见的氧化剂和还原剂氧化剂: O2、Cl2、浓硫酸、HNO3、KMnO4、 FeCl3等还原剂:Al、Zn、Fe、C、H2、CO等3. 氧化性、还原性强弱判断 氧化剂的氧化性 > 氧化产物的氧化性。
还原剂的还原性 > 还原产物的还原性。(1)原子或离子的得电子能力越强,物质氧化性越强一般规律:(2)原子或离子的失电子能力越强,物质还原性越强小结:(1)氧化剂和还原剂分别是不同的物质(2)氧化剂和还原剂都是同一种物质(3)氧化剂和还原剂都是同一种物质,而且被氧化与被还原的元素都是相同价态的同种元素(4)反应物参加反应的总量中仅有一部分为氧化剂,另一部分为反应介质用双线桥应注意的事项: 正确判断各反应物、生成物各元素的化合价及其变化 两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。 电子符号用“e-”来表示 得失电子总数表示:原子个数 × 每个原子得失电子数
注意:反应中失去电子的总数等于得到电子的总数(五)、 氧化还原反应的表示方法1、双线桥法2、单线桥法
单线桥法的线桥从还原剂开始,指向氧化剂,线桥上只标得到电子或失去电子的总数目,不标得或失;它表示电子转移的方向,即箭头的方向就是电子转移的方向。
练习1:用双线桥和单线桥表示下列氧化还原反应,并指出氧化剂和还原剂2. 填空:
(1)Fe→FeCl2 ,需加____剂,例如: 。
(2)CuO→Cu,需加____剂,例如: 。
(3)HCl→Cl2,需加____剂,例如: 。
(4)HCl→H2,需加____剂,例如: 。
(5)Fe3+→Fe,需加____剂,例如: 。①Fe+ H2SO4(稀) = FeSO4 +H2↑
②2KClO3 = 2KCl + 3O2
③Cl2 + 2NaOH = NaCl + NaClO + H2O
④2H2S+SO2 =3S↓+2H2O
(六)、学习氧化还原反应的重要意义 氧化还原反应是一类重要的化学反应。在工农业生产、科学技术和日常生活中都有广泛的应用。例如,食物在人体中被消化,以提供生命活动所需的营养和能量,就离不开氧化还原反应。又如,煤燃烧、酿酒、电镀、金属的冶炼等,也都离不开氧化还原反应。
但是有些氧化还原反应会给人类带来危害,如易燃物的自燃、食物的腐败、钢铁的锈蚀等。我们应该运用化学知识来防止这类氧化还原反应的发生或减慢其进程。拓展训练分析下列氧化还原反应,用双线桥表示电子转移
的方向和数目,并指出氧化剂和还原剂、氧化产
物和还原产物。
(1)KClO3 +6HCl= KCl+3Cl2↑+3H2O
(2)5NH4NO3 4N2↑+2HNO3+9H2O
(3)Cl2+H2O= HCl +HClO KClO3 +6HCl= KCl+3Cl2↑+3H2O
氧化剂:KClO3 还原剂:HCl
氧化产物、还原产物都是Cl2(同种元素的不同价态之间的氧化还原反应,价态的
变化有何规律?)+5-10失5×1e-得1×5e-5NH4NO3 4N2↑+2HNO3+9H2O
氧化剂与还原剂为同种物质:NH4NO3
氧化产物与还原产物为同一种物质:N2(此 氧化还原反应发生在同一种物质中的不同价态元
素之间,称为自身氧化还原反应)-3+50得3×5e-失5×3e-Cl2+H2O= HCl +HClO
氧化剂与还原剂同为Cl2
氧化产物为HClO,还原产物为HCl(此反应电子转移发生在同一物质里同一价态的同一
元素原子上,为自身氧化还原反应的特殊形式,称为
歧化反应)0-1+1失e-得e-
