人教版化学选修四第四章第三节《电解池 金属的电化腐蚀与防护》课件 (共28张PPT)
文档属性
| 名称 | 人教版化学选修四第四章第三节《电解池 金属的电化腐蚀与防护》课件 (共28张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 367.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-01 09:50:05 | ||
图片预览






文档简介
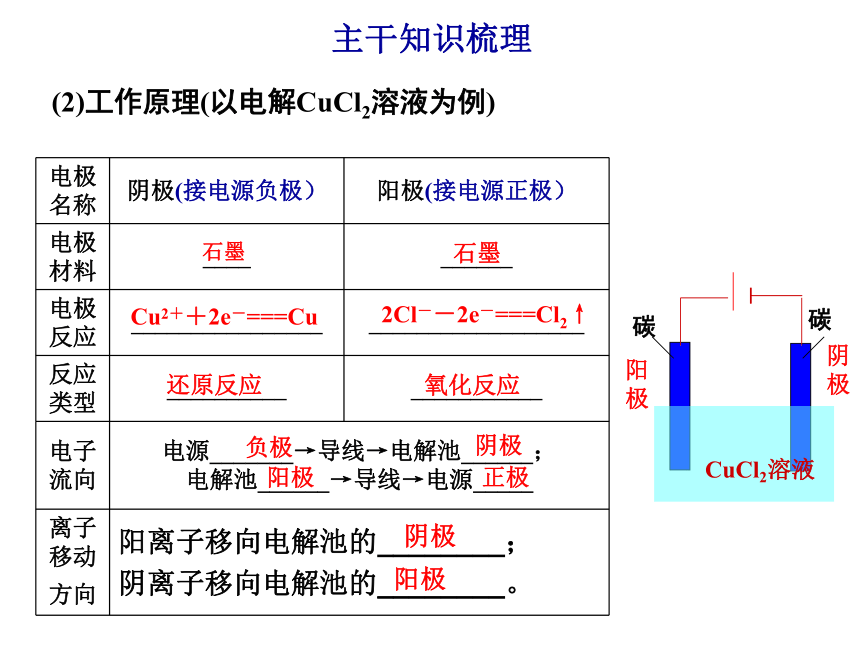
课件28张PPT。第三节 电解池 金属的电化腐蚀与防护 一、电解原理主干知识梳理电能氧化反应还原反应氧化还原反应2.电解池(1)定义:将______转化为__________的装置电流化学能1.电解(2)特点
①电解过程是非自发的。
②电解质导电一定发生________________。(2)工作原理(以电解CuCl2溶液为例)石墨石墨Cu2++2e-===Cu2Cl--2e-===Cl2↑还原反应氧化反应负极阴极阳极正极阴极阳极主干知识梳理(3)构成条件
①有与_______相连的两个电极。
② __________(或 _________)。
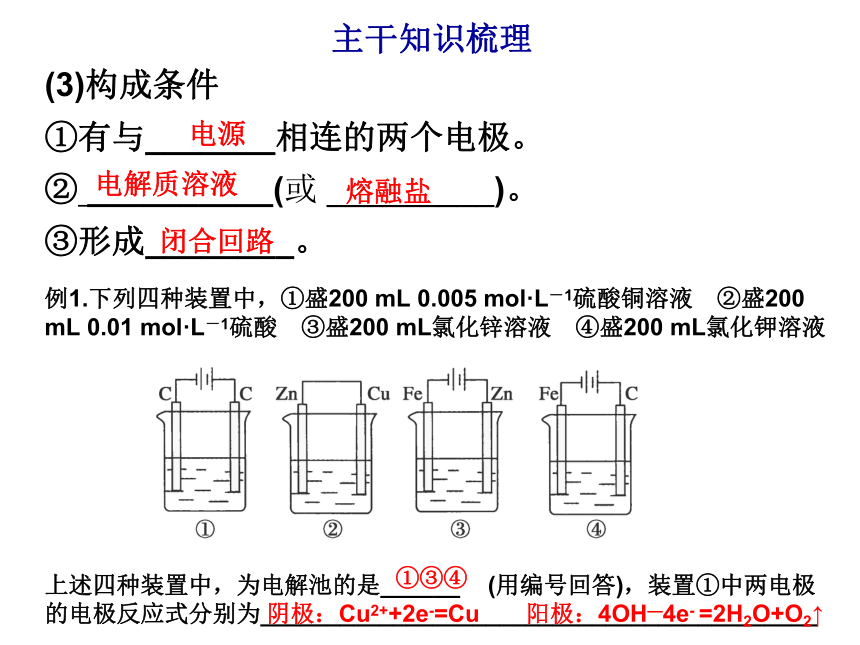
③形成________。电解质溶液熔融盐闭合回路电源主干知识梳理例1.下列四种装置中,①盛200 mL 0.005 mol·L-1硫酸铜溶液 ②盛200 mL 0.01 mol·L-1硫酸 ③盛200 mL氯化锌溶液 ④盛200 mL氯化钾溶液
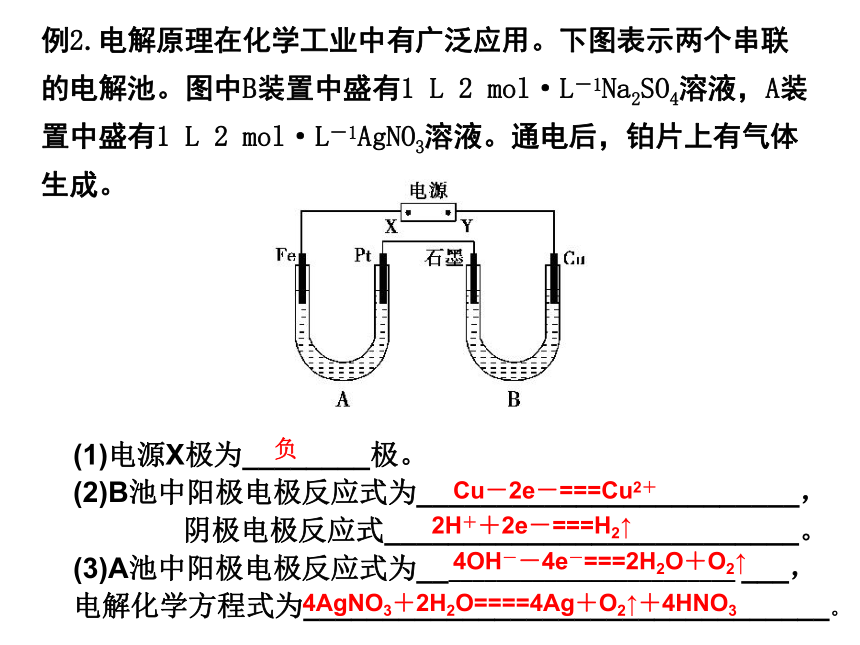
上述四种装置中,为电解池的是______ (用编号回答),装置①中两电极的电极反应式分别为__________________________________________①③④阴极:Cu2++2e-=Cu 阳极:4OH—4e- =2H2O+O2↑ 例2.电解原理在化学工业中有广泛应用。下图表示两个串联的电解池。图中B装置中盛有1 L 2 mol·L-1Na2SO4溶液,A装置中盛有1 L 2 mol·L-1AgNO3溶液。通电后,铂片上有气体生成。(1)电源X极为________极。
(2)B池中阳极电极反应式为________________________,
阴极电极反应式__________________________。
(3)A池中阳极电极反应式为__________________________ ___,电解化学方程式为_________________________________。负Cu-2e-===Cu2+ 2H++2e-===H2↑ 4OH--4e-===2H2O+O2↑4AgNO3+2H2O====4Ag+O2↑+4HNO31.电解原理与外界电源正极相连—阳极—氧化反应(失电子)—阴离子移向;与外界电源负极相连—阴极—还原反应(得电子)—阳离子移向;2.两极放电顺序(1)若阳极为活泼金属(金属活动性顺序表 Pt 之前金属),则
金属失电子,电极被溶解;
若是惰性电极(Pt、Au、石墨),则溶液中阴离子失电子,(2)在阴极,阳离子放电,顺序与金属活动性顺序表相反:阴离子放电顺序:S2->I->Br->Cl->OH->含氧酸根离子>F-。考点一、电解原理与电解产物的判断3.电极反应式的书写
(1)首先判断阴、阳极,分析电极材料,判断是电极材料放电还是溶液中的离子放电。阳极为金属活性电极时,电极材料放电。
(2)再分析溶液中的离子种类,根据离子放电顺序,分析电极反应,并判断电极产物,写出电极反应式。
(3)电解水溶液时,应注意放电顺序中H+、OH-之后的离子一般不参与放电反应。例5.写出用惰性电极电解下列各物质的离子方程式:
(1) Na2SO4 (2) HCl (3) NaCl (4) CuSO4含氧酸H2SO4可溶性强碱NaOH氢前金属含氧酸盐Na2SO4无氧酸HCl阳极:4OH-- 4e-= O2 ↑+ 2H2O
阴极:4H+ + 4e- = 2H2↑阳极:2Cl- - 2e- = Cl2↑
阴极:2H+ + 2e- = H2↑氢后金属无氧酸盐CuCl2阳极: 2Cl- - 2e- = Cl2↑
阴极:Cu2+ + 2e- = Cu氢前金属无氧酸盐NaCl阳极: 2Cl- - 2e- = Cl2↑
阴极:2H+ + 2e- = H2↑氢后金属含氧酸盐CuSO4阳极: 2Cu2++ 4e- = 2Cu
阴极: 4OH-- 4e- = O2↑+2H2O惰性电极电解规律小结相当于
电解水相当于
电解溶
质本身溶质和
溶剂同
时电解以惰性电极电解电解质溶液的类型考点二、电解类型及相关计算 例6. (2011·大纲全国高考)用石墨作电极电解CuSO4溶液。通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的( )
A.CuSO4 B.H2O
C.CuO D.CuSO4·5H2OC例7.(2011 年广东惠州模拟)下图 中 a、b 为直流电源电极,
c、 d 为惰性电极,电解液为淀粉碘化钾溶液,电解时 d
极先呈现蓝色,下列说法不正确的是 ( )
A.a 为直流电源的负极
B.d极电极反应为:2I--2e-===I2
C.电解质溶液电解过程中 pH 值减小
D.要恢复原溶液需要通入一定量的 HIC 例8.(2012·湛江一中质检)在如图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g,试回答:(1)电源电极X名称为________。
(2)pH变化:A________,B________,C________。(填“增大”、“减小”或“不变”)
(3)通电5 min时,B中共收集224 mL气体(标准状况),溶液体积为200 mL。则通电前CuSO4溶液的物质的量浓度为____________(设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200 mL,电解后,溶液的pH为________(设电解前后溶液体积无变化)。负极增大减小不变0.025 mol/L 13反思归纳: 电解计算的类型和方法
(1)计算类型
电解池中有关量的计算或判断主要包括以下几方面:根据直流电源提供的电量求产物的量(析出固体的质量、产生气体的体积等)、溶液的pH、相对原子质量或某元素的化合价、化学式等。
(2)解题方法
①根据电子守恒法计算:
用于串联电路、阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
②根据总反应式计算:
先写出电极反应式,再写出总反应式,最后根据总反应式计算。2Cl--2e-===Cl2↑ 氧化 2H++2e-===H2↑ 还原 氢气烧碱氯气主干知识梳理AgNO3溶液等含镀层Ag-e-===Ag+ Ag++e-===Ag金属阳离子的盐溶液阴阳阳阴不变主干知识梳理镀件Ag 含Ag+的盐溶液2.电镀纯铜粗铜主干知识梳理粗铜 含杂质(Zn Fe Ni Ag Au 等)纯铜粗铜阳极: Zn→ Zn2++2e-
Fe → Fe2++2e-
Ni → Ni2++2e-
Cu→ Cu2++2e-
阴极: Cu2+ + 2e- → Cu阳极泥CuSO4溶液Zn Fe Ni
Cu
Ag Au
3.电解精炼铜2Cl--2e-===Cl2↑ 2Na++2e-===2Na 6O2--12e-===3O2↑ 4Al3++12e-===4Al 主干知识梳理4.电冶金失去电子金属阳离子氧化反应能反应的物质直接电解质溶液无有微弱氧化氧化电化学水膜酸性较强
(pH≤4.3)水膜酸性很弱或呈中性 Fe-2e-===Fe2+ 2H++2e-
===H2↑ O2+2H2O+4e-===4OH- Fe+2H+===Fe2+2Fe+O2+2H2O吸氧腐蚀 +H2↑ ===2Fe(OH)2原电池负极正极电解阴极阳极B高考题组二 金属腐蚀及其防护
例10.(2010·北京高考)下列有关钢铁腐蚀与防护的说法正确的是( )
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是:Fe-3e-===Fe3+B例11.(2011·浙江高考)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( ) A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-===4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-===Cu2+B 热点探究:金属的电化学腐蚀与防护
金属腐蚀既受到其组成的影响,又受到外界因素的影响。通常金属腐蚀遵循以下规律。
(1)在同一电解质溶液中,金属腐蚀的快慢是:电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极。
(2)在不同溶液中,金属在电解质溶液中的腐蚀>金属在非电解质溶液中的腐蚀;金属在强电解质溶液中的腐蚀>金属在弱电解质溶液中的腐蚀。
(3)对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
(4)由于金属表面一般不会遇到酸性较强的溶液,故吸氧腐蚀是金属腐蚀的主要形式,只有在金属活动性顺序表中排在氢以前的金属才可能发生析氢腐蚀,而位于氢之后的金属只能发生吸氧腐蚀。
例12.下面各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( )
A.④>②>①>③ B.②>①>③>④
C.④>②>③>① D.③>②>④>①A例13.下面是某实验小组为研究铁生锈的条件而设计的快速易行的实验方法首先检查制氧气装置的气密性,然后按图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝表面依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于________,能表示其原理的反应方程式为_________________________。
(2)仪器A的名称为____________,其中装的药品可以是______________,其作用是___________________________。
(3)由实验可知,该类铁生锈的条件为_________________________。 【精讲精析】 钢铁在潮湿环境下形成原电池,发生电化学腐蚀。此实验在直形管中的现象说明,潮湿是铁生锈的前提,而没有潮湿程度对生锈快慢的影响,直形管实验与烧杯实验的对比,则说明O2浓度是影响生锈快慢的一个重要因素。
【答案】 (1)电化学腐蚀 负极:2Fe-4e-===2Fe2+ 正极:2H2O+O2+4e-===4OH-(也可写总反应方程式,多写Fe(OH)2―→Fe(OH)3的反应方程式也不算错)
(2)球形干燥管 碱石灰(或无水CaCl2) 干燥O2
(3)①与O2接触;②与水接触
①电解过程是非自发的。
②电解质导电一定发生________________。(2)工作原理(以电解CuCl2溶液为例)石墨石墨Cu2++2e-===Cu2Cl--2e-===Cl2↑还原反应氧化反应负极阴极阳极正极阴极阳极主干知识梳理(3)构成条件
①有与_______相连的两个电极。
② __________(或 _________)。
③形成________。电解质溶液熔融盐闭合回路电源主干知识梳理例1.下列四种装置中,①盛200 mL 0.005 mol·L-1硫酸铜溶液 ②盛200 mL 0.01 mol·L-1硫酸 ③盛200 mL氯化锌溶液 ④盛200 mL氯化钾溶液
上述四种装置中,为电解池的是______ (用编号回答),装置①中两电极的电极反应式分别为__________________________________________①③④阴极:Cu2++2e-=Cu 阳极:4OH—4e- =2H2O+O2↑ 例2.电解原理在化学工业中有广泛应用。下图表示两个串联的电解池。图中B装置中盛有1 L 2 mol·L-1Na2SO4溶液,A装置中盛有1 L 2 mol·L-1AgNO3溶液。通电后,铂片上有气体生成。(1)电源X极为________极。
(2)B池中阳极电极反应式为________________________,
阴极电极反应式__________________________。
(3)A池中阳极电极反应式为__________________________ ___,电解化学方程式为_________________________________。负Cu-2e-===Cu2+ 2H++2e-===H2↑ 4OH--4e-===2H2O+O2↑4AgNO3+2H2O====4Ag+O2↑+4HNO31.电解原理与外界电源正极相连—阳极—氧化反应(失电子)—阴离子移向;与外界电源负极相连—阴极—还原反应(得电子)—阳离子移向;2.两极放电顺序(1)若阳极为活泼金属(金属活动性顺序表 Pt 之前金属),则
金属失电子,电极被溶解;
若是惰性电极(Pt、Au、石墨),则溶液中阴离子失电子,(2)在阴极,阳离子放电,顺序与金属活动性顺序表相反:阴离子放电顺序:S2->I->Br->Cl->OH->含氧酸根离子>F-。考点一、电解原理与电解产物的判断3.电极反应式的书写
(1)首先判断阴、阳极,分析电极材料,判断是电极材料放电还是溶液中的离子放电。阳极为金属活性电极时,电极材料放电。
(2)再分析溶液中的离子种类,根据离子放电顺序,分析电极反应,并判断电极产物,写出电极反应式。
(3)电解水溶液时,应注意放电顺序中H+、OH-之后的离子一般不参与放电反应。例5.写出用惰性电极电解下列各物质的离子方程式:
(1) Na2SO4 (2) HCl (3) NaCl (4) CuSO4含氧酸H2SO4可溶性强碱NaOH氢前金属含氧酸盐Na2SO4无氧酸HCl阳极:4OH-- 4e-= O2 ↑+ 2H2O
阴极:4H+ + 4e- = 2H2↑阳极:2Cl- - 2e- = Cl2↑
阴极:2H+ + 2e- = H2↑氢后金属无氧酸盐CuCl2阳极: 2Cl- - 2e- = Cl2↑
阴极:Cu2+ + 2e- = Cu氢前金属无氧酸盐NaCl阳极: 2Cl- - 2e- = Cl2↑
阴极:2H+ + 2e- = H2↑氢后金属含氧酸盐CuSO4阳极: 2Cu2++ 4e- = 2Cu
阴极: 4OH-- 4e- = O2↑+2H2O惰性电极电解规律小结相当于
电解水相当于
电解溶
质本身溶质和
溶剂同
时电解以惰性电极电解电解质溶液的类型考点二、电解类型及相关计算 例6. (2011·大纲全国高考)用石墨作电极电解CuSO4溶液。通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的( )
A.CuSO4 B.H2O
C.CuO D.CuSO4·5H2OC例7.(2011 年广东惠州模拟)下图 中 a、b 为直流电源电极,
c、 d 为惰性电极,电解液为淀粉碘化钾溶液,电解时 d
极先呈现蓝色,下列说法不正确的是 ( )
A.a 为直流电源的负极
B.d极电极反应为:2I--2e-===I2
C.电解质溶液电解过程中 pH 值减小
D.要恢复原溶液需要通入一定量的 HIC 例8.(2012·湛江一中质检)在如图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g,试回答:(1)电源电极X名称为________。
(2)pH变化:A________,B________,C________。(填“增大”、“减小”或“不变”)
(3)通电5 min时,B中共收集224 mL气体(标准状况),溶液体积为200 mL。则通电前CuSO4溶液的物质的量浓度为____________(设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200 mL,电解后,溶液的pH为________(设电解前后溶液体积无变化)。负极增大减小不变0.025 mol/L 13反思归纳: 电解计算的类型和方法
(1)计算类型
电解池中有关量的计算或判断主要包括以下几方面:根据直流电源提供的电量求产物的量(析出固体的质量、产生气体的体积等)、溶液的pH、相对原子质量或某元素的化合价、化学式等。
(2)解题方法
①根据电子守恒法计算:
用于串联电路、阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。
②根据总反应式计算:
先写出电极反应式,再写出总反应式,最后根据总反应式计算。2Cl--2e-===Cl2↑ 氧化 2H++2e-===H2↑ 还原 氢气烧碱氯气主干知识梳理AgNO3溶液等含镀层Ag-e-===Ag+ Ag++e-===Ag金属阳离子的盐溶液阴阳阳阴不变主干知识梳理镀件Ag 含Ag+的盐溶液2.电镀纯铜粗铜主干知识梳理粗铜 含杂质(Zn Fe Ni Ag Au 等)纯铜粗铜阳极: Zn→ Zn2++2e-
Fe → Fe2++2e-
Ni → Ni2++2e-
Cu→ Cu2++2e-
阴极: Cu2+ + 2e- → Cu阳极泥CuSO4溶液Zn Fe Ni
Cu
Ag Au
3.电解精炼铜2Cl--2e-===Cl2↑ 2Na++2e-===2Na 6O2--12e-===3O2↑ 4Al3++12e-===4Al 主干知识梳理4.电冶金失去电子金属阳离子氧化反应能反应的物质直接电解质溶液无有微弱氧化氧化电化学水膜酸性较强
(pH≤4.3)水膜酸性很弱或呈中性 Fe-2e-===Fe2+ 2H++2e-
===H2↑ O2+2H2O+4e-===4OH- Fe+2H+===Fe2+2Fe+O2+2H2O吸氧腐蚀 +H2↑ ===2Fe(OH)2原电池负极正极电解阴极阳极B高考题组二 金属腐蚀及其防护
例10.(2010·北京高考)下列有关钢铁腐蚀与防护的说法正确的是( )
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是:Fe-3e-===Fe3+B例11.(2011·浙江高考)将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( ) A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-===4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-===Cu2+B 热点探究:金属的电化学腐蚀与防护
金属腐蚀既受到其组成的影响,又受到外界因素的影响。通常金属腐蚀遵循以下规律。
(1)在同一电解质溶液中,金属腐蚀的快慢是:电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极。
(2)在不同溶液中,金属在电解质溶液中的腐蚀>金属在非电解质溶液中的腐蚀;金属在强电解质溶液中的腐蚀>金属在弱电解质溶液中的腐蚀。
(3)对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。
(4)由于金属表面一般不会遇到酸性较强的溶液,故吸氧腐蚀是金属腐蚀的主要形式,只有在金属活动性顺序表中排在氢以前的金属才可能发生析氢腐蚀,而位于氢之后的金属只能发生吸氧腐蚀。
例12.下面各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( )
A.④>②>①>③ B.②>①>③>④
C.④>②>③>① D.③>②>④>①A例13.下面是某实验小组为研究铁生锈的条件而设计的快速易行的实验方法首先检查制氧气装置的气密性,然后按图连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝表面依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于________,能表示其原理的反应方程式为_________________________。
(2)仪器A的名称为____________,其中装的药品可以是______________,其作用是___________________________。
(3)由实验可知,该类铁生锈的条件为_________________________。 【精讲精析】 钢铁在潮湿环境下形成原电池,发生电化学腐蚀。此实验在直形管中的现象说明,潮湿是铁生锈的前提,而没有潮湿程度对生锈快慢的影响,直形管实验与烧杯实验的对比,则说明O2浓度是影响生锈快慢的一个重要因素。
【答案】 (1)电化学腐蚀 负极:2Fe-4e-===2Fe2+ 正极:2H2O+O2+4e-===4OH-(也可写总反应方程式,多写Fe(OH)2―→Fe(OH)3的反应方程式也不算错)
(2)球形干燥管 碱石灰(或无水CaCl2) 干燥O2
(3)①与O2接触;②与水接触
