新人教版选修3化学1.2《原子结构与元素的性质》课件 (共23张PPT)
文档属性
| 名称 | 新人教版选修3化学1.2《原子结构与元素的性质》课件 (共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-01 10:40:42 | ||
图片预览






文档简介
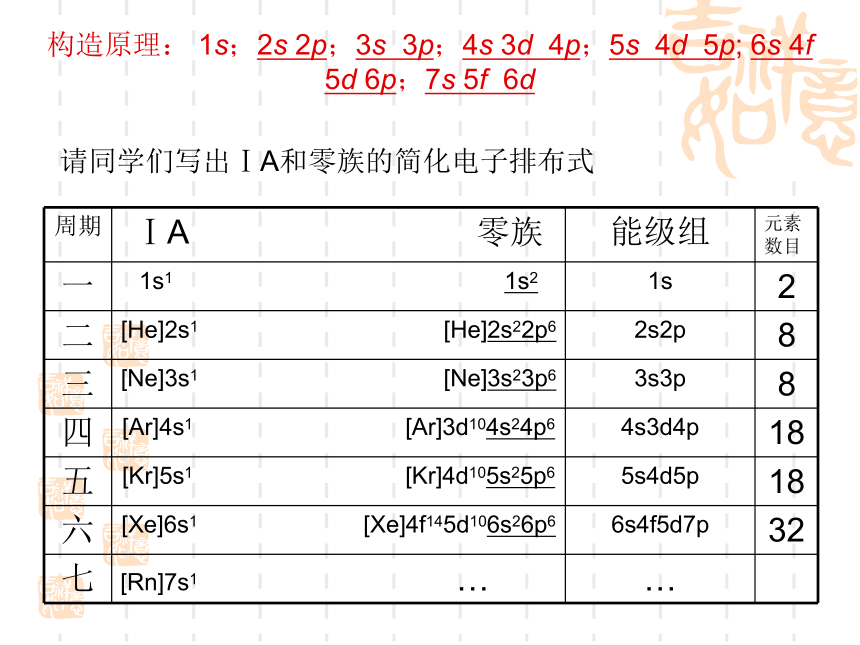
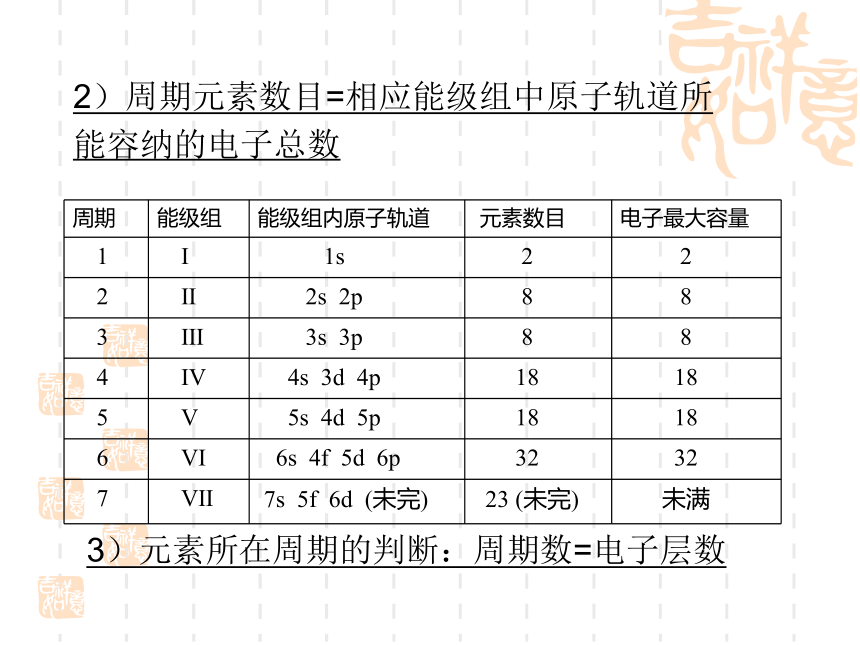
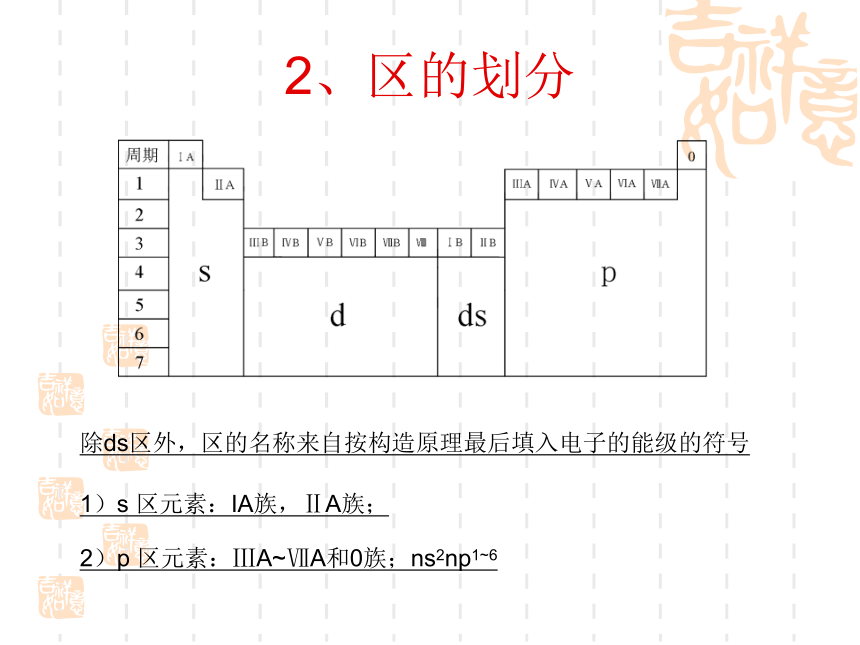
课件23张PPT。第一章 原子结构与性质第二节 原子结构与元素的性质一、原子结构与元素周期表复习:元素周期表的结构构造原理: 1s;2s 2p;3s 3p;4s 3d 4p;5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d请同学们写出ⅠA和零族的简化电子排布式1、周期的划分1)除第一周期外, 各周期均以填充 s 轨道的元素开始, 并以填充满p 轨道的元素告终.(第一周期除外)2)周期元素数目=相应能级组中原子轨道所 能容纳的电子总数3)元素所在周期的判断:周期数=电子层数2、区的划分1)s 区元素:IA族,ⅡA族;2)p 区元素:ⅢA~ⅦA和0族;ns2np1~6除ds区外,区的名称来自按构造原理最后填入电子的能级的符号4)ds 区元素: ⅠB和ⅡB ;(n-1)d10ns1~23)d 区元素:过渡元素,ⅢB~ⅦB和 Ⅷ;(n-1)d1~10ns1~2 (Pd无 s 电子)5)f 区元素:镧系和锕系;3、族的划分1)外围电子结构相同2)元素所在族的判断:①主族元素:主族序数=外围电子数=最外层电子数②副族元素:以外围(n-1)d+ns的电子总数判断A、电子总数为3~7,ⅢB~ⅦB
B、电子总数为8~10,Ⅷ
C、电子总数为11~12,ⅠB和ⅡB二、元素周期律1、核外电子排布的周期性变化2、元素化合价的周期性变化3、元素金属性和非金属性的周期性变化金属性:Na>Mg>Al以第三周期元素为例:Na Mg Al Si P S Cl非金属性:Si < P < S < Cl综上所述:Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强4、原子半径的周期性变化1)决定因素:电子层数
核电荷数2)递变规律:从左到右,逐渐减小
从上到下,逐渐增大5、电离能的周期性变化1)第一电离能:①概念②第一电离能的意义:衡量元素的原子失去一个电子的难易程度2)第一电离能的周期性变化递变规律:主族:左→右,增大;
上→下,减小。3)元素电离能与元素性质的关系①金属性与非金属性②元素化合价图中哪些元素的第一电离能出现异常?试用全充满和半充满状态的结构解释。6.电负性1)电负性:用来描述不同元素的原子对键合电子吸引力的大小。电负性越大的原子,对键合电子的吸引力越大2)电负性大小的标准:3)电负性的变化规律:①同周期:左→右,增大
②同主族:上→下,减小F:4.0 Li: 1.04)电负性的应用:①判断元素的金属性和非金属性的强弱一般:非金属>1.8 金属<1.8 类金属≈1.8②判断化学键的类型一般:成键元素原子的电负性差>1.7,离子键
成键元素原子的电负性差<1.7,共价键例:H:2.1,Cl:3.0 3.0-2.1=0.9
HCl为共价化合物③判断化合物中元素化合价的正负例:NaH中,Na:0.9 H:2.1
Na显正价,H显负价1、每一周期元素都是从碱金属开始,以稀有气体结束
2、f区都是副族元素,s区和p区的都是主族元素
3、已知在200C 1mol Na失去1 mol电子需吸收650kJ能量,则其第一电离能为650KJ/mol。
4、Ge的电负性为1.8,则其是典型的非金属
5、气态O原子的电子排布为:
6、?半径:K+>Cl-
7、酸性 HClO4>H2SO4 ,碱性:NaOH > Mg(OH)2
8、第一周期有2×12=2,第二周期有2×22=8,则第五周期有2×52=50种元素。概念辩析×××××√××高考链接1.CNSClFe高考链接2.高考链接
B、电子总数为8~10,Ⅷ
C、电子总数为11~12,ⅠB和ⅡB二、元素周期律1、核外电子排布的周期性变化2、元素化合价的周期性变化3、元素金属性和非金属性的周期性变化金属性:Na>Mg>Al以第三周期元素为例:Na Mg Al Si P S Cl非金属性:Si < P < S < Cl综上所述:Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强4、原子半径的周期性变化1)决定因素:电子层数
核电荷数2)递变规律:从左到右,逐渐减小
从上到下,逐渐增大5、电离能的周期性变化1)第一电离能:①概念②第一电离能的意义:衡量元素的原子失去一个电子的难易程度2)第一电离能的周期性变化递变规律:主族:左→右,增大;
上→下,减小。3)元素电离能与元素性质的关系①金属性与非金属性②元素化合价图中哪些元素的第一电离能出现异常?试用全充满和半充满状态的结构解释。6.电负性1)电负性:用来描述不同元素的原子对键合电子吸引力的大小。电负性越大的原子,对键合电子的吸引力越大2)电负性大小的标准:3)电负性的变化规律:①同周期:左→右,增大
②同主族:上→下,减小F:4.0 Li: 1.04)电负性的应用:①判断元素的金属性和非金属性的强弱一般:非金属>1.8 金属<1.8 类金属≈1.8②判断化学键的类型一般:成键元素原子的电负性差>1.7,离子键
成键元素原子的电负性差<1.7,共价键例:H:2.1,Cl:3.0 3.0-2.1=0.9
HCl为共价化合物③判断化合物中元素化合价的正负例:NaH中,Na:0.9 H:2.1
Na显正价,H显负价1、每一周期元素都是从碱金属开始,以稀有气体结束
2、f区都是副族元素,s区和p区的都是主族元素
3、已知在200C 1mol Na失去1 mol电子需吸收650kJ能量,则其第一电离能为650KJ/mol。
4、Ge的电负性为1.8,则其是典型的非金属
5、气态O原子的电子排布为:
6、?半径:K+>Cl-
7、酸性 HClO4>H2SO4 ,碱性:NaOH > Mg(OH)2
8、第一周期有2×12=2,第二周期有2×22=8,则第五周期有2×52=50种元素。概念辩析×××××√××高考链接1.CNSClFe高考链接2.高考链接
