新人教版选修3化学-2.3《分子的性质》ppt课件 (共58张PPT)
文档属性
| 名称 | 新人教版选修3化学-2.3《分子的性质》ppt课件 (共58张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-01 21:26:01 | ||
图片预览








文档简介
课件58张PPT。高中《化学》新人教版
选修3系列课件物质结构与性质2.3《分子的性质》教学目标 知识与能力
1、了解极性共价键和非极性共价键;
2、结合常见物质分子立体结构,判断极性分子和非极性分子;
3、培养学生分析问题、解决问题的能力和严谨认真的科学态度。
4、范德华力、氢键及其对物质性质的影响
5、能举例说明化学键和分子间作用力的区别
6、例举含有氢键的物质
7、采用图表、比较、讨论、归纳、综合的方法进行教学
8、培养学生分析、归纳、综合的能力9、从分子结构的角度,认识“相似相溶”规律。
10、了解“手性分子”在生命科学等方面的应用。
11、能用分子结构的知识解释无机含氧酸分子的酸性。
12、培养学生分析、归纳、综合的能力
13、采用比较、讨论、归纳、总结的方法进行教学
教学重点:
多原子分子中,极性分子和非极性分子的判断。 分子间作用力、氢键及其对物质性质的影响。手性分子和无机含氧酸分子的酸性
教学难点:
分子间作用力、氢键及其对物质性质的影响。手性分子和无机含氧酸分子的酸性第二章 分子结构与性质
第三节 分子的性质
(第一课时)
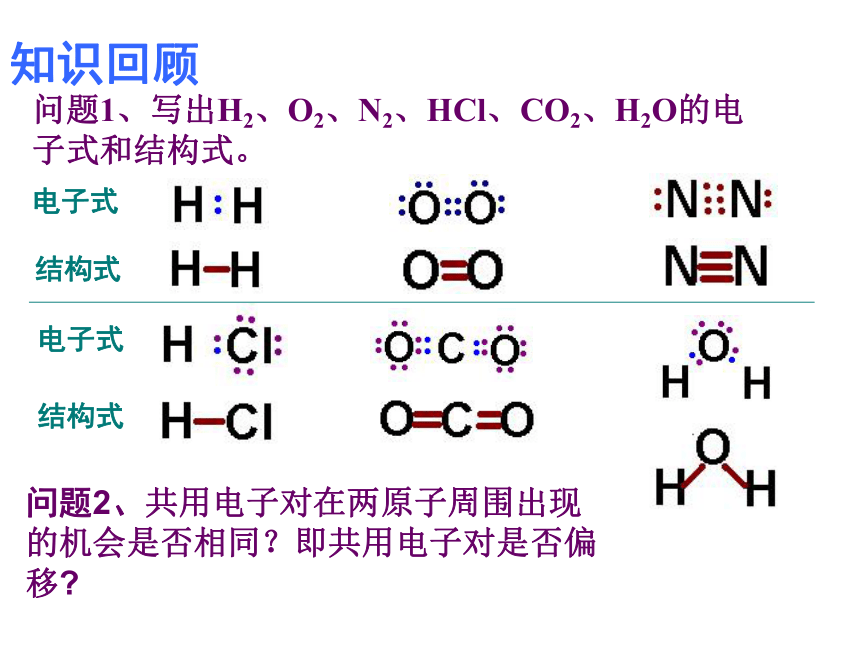
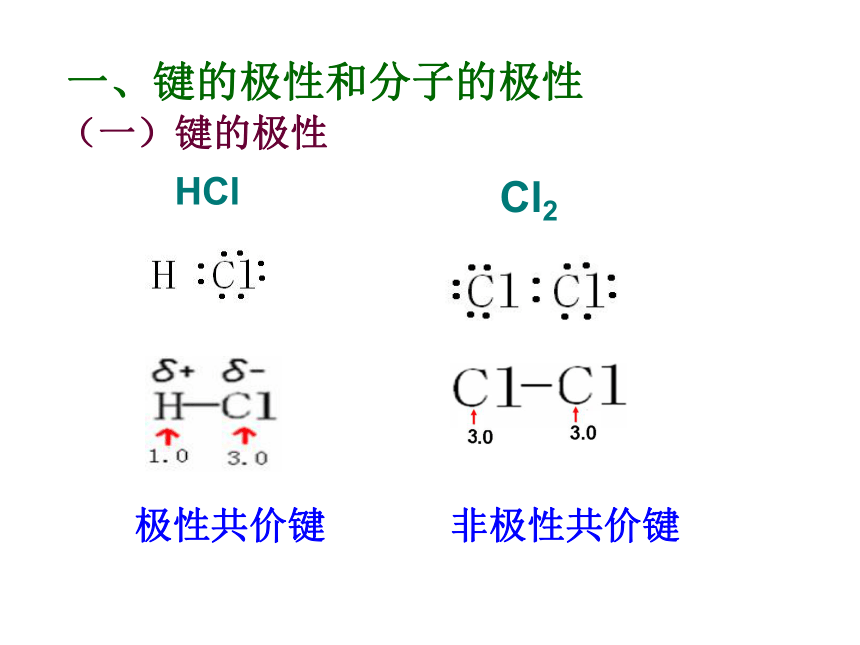
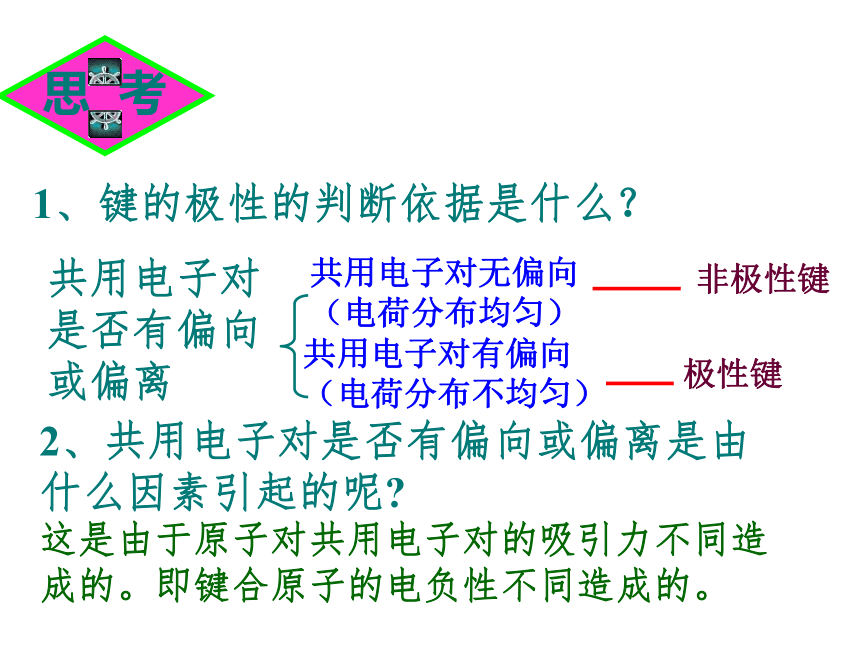
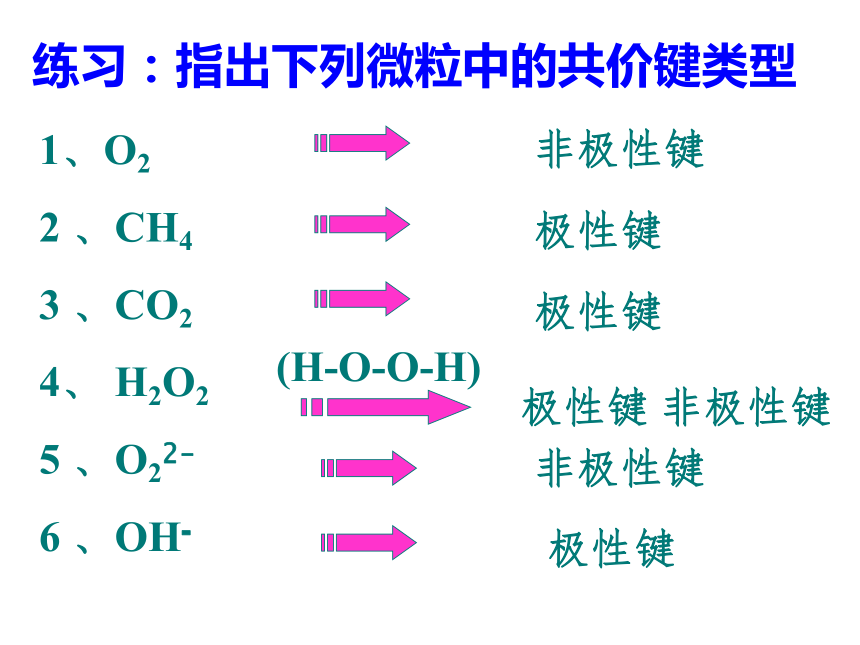
知识回顾问题1、写出H2、O2、N2、HCl、CO2、H2O的电子式和结构式。问题2、共用电子对在两原子周围出现的机会是否相同?即共用电子对是否偏移?电子式结构式电子式结构式极性共价键 非极性共价键一、键的极性和分子的极性(一)键的极性HClCl22、共用电子对是否有偏向或偏离是由什么因素引起的呢?这是由于原子对共用电子对的吸引力不同造成的。即键合原子的电负性不同造成的。1、键的极性的判断依据是什么?共用电子对是否有偏向或偏离共用电子对有偏向(电荷分布不均匀)共用电子对无偏向(电荷分布均匀)非极性键极性键3、判断方法:(1)同种非金属元素的原子间形成的共价键是非极性键。(2)不同种非金属元素的原子间形成的共价键是极性键。练习:指出下列微粒中的共价键类型1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、O22-
6 、OH-非极性键极性键极性键(H-O-O-H)极性键 非极性键非极性键极性键问题:共价键有极性和非极性,分子是否也有极性和非极性呢?请看下面演示实验。观察现象,说明什么问题?现象:水流方向有变化,而CCl4流的方向没
有变化。 说明H2O分子与CCl4分子不同, H2O分子受静电作用, CCl4分子不受静电作用。这是由于H2O分子中正电荷的中心和负电荷的中心不重合,而CCl4分子的正电荷中心和负电荷中心重合。极性分子:正电中心和负电中心不重合非极性分子:正电中心和负电中心重合看正电中心和负电中心 是否重合 (2)化学键的极性的向量和是否等于零(1)看键的极性,也看分子的空间构型 2、判断方法:1、概念(二)分子的极性第一类:全部由非极性键组成的分子 是非极性分子。 如:P4、C60、S8 C70、B12 第二类:对于ABn型分子极性判别方法由极性键组成的双原子分子 一定是极性分子。如:HX、CO、NO、 在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消), F合≠0,为极性分子(极性不抵消)思考从力学的角度分析:
分子中各键的极性向量和 C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子180oF1F2F合=0104o30'F1F2F合≠0O-H键是极性键,共用电子对偏O原子,由于分子是折线型构型,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子BF3NH3120o107o18' 三角锥型, 不对称,键的极性不能抵消,是极性分子F1F2F3F’平面三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子F合1、带静电的有机玻璃棒靠近下列液体的细流,细流会发生偏转的是 ( )
A.苯 B.二硫化碳 C. 溴水 D.四氯化碳结论:由同种元素组成的非金属单质分子不一定
是非性分子。C大极性极性分子练习:自学:
科学视野—表面活性剂和细胞膜 1、什么是表面活性剂?亲水基团?疏水基团?肥皂和 洗涤剂的去污原理是什么?2、什么是单分子膜?双分子膜?举例说明。 3、为什么双分子膜以头向外而尾向内的方式排列? 思考:第二章 分子结构与性质
第三节 分子的性质
(第二课时)二、范德华力及其对物质性质的影响1. 定义:把分子聚集在一起的作用力,
又称范德华力。请分析下表中数据2. 特点:范德华力 ,约比化学键能 。 ?
?
3. 影响范德华力大小的因素(1)结构 的分子,相对分子质量越 ,范德华力越 ,熔、沸越 。?
?
相似大大请分析下表中数据高四卤化碳的熔沸点与相对原子质量的关系(2)相对分子质量 或 时,分子的极性越 ,范德华力越 ,熔、沸越 。 相同相近大大请分析下表中数据高4. 分子间的范德华力有以下几个特征: (1)作用力的范围很小
(2)很弱,约比化学键能小1~2个数量级,
大约只有几到几十 KJ·mol-1。
(3)一般无方向性和饱和性
(4)相对分子质量越大,范德华力越大;分子
的极性越大,范德华力越大(1)将干冰气化,破坏了CO2分子晶
体的 。(2)将CO2气体溶于水,破坏了CO2
分子 。分子间作用力共价键思考:(3)解释CCl4(液体)CH4及CF4是气体,
CI4是固体的原因。 它们均是正四面体结构,它们的分子间作用力随相对分子质量增大而增大,相对分子质量越大,分子间作用力越大。 分子间作用力大小: CI4> CCl4 >CF4 >CH4四卤化碳的熔沸点与相对原子质量的关系 非金属元素的氢化物在固态时是分子晶体,其熔沸点与其分子量有关.对于同一主族非金属元素而言,从上到下,分子量逐渐增大,熔沸点应逐渐升高.而HF、H2O、NH3却出现反常,为什么? 说明在HF、H2O、NH3分子间还存在除分子间作力之外的其他作用.这种作用就是氢键.三、氢键及其对物质性质的影响氢键是一种特殊的分子间作用力,它是由已经与电负性很强的原子形成共 价键的氢原子与另一分子中电负性很强的原子之间的作用力.
1. 氢键概念例如: 在HF中 F 的电负性相当大, 电子对强烈地偏向 F, 而 H 几乎成了质子(H+), 这种 H 与另一个HF分子中电负性相当大、r 小的F相互接近时, 产生一种特殊的分子间力 —— 氢键.
氢键可以表示为 ···· ,如: F-H····F-H不属于化学键
(2)一般表示为: X—H----Y(其中X、Y为F、O、N)
表示式中的实线表示共价键,虚线表示氢键。
(3)形成的两个条件:
①与电负性大且 r 小的原子(F, O, N)相连的 H ;
② 在附近有电负性大, r 小的原子(F, O, N). 知识积累:甲醇2. 氢键的存在(1)分子间氢键 氢键普遍存在于已经与N、O、F形成共价键的氢原子与另外的N、O、F原子之间。如:HF、H2O、NH3 相互之间C2H5OH、CH3COOH、H2O相互之间 (2)分子内氢键
某些物质在分子内也可形成氢键,例如当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构. (2)分子内氢键: 例如 (1)分子间氢键:3. 氢键键能大小范围 氢键介于范德华力和化学键之间,是一种较弱的作用力。 氢键强弱与X和Y的吸引电子的能力有关,即与X和Y的电负性有关.它们的吸引电子能力越强(即电负性越大),则氢键越强,如F原子得电子能力最强,因而F-H…F是最强的氢键; 原子吸引电子能力不同,所以氢键强弱变化顺序为:
F-H…F > O-H…O > O-H…N > N-H…N?
C原子吸引电子能力较弱,一般不形成氢键。4. 氢键强弱(1)分子间氢键使物质熔沸点升高
(2)分子内氢键使物质熔沸点降低
(3)物质的溶解性5. 氢键对物质物理性质的影响:思考:NH3为什么极易溶于水?NH3溶于水是形成N-
H…O还是形成O-H…N?NH3溶于水形成氢键示意图如右,正是这样,NH3溶于水溶液呈碱性 我们在学习化学的过程中还有什么地方能用氢键的知识来解释的?(1)醇比含有相同碳原子的烃熔沸点高
(2)低级醇易溶于水
(3)HF酸是弱酸6. 氢键的应用 ……(04广东)下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键 练习:C第二章 分子结构与性质
第三节 分子的性质
(第三课时)2. 若存在氢键,溶质和溶剂之间的氢键作用力越 大 ,溶解性越 好 。1. “相似相溶”规律: 非极性 物质一般易溶于非极性 溶剂,极性溶质一般易溶于极性溶剂。3. 若溶质遇水能反应将增加其在水中的溶解度。4. “相似相溶”还适用于分子结构的相似性。阅读 资料卡片四、溶解性思考与交流1. NH3是极性分子,CH4为非极性分子,而水是极性分子,根据“相似相溶”规律, NH3易溶于水,而CH4不易溶于水。并且NH3与水分子之间还可以形成氢键,使得NH3更易溶于水。2. 油漆是非极性分子,有机溶剂如(乙酸乙酯)也是非极性溶剂,而水为极性溶剂,根据“相似相溶”规律,应当用有机溶剂溶解油漆而不能用水溶解油漆。3. 实验表明碘在四氯化碳溶液中的溶解性较好。这是因为碘和四氯化碳都是非极性分子,非极性溶质一般能溶于非极性溶剂,而水是极性分子。试一试:是否重合1. 手性:镜像对称,在三维空间里不能重叠。 具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。2. 手性异构体3. 手性分子:有手性异构体的分子叫做手性分子。五. 手性4. 手性碳原子 当碳原子结合的四个原子或原子团各不相同时,该碳原子是手性碳原子。5. 判断分子是否手性的依据:
(1) 凡具有对称面、对称中心的分子,都是非手性分子。
(2)有无对称轴,对分子是否有手性无决定作用。一般:
※ 当分子中只有一个C* ,分子一定有手性。
※ 当分子中有多个手性中心时,要借助对称因素。无对称
面,又无对称中心的分子,必是手性分子。手性分子在生命科学和生产手性药物方面有广泛的应用。如图所示的分子,是由一家德国制药厂在1957年10月1日上市的高效镇静剂,中文药名为“反应停”,它能使失眠者美美地睡个好觉,能迅速止痛并能够减轻孕妇的妊娠反应。然而,不久就发现世界各地相继出现了一些畸形儿,后被科学家证实,是孕妇服用了这种药物导致的随后的药物化学研究证实,在这种药物中,只有图左边的分子才有这种毒副作用,而右边的分子却没有这种毒副作用。人类从这一药物史上的悲剧中吸取教训,不久各国纷纷规定,今后凡生产手性药物,必须把手性异构体分离开,只出售能治病的那种手性异构体的药物。
“反应停”事件 拓展体验1. 下列说法不正确的是( )
A. 互为手性异构的分子组成相同,官能
团不同
B. 手性异构体的性质不完全相同
C. 手性异构体是同分异构体的一种
D. 利用手性催化剂合成可得到或主要得
到一种手性分子
A2. 下列化合物中含有手性碳原子的是( )
A.CCl2F2 B.CH3—CH—COOH
C.CH3CH2OH D.CH3—OH
B 拓展体验
3. 下列两分子的关系是 ( )
A.互为同分异构体 B.是同一物质
C.是手性分子 D.互为同系物B科学史话:了解巴斯德实验室合成的有机物酒石酸盐并制得手性机物酒石酸盐过程。
多美的晶体啊!六. 无机含氧酸的酸性1.在同一周期中,处于最高价态的元素,其含氧酸的酸性随原子序数递增,自左至右增强。如:H3PO4 < H2SO4 < HClO4高氯酸是非金属含氧酸中酸性最强的无机酸(一)知识回顾与归纳:2.在同一主族中,处于相同价态的不同元素,其含氧酸的酸性随成酸元素的原子序数递增,自上而下减弱。如HClO>HBrO>HIOHClO2>HBrO2>HIO2HClO3>HBrO3>HIO3HClO4>HBrO4>HIO43.同一元素若能形成几种不同价态的含氧酸,其酸性依化合价的递增而递增;如:HClO< HClO2< HClO3HClO3 : (HO) ClO2 n=2 ; HClO4 : (HO) ClO3 n=3∴ HNO3 > HNO2∴ HClO4 > HClO3 > HClO2 > HClO例如再认识拓展2. (HO)mROn,如果成酸元素R不同时,则非羟基氧原子数n值越大,即酸性越强。再见
选修3系列课件物质结构与性质2.3《分子的性质》教学目标 知识与能力
1、了解极性共价键和非极性共价键;
2、结合常见物质分子立体结构,判断极性分子和非极性分子;
3、培养学生分析问题、解决问题的能力和严谨认真的科学态度。
4、范德华力、氢键及其对物质性质的影响
5、能举例说明化学键和分子间作用力的区别
6、例举含有氢键的物质
7、采用图表、比较、讨论、归纳、综合的方法进行教学
8、培养学生分析、归纳、综合的能力9、从分子结构的角度,认识“相似相溶”规律。
10、了解“手性分子”在生命科学等方面的应用。
11、能用分子结构的知识解释无机含氧酸分子的酸性。
12、培养学生分析、归纳、综合的能力
13、采用比较、讨论、归纳、总结的方法进行教学
教学重点:
多原子分子中,极性分子和非极性分子的判断。 分子间作用力、氢键及其对物质性质的影响。手性分子和无机含氧酸分子的酸性
教学难点:
分子间作用力、氢键及其对物质性质的影响。手性分子和无机含氧酸分子的酸性第二章 分子结构与性质
第三节 分子的性质
(第一课时)
知识回顾问题1、写出H2、O2、N2、HCl、CO2、H2O的电子式和结构式。问题2、共用电子对在两原子周围出现的机会是否相同?即共用电子对是否偏移?电子式结构式电子式结构式极性共价键 非极性共价键一、键的极性和分子的极性(一)键的极性HClCl22、共用电子对是否有偏向或偏离是由什么因素引起的呢?这是由于原子对共用电子对的吸引力不同造成的。即键合原子的电负性不同造成的。1、键的极性的判断依据是什么?共用电子对是否有偏向或偏离共用电子对有偏向(电荷分布不均匀)共用电子对无偏向(电荷分布均匀)非极性键极性键3、判断方法:(1)同种非金属元素的原子间形成的共价键是非极性键。(2)不同种非金属元素的原子间形成的共价键是极性键。练习:指出下列微粒中的共价键类型1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、O22-
6 、OH-非极性键极性键极性键(H-O-O-H)极性键 非极性键非极性键极性键问题:共价键有极性和非极性,分子是否也有极性和非极性呢?请看下面演示实验。观察现象,说明什么问题?现象:水流方向有变化,而CCl4流的方向没
有变化。 说明H2O分子与CCl4分子不同, H2O分子受静电作用, CCl4分子不受静电作用。这是由于H2O分子中正电荷的中心和负电荷的中心不重合,而CCl4分子的正电荷中心和负电荷中心重合。极性分子:正电中心和负电中心不重合非极性分子:正电中心和负电中心重合看正电中心和负电中心 是否重合 (2)化学键的极性的向量和是否等于零(1)看键的极性,也看分子的空间构型 2、判断方法:1、概念(二)分子的极性第一类:全部由非极性键组成的分子 是非极性分子。 如:P4、C60、S8 C70、B12 第二类:对于ABn型分子极性判别方法由极性键组成的双原子分子 一定是极性分子。如:HX、CO、NO、 在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消), F合≠0,为极性分子(极性不抵消)思考从力学的角度分析:
分子中各键的极性向量和 C=O键是极性键,但从分子总体而言CO2是直线型分子,两个C=O键是对称排列的,两键的极性互相抵消( F合=0),∴整个分子没有极性,电荷分布均匀,是非极性分子180oF1F2F合=0104o30'F1F2F合≠0O-H键是极性键,共用电子对偏O原子,由于分子是折线型构型,两个O-H键的极性不能抵消( F合≠0),∴整个分子电荷分布不均匀,是极性分子BF3NH3120o107o18' 三角锥型, 不对称,键的极性不能抵消,是极性分子F1F2F3F’平面三角形,对称,键的极性互相抵消( F合=0) ,是非极性分子109o28' 正四面体型 ,对称结构,C-H键的极性互相抵消( F合=0) ,是非极性分子F合1、带静电的有机玻璃棒靠近下列液体的细流,细流会发生偏转的是 ( )
A.苯 B.二硫化碳 C. 溴水 D.四氯化碳结论:由同种元素组成的非金属单质分子不一定
是非性分子。C大极性极性分子练习:自学:
科学视野—表面活性剂和细胞膜 1、什么是表面活性剂?亲水基团?疏水基团?肥皂和 洗涤剂的去污原理是什么?2、什么是单分子膜?双分子膜?举例说明。 3、为什么双分子膜以头向外而尾向内的方式排列? 思考:第二章 分子结构与性质
第三节 分子的性质
(第二课时)二、范德华力及其对物质性质的影响1. 定义:把分子聚集在一起的作用力,
又称范德华力。请分析下表中数据2. 特点:范德华力 ,约比化学键能 。 ?
?
3. 影响范德华力大小的因素(1)结构 的分子,相对分子质量越 ,范德华力越 ,熔、沸越 。?
?
相似大大请分析下表中数据高四卤化碳的熔沸点与相对原子质量的关系(2)相对分子质量 或 时,分子的极性越 ,范德华力越 ,熔、沸越 。 相同相近大大请分析下表中数据高4. 分子间的范德华力有以下几个特征: (1)作用力的范围很小
(2)很弱,约比化学键能小1~2个数量级,
大约只有几到几十 KJ·mol-1。
(3)一般无方向性和饱和性
(4)相对分子质量越大,范德华力越大;分子
的极性越大,范德华力越大(1)将干冰气化,破坏了CO2分子晶
体的 。(2)将CO2气体溶于水,破坏了CO2
分子 。分子间作用力共价键思考:(3)解释CCl4(液体)CH4及CF4是气体,
CI4是固体的原因。 它们均是正四面体结构,它们的分子间作用力随相对分子质量增大而增大,相对分子质量越大,分子间作用力越大。 分子间作用力大小: CI4> CCl4 >CF4 >CH4四卤化碳的熔沸点与相对原子质量的关系 非金属元素的氢化物在固态时是分子晶体,其熔沸点与其分子量有关.对于同一主族非金属元素而言,从上到下,分子量逐渐增大,熔沸点应逐渐升高.而HF、H2O、NH3却出现反常,为什么? 说明在HF、H2O、NH3分子间还存在除分子间作力之外的其他作用.这种作用就是氢键.三、氢键及其对物质性质的影响氢键是一种特殊的分子间作用力,它是由已经与电负性很强的原子形成共 价键的氢原子与另一分子中电负性很强的原子之间的作用力.
1. 氢键概念例如: 在HF中 F 的电负性相当大, 电子对强烈地偏向 F, 而 H 几乎成了质子(H+), 这种 H 与另一个HF分子中电负性相当大、r 小的F相互接近时, 产生一种特殊的分子间力 —— 氢键.
氢键可以表示为 ···· ,如: F-H····F-H不属于化学键
(2)一般表示为: X—H----Y(其中X、Y为F、O、N)
表示式中的实线表示共价键,虚线表示氢键。
(3)形成的两个条件:
①与电负性大且 r 小的原子(F, O, N)相连的 H ;
② 在附近有电负性大, r 小的原子(F, O, N). 知识积累:甲醇2. 氢键的存在(1)分子间氢键 氢键普遍存在于已经与N、O、F形成共价键的氢原子与另外的N、O、F原子之间。如:HF、H2O、NH3 相互之间C2H5OH、CH3COOH、H2O相互之间 (2)分子内氢键
某些物质在分子内也可形成氢键,例如当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构. (2)分子内氢键: 例如 (1)分子间氢键:3. 氢键键能大小范围 氢键介于范德华力和化学键之间,是一种较弱的作用力。 氢键强弱与X和Y的吸引电子的能力有关,即与X和Y的电负性有关.它们的吸引电子能力越强(即电负性越大),则氢键越强,如F原子得电子能力最强,因而F-H…F是最强的氢键; 原子吸引电子能力不同,所以氢键强弱变化顺序为:
F-H…F > O-H…O > O-H…N > N-H…N?
C原子吸引电子能力较弱,一般不形成氢键。4. 氢键强弱(1)分子间氢键使物质熔沸点升高
(2)分子内氢键使物质熔沸点降低
(3)物质的溶解性5. 氢键对物质物理性质的影响:思考:NH3为什么极易溶于水?NH3溶于水是形成N-
H…O还是形成O-H…N?NH3溶于水形成氢键示意图如右,正是这样,NH3溶于水溶液呈碱性 我们在学习化学的过程中还有什么地方能用氢键的知识来解释的?(1)醇比含有相同碳原子的烃熔沸点高
(2)低级醇易溶于水
(3)HF酸是弱酸6. 氢键的应用 ……(04广东)下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键 练习:C第二章 分子结构与性质
第三节 分子的性质
(第三课时)2. 若存在氢键,溶质和溶剂之间的氢键作用力越 大 ,溶解性越 好 。1. “相似相溶”规律: 非极性 物质一般易溶于非极性 溶剂,极性溶质一般易溶于极性溶剂。3. 若溶质遇水能反应将增加其在水中的溶解度。4. “相似相溶”还适用于分子结构的相似性。阅读 资料卡片四、溶解性思考与交流1. NH3是极性分子,CH4为非极性分子,而水是极性分子,根据“相似相溶”规律, NH3易溶于水,而CH4不易溶于水。并且NH3与水分子之间还可以形成氢键,使得NH3更易溶于水。2. 油漆是非极性分子,有机溶剂如(乙酸乙酯)也是非极性溶剂,而水为极性溶剂,根据“相似相溶”规律,应当用有机溶剂溶解油漆而不能用水溶解油漆。3. 实验表明碘在四氯化碳溶液中的溶解性较好。这是因为碘和四氯化碳都是非极性分子,非极性溶质一般能溶于非极性溶剂,而水是极性分子。试一试:是否重合1. 手性:镜像对称,在三维空间里不能重叠。 具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称手性异构体。2. 手性异构体3. 手性分子:有手性异构体的分子叫做手性分子。五. 手性4. 手性碳原子 当碳原子结合的四个原子或原子团各不相同时,该碳原子是手性碳原子。5. 判断分子是否手性的依据:
(1) 凡具有对称面、对称中心的分子,都是非手性分子。
(2)有无对称轴,对分子是否有手性无决定作用。一般:
※ 当分子中只有一个C* ,分子一定有手性。
※ 当分子中有多个手性中心时,要借助对称因素。无对称
面,又无对称中心的分子,必是手性分子。手性分子在生命科学和生产手性药物方面有广泛的应用。如图所示的分子,是由一家德国制药厂在1957年10月1日上市的高效镇静剂,中文药名为“反应停”,它能使失眠者美美地睡个好觉,能迅速止痛并能够减轻孕妇的妊娠反应。然而,不久就发现世界各地相继出现了一些畸形儿,后被科学家证实,是孕妇服用了这种药物导致的随后的药物化学研究证实,在这种药物中,只有图左边的分子才有这种毒副作用,而右边的分子却没有这种毒副作用。人类从这一药物史上的悲剧中吸取教训,不久各国纷纷规定,今后凡生产手性药物,必须把手性异构体分离开,只出售能治病的那种手性异构体的药物。
“反应停”事件 拓展体验1. 下列说法不正确的是( )
A. 互为手性异构的分子组成相同,官能
团不同
B. 手性异构体的性质不完全相同
C. 手性异构体是同分异构体的一种
D. 利用手性催化剂合成可得到或主要得
到一种手性分子
A2. 下列化合物中含有手性碳原子的是( )
A.CCl2F2 B.CH3—CH—COOH
C.CH3CH2OH D.CH3—OH
B 拓展体验
3. 下列两分子的关系是 ( )
A.互为同分异构体 B.是同一物质
C.是手性分子 D.互为同系物B科学史话:了解巴斯德实验室合成的有机物酒石酸盐并制得手性机物酒石酸盐过程。
多美的晶体啊!六. 无机含氧酸的酸性1.在同一周期中,处于最高价态的元素,其含氧酸的酸性随原子序数递增,自左至右增强。如:H3PO4 < H2SO4 < HClO4高氯酸是非金属含氧酸中酸性最强的无机酸(一)知识回顾与归纳:2.在同一主族中,处于相同价态的不同元素,其含氧酸的酸性随成酸元素的原子序数递增,自上而下减弱。如HClO>HBrO>HIOHClO2>HBrO2>HIO2HClO3>HBrO3>HIO3HClO4>HBrO4>HIO43.同一元素若能形成几种不同价态的含氧酸,其酸性依化合价的递增而递增;如:HClO< HClO2< HClO3
