新人教版选修3化学-3.2《分子晶体与原子晶体》ppt课件 (共49张PPT)
文档属性
| 名称 | 新人教版选修3化学-3.2《分子晶体与原子晶体》ppt课件 (共49张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 944.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-01 21:27:53 | ||
图片预览











文档简介
课件49张PPT。高中《化学》新人教版
选修3系列课件物质结构与性质3.2《分子晶体与 原子晶体》教学目标 知识与能力
1、使学生了解分子晶体的组成粒子、结构模型和结构特点及其性质的一般特点。
2、使学生了解晶体类型与性质的关系。
3、使学生理解分子间作用力和氢键对物质物理性质的影响。
4、知道一些常见的属于分子晶体的物质类别。
5、使学生主动参与科学探究,体验研究过程,激发他们的学习兴趣。
6、掌握原子晶体的概念,能够区分原子晶体和分子晶体。
7、了解金刚石等典型原子晶体的结构特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。教学重点难点:
重点:掌握分子晶体的结构特点和性质特点;原子晶体的结构与性质的关系
难点:是氢键的方向性和氢键对物体物理性质的影响
从三维空间结构认识晶胞的组成结构
教学方法建议:
运用模型和类比方法诱导分析归纳
微粒为分子:
分子间作用力(或范德华力)或氢键;
微粒为原子:极性共价键或非极性共价键;
微粒为离子:离子键。
复习总结:微粒间作用思考与交流
石墨和金刚石同属于碳的单质,为什么在硬度上会相差如此之大?
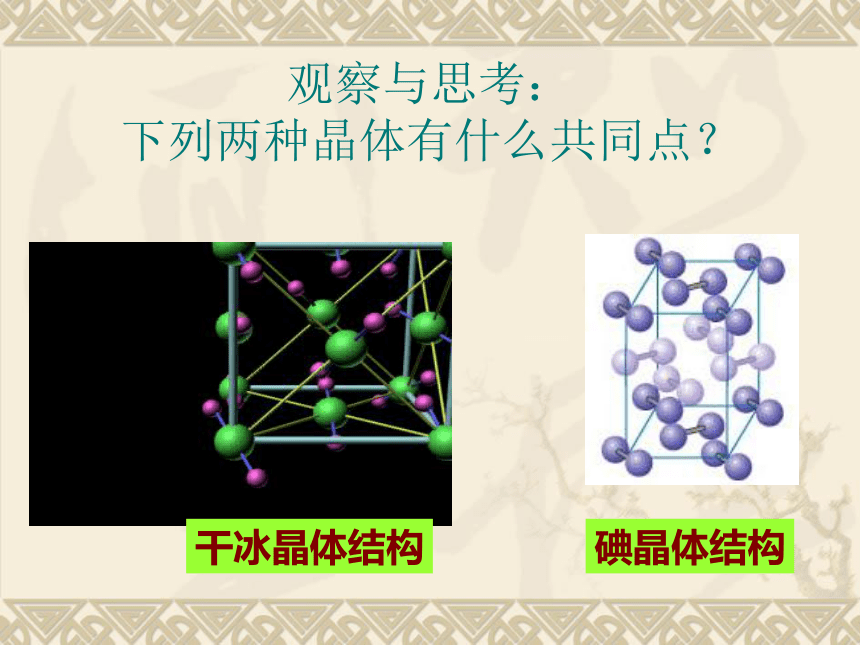
观察与思考: 下列两种晶体有什么共同点?碘晶体结构干冰晶体结构一、分子晶体1、概念
分子间以分子间作用力(范德华力,氢键)相结合的晶体叫分子晶体
(1)构成分子晶体的粒子是分子。
(2)粒子间的相互作用是分子间作用力。
(3)范德华力远小于化学键的作用;
(4)分子晶体熔化破坏的是分子间作用力。分子晶体有哪些物理特性,为什么?思考与交流
(1)较低的熔点和沸点,易升华;
(2)较小的硬度;
(3)一般都是绝缘体,熔融状态也不导电。原因:分子间作用力较弱2、物理特性:3、典型的分子晶体:
非金属氢化物:H2O,H2S,NH3,CH4,HX
酸:H2SO4,HNO3,H3PO4
部分非金属单质:X2,O2,H2, S8,P4, C60
部分非金属氧化物: CO2, SO2, NO2, P4O6, P4O10
大多数有机物:乙醇,冰醋酸,蔗糖4、分子晶体结构特征
只有范德华力,无分子间氢键——分子密堆积
每个分子周围有12个紧邻的分子,如:C60、干冰 、I2、O2
有分子间氢键——不具有分子密堆积特征
如:HF 、冰、NH3 分子的密堆积(与每个分子距离最近的相同分子共有12个 )氧(O2)的晶体结构碳60的晶胞分子的密堆积(与CO2分子距离最近的CO2分子共有12个 )干冰的晶体结构图冰中1个水分子周围有4个水分子冰的结构氢键具有方向性分子的非密堆积思考:1mol冰周围有?mol氢键冰中1个水分子周围有4个水分子形成什么空间构型?〖归纳要点〗分子的密度取决于晶体的体积,取决于紧密堆积程度,分子晶体的紧密堆积由以下两个因素决定:(1)范德华力
(2)分子间氢键
5、分子晶体熔、沸点高低的比较规律
分子晶体要熔化或汽化都需要克服分子间的作用力。分子间作用力越大,物质熔化和汽化时需要的能量就越多,物质的熔、沸点就越高。
因此,比较分子晶体的熔、沸点高低,实际上就是比较分子间作用力(包括范力和氢键)的大小。(1)组成和结构相似的物质,相对分子质量越大,范德华力越大,熔沸点越高。如:O2>N2,HI>HBr>HCl。
(2)分子量相等或相近,极性分子的范德华力大,熔沸点高,如CO>N2
(3)含有氢键的,熔沸点较高。如H2O>H2Te>H2Se>H2S,HF>HCl,NH3>PH3
(4)在烷烃的同分异构体中,一般来说,支链数越多,熔沸点越低。如沸点:正戊烷>异戊烷>新戊烷;芳香烃及其衍生物苯环上的同分异构体一般按照“邻位>间位>对位”的顺序。〖思考1〗是不是在分子晶体中分子间只存在范德华力?
〖思考2〗为什么冰融化为水时,密度增大?
不对,分子间氢键也是一种分子间作用力,
如冰中就同时存在着范德华力和氢键。在冰晶体中,每个分子周围只有4个紧邻的水分子,由于水分子之间的主要作用力是氢键,氢键跟共价键一样具有方向性,即氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不变,留有相当大的空隙。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大。〖思考3〗为何干冰的熔沸点比冰低,密度却比冰大? 由于冰中除了范德华力外还有氢键作用,破坏分子间作用力较难,所以熔沸点比干冰高。
由于分子间作用力特别是氢键的方向性,导致晶体中有相当大的空隙,所以相同状况下体积较大
由于CO2分子的相对分子质量>H2O,所以干冰的密度大。
科学视野:笼装化合物20世纪末,科学家发现海底存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷, 因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”………笼装化合物思考与交流CO2和SiO2的一些物理性质如下表所示,通过比较试判断SiO2晶体是否属于分子晶体。
碳元素和硅元素处于元素周期表中同一主族,为什么CO2晶体的熔、沸点很低,而SiO2晶体的熔沸点很高?180o109o28′SiO共价键二氧化硅晶体结构示意图109o28′共价键金刚石的晶体结构示意图二.原子晶体(共价晶体)1、概念:
相邻原子间以共价键相结合而形成空间立体网状结构的晶体。
(1)构成原子晶体的粒子是原子;
(2)原子晶体的粒子间以较强的共价键相结合;
(3)原子晶体熔化破坏的是共价键。观察·思考对比分子晶体和原子晶体的数据,原子晶体有何物理特性?2、原子晶体的物理特性在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状结构,所以原子晶体的
熔点和沸点高
硬度大
一般不导电
且难溶于一些常见的溶剂 在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状结构,所以原子晶体有特殊的物理性质。3、常见的原子晶体某些非金属单质:
金刚石(C)、晶体硅(Si)、晶体硼(B)、晶体锗(Ge)等
某些非金属化合物:
碳化硅(SiC)晶体、氮化硼(BN)晶体
某些氧化物:
二氧化硅( SiO2)晶体、Al2O3109o28′金刚石的晶体结构示意图共价键 思考:在金刚石晶体中,每个碳与周围多少个碳原子成键?形成怎样的空间结构?最小碳环由多少个碳原子组成?它们是否在同一平面内? 在金刚石晶体中,碳原子个数与C-C键数之比为多少?12g金刚石C-C键数为多少NA?①金刚石中每个C原子以sp3杂化,分别与4个相邻的C 原子形成4个σ键,故键角为109°28′,每个C原子的配位数为4;
②每个C原子均可与相邻的4个C构成实心的正四面体,向空间无限延伸得到立体网状的金刚石晶体,在一个小正四面体中平均含有1+4×1/4 =2个碳原子;
③在金刚石中最小的环是六元环,1个环中平均含有6×1/12=1/2个C原子,含C-C键数为6×1/6=1;
④金刚石的晶胞中含有C原子为8个,内含4个小正四面体,含有C-C键数为16。180o109o28′SiO二氧化硅的晶体结构示意图共价键①二氧化硅中Si原子均以sp3杂化,分别与4个O原子成键,每个O原子与2个Si原子成键;
②晶体中的最小环为十二元环,其中有6个Si原子和6个O原子,含有12个Si-O键;每个Si原子被12个十二元环共有,每个O原子被6个十二元环共有,每个Si-O键被6个十二元环共有;每个十二元环所拥有的Si原子数为6×1/12=1/2,拥有的O原子数为6×1/6=1,拥有的Si-O键数为12×1/6=2,则Si原子数与O原子数之比为1:2。思考1
原子晶体的化学式是否可以代表其分子式?
不能。因为原子晶体是一个三维的网状结构,无小分子存在。
思考2
以金刚石为例,说明原子晶体的微观结构与分子晶体有哪些不同?
(1)组成微粒不同,原子晶体中只存在原子,没有分子。
(2)相互作用不同,原子晶体中存在的是共价键。4、原子晶体熔、沸点比较规律
对于原子晶体,一般来说,原子间键长越短,键能越大,共价键越稳定,物质的熔沸点越高,硬度越大。思考3
为何CO2熔沸点低?而破坏CO2分子却比SiO2更难?
??? 因为CO2是分子晶体,SiO2是原子晶体,所以熔化时CO2是破坏范德华力而SiO2是破坏化学键。所以SiO2熔沸点高。破坏CO2分子与SiO2时,都是破坏共价键,而C—O键能>Si-O键能,所以CO2分子更稳定。
思考4
怎样从原子结构角度理解金刚石、碳化硅和锗的熔点和硬度依次下降?
因为结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越高,所以熔点和硬度有如下关系:金刚石>碳化硅>锗。分子晶体、原子晶体结构与性质关系的比较 构成晶体粒子分子原子分子间作用力共价键结构、性质较小较大较低很高固态和熔融状态都不导电不导电相似相溶难溶于常见溶剂【总结】非金属单质是原子晶体还是分子晶体的判断方法
(1)依据组成晶体的粒子和粒子间的作用判断:原子晶体的粒子是原子,质点间的作用是共价键;分子晶体的粒子是分子,质点间的作用是范德华力。
(2)记忆常见的、典型的原子晶体。
(3)依据晶体的熔点判断:原子晶体熔、沸点高,常在1000℃以上;分子晶体熔、沸点低,常在数百度以下至很低的温度。
(4)依据导电性判断:分子晶体为非导体,但部分分子晶体溶于水后能导电;原子晶体多数为非导体,但晶体硅、晶体锗是半导体。
(5)依据硬度和机械性能判断:原子晶体硬度大,分子晶体硬度小且较脆。
?石墨晶体结构知识拓展-石墨(1)石墨中C原子以sp2杂化;
(2)石墨晶体中最小环为六元环,含有C
2个,C-C键为 3;
(3)石墨分层,层间为范德华力,硬度小,可导电;
(4)石墨中r(C-C)比金刚石中r(C-C)短。思考:(1)石墨为什么很软?
(2)石墨的熔沸点为什么很高?石墨的熔点为什么高于金刚石?
(3)石墨属于哪类晶体?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。它们都有很强的C-C共价键。在石墨中各层均为平面网状结构,碳原子之间存在很强的共价键(大π键), C-C键长比金刚石的短,键的强度大,故其熔点金刚石高。石墨为混合键型晶体。
例1. 氮化硅(Si3N4)是一种新型的耐高温耐磨材料,在工业上有广泛用途,它属于
原子晶体? B. 分子晶体??
C. 金属晶体???D. 离子晶体
答案:A
?典型例题例2 碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中C原子和S原子的位置是交替的。在下列三种晶体①金刚石? ②晶体硅? ③碳化硅中,它们的熔点从高到低的顺序是??? (??? )
A.①③②???? B.②③①??? C.③①②??? D.②①③
分析:C与Si同为IVA族元素,它们的相似性表现在金刚石是原子晶体,晶体硅,碳化硅也是原子晶体。从碳到硅原子半径逐渐增大,形成共价键的键能逐渐减弱。可推断碳化硅应在Si与C之间。三种原子晶体,空间结构相似,熔点决定于它们的键长与键能,故熔点从高到低分别是金刚石、碳化硅、晶体硅。
答案:A例3、单质硼有无定形和晶体两种,参考下表数据
(1)晶体硼的晶体类型属于________晶体,
理由是___________________。(2)已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有1个B原子。通过视察图形及推算,此晶体结构单元由_____个硼原子构成。其中B—B键的键角为_______。分析:晶体硼的熔、沸点和硬度都介于晶体Si和金刚石之间,而金刚石和晶体Si均为原子晶体,B与C相邻与Si处于对角线处,则晶体硼也为原子晶体。晶体硼每个三角形的顶点被5个三角形所共有,所以,此顶点完全属于一个三角形的只占到1/5,每个三角形中有3个这样的点,且晶体B中有20个这样的三角形,因此,晶体B中这样的顶点(B原子)有3/5×20=12个。又因晶体硼中的三角形面为正三角形,所以键角为60°。
答案:原子,晶体硼具有很高的熔沸点和很大的硬度;12,60°
?再见
选修3系列课件物质结构与性质3.2《分子晶体与 原子晶体》教学目标 知识与能力
1、使学生了解分子晶体的组成粒子、结构模型和结构特点及其性质的一般特点。
2、使学生了解晶体类型与性质的关系。
3、使学生理解分子间作用力和氢键对物质物理性质的影响。
4、知道一些常见的属于分子晶体的物质类别。
5、使学生主动参与科学探究,体验研究过程,激发他们的学习兴趣。
6、掌握原子晶体的概念,能够区分原子晶体和分子晶体。
7、了解金刚石等典型原子晶体的结构特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。教学重点难点:
重点:掌握分子晶体的结构特点和性质特点;原子晶体的结构与性质的关系
难点:是氢键的方向性和氢键对物体物理性质的影响
从三维空间结构认识晶胞的组成结构
教学方法建议:
运用模型和类比方法诱导分析归纳
微粒为分子:
分子间作用力(或范德华力)或氢键;
微粒为原子:极性共价键或非极性共价键;
微粒为离子:离子键。
复习总结:微粒间作用思考与交流
石墨和金刚石同属于碳的单质,为什么在硬度上会相差如此之大?
观察与思考: 下列两种晶体有什么共同点?碘晶体结构干冰晶体结构一、分子晶体1、概念
分子间以分子间作用力(范德华力,氢键)相结合的晶体叫分子晶体
(1)构成分子晶体的粒子是分子。
(2)粒子间的相互作用是分子间作用力。
(3)范德华力远小于化学键的作用;
(4)分子晶体熔化破坏的是分子间作用力。分子晶体有哪些物理特性,为什么?思考与交流
(1)较低的熔点和沸点,易升华;
(2)较小的硬度;
(3)一般都是绝缘体,熔融状态也不导电。原因:分子间作用力较弱2、物理特性:3、典型的分子晶体:
非金属氢化物:H2O,H2S,NH3,CH4,HX
酸:H2SO4,HNO3,H3PO4
部分非金属单质:X2,O2,H2, S8,P4, C60
部分非金属氧化物: CO2, SO2, NO2, P4O6, P4O10
大多数有机物:乙醇,冰醋酸,蔗糖4、分子晶体结构特征
只有范德华力,无分子间氢键——分子密堆积
每个分子周围有12个紧邻的分子,如:C60、干冰 、I2、O2
有分子间氢键——不具有分子密堆积特征
如:HF 、冰、NH3 分子的密堆积(与每个分子距离最近的相同分子共有12个 )氧(O2)的晶体结构碳60的晶胞分子的密堆积(与CO2分子距离最近的CO2分子共有12个 )干冰的晶体结构图冰中1个水分子周围有4个水分子冰的结构氢键具有方向性分子的非密堆积思考:1mol冰周围有?mol氢键冰中1个水分子周围有4个水分子形成什么空间构型?〖归纳要点〗分子的密度取决于晶体的体积,取决于紧密堆积程度,分子晶体的紧密堆积由以下两个因素决定:(1)范德华力
(2)分子间氢键
5、分子晶体熔、沸点高低的比较规律
分子晶体要熔化或汽化都需要克服分子间的作用力。分子间作用力越大,物质熔化和汽化时需要的能量就越多,物质的熔、沸点就越高。
因此,比较分子晶体的熔、沸点高低,实际上就是比较分子间作用力(包括范力和氢键)的大小。(1)组成和结构相似的物质,相对分子质量越大,范德华力越大,熔沸点越高。如:O2>N2,HI>HBr>HCl。
(2)分子量相等或相近,极性分子的范德华力大,熔沸点高,如CO>N2
(3)含有氢键的,熔沸点较高。如H2O>H2Te>H2Se>H2S,HF>HCl,NH3>PH3
(4)在烷烃的同分异构体中,一般来说,支链数越多,熔沸点越低。如沸点:正戊烷>异戊烷>新戊烷;芳香烃及其衍生物苯环上的同分异构体一般按照“邻位>间位>对位”的顺序。〖思考1〗是不是在分子晶体中分子间只存在范德华力?
〖思考2〗为什么冰融化为水时,密度增大?
不对,分子间氢键也是一种分子间作用力,
如冰中就同时存在着范德华力和氢键。在冰晶体中,每个分子周围只有4个紧邻的水分子,由于水分子之间的主要作用力是氢键,氢键跟共价键一样具有方向性,即氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不变,留有相当大的空隙。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大。〖思考3〗为何干冰的熔沸点比冰低,密度却比冰大? 由于冰中除了范德华力外还有氢键作用,破坏分子间作用力较难,所以熔沸点比干冰高。
由于分子间作用力特别是氢键的方向性,导致晶体中有相当大的空隙,所以相同状况下体积较大
由于CO2分子的相对分子质量>H2O,所以干冰的密度大。
科学视野:笼装化合物20世纪末,科学家发现海底存在大量天然气水合物晶体。这种晶体的主要气体成分是甲烷, 因而又称甲烷水合物。它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”………笼装化合物思考与交流CO2和SiO2的一些物理性质如下表所示,通过比较试判断SiO2晶体是否属于分子晶体。
碳元素和硅元素处于元素周期表中同一主族,为什么CO2晶体的熔、沸点很低,而SiO2晶体的熔沸点很高?180o109o28′SiO共价键二氧化硅晶体结构示意图109o28′共价键金刚石的晶体结构示意图二.原子晶体(共价晶体)1、概念:
相邻原子间以共价键相结合而形成空间立体网状结构的晶体。
(1)构成原子晶体的粒子是原子;
(2)原子晶体的粒子间以较强的共价键相结合;
(3)原子晶体熔化破坏的是共价键。观察·思考对比分子晶体和原子晶体的数据,原子晶体有何物理特性?2、原子晶体的物理特性在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状结构,所以原子晶体的
熔点和沸点高
硬度大
一般不导电
且难溶于一些常见的溶剂 在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状结构,所以原子晶体有特殊的物理性质。3、常见的原子晶体某些非金属单质:
金刚石(C)、晶体硅(Si)、晶体硼(B)、晶体锗(Ge)等
某些非金属化合物:
碳化硅(SiC)晶体、氮化硼(BN)晶体
某些氧化物:
二氧化硅( SiO2)晶体、Al2O3109o28′金刚石的晶体结构示意图共价键 思考:在金刚石晶体中,每个碳与周围多少个碳原子成键?形成怎样的空间结构?最小碳环由多少个碳原子组成?它们是否在同一平面内? 在金刚石晶体中,碳原子个数与C-C键数之比为多少?12g金刚石C-C键数为多少NA?①金刚石中每个C原子以sp3杂化,分别与4个相邻的C 原子形成4个σ键,故键角为109°28′,每个C原子的配位数为4;
②每个C原子均可与相邻的4个C构成实心的正四面体,向空间无限延伸得到立体网状的金刚石晶体,在一个小正四面体中平均含有1+4×1/4 =2个碳原子;
③在金刚石中最小的环是六元环,1个环中平均含有6×1/12=1/2个C原子,含C-C键数为6×1/6=1;
④金刚石的晶胞中含有C原子为8个,内含4个小正四面体,含有C-C键数为16。180o109o28′SiO二氧化硅的晶体结构示意图共价键①二氧化硅中Si原子均以sp3杂化,分别与4个O原子成键,每个O原子与2个Si原子成键;
②晶体中的最小环为十二元环,其中有6个Si原子和6个O原子,含有12个Si-O键;每个Si原子被12个十二元环共有,每个O原子被6个十二元环共有,每个Si-O键被6个十二元环共有;每个十二元环所拥有的Si原子数为6×1/12=1/2,拥有的O原子数为6×1/6=1,拥有的Si-O键数为12×1/6=2,则Si原子数与O原子数之比为1:2。思考1
原子晶体的化学式是否可以代表其分子式?
不能。因为原子晶体是一个三维的网状结构,无小分子存在。
思考2
以金刚石为例,说明原子晶体的微观结构与分子晶体有哪些不同?
(1)组成微粒不同,原子晶体中只存在原子,没有分子。
(2)相互作用不同,原子晶体中存在的是共价键。4、原子晶体熔、沸点比较规律
对于原子晶体,一般来说,原子间键长越短,键能越大,共价键越稳定,物质的熔沸点越高,硬度越大。思考3
为何CO2熔沸点低?而破坏CO2分子却比SiO2更难?
??? 因为CO2是分子晶体,SiO2是原子晶体,所以熔化时CO2是破坏范德华力而SiO2是破坏化学键。所以SiO2熔沸点高。破坏CO2分子与SiO2时,都是破坏共价键,而C—O键能>Si-O键能,所以CO2分子更稳定。
思考4
怎样从原子结构角度理解金刚石、碳化硅和锗的熔点和硬度依次下降?
因为结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越高,所以熔点和硬度有如下关系:金刚石>碳化硅>锗。分子晶体、原子晶体结构与性质关系的比较 构成晶体粒子分子原子分子间作用力共价键结构、性质较小较大较低很高固态和熔融状态都不导电不导电相似相溶难溶于常见溶剂【总结】非金属单质是原子晶体还是分子晶体的判断方法
(1)依据组成晶体的粒子和粒子间的作用判断:原子晶体的粒子是原子,质点间的作用是共价键;分子晶体的粒子是分子,质点间的作用是范德华力。
(2)记忆常见的、典型的原子晶体。
(3)依据晶体的熔点判断:原子晶体熔、沸点高,常在1000℃以上;分子晶体熔、沸点低,常在数百度以下至很低的温度。
(4)依据导电性判断:分子晶体为非导体,但部分分子晶体溶于水后能导电;原子晶体多数为非导体,但晶体硅、晶体锗是半导体。
(5)依据硬度和机械性能判断:原子晶体硬度大,分子晶体硬度小且较脆。
?石墨晶体结构知识拓展-石墨(1)石墨中C原子以sp2杂化;
(2)石墨晶体中最小环为六元环,含有C
2个,C-C键为 3;
(3)石墨分层,层间为范德华力,硬度小,可导电;
(4)石墨中r(C-C)比金刚石中r(C-C)短。思考:(1)石墨为什么很软?
(2)石墨的熔沸点为什么很高?石墨的熔点为什么高于金刚石?
(3)石墨属于哪类晶体?石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软。它们都有很强的C-C共价键。在石墨中各层均为平面网状结构,碳原子之间存在很强的共价键(大π键), C-C键长比金刚石的短,键的强度大,故其熔点金刚石高。石墨为混合键型晶体。
例1. 氮化硅(Si3N4)是一种新型的耐高温耐磨材料,在工业上有广泛用途,它属于
原子晶体? B. 分子晶体??
C. 金属晶体???D. 离子晶体
答案:A
?典型例题例2 碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中C原子和S原子的位置是交替的。在下列三种晶体①金刚石? ②晶体硅? ③碳化硅中,它们的熔点从高到低的顺序是??? (??? )
A.①③②???? B.②③①??? C.③①②??? D.②①③
分析:C与Si同为IVA族元素,它们的相似性表现在金刚石是原子晶体,晶体硅,碳化硅也是原子晶体。从碳到硅原子半径逐渐增大,形成共价键的键能逐渐减弱。可推断碳化硅应在Si与C之间。三种原子晶体,空间结构相似,熔点决定于它们的键长与键能,故熔点从高到低分别是金刚石、碳化硅、晶体硅。
答案:A例3、单质硼有无定形和晶体两种,参考下表数据
(1)晶体硼的晶体类型属于________晶体,
理由是___________________。(2)已知晶体硼结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有1个B原子。通过视察图形及推算,此晶体结构单元由_____个硼原子构成。其中B—B键的键角为_______。分析:晶体硼的熔、沸点和硬度都介于晶体Si和金刚石之间,而金刚石和晶体Si均为原子晶体,B与C相邻与Si处于对角线处,则晶体硼也为原子晶体。晶体硼每个三角形的顶点被5个三角形所共有,所以,此顶点完全属于一个三角形的只占到1/5,每个三角形中有3个这样的点,且晶体B中有20个这样的三角形,因此,晶体B中这样的顶点(B原子)有3/5×20=12个。又因晶体硼中的三角形面为正三角形,所以键角为60°。
答案:原子,晶体硼具有很高的熔沸点和很大的硬度;12,60°
?再见
