新人教版选修3化学-3.4《离子晶体》ppt课件 (共37张PPT)
文档属性
| 名称 | 新人教版选修3化学-3.4《离子晶体》ppt课件 (共37张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 865.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-02 10:16:20 | ||
图片预览







文档简介
课件37张PPT。高中《化学》新人教版
选修3系列课件物质结构与性质3.4《离子晶体》教学目标 知识与能力:
1.掌握离子晶体的概念,能识别氯化钠、氯化铯、氟化钙的晶胞结构。
2.学会离子晶体的性质与晶胞结构的关系。
3.通过探究知道离子晶体的配位数与离子半径比的关系。
4、通过碳酸盐的热分解温度与阳离子半径的自学,拓展学生视野。
5、通过分析数据和信息,能说明晶格能的大小与离子晶体性质的关系。 教学重点难点:
1、离子晶体的物理性质的特点
2、离子晶体配位数及其影响因素
3、晶格能的定义和应用
教学方法建议:
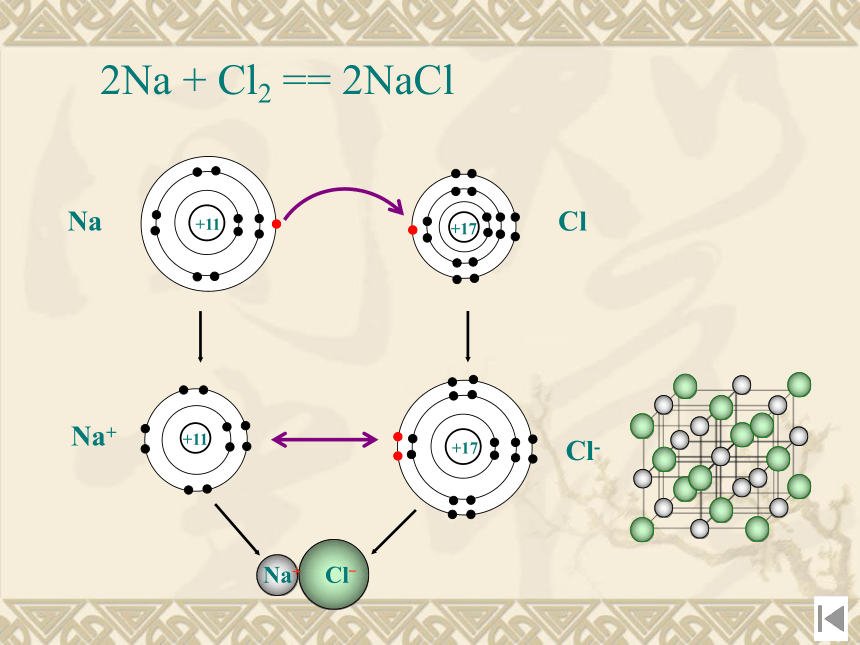
分析、归纳、讨论、探究2Na + Cl2 == 2NaCl 一、离子晶体1、定义:由阳离子和阴离子通过离
子键结合而成的晶体。
2、成键粒子:阴、阳离子
3、相互作用力:离子键4、常见的离子晶体:
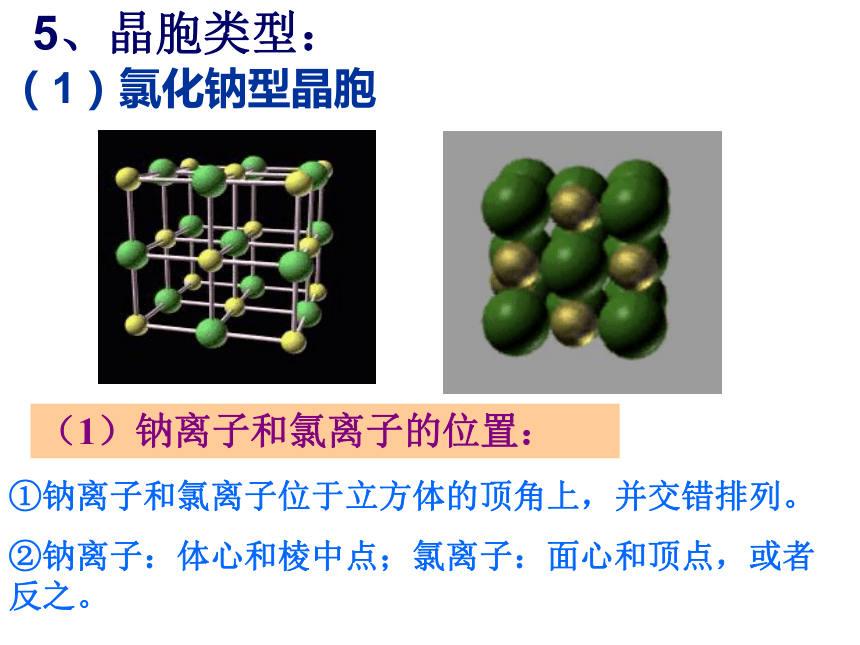
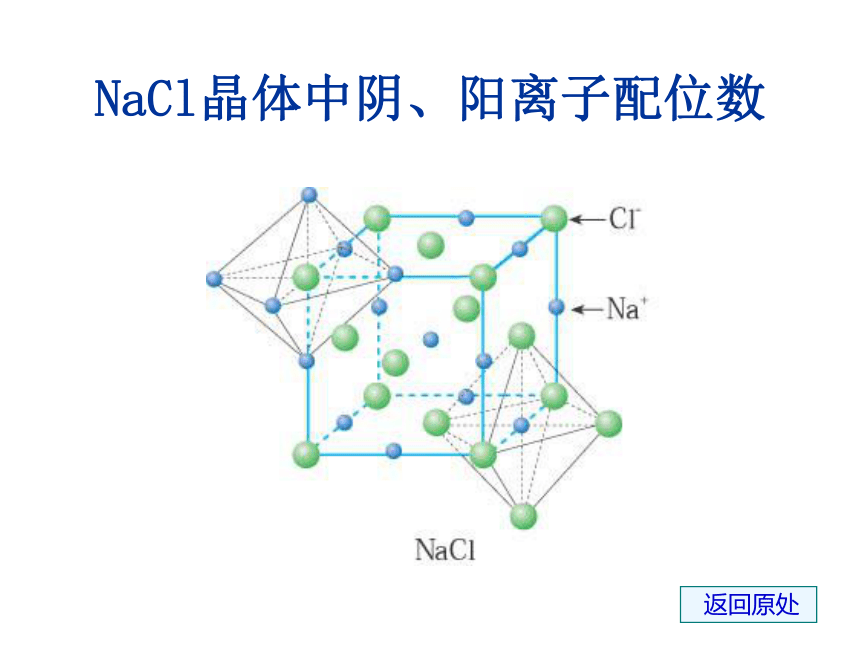
强碱、活泼金属氧化物、大部分的盐类。可见:在NaCl晶体中,钠离子、氯离子按一定的规律在空间排列成立方体。主页5、晶胞类型:(1)氯化钠型晶胞(1)钠离子和氯离子的位置:①钠离子和氯离子位于立方体的顶角上,并交错排列。
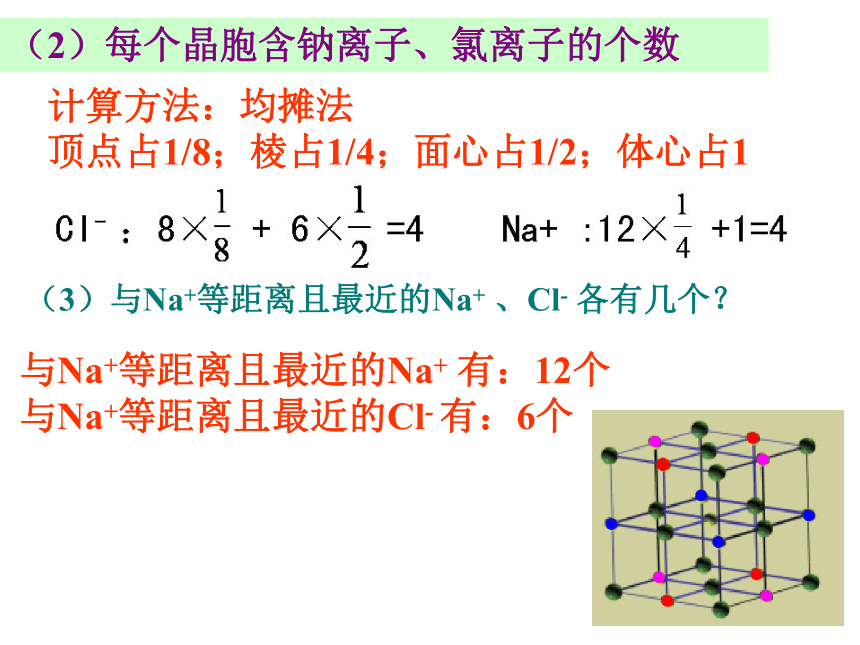
②钠离子:体心和棱中点;氯离子:面心和顶点,或者反之。5、晶胞类型:(1)氯化钠型晶胞(3)与Na+等距离且最近的Na+ 、Cl- 各有几个? 计算方法:均摊法
顶点占1/8;棱占1/4;面心占1/2;体心占1 (2)每个晶胞含钠离子、氯离子的个数与Na+等距离且最近的Na+ 有:12个
与Na+等距离且最近的Cl- 有:6个
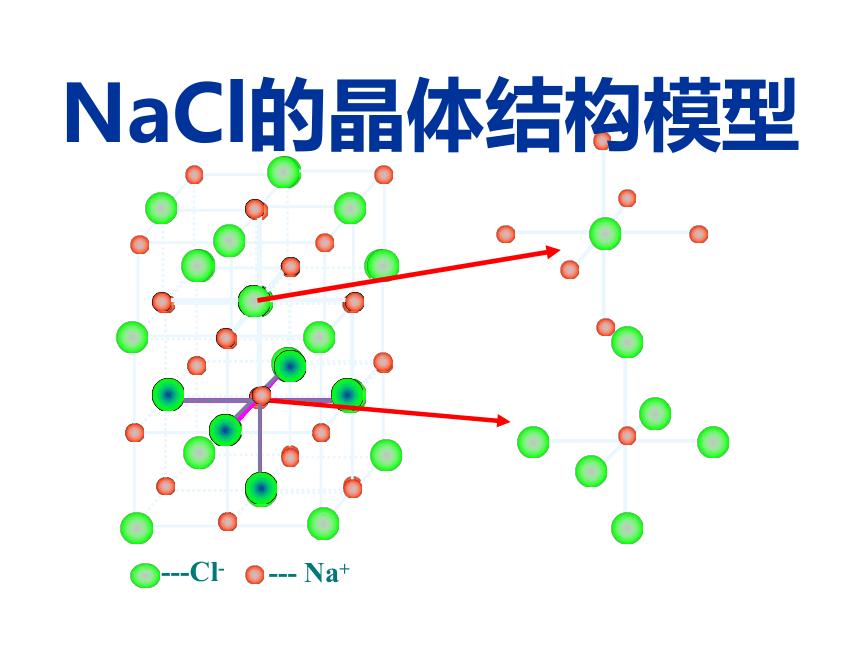
NaCl的晶体结构模型NaCl晶体中阴、阳离子配位数 返回原处(2)氯化铯型晶胞CsCl的晶体结构及晶胞构示意图CsCl晶胞(1)铯离子和氯离子的位置:铯离子:体心
氯离子:顶点;或者反之。(2)每个晶胞含铯离子、氯离子的个数铯离子:1个 ;氯离子:1个(3)与铯离子等距离且最近的铯离子、氯离子各有几个?铯离子:6个 ;氯离子:8个(3)CaF2型晶胞①Ca2+的配位数:8②F-的配位数:4③一个CaF2晶胞中含: 4个Ca2+和8个F-(4)ZnS型晶胞①阳离子的配位数:4②阴离子的配位数:4③一个ZnS晶胞中含: 4个阳离子和4个阴离子科学探究:找出CsCl、NaCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?6688科学探究:你认为是什么因素决定了离子晶体中离子的配位数?根据表3—5、表3—6分析影响离子晶体中离子配位数的因素。决定离子晶体结构的因素几何因素
晶体中正负离子的半径比
电荷因素
晶体中正负离子的电荷比
键性因素
离子键的纯粹因素科学视野[阅读思考] 碳酸盐热分解的实质是什么?
表3-7的有关数值说明了什么? 组成碳酸盐中阳离子的金属的金属性越弱,金属阳离子的半径越小,碳酸盐的热稳定性越差,反之越好。二、晶格能定义:气态离子形成1摩离子晶体时释放的能量。
晶格能的大小与阴、阳离子所带电荷的乘积成正比,与阴、阳离子间的距离成反比。
简言之,晶格能的大小与离子带电量成正比,与离子半径成反比. 晶格能越大:
形成的离子晶体越稳定;(离子键越强)
熔点越高;硬度越大。仔细阅读表3—8,分析晶格能的大小与离子晶体的熔点有什么关系?离子晶体的晶格能与哪些因素有关?总结离子晶体有什么特点?
无单个分子存在;NaCl不表示分子式。
熔沸点较高,硬度较大,难挥发难压缩。且随着离子电荷的增加,核间距离的缩短,晶格能增大,熔点升高。
一般易溶于水,而难溶于非极性溶剂。
固态不导电,水溶液或者熔融状态下能导电。
哪些物质属于离子晶体?
强碱、部分金属氧化物、部分盐类。各类型离子晶体晶胞的比较Na+:6Cl-:6Cs+:Cl-:88Zn2+:S2-:44Ca2+:F-:48Na+:Cl-:Cs+:Cl-:Zn2+:S2-:Ca2+:F-:Na+:Cl-:Cs+:Cl-:Zn2+:S2-:Ca2+:F-:6688444844114484KBr AgCl、MgO、CaS、BaSeZnS、AgI、
BeOCsCl、CsBr、CsI、TlCl碱土金属卤化物、碱金属氧化物。【总结归纳】物质的熔点与晶体类型的关系
1、若晶体类型不同,一般情况下:原子晶体>离子晶体>分子晶体。
2、若晶体类型相同,则有:
⑴离子晶体中,结构相似时,离子半径越小,离子电荷越高,晶格能越大,离子键就越强,熔点就越高。
⑵原子晶体中,结构相似时,原子半径越小,共价键键长越短,键能越大,熔点越高。
⑶分子晶体中(不含氢键时),分子组成和结构相似时,相对分子质量越大,范德华力就越强,熔点就越高。
⑷金属晶体中,离子半径越小,离子电荷越高,金属键就越强,熔点就越高。合金的熔点比它的各成分金属的熔点低。练习 1、下表列出了有关晶体的知识,其中错误的是( )
2、下列物质的晶体,按其熔点由低到高的排列顺序正确的是( )
A.NaCl、SiO2、CO2 B.NaCl、CO2、SiO2
C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO
3、用离子的电荷和半径解释下列离子晶体熔点高低的顺序。
(1)MgO>KCl (2)MgO>SrS
(3)NaF>NaCl>NaBrBC1 23 45 68 78 中学教材上图示的NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO晶体结构与NaCl相同,Ni2+与邻近的O2-核间距为a×10-8 ㎝,计算NiO晶体密度(已知NiO摩尔质量为74.7g·mol-1)解:在该晶体中最小正方体中所含的
Ni2+、O2-个数均为:即晶体中每个小正方体中平均含有1/2个
NiO.其质量为:而此小正方体体积为(a×10-8㎝)3故NiO晶体密度为:总结课 堂 练 习 题(a×10-8㎝)3综合应用变式 (1)NiO晶体结构与NaCl相同,设NiO的摩尔质量M g/mol,密度为ρg/mL,阿伏加德罗常数为NA,求晶胞中两个距离最近的氧离子中心间的距离为多少cm?解题思路: (1)每个晶胞中含NiO的个数(2)一个晶胞的质量(3)一个晶胞的体积(4)晶胞的边长(5)晶胞中任一个面对角线长度的一半主页综合应用(2)天然的和大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在以下缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。 返回主菜单参考答案: Ni3+ :Ni2+=6 :91 本题命题角度较新颖,实际上难度不大,第(2)题所提供的Ni0.97O信息,实际上是一种“平均化学式”。尽管题给示意图及题目叙述中提到了有“Ni2+”空缺,但“Ni0.97O”的平均化学式与所述的“空缺”无关,它只是遵循着电中性原则,即由于掺杂多带一个电荷的Ni3+代替了部分Ni2+ ,才使“NiO”变成了“Ni0.97O”。 一题多解:
( 1)由题意可得氧化镍中有许多由4个Ni2+和4个O2-相邻且占据顶点的小立方体构成,如图所示:此小立方体的每个Ni2+与O2-均为8个小立方体共用,因此小立方体拥有Ni2+与O2-均为:4×4/8=1/2,取1 mol晶体,则含有6.02×1023/(1/2)个小立方体。晶体密度 = m/V=74.7g÷[(a×10-8cm)3×6.02×1023/(1/2)]=62.0/a3 g·cm-3。(2)0.97 mol的镍离子的平均带电量为2,那么1 mol镍离子的平均带电量为2/0.97,这是+2和+3价的镍离子的共同电量,由此可列方程式。不同于上解的是,这种做法将0.97 mol镍离子化为1 mol镍离子来计算。
设1molNi中含Ni2+ x mol,则含Ni3+(1-x)mol,根据电荷守恒:
2x+3(1-x)=2/0.97
x=91/97
n(Ni3+)∶n(Ni2+)=(1-91/97)∶91/97=6∶91 法三:因为中Nio.97O中既有+2价的离子又有+3价的镍离子,所以可写成xNiO·yNi2O3的复合形式,该形式中很容易看出镍离子的总和为x+2y,氧离子的总和为x+3y,因此可列方程如下:
x+2y=0.97 镍离子个数守恒
x+3y=1 氧离子个数守恒
或者列成分式形式:(x+2y )/(x+3y)=0.97/1 同样可以求出三价镍与二价镍离子数目之比。
主页可以整体移动的晶胞 可以整体移动的晶格CaF2的晶胞 返回原处NaCl晶体中阴、阳离子配位数 返回原处某些离子晶体的晶格能 返回原处卤化钠及碱土金属离子晶体 返回原处再见
选修3系列课件物质结构与性质3.4《离子晶体》教学目标 知识与能力:
1.掌握离子晶体的概念,能识别氯化钠、氯化铯、氟化钙的晶胞结构。
2.学会离子晶体的性质与晶胞结构的关系。
3.通过探究知道离子晶体的配位数与离子半径比的关系。
4、通过碳酸盐的热分解温度与阳离子半径的自学,拓展学生视野。
5、通过分析数据和信息,能说明晶格能的大小与离子晶体性质的关系。 教学重点难点:
1、离子晶体的物理性质的特点
2、离子晶体配位数及其影响因素
3、晶格能的定义和应用
教学方法建议:
分析、归纳、讨论、探究2Na + Cl2 == 2NaCl 一、离子晶体1、定义:由阳离子和阴离子通过离
子键结合而成的晶体。
2、成键粒子:阴、阳离子
3、相互作用力:离子键4、常见的离子晶体:
强碱、活泼金属氧化物、大部分的盐类。可见:在NaCl晶体中,钠离子、氯离子按一定的规律在空间排列成立方体。主页5、晶胞类型:(1)氯化钠型晶胞(1)钠离子和氯离子的位置:①钠离子和氯离子位于立方体的顶角上,并交错排列。
②钠离子:体心和棱中点;氯离子:面心和顶点,或者反之。5、晶胞类型:(1)氯化钠型晶胞(3)与Na+等距离且最近的Na+ 、Cl- 各有几个? 计算方法:均摊法
顶点占1/8;棱占1/4;面心占1/2;体心占1 (2)每个晶胞含钠离子、氯离子的个数与Na+等距离且最近的Na+ 有:12个
与Na+等距离且最近的Cl- 有:6个
NaCl的晶体结构模型NaCl晶体中阴、阳离子配位数 返回原处(2)氯化铯型晶胞CsCl的晶体结构及晶胞构示意图CsCl晶胞(1)铯离子和氯离子的位置:铯离子:体心
氯离子:顶点;或者反之。(2)每个晶胞含铯离子、氯离子的个数铯离子:1个 ;氯离子:1个(3)与铯离子等距离且最近的铯离子、氯离子各有几个?铯离子:6个 ;氯离子:8个(3)CaF2型晶胞①Ca2+的配位数:8②F-的配位数:4③一个CaF2晶胞中含: 4个Ca2+和8个F-(4)ZnS型晶胞①阳离子的配位数:4②阴离子的配位数:4③一个ZnS晶胞中含: 4个阳离子和4个阴离子科学探究:找出CsCl、NaCl两种离子晶体中阳离子和阴离子的配位数,它们是否相等?6688科学探究:你认为是什么因素决定了离子晶体中离子的配位数?根据表3—5、表3—6分析影响离子晶体中离子配位数的因素。决定离子晶体结构的因素几何因素
晶体中正负离子的半径比
电荷因素
晶体中正负离子的电荷比
键性因素
离子键的纯粹因素科学视野[阅读思考] 碳酸盐热分解的实质是什么?
表3-7的有关数值说明了什么? 组成碳酸盐中阳离子的金属的金属性越弱,金属阳离子的半径越小,碳酸盐的热稳定性越差,反之越好。二、晶格能定义:气态离子形成1摩离子晶体时释放的能量。
晶格能的大小与阴、阳离子所带电荷的乘积成正比,与阴、阳离子间的距离成反比。
简言之,晶格能的大小与离子带电量成正比,与离子半径成反比. 晶格能越大:
形成的离子晶体越稳定;(离子键越强)
熔点越高;硬度越大。仔细阅读表3—8,分析晶格能的大小与离子晶体的熔点有什么关系?离子晶体的晶格能与哪些因素有关?总结离子晶体有什么特点?
无单个分子存在;NaCl不表示分子式。
熔沸点较高,硬度较大,难挥发难压缩。且随着离子电荷的增加,核间距离的缩短,晶格能增大,熔点升高。
一般易溶于水,而难溶于非极性溶剂。
固态不导电,水溶液或者熔融状态下能导电。
哪些物质属于离子晶体?
强碱、部分金属氧化物、部分盐类。各类型离子晶体晶胞的比较Na+:6Cl-:6Cs+:Cl-:88Zn2+:S2-:44Ca2+:F-:48Na+:Cl-:Cs+:Cl-:Zn2+:S2-:Ca2+:F-:Na+:Cl-:Cs+:Cl-:Zn2+:S2-:Ca2+:F-:6688444844114484KBr AgCl、MgO、CaS、BaSeZnS、AgI、
BeOCsCl、CsBr、CsI、TlCl碱土金属卤化物、碱金属氧化物。【总结归纳】物质的熔点与晶体类型的关系
1、若晶体类型不同,一般情况下:原子晶体>离子晶体>分子晶体。
2、若晶体类型相同,则有:
⑴离子晶体中,结构相似时,离子半径越小,离子电荷越高,晶格能越大,离子键就越强,熔点就越高。
⑵原子晶体中,结构相似时,原子半径越小,共价键键长越短,键能越大,熔点越高。
⑶分子晶体中(不含氢键时),分子组成和结构相似时,相对分子质量越大,范德华力就越强,熔点就越高。
⑷金属晶体中,离子半径越小,离子电荷越高,金属键就越强,熔点就越高。合金的熔点比它的各成分金属的熔点低。练习 1、下表列出了有关晶体的知识,其中错误的是( )
2、下列物质的晶体,按其熔点由低到高的排列顺序正确的是( )
A.NaCl、SiO2、CO2 B.NaCl、CO2、SiO2
C.NaCl、MgO、SiO2 D.NaCl、SiO2、MgO
3、用离子的电荷和半径解释下列离子晶体熔点高低的顺序。
(1)MgO>KCl (2)MgO>SrS
(3)NaF>NaCl>NaBrBC1 23 45 68 78 中学教材上图示的NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO晶体结构与NaCl相同,Ni2+与邻近的O2-核间距为a×10-8 ㎝,计算NiO晶体密度(已知NiO摩尔质量为74.7g·mol-1)解:在该晶体中最小正方体中所含的
Ni2+、O2-个数均为:即晶体中每个小正方体中平均含有1/2个
NiO.其质量为:而此小正方体体积为(a×10-8㎝)3故NiO晶体密度为:总结课 堂 练 习 题(a×10-8㎝)3综合应用变式 (1)NiO晶体结构与NaCl相同,设NiO的摩尔质量M g/mol,密度为ρg/mL,阿伏加德罗常数为NA,求晶胞中两个距离最近的氧离子中心间的距离为多少cm?解题思路: (1)每个晶胞中含NiO的个数(2)一个晶胞的质量(3)一个晶胞的体积(4)晶胞的边长(5)晶胞中任一个面对角线长度的一半主页综合应用(2)天然的和大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在以下缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。 返回主菜单参考答案: Ni3+ :Ni2+=6 :91 本题命题角度较新颖,实际上难度不大,第(2)题所提供的Ni0.97O信息,实际上是一种“平均化学式”。尽管题给示意图及题目叙述中提到了有“Ni2+”空缺,但“Ni0.97O”的平均化学式与所述的“空缺”无关,它只是遵循着电中性原则,即由于掺杂多带一个电荷的Ni3+代替了部分Ni2+ ,才使“NiO”变成了“Ni0.97O”。 一题多解:
( 1)由题意可得氧化镍中有许多由4个Ni2+和4个O2-相邻且占据顶点的小立方体构成,如图所示:此小立方体的每个Ni2+与O2-均为8个小立方体共用,因此小立方体拥有Ni2+与O2-均为:4×4/8=1/2,取1 mol晶体,则含有6.02×1023/(1/2)个小立方体。晶体密度 = m/V=74.7g÷[(a×10-8cm)3×6.02×1023/(1/2)]=62.0/a3 g·cm-3。(2)0.97 mol的镍离子的平均带电量为2,那么1 mol镍离子的平均带电量为2/0.97,这是+2和+3价的镍离子的共同电量,由此可列方程式。不同于上解的是,这种做法将0.97 mol镍离子化为1 mol镍离子来计算。
设1molNi中含Ni2+ x mol,则含Ni3+(1-x)mol,根据电荷守恒:
2x+3(1-x)=2/0.97
x=91/97
n(Ni3+)∶n(Ni2+)=(1-91/97)∶91/97=6∶91 法三:因为中Nio.97O中既有+2价的离子又有+3价的镍离子,所以可写成xNiO·yNi2O3的复合形式,该形式中很容易看出镍离子的总和为x+2y,氧离子的总和为x+3y,因此可列方程如下:
x+2y=0.97 镍离子个数守恒
x+3y=1 氧离子个数守恒
或者列成分式形式:(x+2y )/(x+3y)=0.97/1 同样可以求出三价镍与二价镍离子数目之比。
主页可以整体移动的晶胞 可以整体移动的晶格CaF2的晶胞 返回原处NaCl晶体中阴、阳离子配位数 返回原处某些离子晶体的晶格能 返回原处卤化钠及碱土金属离子晶体 返回原处再见
