江苏省宜兴市树人中学2016-2017学年第一学期初三化学第五单元《质量守恒定律》复习课件(共18张PPT)
文档属性
| 名称 | 江苏省宜兴市树人中学2016-2017学年第一学期初三化学第五单元《质量守恒定律》复习课件(共18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 752.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-02 15:30:34 | ||
图片预览






文档简介
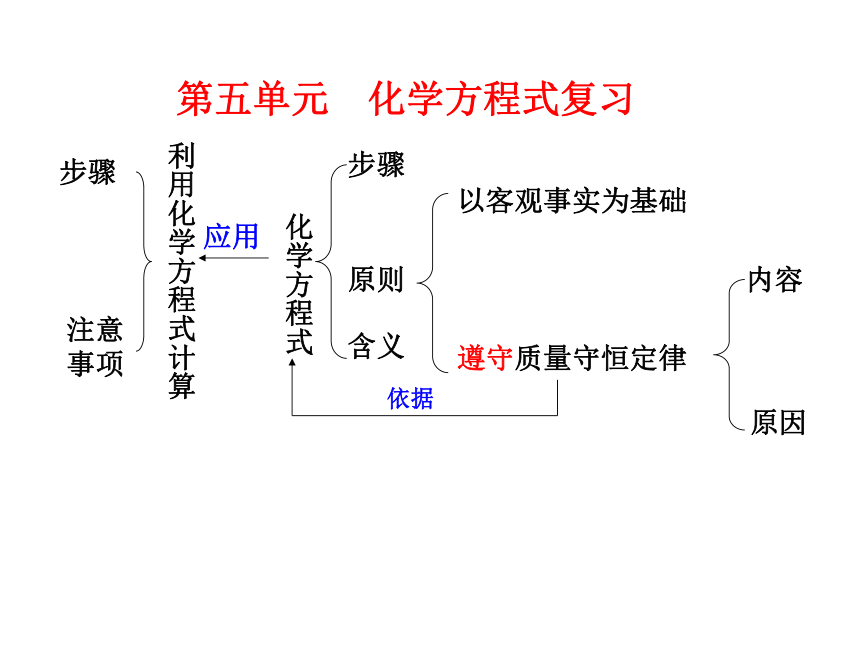
课件18张PPT。第五单元 化学方程式复习①能用质量守恒定律解释生活现象,并判断物质的组成、化学式等。
②理解质量守恒定律,能说明化学反应中的质量关系。
③能正确书写化学方程式,并进行简单计算。
④认识定量研究对于化学科学发展的重大作用。复习目标下列变化不符合质量守恒定律的是( )
A.镁在空气中燃烧后,生成物的质量比原来镁条的质量大
B.水加热一段时间后质量变小
C.4g氢气在34g氧气中充分燃烧生成36g水
D.高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小B二甲醚(CH3OCH3)可由一氧化碳和物质X在一定的条件下制得。反应的化学方程式为:
2CO+4X ========== CH3OCH3 + H2O。则X的化学式为? ( )
A.C2H5OH B.H2O2?
C.C2H4? D.H2??一定条件D山茶油是一种绿色保健品,其主要成分
是柠檬醛。现从山茶油中提取7.6 g柠
檬醛,使其在氧气中完全燃烧,只生成
22 g二氧化碳和7.2 g水,则柠檬醛中
各元素的质量比为 。
C:H:O=15:2:2化学反应前后肯定没有变化的是( )
①原子数目②分子数目③元素种类
④ 物质种类⑤原子种类⑥物质的总质量
①④⑥ B.①③⑤⑥
C.①②⑥ D.②③⑤B铜在空气中长时间暴露会与空气中的氧气和
空气中另外两种常见物质发生化学反应而生成
绿色的铜绿,铜绿的化学式为[Cu2(OH)2CO3]。
请判断:生成铜绿时,参加反应的空气中的另外
两种物质是________和________。H2OCO2写出下列反应的化学方程式:
1.镁粉和氧化铜在高温条件下反应生成一种
紫红色单质和一种白色氧化物。
2.二氧化碳是常见的灭火剂,但金属镁着火
却不能用二氧化碳扑灭,因为镁能在二氧化碳
中继续燃烧,生成黑色和白色两种固体粉末。如图,四位同学正在讨论某一个化学方程式表示的意义。下列四个化学方程式中,同时符合这四位同学所描述的是 ( )C在反应A+3B=2C+2D中,A、B的相对分子质量之比
为9:11。已知1.8gA与一定量B恰好完全反应,生成5.1gD。则在此反应中,B与C的质量比为 ( )
A、2:1 B、3:4 C、12:11 D、1:1A下图表示治理汽车尾气所涉及反应的微观过程。下列说法正确的是 ( )
A. 该反应不符合质量守恒定律
B. 生成单质与化合物的质量比为7:22
C. 该反应属于置换反应??
D. 生成物的分子个数比为1:1??B在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下存在某个反应,测得反应过程中各物质的质量变化如下表:
对该反应,下列描述正确的是 ( )
A.该反应是分解反应
B.乙的待测质量一定为4 g
C.乙在该反应中可能是催化剂
D.参加反应的甲、丙、丁的质量比为1∶16∶13AC某研究性小组在实验室中模拟炼铁化学原理的实验。
I.定性探究
在一定温度下,该小组同学用一氧化碳还原纯净的氧化铁(实验装置如下图,从环保角度看,该小组设计的实验装置有不足之处,你认为该如何改进?_________________________),
观察到玻璃管内固体由红色全部变为黑色。
小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家分头查阅资料。【查阅资料】
(1)一氧化碳还原氧化铁的固体产物的成分与反应温度、
反应时间等因素有关。
(2)一氧化碳还原氧化铁的实验过程中固体产物可能有
四氧化三铁、氧化亚铁、铁。
(3)
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁
吸引,发现黑色固体全部能被吸引,则该黑色固体中
不可能含有 。
(2)进行猜想:黑色固体可能:
a.全部为铁 b. c._____________
Ⅱ.定量探究
取上述研磨后的黑色固体20g,设计如下实验:
(1)小明同学的猜想是否成立?
(2)通过计算,确定20g黑色固体的成分及质量(请写出计算过程)。
【继续实验】
若要从以上探究所得FeSO4、CuSO4的混合溶液中回收铜和硫酸亚铁晶体,可设计如下实验方案:
(1)步骤①中,金属X是 ,该反应的化学方程式为 。
(2)步骤②中,加入过量稀硫酸的目的是
。 将氯酸钾和二氧化锰的固体混合物30.0g
加热至质量不再改变为止,冷却后称量剩
余固体物质的质量为20.4g。试问:
(1)共产生氧气多少克?
(2)剩余固体物质里含有哪些物质,质量各是多少克? (K—39、Cl—35.5、O—16)课堂练习
②理解质量守恒定律,能说明化学反应中的质量关系。
③能正确书写化学方程式,并进行简单计算。
④认识定量研究对于化学科学发展的重大作用。复习目标下列变化不符合质量守恒定律的是( )
A.镁在空气中燃烧后,生成物的质量比原来镁条的质量大
B.水加热一段时间后质量变小
C.4g氢气在34g氧气中充分燃烧生成36g水
D.高锰酸钾受热分解后,剩余固体的质量比原反应物的质量小B二甲醚(CH3OCH3)可由一氧化碳和物质X在一定的条件下制得。反应的化学方程式为:
2CO+4X ========== CH3OCH3 + H2O。则X的化学式为? ( )
A.C2H5OH B.H2O2?
C.C2H4? D.H2??一定条件D山茶油是一种绿色保健品,其主要成分
是柠檬醛。现从山茶油中提取7.6 g柠
檬醛,使其在氧气中完全燃烧,只生成
22 g二氧化碳和7.2 g水,则柠檬醛中
各元素的质量比为 。
C:H:O=15:2:2化学反应前后肯定没有变化的是( )
①原子数目②分子数目③元素种类
④ 物质种类⑤原子种类⑥物质的总质量
①④⑥ B.①③⑤⑥
C.①②⑥ D.②③⑤B铜在空气中长时间暴露会与空气中的氧气和
空气中另外两种常见物质发生化学反应而生成
绿色的铜绿,铜绿的化学式为[Cu2(OH)2CO3]。
请判断:生成铜绿时,参加反应的空气中的另外
两种物质是________和________。H2OCO2写出下列反应的化学方程式:
1.镁粉和氧化铜在高温条件下反应生成一种
紫红色单质和一种白色氧化物。
2.二氧化碳是常见的灭火剂,但金属镁着火
却不能用二氧化碳扑灭,因为镁能在二氧化碳
中继续燃烧,生成黑色和白色两种固体粉末。如图,四位同学正在讨论某一个化学方程式表示的意义。下列四个化学方程式中,同时符合这四位同学所描述的是 ( )C在反应A+3B=2C+2D中,A、B的相对分子质量之比
为9:11。已知1.8gA与一定量B恰好完全反应,生成5.1gD。则在此反应中,B与C的质量比为 ( )
A、2:1 B、3:4 C、12:11 D、1:1A下图表示治理汽车尾气所涉及反应的微观过程。下列说法正确的是 ( )
A. 该反应不符合质量守恒定律
B. 生成单质与化合物的质量比为7:22
C. 该反应属于置换反应??
D. 生成物的分子个数比为1:1??B在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下存在某个反应,测得反应过程中各物质的质量变化如下表:
对该反应,下列描述正确的是 ( )
A.该反应是分解反应
B.乙的待测质量一定为4 g
C.乙在该反应中可能是催化剂
D.参加反应的甲、丙、丁的质量比为1∶16∶13AC某研究性小组在实验室中模拟炼铁化学原理的实验。
I.定性探究
在一定温度下,该小组同学用一氧化碳还原纯净的氧化铁(实验装置如下图,从环保角度看,该小组设计的实验装置有不足之处,你认为该如何改进?_________________________),
观察到玻璃管内固体由红色全部变为黑色。
小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家分头查阅资料。【查阅资料】
(1)一氧化碳还原氧化铁的固体产物的成分与反应温度、
反应时间等因素有关。
(2)一氧化碳还原氧化铁的实验过程中固体产物可能有
四氧化三铁、氧化亚铁、铁。
(3)
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁
吸引,发现黑色固体全部能被吸引,则该黑色固体中
不可能含有 。
(2)进行猜想:黑色固体可能:
a.全部为铁 b. c._____________
Ⅱ.定量探究
取上述研磨后的黑色固体20g,设计如下实验:
(1)小明同学的猜想是否成立?
(2)通过计算,确定20g黑色固体的成分及质量(请写出计算过程)。
【继续实验】
若要从以上探究所得FeSO4、CuSO4的混合溶液中回收铜和硫酸亚铁晶体,可设计如下实验方案:
(1)步骤①中,金属X是 ,该反应的化学方程式为 。
(2)步骤②中,加入过量稀硫酸的目的是
。 将氯酸钾和二氧化锰的固体混合物30.0g
加热至质量不再改变为止,冷却后称量剩
余固体物质的质量为20.4g。试问:
(1)共产生氧气多少克?
(2)剩余固体物质里含有哪些物质,质量各是多少克? (K—39、Cl—35.5、O—16)课堂练习
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
