4.3氧气的实验室制法 课件(34张PPT)
文档属性
| 名称 | 4.3氧气的实验室制法 课件(34张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 418.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-02 00:00:00 | ||
图片预览











文档简介
课件34张PPT。 第三节
氧气的实验室制法
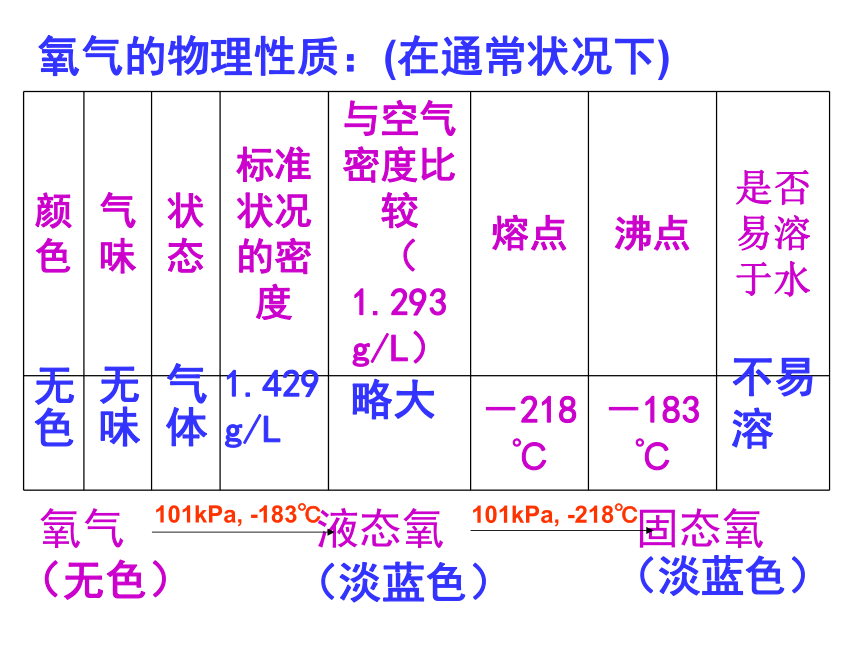
复习:到目前为止,你知道哪些方法能得到氧气?能否用这些方法在实验室中制得氧气? 氧气的物理性质:(在通常状况下)无色无味气体略大不易 溶1.429 g/L氧气 液态氧 固态氧
101kPa, -183℃101kPa, -218℃(无色)(淡蓝色)(淡蓝色)氧气贮存在天蓝色钢瓶中下列哪些物质可能产生氧气?1、食盐(主要成分为NaCl)
2、过氧化氢( H2O2)
3、氧化汞 ( HgO )
4、高锰酸钾(KMnO4)
5、氯酸钾(KClO3)
6、甲烷(CH4)
7、水 ( H2O )(1)KMnO4高锰酸钾是一种紫黑色的固体,在加热时能产生氧气,成本较高。
(2)KClO3氯酸钾是一种白色固体,加热时能产生氧气,如果混有可燃性杂质可能会发生爆炸。
(3)H2O2过氧化氢又称双氧水,是一种无色的液体,常温下就可生成氧气和水,反应速度适中,价格低廉。
(4)HgO氧化汞是一种红色粉末,加热时能产生氧气,同时产生有毒的物质汞。
(5)H2O水在通电的条件下能产生氧气,成本高,反应速度太慢。
资料介绍实验室制取气体要求:装置简单,操作方便,条件不能太高,无安全隐患,符合绿色化学观点一、氧气的实验室制法
(一)原理在二氧化锰的催化作用下,过氧化氢迅速分解产生氧气和水。表达式: 双氧水 二氧化锰 水+氧气1.药品:二氧化锰、双氧水
2.条件:不需加热
3.反应类型:分解反应 二、催化剂
P88实验探究
讨论:1.比较上述几个实验,说明过氧化氢分解出氧气需要什么条件? 在二氧化锰存在条件下2、若在实验前准确称出MnO2质量,实验后将MnO2回收、干燥、再称量,会发现它质量不变,你对MnO2所起的作用有什么看法?MnO2能促使H2O2分解,但它质量不变说明它本身不分解 3、将分离出来的MnO2再放入A试管中和MnO2在B试管中起相同作用,这又说明什么?MnO2在化学反应前后化学性质没有改变小结:
凡能改变其它物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂
特点:“一变两不变” 催化剂在生产、生活和科研中有重要作用。实验室用过氧化氢分解制氧气,常用MnO2作催化剂。 [提出问题]其他物质能作分解的催化剂吗? [猜想]甲同学认为CuO或Fe2O3可以代替MnO2 ,因为按物质的分类MnO2 、CuO 、Fe2O3都属于__。
[设计实验]甲同学按下面步骤进行实验:①在试管中加入5mL5%H2O2的溶液,把带火星的木条伸入试管;
②用精密的天平准确称量0.5g红色粉末,并将其加入另一试管中
③在步骤② 的试管中加入5mL5% H2O2的溶液,把带火星的木条伸入试管;
④待步骤③的试管中没有气泡后,进行“某一操作”,将固体洗净、干燥、称量,得红色固体的质量仍为0.5g。
[现象]甲同学观察到步骤①中的现象为_____ ,步骤③中带火星的木条____ 。
[反思]步骤④中进行的“某一操作”是______ 。乙同学认为在步骤④后还需增加一个实验,请你写出该实验的操作方法和现象_____ 。
[结论]通过以上实验步骤得出的结论是______ 。 请你举一个生活中应用催化剂的事例。三、实验装置
用过氧化氢与二氧化锰的混合物制取氧气的装置
1、发生装置选择的依据:反应物的状态和反应发生条件
①如果反应物为固态和液态,条件为不需加热如前图
②如果反应物为固态,条件为加热如后图
③组装仪器时,按照从左往右,从下往上的顺序固
液
常
温
型固
固
加
热
型1.某化学兴趣小组用氯化铵固体和氢氧化钙固体加热反应制氨气,可选用的发生装置是________.
2.实验室用锌粒固体和稀硫酸(液体)在常温下制氢气,可选用的发生装置是_____.AB2、收集装置选择的依据:在水中溶解性和气体的密度向下排空气法排水集气法向上排空气法排水法:适应于不易溶于水或难溶于水,且不与水发生化学反应的气体
向下排空气法:适应于密度比空气小的气体,且不与空气中任何物质发生化学反应的气体
向上排空气法:适应于密度比空气大的气体,且不与空气中任何物质发生化学反应的气体
注意:密度与空气相近的气体不能用排空气法收集。如 CO、N2等,空气的平均化学式量29注意:排水法与排空气法优点比较
1. 排水法 该方法收集的气体较为纯净
2. 排空气法 该方法收集的气体较为干燥1、某气体只能用向上排空气法收集,则该气体具备下列性质中的哪几项 ( )
A.不易溶于水
B.易溶于水或与水发生化学反应的气体
C.密度比空气小
D.密度比空气大练习: 2、实验室收集气体时,可用向上排空气法,原因是通常状况下____________________________________________
也可采用排水集气法,原因是通常状况下__________________________________________________。密度比空气大,且不与空气
中任何物质发生化学反应不易溶于水或难溶于水,且不与水发生化学反应现有一集气瓶,想要测量该集气瓶最多能收集气体的体积,请你写出简便的测量方法(可以选择必要的器材): 答:在集气瓶中装满水再用量筒量出水的体积即为最多能收集气体的体积通常状况下,氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。收集氨气应采用装置为ABC长颈漏斗用双氧水和二氧化锰混合制取氧气装置四、操作步骤1.检查装置气密性。方法一:关闭分液漏斗活塞,将导管末端放入水中,双手握住锥形瓶,如导管末端有气泡冒出,说明装置气密性良好.
方法二:用弹簧夹夹紧橡皮管,向分液漏斗中加水,如在分液漏斗末端留有一段水柱,说明装置气密性良好.2、先向锥形瓶加入少量固体二氧化锰,塞紧瓶塞再由长颈漏斗加入过氧化氢溶液。
在化学实验是有个原则:液体与固体混合时有,一般都是把液体加到固体中。(如何把固体加入液体中会溅起液滴,这样对有些实验来说不安全) 用排水法或向上排空气法3、收集氧气:氧气不易溶于水、密度比空气大。选用什么方法收集?4、验满与检验:排水法收集时,从集气瓶口逸出大气泡时已集满。
若用向上排空气法收集时,用带火星的木条放在集气瓶口处,木条复燃,证明已满。5、撤离,将用剩的药品到入废液缸,洗涤仪器。2.用过氧化氢和二氧化锰混合物制取氧气的实验步骤可简称:查;装;收;拆;洗五、注意事项:
1.长颈漏斗要伸入液面下
2.排水法收集时,当导管口产生气泡连续均匀时再收集。
3.集气瓶收集满氧气后正放在桌上。利用其它含氧元素的物质,如高锰酸钾(KMnO4)、氯酸钾(KClO3)等也可以制氧气
101kPa, -183℃101kPa, -218℃(无色)(淡蓝色)(淡蓝色)氧气贮存在天蓝色钢瓶中下列哪些物质可能产生氧气?1、食盐(主要成分为NaCl)
2、过氧化氢( H2O2)
3、氧化汞 ( HgO )
4、高锰酸钾(KMnO4)
5、氯酸钾(KClO3)
6、甲烷(CH4)
7、水 ( H2O )(1)KMnO4高锰酸钾是一种紫黑色的固体,在加热时能产生氧气,成本较高。
(2)KClO3氯酸钾是一种白色固体,加热时能产生氧气,如果混有可燃性杂质可能会发生爆炸。
(3)H2O2过氧化氢又称双氧水,是一种无色的液体,常温下就可生成氧气和水,反应速度适中,价格低廉。
(4)HgO氧化汞是一种红色粉末,加热时能产生氧气,同时产生有毒的物质汞。
(5)H2O水在通电的条件下能产生氧气,成本高,反应速度太慢。
资料介绍实验室制取气体要求:装置简单,操作方便,条件不能太高,无安全隐患,符合绿色化学观点一、氧气的实验室制法
(一)原理在二氧化锰的催化作用下,过氧化氢迅速分解产生氧气和水。表达式: 双氧水 二氧化锰 水+氧气1.药品:二氧化锰、双氧水
2.条件:不需加热
3.反应类型:分解反应 二、催化剂
P88实验探究
讨论:1.比较上述几个实验,说明过氧化氢分解出氧气需要什么条件? 在二氧化锰存在条件下2、若在实验前准确称出MnO2质量,实验后将MnO2回收、干燥、再称量,会发现它质量不变,你对MnO2所起的作用有什么看法?MnO2能促使H2O2分解,但它质量不变说明它本身不分解 3、将分离出来的MnO2再放入A试管中和MnO2在B试管中起相同作用,这又说明什么?MnO2在化学反应前后化学性质没有改变小结:
凡能改变其它物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂
特点:“一变两不变” 催化剂在生产、生活和科研中有重要作用。实验室用过氧化氢分解制氧气,常用MnO2作催化剂。 [提出问题]其他物质能作分解的催化剂吗? [猜想]甲同学认为CuO或Fe2O3可以代替MnO2 ,因为按物质的分类MnO2 、CuO 、Fe2O3都属于__。
[设计实验]甲同学按下面步骤进行实验:①在试管中加入5mL5%H2O2的溶液,把带火星的木条伸入试管;
②用精密的天平准确称量0.5g红色粉末,并将其加入另一试管中
③在步骤② 的试管中加入5mL5% H2O2的溶液,把带火星的木条伸入试管;
④待步骤③的试管中没有气泡后,进行“某一操作”,将固体洗净、干燥、称量,得红色固体的质量仍为0.5g。
[现象]甲同学观察到步骤①中的现象为_____ ,步骤③中带火星的木条____ 。
[反思]步骤④中进行的“某一操作”是______ 。乙同学认为在步骤④后还需增加一个实验,请你写出该实验的操作方法和现象_____ 。
[结论]通过以上实验步骤得出的结论是______ 。 请你举一个生活中应用催化剂的事例。三、实验装置
用过氧化氢与二氧化锰的混合物制取氧气的装置
1、发生装置选择的依据:反应物的状态和反应发生条件
①如果反应物为固态和液态,条件为不需加热如前图
②如果反应物为固态,条件为加热如后图
③组装仪器时,按照从左往右,从下往上的顺序固
液
常
温
型固
固
加
热
型1.某化学兴趣小组用氯化铵固体和氢氧化钙固体加热反应制氨气,可选用的发生装置是________.
2.实验室用锌粒固体和稀硫酸(液体)在常温下制氢气,可选用的发生装置是_____.AB2、收集装置选择的依据:在水中溶解性和气体的密度向下排空气法排水集气法向上排空气法排水法:适应于不易溶于水或难溶于水,且不与水发生化学反应的气体
向下排空气法:适应于密度比空气小的气体,且不与空气中任何物质发生化学反应的气体
向上排空气法:适应于密度比空气大的气体,且不与空气中任何物质发生化学反应的气体
注意:密度与空气相近的气体不能用排空气法收集。如 CO、N2等,空气的平均化学式量29注意:排水法与排空气法优点比较
1. 排水法 该方法收集的气体较为纯净
2. 排空气法 该方法收集的气体较为干燥1、某气体只能用向上排空气法收集,则该气体具备下列性质中的哪几项 ( )
A.不易溶于水
B.易溶于水或与水发生化学反应的气体
C.密度比空气小
D.密度比空气大练习: 2、实验室收集气体时,可用向上排空气法,原因是通常状况下____________________________________________
也可采用排水集气法,原因是通常状况下__________________________________________________。密度比空气大,且不与空气
中任何物质发生化学反应不易溶于水或难溶于水,且不与水发生化学反应现有一集气瓶,想要测量该集气瓶最多能收集气体的体积,请你写出简便的测量方法(可以选择必要的器材): 答:在集气瓶中装满水再用量筒量出水的体积即为最多能收集气体的体积通常状况下,氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水。收集氨气应采用装置为ABC长颈漏斗用双氧水和二氧化锰混合制取氧气装置四、操作步骤1.检查装置气密性。方法一:关闭分液漏斗活塞,将导管末端放入水中,双手握住锥形瓶,如导管末端有气泡冒出,说明装置气密性良好.
方法二:用弹簧夹夹紧橡皮管,向分液漏斗中加水,如在分液漏斗末端留有一段水柱,说明装置气密性良好.2、先向锥形瓶加入少量固体二氧化锰,塞紧瓶塞再由长颈漏斗加入过氧化氢溶液。
在化学实验是有个原则:液体与固体混合时有,一般都是把液体加到固体中。(如何把固体加入液体中会溅起液滴,这样对有些实验来说不安全) 用排水法或向上排空气法3、收集氧气:氧气不易溶于水、密度比空气大。选用什么方法收集?4、验满与检验:排水法收集时,从集气瓶口逸出大气泡时已集满。
若用向上排空气法收集时,用带火星的木条放在集气瓶口处,木条复燃,证明已满。5、撤离,将用剩的药品到入废液缸,洗涤仪器。2.用过氧化氢和二氧化锰混合物制取氧气的实验步骤可简称:查;装;收;拆;洗五、注意事项:
1.长颈漏斗要伸入液面下
2.排水法收集时,当导管口产生气泡连续均匀时再收集。
3.集气瓶收集满氧气后正放在桌上。利用其它含氧元素的物质,如高锰酸钾(KMnO4)、氯酸钾(KClO3)等也可以制氧气
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
