5.1化学反应中的质量守恒 课件(36张PPT)
文档属性
| 名称 | 5.1化学反应中的质量守恒 课件(36张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-02 20:48:44 | ||
图片预览











文档简介
课件36张PPT。第五单元 定量研究化学反应
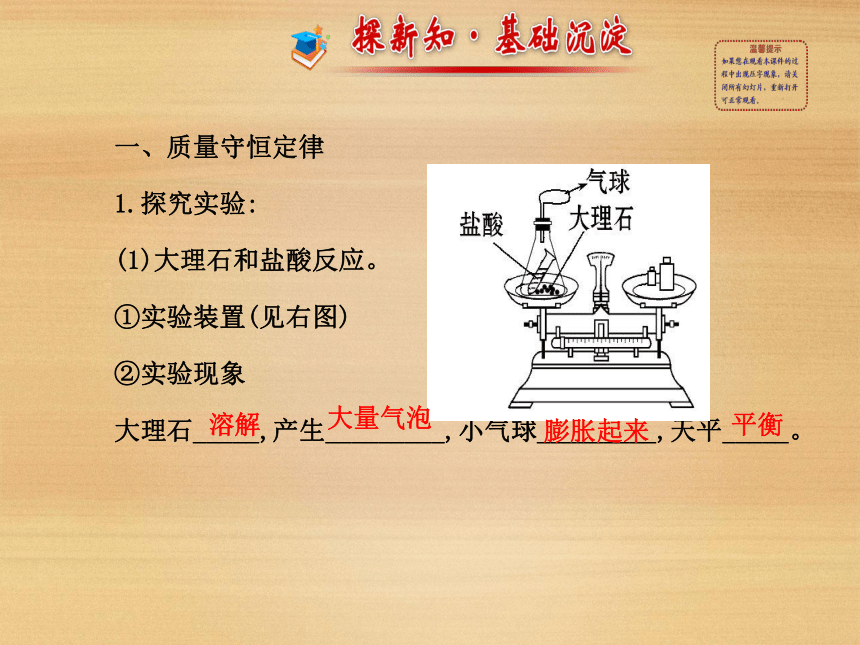
第一节 化学反应中的质量守恒一、质量守恒定律
1.探究实验:
(1)大理石和盐酸反应。
①实验装置(见右图)
②实验现象
大理石_____,产生_________,小气球_________,天平_____。溶解大量气泡膨胀起来平衡③文字表达式
________________________________。
④实验结论
化学反应前后,物质的总质量_____。碳酸钙+盐酸→氯化钙+二氧化碳+水不变(2)氢氧化钠溶液与硫酸铜溶液
的反应。
①实验装置(见右图)
②实验现象
两种溶液混合后有_________生成,天平_________。
③反应的文字表达式:
__________________________________。
④实验结论
化学反应前后,物质的总质量_____。蓝色沉淀保持平衡氢氧化钠+硫酸铜→氢氧化铜+硫酸钠不变(3)白磷燃烧实验。
①实验装置(见右图)
②实验现象
白磷燃烧,生成_________,
冷却后天平_________。
③反应的文字表达式
_________________________。
④实验结论
化学反应前后,物质的总质量_____。大量白烟保持平衡磷+氧气 五氧化二磷不变2.定义:参加_________的各物质的_________等于反应后生成
的各物质的_________。化学反应质量总和质量总和二、质量守恒定律的微观解释
化学反应的过程,就是原子_________的过程。即在一切化学反
应中,反应前后原子的_____没有改变,原子的_____没有增减,
原子_____没有变化,所以,参加反应的各物质的质量总和必然
_____反应生成的各物质的质量总和。重新组合种类数目质量等于1.判断正误:
(1)100 g冰融化变成100 g水符合质量守恒定律。 ( )
提示:100 g冰融化变成100 g水这一变化前后质量虽然相等,但
发生的是物理变化,不能用质量守恒定律来解释。
(2)镁燃烧后生成氧化镁的质量大于镁的质量,所以不符合质量
守恒定律。 ( )
提示:任何化学反应都遵循质量守恒定律,因为有氧气参加,所
以生成氧化镁的质量大于镁的质量。××(3)化学变化中原子的种类与数目不发生改变。 ( )
提示:化学反应是原子的重新组合过程,化学反应前后原子的种
类与数目不变。
(4)探究质量守恒定律时,有气体参加或生成的化学反应应在密
闭容器中进行。 ( )
提示:有气体参加或生成的化学反应必须在密闭容器中验证质
量守恒定律,否则会导致实验结果产生偏差。√√2.在化学反应A+B====C+D中,已知80 g A与24 g B恰好完全反应生成42 g C,则生成D的质量为( )
A.56 g B.62 g C.52 g D.60 g
【解析】选B。根据质量守恒定律反应物的质量和等于生成物的质量和,所以生成D的质量为80 g+24 g-42 g=62 g。3.NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( )
A.CO2 B.Cl2 C.O2 D.N2
【解析】选A。反应前后元素的种类保持不变,反应前有H、N、Cl、O 4种元素,则生成物中只能有这4种元素。4.在化学反应前后可能发生改变的是( )
A.原子种类 B.原子数目
C.分子数目 D.各物质的总质量
【解析】选C。本题主要考查质量守恒定律的内容与实质。化学反应的实质是原子的重新组合过程,反应前后原子的种类、数目不变,但分子的数目可能改变;任何化学反应都遵循质量守恒定律,反应前后各物质的质量总和不变。5.如图所示的甲、乙两个装置(气密性良好),从分液漏斗中加入液体,一段时间后两装置中的气球都胀大(忽略液体体积对气球体积的影响)。精确称量发现:两个实验反应后质量均与反应前数值不相等。(1)两个反应________(填“遵守”或“不遵守”)质量守恒定律。
(2)请分别解释两个装置中气球胀大的原因______________。
【解析】任何化学反应都遵守质量守恒定律。结合示意图甲中由于碳酸钠和稀盐酸反应有气体生成,使瓶内压强增大,所以气球胀大,乙中由于二氧化碳和澄清石灰水反应,使瓶内压强减小,所以气球胀大。答案:(1)遵守 (2)甲中碳酸钠和稀盐酸反应有气体生成,使瓶内压强增大;乙中二氧化碳和澄清石灰水反应,使瓶内压强减小要点一 质量守恒定律的解读
1.概念解读:
(1)“参加反应”的含义。
“参加反应”的物质质量是指参与了化学反应的物质质量,不能把“参加反应”的物质理解成反应物,化学反应中会存在反应物过量的问题。(2)“质量总和”的含义。
一些反应可能有气体参加,也可能有气体或沉淀生成,应用质量守恒定律时,各状态的物质都要包括,不能遗漏。如铁丝燃烧后看似固体质量增加,但实际上没有计算参加反应的氧气的质量。2.特别提醒:
(1)质量守恒定律只能解释化学变化不能解释物理变化。
(2)质量守恒是物质的“质量”守恒,而非“体积”守恒。【示范题1】(2013·黄冈中考改编)下列有关对质量守恒定律的理解,正确的是( )
A.将5 g铁和5 g铜混合加热后,物质的总质量为10 g,遵循质量守恒定律
B.化学反应前后分子的总数一定不会发生变化
C.化学反应前后,原子的种类和个数一定不发生变化
D.镁条燃烧后质量增加,不遵循质量守恒定律【解析】选C。质量守恒定律的适用范围为化学变化,A发生的不是化学变化,错误;化学反应前后分子的总数可能会发生变化,B错误;镁条燃烧后质量增加,是因为没有计算参加反应氧气的质量,应该为镁条的质量与参加反应氧气的质量和等于生成氧化镁的质量,遵循质量守恒定律,D错误;化学反应前后原子的种类和个数一定不会发生变化,C正确。【备选习题】(2013·江西中考)如图是某反应过程的微观示意
图,“ ”与“ ”分别表示不同元素的原子。图中X处的粒
子示意图是( )【解析】选C。本题考查质量守恒定律。根据化学反应前后原
子的种类和数目不变,观察微观示意图可知反应前有4个 原
子,反应后有6个 原子和2个 原子,因此X中应含有2个 原
子和2个 原子,故C符合题意。 要点二 质量守恒定律的探究上图是红磷燃烧前后质量的测定。
(1)上述实验中锥形瓶上方玻璃管管口处小气球的作用是什么,锥形瓶瓶底为何铺一层细沙?
提示:红磷燃烧放出热量,锥形瓶内气体膨胀,会导致瓶内压强增大,如不系小气球可能会使橡胶塞弹出,从而导致实验失败。红磷燃烧会放出大量的热,不铺细沙易使锥形瓶瓶底炸裂。(2)分析上述实验思考:有气体参加或生成的反应,在探究质量守恒定律时,应注意什么问题?
提示:为使结果准确,应让反应在密闭容器中进行。【示范题2】下列装置不能用于证明质量守恒定律实验的是
( )
【解析】选C。本题考查质量守恒定律的探究实验。验证质量
守恒定律时,应考虑到装置的合理性。若化学反应中生成了气
体散失到空气中,则会影响到质量变化,故应选择密闭装置,A、
D可行,B中无气体生成,可行,故选C。【归纳总结】质量守恒定律的实验探究方法
1.药品选择:若在敞口容器中进行,需要选择化学反应现象明显且没有气体生成的药品,通过对比实验得出结论。
2.实验装置要求:如果所选的化学反应中有气体参加或生成,则应该在密闭容器中进行。3.实验现象分析:
应从以下三个方面重点关注:
(1)通过观察化学反应现象,确认肯定发生了反应。
(2)通过观察天平是否平衡,说明化学反应前后的质量变化情况。
(3)如果反应后天平不平衡,分析现象并对现象进行解释,如反应中是否有气体逸散,外界物质是否参与反应,用气球收集气体是否有浮力等因素。【备选习题】在用白磷(白磷与红磷组成相同,着火点为40℃)探究质量守恒定律的实验中,晓涵同学将橡皮塞上的细玻璃管下端放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并引燃白磷,实验过程如下图所示。请回答下列问题:(1)实验观察到A、C中气球的大小不同,用理化知识解释产生此
现象的原因是________________________________________。
(2)将C再次放到天平上称量,天平仍然平衡,在此化学反应中,
从具体的反应物和生成物分析天平平衡的原因是___________
____________________________________________________。【解析】(1)实验观察到A、C中气球的大小不同,主要原因是白磷燃烧消耗瓶内的氧气,生成固体五氧化二磷,使瓶内压强减小,小于外界气压,在大气压的作用下,C中气球变小,A中压强等于外界大气压,所以A、C中气球大小不同。(2)根据质量守恒定律,参加反应的白磷的质量和氧气的质量总和等于生成的五氧化二磷的质量,故天平仍然平衡。答案:(1)白磷燃烧消耗瓶内的氧气,生成固体五氧化二磷,使瓶内压强减小,小于外界气压,在大气压的作用下,C中气球变小,A中压强等于外界大气压,所以A、C中气球大小不同
(2)参加反应(或消耗或反应掉)的白磷的质量和氧气的质量总和等于生成的五氧化二磷的质量1.结合所学知识,请将丙的分子结构图示填入相应方框内。提示:由图示可看出,反应前共有4个A原子,4个B原子,反应后乙
分子中含有2个A原子,1个B原子,所以在生成的2个乙分子中,共
含有4个A原子,2个B原子,由此推断每个丙分子中含有2个B原子,
其图示可简画为 。2.请结合质量守恒定律的实质,从宏观和微观角度将下表填完整。提示:化学反应的实质是原子的重新组合过程,化学反应前后原子的种类与数目都不变,原子的质量不变,元素的种类不变,物质的总质量不变,而分子的种类与物质的种类一定变,分子的数目可能变。
第一节 化学反应中的质量守恒一、质量守恒定律
1.探究实验:
(1)大理石和盐酸反应。
①实验装置(见右图)
②实验现象
大理石_____,产生_________,小气球_________,天平_____。溶解大量气泡膨胀起来平衡③文字表达式
________________________________。
④实验结论
化学反应前后,物质的总质量_____。碳酸钙+盐酸→氯化钙+二氧化碳+水不变(2)氢氧化钠溶液与硫酸铜溶液
的反应。
①实验装置(见右图)
②实验现象
两种溶液混合后有_________生成,天平_________。
③反应的文字表达式:
__________________________________。
④实验结论
化学反应前后,物质的总质量_____。蓝色沉淀保持平衡氢氧化钠+硫酸铜→氢氧化铜+硫酸钠不变(3)白磷燃烧实验。
①实验装置(见右图)
②实验现象
白磷燃烧,生成_________,
冷却后天平_________。
③反应的文字表达式
_________________________。
④实验结论
化学反应前后,物质的总质量_____。大量白烟保持平衡磷+氧气 五氧化二磷不变2.定义:参加_________的各物质的_________等于反应后生成
的各物质的_________。化学反应质量总和质量总和二、质量守恒定律的微观解释
化学反应的过程,就是原子_________的过程。即在一切化学反
应中,反应前后原子的_____没有改变,原子的_____没有增减,
原子_____没有变化,所以,参加反应的各物质的质量总和必然
_____反应生成的各物质的质量总和。重新组合种类数目质量等于1.判断正误:
(1)100 g冰融化变成100 g水符合质量守恒定律。 ( )
提示:100 g冰融化变成100 g水这一变化前后质量虽然相等,但
发生的是物理变化,不能用质量守恒定律来解释。
(2)镁燃烧后生成氧化镁的质量大于镁的质量,所以不符合质量
守恒定律。 ( )
提示:任何化学反应都遵循质量守恒定律,因为有氧气参加,所
以生成氧化镁的质量大于镁的质量。××(3)化学变化中原子的种类与数目不发生改变。 ( )
提示:化学反应是原子的重新组合过程,化学反应前后原子的种
类与数目不变。
(4)探究质量守恒定律时,有气体参加或生成的化学反应应在密
闭容器中进行。 ( )
提示:有气体参加或生成的化学反应必须在密闭容器中验证质
量守恒定律,否则会导致实验结果产生偏差。√√2.在化学反应A+B====C+D中,已知80 g A与24 g B恰好完全反应生成42 g C,则生成D的质量为( )
A.56 g B.62 g C.52 g D.60 g
【解析】选B。根据质量守恒定律反应物的质量和等于生成物的质量和,所以生成D的质量为80 g+24 g-42 g=62 g。3.NH4ClO4(高氯酸铵)可用作火箭推进剂,当它发生分解反应时,不能生成的物质是( )
A.CO2 B.Cl2 C.O2 D.N2
【解析】选A。反应前后元素的种类保持不变,反应前有H、N、Cl、O 4种元素,则生成物中只能有这4种元素。4.在化学反应前后可能发生改变的是( )
A.原子种类 B.原子数目
C.分子数目 D.各物质的总质量
【解析】选C。本题主要考查质量守恒定律的内容与实质。化学反应的实质是原子的重新组合过程,反应前后原子的种类、数目不变,但分子的数目可能改变;任何化学反应都遵循质量守恒定律,反应前后各物质的质量总和不变。5.如图所示的甲、乙两个装置(气密性良好),从分液漏斗中加入液体,一段时间后两装置中的气球都胀大(忽略液体体积对气球体积的影响)。精确称量发现:两个实验反应后质量均与反应前数值不相等。(1)两个反应________(填“遵守”或“不遵守”)质量守恒定律。
(2)请分别解释两个装置中气球胀大的原因______________。
【解析】任何化学反应都遵守质量守恒定律。结合示意图甲中由于碳酸钠和稀盐酸反应有气体生成,使瓶内压强增大,所以气球胀大,乙中由于二氧化碳和澄清石灰水反应,使瓶内压强减小,所以气球胀大。答案:(1)遵守 (2)甲中碳酸钠和稀盐酸反应有气体生成,使瓶内压强增大;乙中二氧化碳和澄清石灰水反应,使瓶内压强减小要点一 质量守恒定律的解读
1.概念解读:
(1)“参加反应”的含义。
“参加反应”的物质质量是指参与了化学反应的物质质量,不能把“参加反应”的物质理解成反应物,化学反应中会存在反应物过量的问题。(2)“质量总和”的含义。
一些反应可能有气体参加,也可能有气体或沉淀生成,应用质量守恒定律时,各状态的物质都要包括,不能遗漏。如铁丝燃烧后看似固体质量增加,但实际上没有计算参加反应的氧气的质量。2.特别提醒:
(1)质量守恒定律只能解释化学变化不能解释物理变化。
(2)质量守恒是物质的“质量”守恒,而非“体积”守恒。【示范题1】(2013·黄冈中考改编)下列有关对质量守恒定律的理解,正确的是( )
A.将5 g铁和5 g铜混合加热后,物质的总质量为10 g,遵循质量守恒定律
B.化学反应前后分子的总数一定不会发生变化
C.化学反应前后,原子的种类和个数一定不发生变化
D.镁条燃烧后质量增加,不遵循质量守恒定律【解析】选C。质量守恒定律的适用范围为化学变化,A发生的不是化学变化,错误;化学反应前后分子的总数可能会发生变化,B错误;镁条燃烧后质量增加,是因为没有计算参加反应氧气的质量,应该为镁条的质量与参加反应氧气的质量和等于生成氧化镁的质量,遵循质量守恒定律,D错误;化学反应前后原子的种类和个数一定不会发生变化,C正确。【备选习题】(2013·江西中考)如图是某反应过程的微观示意
图,“ ”与“ ”分别表示不同元素的原子。图中X处的粒
子示意图是( )【解析】选C。本题考查质量守恒定律。根据化学反应前后原
子的种类和数目不变,观察微观示意图可知反应前有4个 原
子,反应后有6个 原子和2个 原子,因此X中应含有2个 原
子和2个 原子,故C符合题意。 要点二 质量守恒定律的探究上图是红磷燃烧前后质量的测定。
(1)上述实验中锥形瓶上方玻璃管管口处小气球的作用是什么,锥形瓶瓶底为何铺一层细沙?
提示:红磷燃烧放出热量,锥形瓶内气体膨胀,会导致瓶内压强增大,如不系小气球可能会使橡胶塞弹出,从而导致实验失败。红磷燃烧会放出大量的热,不铺细沙易使锥形瓶瓶底炸裂。(2)分析上述实验思考:有气体参加或生成的反应,在探究质量守恒定律时,应注意什么问题?
提示:为使结果准确,应让反应在密闭容器中进行。【示范题2】下列装置不能用于证明质量守恒定律实验的是
( )
【解析】选C。本题考查质量守恒定律的探究实验。验证质量
守恒定律时,应考虑到装置的合理性。若化学反应中生成了气
体散失到空气中,则会影响到质量变化,故应选择密闭装置,A、
D可行,B中无气体生成,可行,故选C。【归纳总结】质量守恒定律的实验探究方法
1.药品选择:若在敞口容器中进行,需要选择化学反应现象明显且没有气体生成的药品,通过对比实验得出结论。
2.实验装置要求:如果所选的化学反应中有气体参加或生成,则应该在密闭容器中进行。3.实验现象分析:
应从以下三个方面重点关注:
(1)通过观察化学反应现象,确认肯定发生了反应。
(2)通过观察天平是否平衡,说明化学反应前后的质量变化情况。
(3)如果反应后天平不平衡,分析现象并对现象进行解释,如反应中是否有气体逸散,外界物质是否参与反应,用气球收集气体是否有浮力等因素。【备选习题】在用白磷(白磷与红磷组成相同,着火点为40℃)探究质量守恒定律的实验中,晓涵同学将橡皮塞上的细玻璃管下端放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并引燃白磷,实验过程如下图所示。请回答下列问题:(1)实验观察到A、C中气球的大小不同,用理化知识解释产生此
现象的原因是________________________________________。
(2)将C再次放到天平上称量,天平仍然平衡,在此化学反应中,
从具体的反应物和生成物分析天平平衡的原因是___________
____________________________________________________。【解析】(1)实验观察到A、C中气球的大小不同,主要原因是白磷燃烧消耗瓶内的氧气,生成固体五氧化二磷,使瓶内压强减小,小于外界气压,在大气压的作用下,C中气球变小,A中压强等于外界大气压,所以A、C中气球大小不同。(2)根据质量守恒定律,参加反应的白磷的质量和氧气的质量总和等于生成的五氧化二磷的质量,故天平仍然平衡。答案:(1)白磷燃烧消耗瓶内的氧气,生成固体五氧化二磷,使瓶内压强减小,小于外界气压,在大气压的作用下,C中气球变小,A中压强等于外界大气压,所以A、C中气球大小不同
(2)参加反应(或消耗或反应掉)的白磷的质量和氧气的质量总和等于生成的五氧化二磷的质量1.结合所学知识,请将丙的分子结构图示填入相应方框内。提示:由图示可看出,反应前共有4个A原子,4个B原子,反应后乙
分子中含有2个A原子,1个B原子,所以在生成的2个乙分子中,共
含有4个A原子,2个B原子,由此推断每个丙分子中含有2个B原子,
其图示可简画为 。2.请结合质量守恒定律的实质,从宏观和微观角度将下表填完整。提示:化学反应的实质是原子的重新组合过程,化学反应前后原子的种类与数目都不变,原子的质量不变,元素的种类不变,物质的总质量不变,而分子的种类与物质的种类一定变,分子的数目可能变。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
