7.2溶液组成的定量表示 课件
文档属性
| 名称 | 7.2溶液组成的定量表示 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 758.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-02 21:33:37 | ||
图片预览











文档简介
课件32张PPT。
溶液组成的定量表示一、溶液组成的表示方法
1.溶质的质量分数概念:_____与_____的质量比值。
2.溶质质量分数的表达式:溶质的质量分数=____________
×100%=___________________×100%溶质溶液二、溶液的配制
1.实验目的:配制50 g 16%的氯化钠溶液。
2.实验过程:
(1)计算:配制50 g 16%的氯化钠溶液。
①需氯化钠的质量是______________。
②需水的质量为______________,
体积为___________________。50 g×16%=8 g50 g-8 g=42 g(2)称量。
①称量固体氯化钠选用的仪器是_________。
②量取水选用的仪器是______的量筒。
(3)溶解:为加速溶解,你采用的方法是_____________。
(4)装瓶存放:把配制好的溶液装入试剂瓶中,盖好瓶盖,贴上标
签(注明_________和_______________),放入_______中。托盘天平50 mL用玻璃棒搅拌药品名称溶质的质量分数试剂柜【微点拨】
因液体的取用使用量筒比较方便,所以一般称量一定质量的液体时,常换算成体积单位。同理,计算溶质质量分数时,若题目中告知了液体的体积时,也应换算成液体的质量进行计算。1.判断正误:
(1)溶质质量分数是溶液中的溶质与溶剂的质量比值。( )
提示:溶质质量分数为溶质与溶液的质量比值。
(2)将1 g硝酸钾溶解到10 g水中,全部溶解后所得溶液溶质的
质量分数为 ×100%。( )
提示:溶解后溶液质量为1 g+10 g=11 g,据溶质质量分数的表
达式知溶质质量分数为 ×100%。×√(3)常温下,向100 g水中逐渐加入食盐固体,所得溶液的质量分
数会一直增大,直至100%。( )
提示:常温下,一定量水中溶解食盐的量是有限的,当溶液达到
饱和时,溶液中溶质的质量不会再增加,故题目说法错误。
(4)从盛有100 mL 10%的蓝色硫酸铜溶液的试剂瓶中,取出10 mL
溶液,则取出的溶液蓝色将变淡,溶质质量分数为1%。( )
提示:溶液具有均一性,取出的10 mL溶液的颜色和质量分数与
原溶液相比都没有变化。××2.常温下,在15 g氯化钠中加入60 g水,完全溶解后,溶液中氯化钠的质量分数为( )
A.15% B.20% C.25% D.33.3%
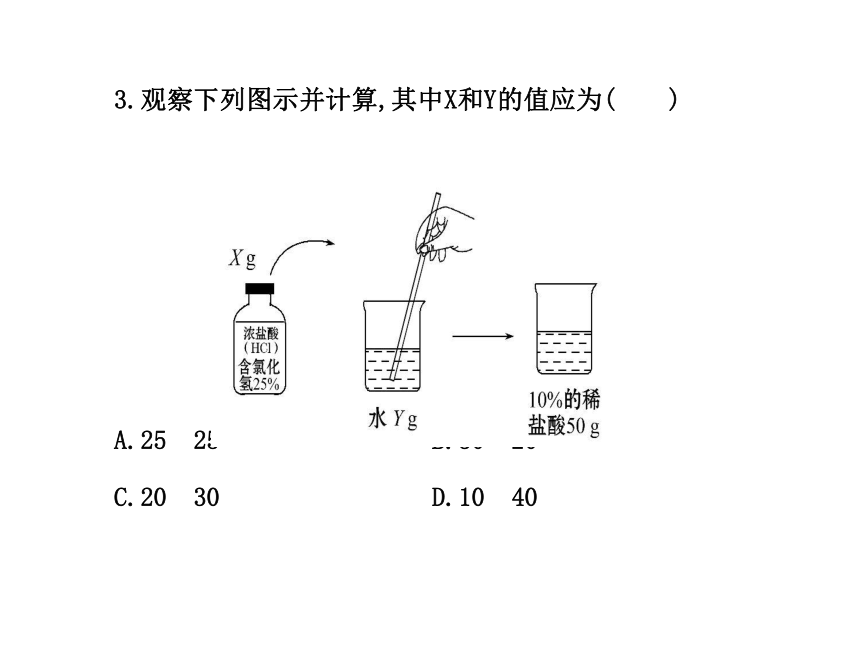
【解析】选B。溶液中氯化钠的质量分数为15 g/(15 g+60 g) ×100%=20%。3.观察下列图示并计算,其中X和Y的值应为( )
A.25 25 B.30 20
C.20 30 D.10 40【解析】选C。观察图示知,图中为用25%的盐酸和水配制10%的稀盐酸,根据稀释前后溶质质量相等得,10%×50 g=Xg×25%,解得X=20,所需水量为Y=50-20=30。4.一种抗生素为粉末状固体,每瓶含0.5 g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水( )
A.1.5 mL B.2 mL C.3 mL D.4 mL
【解析】选B。本题考查有关质量分数的计算。配制溶液的质量=溶质的质量÷溶质的质量分数=0.5 g÷20%=2.5 g;溶剂水的质量=溶液的质量-溶质的质量=2.5 g-0.5 g=2 g;水的体积=水的质量÷水的密度=2 g÷1 g·cm-3=2 mL。5.若恒温蒸发50 g 5%的食盐水,一段时间后,溶液溶质质量分数变为10%,则蒸发掉水的质量为________。
【解析】设蒸发水的质量为x,则剩余溶液的质量为50 g-x,据蒸发前后溶质质量不变得50 g×5%=(50 g-x)×10%,解得x=
25 g。
答案:25 g6.向50 g 5%的食盐水中加入50 g水后,所得溶液的质量分数变
为多少?
【解析】加水稀释的过程中溶质质量不变,溶液质量增加,故所
得溶液的质量分数为 ×100%=2.5%。
答案:2.5%7.现有下列仪器,请根据所学知识完成下列问题。
①烧杯 ②酒精灯 ③托盘天平 ④试管 ⑤量筒
⑥胶头滴管
计划用固体氯化钠配制50 g溶质质量分数为6%的食盐溶液。
(1)配制过程中需用到上述仪器组合有________(填字母编号)。
A.①②③⑤ B.①③⑤⑥ C.①③④⑤(2)配制上述食盐溶液需要进行以下四个基本步骤:
①配制上述食盐溶液需固体氯化钠______g,水______mL;
②将天平调平后,把固体氯化钠直接放在左盘上称量,然后倒入烧杯中;
③用量筒量取所需水后,倒入盛有氯化钠的烧杯中,用玻璃棒搅拌使其全部溶解;
④将配制好的溶液装入试剂瓶中,贴上标签。
在上述实验操作中,存在明显操作失误的步骤是________(填序号)。【解析】(1)用食盐固体配制食盐溶液时,称量固体需托盘天平,量取水的体积需量筒和胶头滴管,溶解需烧杯;
(2)①需食盐质量为50 g×6%=3 g,需水质量为50 g-3 g=47 g,折合体积为47 g÷1 g·mL-1=47 mL;使用托盘天平时,所称物品不能直接放在左盘上,应先在天平左右盘上放置等大的纸片,然后将药品放到纸上进行称量。
答案:(1)B (2)3 47 ②要点一 溶质质量分数的计算
有关溶液中溶质的质量分数的计算类型
1.溶质的质量、溶液的质量(或溶剂的质量)、溶质的质量分数之间的换算,直接应用公式。
2.溶液去水浓缩或加水稀释的计算,解此类题目抓住一点即可:浓缩或稀释前后溶液中溶质的质量不变。3.一定质量的溶液中进行溶质的质量分数的计算时,涉及溶液的体积、密度的计算,应先根据公式m=ρV(即溶液的质量=溶液的密度×溶液的体积)进行换算,或先计算质量,再利用公式进行换算。
4.不同质量分数的同种溶质的溶液混合的计算。
m1·a1%+m2·a2%=(m1+m2)·a%【示范题1】(2013·河北中考改编)20℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入到四个各盛有50 g水的烧杯中,充分溶解,其溶解情况如下表:下列说法正确的是( )
A.所得四杯溶液都是饱和溶液
B.丁溶液的溶质质量分数最大
C.丙形成溶液的溶质质量分数为 ×100%
D.乙形成溶液的溶质质量分数为 ×100%【解析】选C。根据所给数据可知,甲、乙、丁三种物质有剩余,
在该温度下所得溶液为饱和溶液,丙物质没有剩余,所得溶液不
一定为饱和溶液,A错误。丙物质全部溶解,溶剂相同,故丙溶液
的溶质质量分数最大,B错误。由表中信息知,丙未溶解固体质
量为零,即20 g丙固体全部溶解,故所得溶液溶质质量分数为
×100%;乙未溶解固体质量为2 g,溶解的固体为20 g
-2 g=18 g,所得溶液溶质质量分数为 ×100%,C正确、
D错。要点二 溶液的配制
1.溶液配制过程中的注意问题:
(1)计算:要准确。
(2)称量:①托盘天平:左物右码。
②量筒:视线与凹液面最低处相平。(3)溶解:用玻璃棒搅拌时不可碰触烧杯壁和烧杯底。
(4)装瓶存放:标签内容应填写如下两项:
a.药品名称
b.溶质质量分数2.溶液配制误差分析:
(1)导致溶液的溶质质量分数偏小的原因可能有:
①天平使用不正确,如药品和砝码位置放反,且使用了游码;
②量水时仰视刻度;
③称取食盐前,天平未调平衡,天平指针偏左。(2)导致溶液的溶质质量分数偏大的原因可能有:
①称取食盐前,天平未调平衡,指针偏右;
②量水时俯视刻度;
③将量筒内的水倒入烧杯时,有水洒出。【示范题2】(2013·恩施中考)实验室要配制溶质质量分数为10%的NaCl溶液。下图(一)是某同学的实验操作过程:(1)用图(一)中的序号表示配制溶液的正确操作顺序是________,a的名称是________。
(2)若③中游码标尺读数为1.2,则他称取NaCl的质量是________g。
(3)若继续配制10%的食盐溶液,该同学需要水的体积是________mL。(水的密度为1.0 g·mL-1)。
(4)他按图(二)量取水的体积,若其他操作步骤均无误差,则其所配溶液溶质质量分数________(填“大于”“等于”或“小于”)10%。【解析】(1)配制溶液的步骤为计算、称量、溶解,称量时应先取药品,称量准确后,将药品倒入烧杯内,加入水用玻璃棒搅拌溶解。(2)图中天平使用错误,应左物右码,当放反后,NaCl的实际质量为7 g-1.2 g=5.8 g。(3)能配制的10%的食盐溶液的质量是5.8 g/10%=58 g,需水的质量为58 g-5.8 g=52.2 g,折合体积为52.2 mL;(4)图(二)中读数时为仰视,实际体积大于读数,溶剂质量比实际需要的大了,所以可导致溶质质量分数变小。
答案:(1)②③①⑤④ 玻璃棒 (2)5.8 (3)52.2 (4)小于1.结合本课题所学内容,将下图填写完整。提示:溶质质量分数表示溶液中溶质质量与溶液质量之比,计算
公式为 ×100%,溶质质量分数是溶液浓度的定量表示,
溶质的质量分数越大,表示溶液越浓。2.欲配制200 g溶质质量分数为15%的氯化钠溶液,在(A)图中填写有关计算式和结果,在(B)图中写出实验步骤。提示:需氯化钠的质量为:200 g×15%=30 g,需水的质量为:
200 g-30 g=170 g;配制一定溶质质量分数的溶液,一般要经过计算、称量(或量取)、溶解、装瓶存放等步骤。
溶液组成的定量表示一、溶液组成的表示方法
1.溶质的质量分数概念:_____与_____的质量比值。
2.溶质质量分数的表达式:溶质的质量分数=____________
×100%=___________________×100%溶质溶液二、溶液的配制
1.实验目的:配制50 g 16%的氯化钠溶液。
2.实验过程:
(1)计算:配制50 g 16%的氯化钠溶液。
①需氯化钠的质量是______________。
②需水的质量为______________,
体积为___________________。50 g×16%=8 g50 g-8 g=42 g(2)称量。
①称量固体氯化钠选用的仪器是_________。
②量取水选用的仪器是______的量筒。
(3)溶解:为加速溶解,你采用的方法是_____________。
(4)装瓶存放:把配制好的溶液装入试剂瓶中,盖好瓶盖,贴上标
签(注明_________和_______________),放入_______中。托盘天平50 mL用玻璃棒搅拌药品名称溶质的质量分数试剂柜【微点拨】
因液体的取用使用量筒比较方便,所以一般称量一定质量的液体时,常换算成体积单位。同理,计算溶质质量分数时,若题目中告知了液体的体积时,也应换算成液体的质量进行计算。1.判断正误:
(1)溶质质量分数是溶液中的溶质与溶剂的质量比值。( )
提示:溶质质量分数为溶质与溶液的质量比值。
(2)将1 g硝酸钾溶解到10 g水中,全部溶解后所得溶液溶质的
质量分数为 ×100%。( )
提示:溶解后溶液质量为1 g+10 g=11 g,据溶质质量分数的表
达式知溶质质量分数为 ×100%。×√(3)常温下,向100 g水中逐渐加入食盐固体,所得溶液的质量分
数会一直增大,直至100%。( )
提示:常温下,一定量水中溶解食盐的量是有限的,当溶液达到
饱和时,溶液中溶质的质量不会再增加,故题目说法错误。
(4)从盛有100 mL 10%的蓝色硫酸铜溶液的试剂瓶中,取出10 mL
溶液,则取出的溶液蓝色将变淡,溶质质量分数为1%。( )
提示:溶液具有均一性,取出的10 mL溶液的颜色和质量分数与
原溶液相比都没有变化。××2.常温下,在15 g氯化钠中加入60 g水,完全溶解后,溶液中氯化钠的质量分数为( )
A.15% B.20% C.25% D.33.3%
【解析】选B。溶液中氯化钠的质量分数为15 g/(15 g+60 g) ×100%=20%。3.观察下列图示并计算,其中X和Y的值应为( )
A.25 25 B.30 20
C.20 30 D.10 40【解析】选C。观察图示知,图中为用25%的盐酸和水配制10%的稀盐酸,根据稀释前后溶质质量相等得,10%×50 g=Xg×25%,解得X=20,所需水量为Y=50-20=30。4.一种抗生素为粉末状固体,每瓶含0.5 g,注射时应配成质量分数为20%的溶液,则使用时每瓶至少需加入蒸馏水( )
A.1.5 mL B.2 mL C.3 mL D.4 mL
【解析】选B。本题考查有关质量分数的计算。配制溶液的质量=溶质的质量÷溶质的质量分数=0.5 g÷20%=2.5 g;溶剂水的质量=溶液的质量-溶质的质量=2.5 g-0.5 g=2 g;水的体积=水的质量÷水的密度=2 g÷1 g·cm-3=2 mL。5.若恒温蒸发50 g 5%的食盐水,一段时间后,溶液溶质质量分数变为10%,则蒸发掉水的质量为________。
【解析】设蒸发水的质量为x,则剩余溶液的质量为50 g-x,据蒸发前后溶质质量不变得50 g×5%=(50 g-x)×10%,解得x=
25 g。
答案:25 g6.向50 g 5%的食盐水中加入50 g水后,所得溶液的质量分数变
为多少?
【解析】加水稀释的过程中溶质质量不变,溶液质量增加,故所
得溶液的质量分数为 ×100%=2.5%。
答案:2.5%7.现有下列仪器,请根据所学知识完成下列问题。
①烧杯 ②酒精灯 ③托盘天平 ④试管 ⑤量筒
⑥胶头滴管
计划用固体氯化钠配制50 g溶质质量分数为6%的食盐溶液。
(1)配制过程中需用到上述仪器组合有________(填字母编号)。
A.①②③⑤ B.①③⑤⑥ C.①③④⑤(2)配制上述食盐溶液需要进行以下四个基本步骤:
①配制上述食盐溶液需固体氯化钠______g,水______mL;
②将天平调平后,把固体氯化钠直接放在左盘上称量,然后倒入烧杯中;
③用量筒量取所需水后,倒入盛有氯化钠的烧杯中,用玻璃棒搅拌使其全部溶解;
④将配制好的溶液装入试剂瓶中,贴上标签。
在上述实验操作中,存在明显操作失误的步骤是________(填序号)。【解析】(1)用食盐固体配制食盐溶液时,称量固体需托盘天平,量取水的体积需量筒和胶头滴管,溶解需烧杯;
(2)①需食盐质量为50 g×6%=3 g,需水质量为50 g-3 g=47 g,折合体积为47 g÷1 g·mL-1=47 mL;使用托盘天平时,所称物品不能直接放在左盘上,应先在天平左右盘上放置等大的纸片,然后将药品放到纸上进行称量。
答案:(1)B (2)3 47 ②要点一 溶质质量分数的计算
有关溶液中溶质的质量分数的计算类型
1.溶质的质量、溶液的质量(或溶剂的质量)、溶质的质量分数之间的换算,直接应用公式。
2.溶液去水浓缩或加水稀释的计算,解此类题目抓住一点即可:浓缩或稀释前后溶液中溶质的质量不变。3.一定质量的溶液中进行溶质的质量分数的计算时,涉及溶液的体积、密度的计算,应先根据公式m=ρV(即溶液的质量=溶液的密度×溶液的体积)进行换算,或先计算质量,再利用公式进行换算。
4.不同质量分数的同种溶质的溶液混合的计算。
m1·a1%+m2·a2%=(m1+m2)·a%【示范题1】(2013·河北中考改编)20℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入到四个各盛有50 g水的烧杯中,充分溶解,其溶解情况如下表:下列说法正确的是( )
A.所得四杯溶液都是饱和溶液
B.丁溶液的溶质质量分数最大
C.丙形成溶液的溶质质量分数为 ×100%
D.乙形成溶液的溶质质量分数为 ×100%【解析】选C。根据所给数据可知,甲、乙、丁三种物质有剩余,
在该温度下所得溶液为饱和溶液,丙物质没有剩余,所得溶液不
一定为饱和溶液,A错误。丙物质全部溶解,溶剂相同,故丙溶液
的溶质质量分数最大,B错误。由表中信息知,丙未溶解固体质
量为零,即20 g丙固体全部溶解,故所得溶液溶质质量分数为
×100%;乙未溶解固体质量为2 g,溶解的固体为20 g
-2 g=18 g,所得溶液溶质质量分数为 ×100%,C正确、
D错。要点二 溶液的配制
1.溶液配制过程中的注意问题:
(1)计算:要准确。
(2)称量:①托盘天平:左物右码。
②量筒:视线与凹液面最低处相平。(3)溶解:用玻璃棒搅拌时不可碰触烧杯壁和烧杯底。
(4)装瓶存放:标签内容应填写如下两项:
a.药品名称
b.溶质质量分数2.溶液配制误差分析:
(1)导致溶液的溶质质量分数偏小的原因可能有:
①天平使用不正确,如药品和砝码位置放反,且使用了游码;
②量水时仰视刻度;
③称取食盐前,天平未调平衡,天平指针偏左。(2)导致溶液的溶质质量分数偏大的原因可能有:
①称取食盐前,天平未调平衡,指针偏右;
②量水时俯视刻度;
③将量筒内的水倒入烧杯时,有水洒出。【示范题2】(2013·恩施中考)实验室要配制溶质质量分数为10%的NaCl溶液。下图(一)是某同学的实验操作过程:(1)用图(一)中的序号表示配制溶液的正确操作顺序是________,a的名称是________。
(2)若③中游码标尺读数为1.2,则他称取NaCl的质量是________g。
(3)若继续配制10%的食盐溶液,该同学需要水的体积是________mL。(水的密度为1.0 g·mL-1)。
(4)他按图(二)量取水的体积,若其他操作步骤均无误差,则其所配溶液溶质质量分数________(填“大于”“等于”或“小于”)10%。【解析】(1)配制溶液的步骤为计算、称量、溶解,称量时应先取药品,称量准确后,将药品倒入烧杯内,加入水用玻璃棒搅拌溶解。(2)图中天平使用错误,应左物右码,当放反后,NaCl的实际质量为7 g-1.2 g=5.8 g。(3)能配制的10%的食盐溶液的质量是5.8 g/10%=58 g,需水的质量为58 g-5.8 g=52.2 g,折合体积为52.2 mL;(4)图(二)中读数时为仰视,实际体积大于读数,溶剂质量比实际需要的大了,所以可导致溶质质量分数变小。
答案:(1)②③①⑤④ 玻璃棒 (2)5.8 (3)52.2 (4)小于1.结合本课题所学内容,将下图填写完整。提示:溶质质量分数表示溶液中溶质质量与溶液质量之比,计算
公式为 ×100%,溶质质量分数是溶液浓度的定量表示,
溶质的质量分数越大,表示溶液越浓。2.欲配制200 g溶质质量分数为15%的氯化钠溶液,在(A)图中填写有关计算式和结果,在(B)图中写出实验步骤。提示:需氯化钠的质量为:200 g×15%=30 g,需水的质量为:
200 g-30 g=170 g;配制一定溶质质量分数的溶液,一般要经过计算、称量(或量取)、溶解、装瓶存放等步骤。
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
