陕西省柞水中学高中化学 2.1《物质的分类》(共31张PPT) 新人教版必修1
文档属性
| 名称 | 陕西省柞水中学高中化学 2.1《物质的分类》(共31张PPT) 新人教版必修1 |

|
|
| 格式 | zip | ||
| 文件大小 | 435.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-06 00:00:00 | ||
图片预览








文档简介
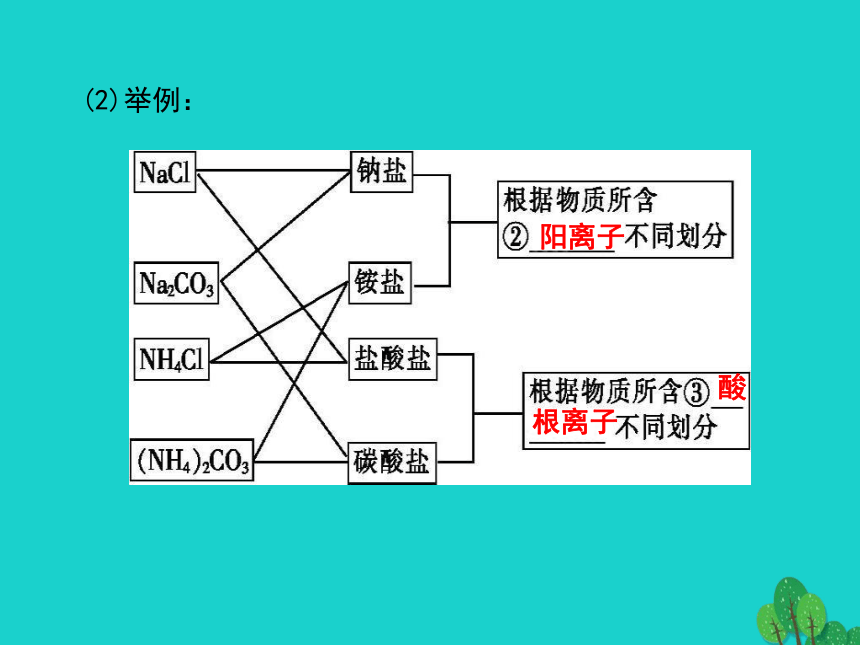
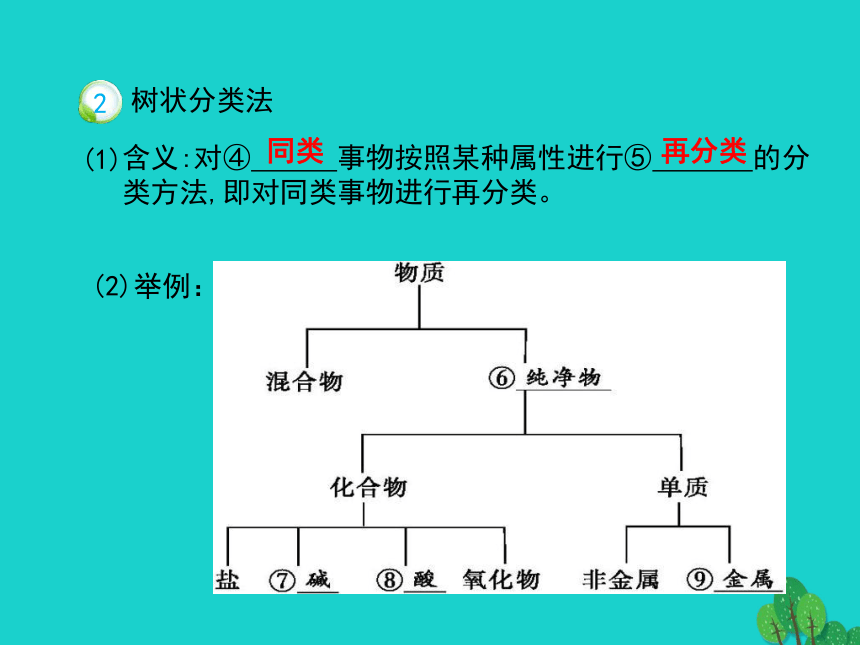
课件31张PPT。第二章第一节《物质的分类》课程学习目标一、简单分类法及其应用同一事物第一层级:知识记忆与理解【知识体系梳理】(2)举例:阳离子 酸
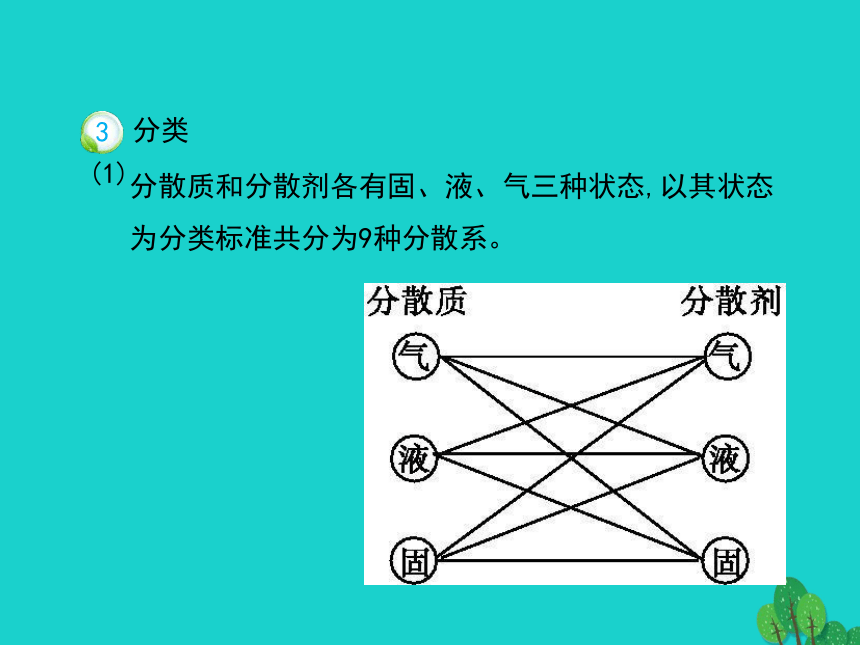
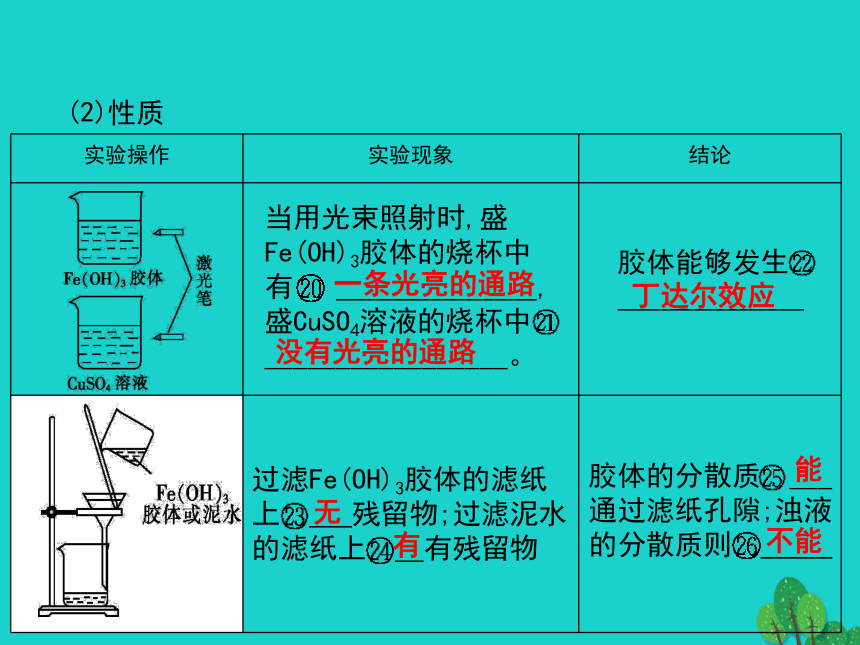
根离子同类再分类(2)举例:可以帮助我们更好地认识物质的性质,找出各类物质之间的关系。金属非金属酸性氧化物碱性氧化物碱酸盐盐二、分散系及其分类把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。分散质分散剂溶液胶体浊液向沸水中逐滴加入5~6滴 ,继续煮沸至溶液呈 ,停止加热,得到的分散系即为Fe(OH)3胶体,反应的化学方程式为 。FeCl3+3H2O Fe(OH)3(胶体)+3HClFeCl3饱和溶液红褐色当用光束照射时,盛Fe(OH)3胶体的烧杯中有 ,盛CuSO4溶液的烧杯中
_________________。 一条光亮的通路没有光亮的通路胶体能够发生
丁达尔效应过滤Fe(OH)3胶体的滤纸上 残留物;过滤泥水的滤纸上 有残留物胶体的分散质 ___ 通过滤纸孔隙;浊液的分散质则 _____ 无有能不能【基础学习交流】第二层级:思维探究与创新【重点难点探究】(1)请用短线连接下列物质:Na2SO4
K2SO4
NaCl
BaSO4含氧酸盐无氧酸盐钠盐硫酸盐(2)上述所示物质分类方法的名称是什么?分散系、胶体及丁达尔效应下列说法正确的是( )。C胶体分散质微粒细小,具有巨大的比表面积(单位质量具有的表面积),能较强地吸附电性相同的离子,从而形成带电微粒,这些带电微粒因带电荷相同,所以相互排斥,不容易聚集成较大的颗粒沉淀。①溶液分散质粒子大小:<1 nm;外观:均一、透明;分散质粒子:分子、离子;能否透过滤纸:能;稳定性:稳定;实例:食盐水、碘酒。②胶体分散质粒子大小:1 nm~100 nm;外观:均一、透明;分散质粒子:大量分子或离子集合体、高分子;能否透过滤纸:能;稳定性:较稳定;实例:肥皂水、氢氧化铁胶体、淀粉溶液、云、烟、雾、碳素墨水。③浊液分散质粒子大小:>100 nm;外观:不均一、不透明;分散质粒子:大量分子或离子集合体;能否透过滤纸:不能;稳定性:不稳定;实例:泥水。C第三层级:技能应用与拓展【基础智能检测】A.碱性氧化物 氧化铁 Fe3O4
B.酸性氧化物 碳酸气 CO
C.酸 硫酸 H2S
D.盐 纯碱 Na2CO3DC 用一束光照 射烧杯内的液体,若能产生丁达尔效应,则证明生成了Fe(OH)3胶体②证明有红褐色胶体生成的实验操作是___________
_____________________________________________
______________。请回答下列问题:(1)请将分类依据代号填入相应的括号内:
( )两种物质都是钠的化合物
( )两种物质都是氧化物
( )两种物质都是盐CBD①物质M的化学式为 。FeCl3第四层级:总结评价与反思【思维导图构建】谢谢大家
根离子同类再分类(2)举例:可以帮助我们更好地认识物质的性质,找出各类物质之间的关系。金属非金属酸性氧化物碱性氧化物碱酸盐盐二、分散系及其分类把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。分散质分散剂溶液胶体浊液向沸水中逐滴加入5~6滴 ,继续煮沸至溶液呈 ,停止加热,得到的分散系即为Fe(OH)3胶体,反应的化学方程式为 。FeCl3+3H2O Fe(OH)3(胶体)+3HClFeCl3饱和溶液红褐色当用光束照射时,盛Fe(OH)3胶体的烧杯中有 ,盛CuSO4溶液的烧杯中
_________________。 一条光亮的通路没有光亮的通路胶体能够发生
丁达尔效应过滤Fe(OH)3胶体的滤纸上 残留物;过滤泥水的滤纸上 有残留物胶体的分散质 ___ 通过滤纸孔隙;浊液的分散质则 _____ 无有能不能【基础学习交流】第二层级:思维探究与创新【重点难点探究】(1)请用短线连接下列物质:Na2SO4
K2SO4
NaCl
BaSO4含氧酸盐无氧酸盐钠盐硫酸盐(2)上述所示物质分类方法的名称是什么?分散系、胶体及丁达尔效应下列说法正确的是( )。C胶体分散质微粒细小,具有巨大的比表面积(单位质量具有的表面积),能较强地吸附电性相同的离子,从而形成带电微粒,这些带电微粒因带电荷相同,所以相互排斥,不容易聚集成较大的颗粒沉淀。①溶液分散质粒子大小:<1 nm;外观:均一、透明;分散质粒子:分子、离子;能否透过滤纸:能;稳定性:稳定;实例:食盐水、碘酒。②胶体分散质粒子大小:1 nm~100 nm;外观:均一、透明;分散质粒子:大量分子或离子集合体、高分子;能否透过滤纸:能;稳定性:较稳定;实例:肥皂水、氢氧化铁胶体、淀粉溶液、云、烟、雾、碳素墨水。③浊液分散质粒子大小:>100 nm;外观:不均一、不透明;分散质粒子:大量分子或离子集合体;能否透过滤纸:不能;稳定性:不稳定;实例:泥水。C第三层级:技能应用与拓展【基础智能检测】A.碱性氧化物 氧化铁 Fe3O4
B.酸性氧化物 碳酸气 CO
C.酸 硫酸 H2S
D.盐 纯碱 Na2CO3DC 用一束光照 射烧杯内的液体,若能产生丁达尔效应,则证明生成了Fe(OH)3胶体②证明有红褐色胶体生成的实验操作是___________
_____________________________________________
______________。请回答下列问题:(1)请将分类依据代号填入相应的括号内:
( )两种物质都是钠的化合物
( )两种物质都是氧化物
( )两种物质都是盐CBD①物质M的化学式为 。FeCl3第四层级:总结评价与反思【思维导图构建】谢谢大家
