陕西省柞水中学高中化学 第三章 水溶液中的离子平衡复习课(共14张PPT) 新人教版选修4
文档属性
| 名称 | 陕西省柞水中学高中化学 第三章 水溶液中的离子平衡复习课(共14张PPT) 新人教版选修4 |  | |
| 格式 | zip | ||
| 文件大小 | 136.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-06 19:12:22 | ||
图片预览





文档简介
课件14张PPT。3 水溶液中的离子平衡复习弱电解质的电离水的电离和溶液的酸碱性盐类的水解难容电解质的溶解平衡水溶液中的离子平衡电离方程式的书写影响电离平衡的因素弱酸、弱碱的判断强弱电解质的判断水的电离方程式书写Kw的表达式及应用溶液酸碱性的判断及pH的计算影响水的电离平衡的因素盐类水解的规律影响盐类水解的因素盐类水解的应用影响溶解平衡的因素难溶物溶解平衡的应用溶度积Ksp的表达及计算例: 请将下列物质分类(从物质类别判断):
①HCl②H2S③NaHCO3④CO2⑤Al2(SO4)3⑥Cl2
⑦NH3⑧CH4⑨BaSO4⑩Fe(OH)3 (1)属于强电解质的是_______ (2)属于弱电解质的是______ (3)属于非电解质的是______例:会写电离方程式:(必须分清强和弱)
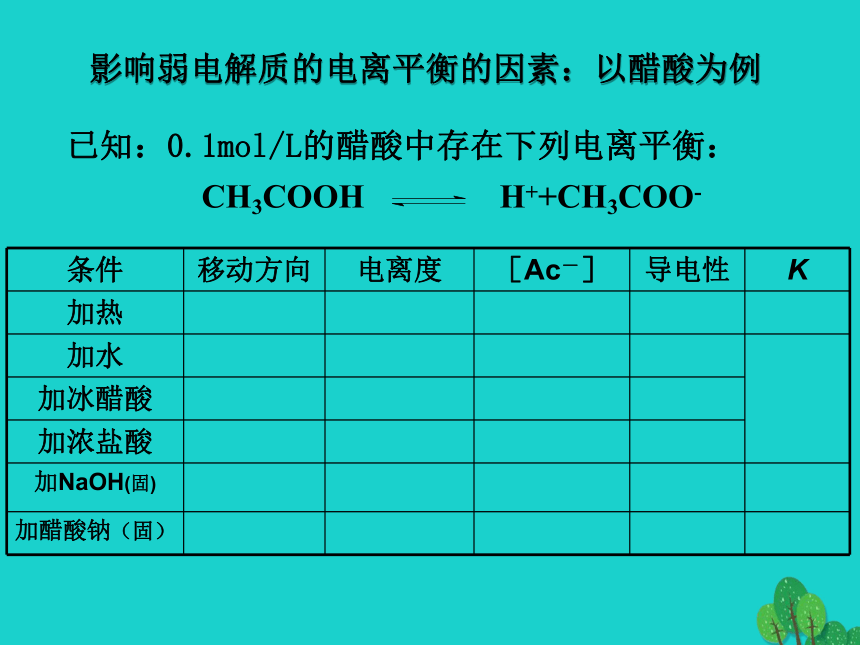
A. NH3·H2O B. Cu(OH)2 C. H3PO4 D. CaCO3 E. HClO F. NaHCO3 G. H2SO4 H. NaHSO4强弱电解质的判断方法一:取同浓度的HCl和CH3COOH,进行溶液导电性实验方法三:测定CH3COONa的水溶液应呈碱性方法二:测定0.1mol/L CH3COOH 的pH值,若大于理论的pH值,则为弱酸。方法四:相同浓度的HCl 和 CH3COOH 和相同大小颗粒的
锌粒比较初始反应速率方法五:相同 pH值,相同体积 的HCl 和 CH3COOH,
和足量的锌粒反应, CH3COOH产生的氢气多方法六:取相同pH的HCl 和 CH3COOH ,稀释100倍,
pH值变化小的是 CH3COOH如何判断弱酸?以醋酸为例练习: 常温下,将相同体积、pH=2的两种酸溶液HA和HB,分别加水稀释,其pH与所加水的体积变化如图所示,下列结论正确的是:
A.酸HB是比HA更强的酸
B.酸HA是比HB更强的酸
C.稀释前HA的物质的量浓度大
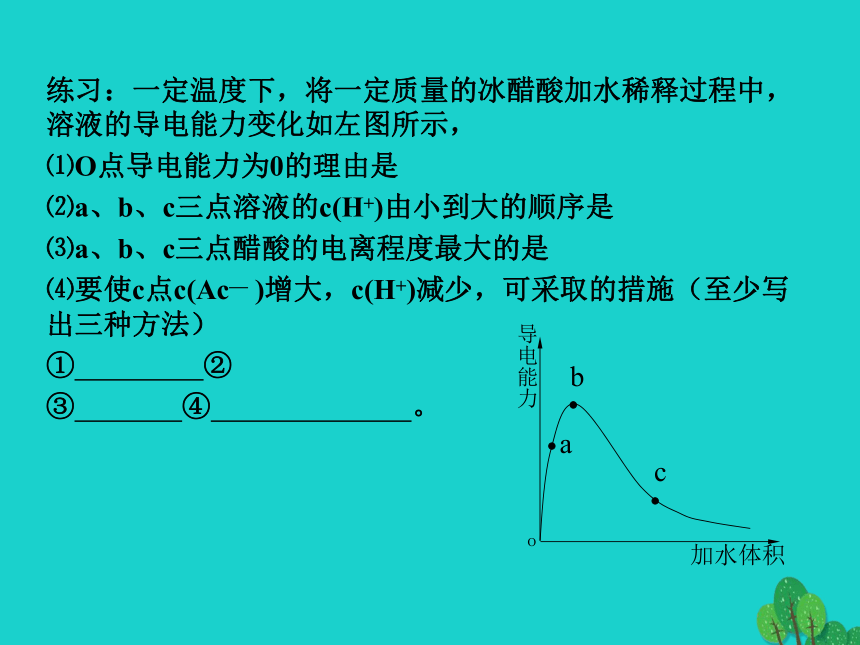
D.稀释前酸的物质的量浓度一样大B影响弱电解质的电离平衡的因素:以醋酸为例练习:一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如左图所示,
⑴O点导电能力为0的理由是
⑵a、b、c三点溶液的c(H+)由小到大的顺序是
⑶a、b、c三点醋酸的电离程度最大的是
⑷要使c点c(Ac— )增大,c(H+)减少,可采取的措施(至少写出三种方法)
① ②
③ ④ 。酸碱混合后溶液的酸碱性判断当酸中的氢离子浓度等于碱中的氢氧根浓度时,且酸碱等体积混合(例:常温下,pH=3 的 HA 与 pH=11 的NaOH混合):
①若为强酸强碱混合,则恰好反应,溶液呈中性
②若为强酸弱碱混合,则碱剩余,溶液呈碱性
③若为强碱弱酸混合,则酸剩余,溶液呈酸性
※c(弱酸)>c(H+); c(弱碱)>c(OH-)练习:常温下pH=3 的 HA V1 mL与 pH=11 的NaOH V2 mL混合
(1)若V1 = V2,反应后溶液pH一定等于7
(2)若反应后溶液呈酸性,则V1 一定大于V2
(3)若反应后溶液呈碱性,则V1 一定小于V2盐类水解的规律1、有弱才水解,无弱不水解
2、越弱越水解,都弱都水解
3、谁强显谁性,同强显中性
4、越热越水解,越稀越水解
4、弱碱阳离子水解显酸性,弱酸阴离子水解显碱性判断以下盐能水解的是:
NaHCO3、K2SO4、CH3COOK、Na2SO3、
KCN、NaClO、NaCl、FeCl3、CuSO4
溶液中离子浓度的大小比较1、看清溶液的溶质。酸和碱写电离方程式;
盐先写电离再写相应的水解方程式;
强碱弱酸的酸式盐中,酸式根既电离又水解;
最后写水的电离方程式。
2、根据溶液具体的酸碱性,标明各个过程的主次和强弱。
3、熟练书写和应用电荷守恒、物料守恒、质子守恒。
4、对于溶液中只有4种离子的混合溶液,可根据溶液的
酸碱性判断出离子浓度的大小。练习1:200mL 0.1mol/L醋酸与100mL 0.2mol/L氢氧化钠溶液混合,溶液中各离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。练习2:醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,下列有关
0.1 mol/L醋酸钡溶液中粒子浓度大小的比较,其中错误的是( )
A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)
C.c(H+)=c(OH-)-c(CH3COOH)
D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH)盐类水解的应用1、盐类水解在日常生活中的应用:泡沫灭火器;氨态氮肥
和草木灰不能混合使用;ZnCl2、FeCl3等强酸弱碱盐溶液可
做焊接金属中的除锈剂。
2、盐类水解在实验中的应用:配制FeCl3等强酸弱碱盐时应
加入相应的酸,抑制其阳离子水解;NaOH、Na2CO3碱性溶
液不能用磨口玻璃塞。
3、盐溶液蒸干产物的判断
4、离子共存的问题:弱碱阳离子和弱酸阴离子能相互促进
水解,因此不能大量共存;能反应生成沉淀、气体、弱酸、
弱碱、水的离子不能大量共存;能发生氧化还原反应的离子
不能大量共存。有关Ksp的计算1、已知:室温下PbI2的溶度积为7.1×10-9,求饱和溶液中
Pb2+ 和 I- 的浓度?在c(I-)=0.1mol·L-1的溶液中,Pb2+的浓
度最大可达到多少?2、如果将2×10-4 mol·L-1 的CaCl2溶液与3×10-4 mol·L-1 的
Na2CO3 溶液等体积混合,问能否产生沉淀?
(已知: CaCO3 的Ksp = 5.0×10-9)3、常温时,Fe(OH)3的Ksp = 1×10-38 ,要使溶液中的Fe3+
沉淀完全(残留在溶液中的c(Fe3+)<10-5 mol·L-1 ),则溶液
的pH最小为 1、某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是_____
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大
于c点对应的Ksp C
①HCl②H2S③NaHCO3④CO2⑤Al2(SO4)3⑥Cl2
⑦NH3⑧CH4⑨BaSO4⑩Fe(OH)3 (1)属于强电解质的是_______ (2)属于弱电解质的是______ (3)属于非电解质的是______例:会写电离方程式:(必须分清强和弱)
A. NH3·H2O B. Cu(OH)2 C. H3PO4 D. CaCO3 E. HClO F. NaHCO3 G. H2SO4 H. NaHSO4强弱电解质的判断方法一:取同浓度的HCl和CH3COOH,进行溶液导电性实验方法三:测定CH3COONa的水溶液应呈碱性方法二:测定0.1mol/L CH3COOH 的pH值,若大于理论的pH值,则为弱酸。方法四:相同浓度的HCl 和 CH3COOH 和相同大小颗粒的
锌粒比较初始反应速率方法五:相同 pH值,相同体积 的HCl 和 CH3COOH,
和足量的锌粒反应, CH3COOH产生的氢气多方法六:取相同pH的HCl 和 CH3COOH ,稀释100倍,
pH值变化小的是 CH3COOH如何判断弱酸?以醋酸为例练习: 常温下,将相同体积、pH=2的两种酸溶液HA和HB,分别加水稀释,其pH与所加水的体积变化如图所示,下列结论正确的是:
A.酸HB是比HA更强的酸
B.酸HA是比HB更强的酸
C.稀释前HA的物质的量浓度大
D.稀释前酸的物质的量浓度一样大B影响弱电解质的电离平衡的因素:以醋酸为例练习:一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如左图所示,
⑴O点导电能力为0的理由是
⑵a、b、c三点溶液的c(H+)由小到大的顺序是
⑶a、b、c三点醋酸的电离程度最大的是
⑷要使c点c(Ac— )增大,c(H+)减少,可采取的措施(至少写出三种方法)
① ②
③ ④ 。酸碱混合后溶液的酸碱性判断当酸中的氢离子浓度等于碱中的氢氧根浓度时,且酸碱等体积混合(例:常温下,pH=3 的 HA 与 pH=11 的NaOH混合):
①若为强酸强碱混合,则恰好反应,溶液呈中性
②若为强酸弱碱混合,则碱剩余,溶液呈碱性
③若为强碱弱酸混合,则酸剩余,溶液呈酸性
※c(弱酸)>c(H+); c(弱碱)>c(OH-)练习:常温下pH=3 的 HA V1 mL与 pH=11 的NaOH V2 mL混合
(1)若V1 = V2,反应后溶液pH一定等于7
(2)若反应后溶液呈酸性,则V1 一定大于V2
(3)若反应后溶液呈碱性,则V1 一定小于V2盐类水解的规律1、有弱才水解,无弱不水解
2、越弱越水解,都弱都水解
3、谁强显谁性,同强显中性
4、越热越水解,越稀越水解
4、弱碱阳离子水解显酸性,弱酸阴离子水解显碱性判断以下盐能水解的是:
NaHCO3、K2SO4、CH3COOK、Na2SO3、
KCN、NaClO、NaCl、FeCl3、CuSO4
溶液中离子浓度的大小比较1、看清溶液的溶质。酸和碱写电离方程式;
盐先写电离再写相应的水解方程式;
强碱弱酸的酸式盐中,酸式根既电离又水解;
最后写水的电离方程式。
2、根据溶液具体的酸碱性,标明各个过程的主次和强弱。
3、熟练书写和应用电荷守恒、物料守恒、质子守恒。
4、对于溶液中只有4种离子的混合溶液,可根据溶液的
酸碱性判断出离子浓度的大小。练习1:200mL 0.1mol/L醋酸与100mL 0.2mol/L氢氧化钠溶液混合,溶液中各离子浓度大小顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)。练习2:醋酸钡[(CH3COO)2Ba·H2O]是一种媒染剂,下列有关
0.1 mol/L醋酸钡溶液中粒子浓度大小的比较,其中错误的是( )
A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)
C.c(H+)=c(OH-)-c(CH3COOH)
D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH)盐类水解的应用1、盐类水解在日常生活中的应用:泡沫灭火器;氨态氮肥
和草木灰不能混合使用;ZnCl2、FeCl3等强酸弱碱盐溶液可
做焊接金属中的除锈剂。
2、盐类水解在实验中的应用:配制FeCl3等强酸弱碱盐时应
加入相应的酸,抑制其阳离子水解;NaOH、Na2CO3碱性溶
液不能用磨口玻璃塞。
3、盐溶液蒸干产物的判断
4、离子共存的问题:弱碱阳离子和弱酸阴离子能相互促进
水解,因此不能大量共存;能反应生成沉淀、气体、弱酸、
弱碱、水的离子不能大量共存;能发生氧化还原反应的离子
不能大量共存。有关Ksp的计算1、已知:室温下PbI2的溶度积为7.1×10-9,求饱和溶液中
Pb2+ 和 I- 的浓度?在c(I-)=0.1mol·L-1的溶液中,Pb2+的浓
度最大可达到多少?2、如果将2×10-4 mol·L-1 的CaCl2溶液与3×10-4 mol·L-1 的
Na2CO3 溶液等体积混合,问能否产生沉淀?
(已知: CaCO3 的Ksp = 5.0×10-9)3、常温时,Fe(OH)3的Ksp = 1×10-38 ,要使溶液中的Fe3+
沉淀完全(残留在溶液中的c(Fe3+)<10-5 mol·L-1 ),则溶液
的pH最小为 1、某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是_____
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大
于c点对应的Ksp C
