陕西省柞水中学高中化学 第三章 水溶液中的离子平衡复习课(共18张PPT) 新人教版选修4
文档属性
| 名称 | 陕西省柞水中学高中化学 第三章 水溶液中的离子平衡复习课(共18张PPT) 新人教版选修4 |

|
|
| 格式 | zip | ||
| 文件大小 | 127.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-06 00:00:00 | ||
图片预览





文档简介
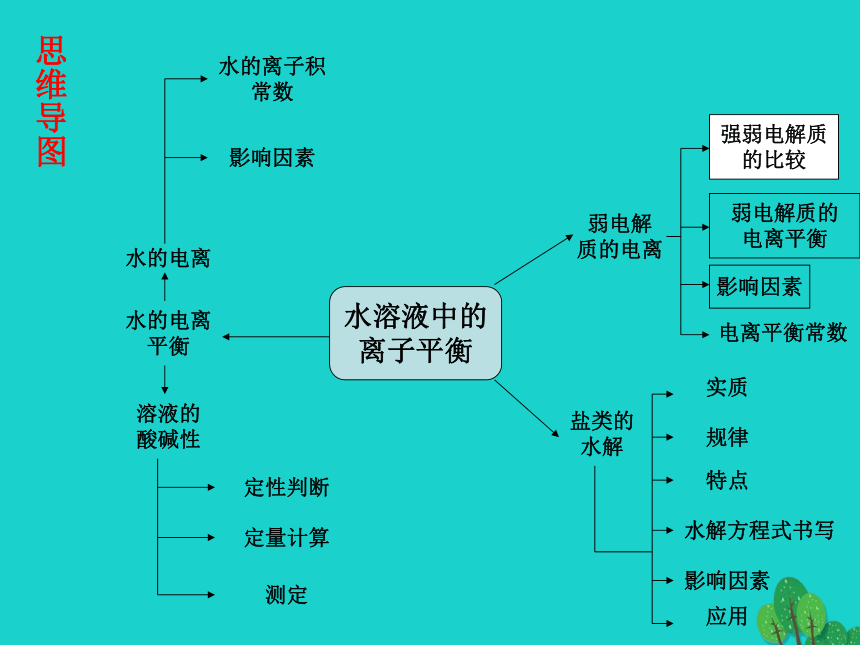
课件18张PPT。第三章 水溶液中的离子平衡
复习课弱电解
质的电离水的离子积
常数水的电离
平衡水的电离溶液的
酸碱性影响因素定性判断测定定量计算盐类的
水解实质规律特点水解方程式书写应用影响因素思维导图考点一:强弱电解质的概念及判断练1.请将下列物质分类:①HCl ②H2S
③NaHCO3 ④CO2 ⑤Al2(SO4)3 ⑥Cl2
⑦NH3 ⑧CH4 ⑨BaSO4 ⑩Fe(OH)3 (1)属于强电解质的是_______ (2)属于弱电解质的是______ (3)属于非电解质的是______练2: 通过那些事实(或实验)可以证明CH3COOH是弱电解质?方法一、取同浓度的HCl和CH3COOH,进行溶液导 电性实验方法二、测定CH3COONa的水溶液应呈碱性。方法三、测定0.1mol/L CH3COOH 的pH值。方法四、相同浓度的HCl 和 CH3COOH 和相同大 小颗粒的锌粒比较反应速率。方法五、相同 pH值,相同体积 的HCl 和 CH3COOH, 和 足量的锌粒反应, CH3COOH产生的氢气多。方法六、取相同浓度的HCl 和 CH3COOH ,稀释 100倍,pH值变化小的是 CH3COOH 。A.HCN易溶于水
B.1 mol?L-1氢氰酸溶液的pH约为3
C.10 mL1mol?L-1 HCN恰好与10mL1mol?L-1
NaOH溶液完全反应
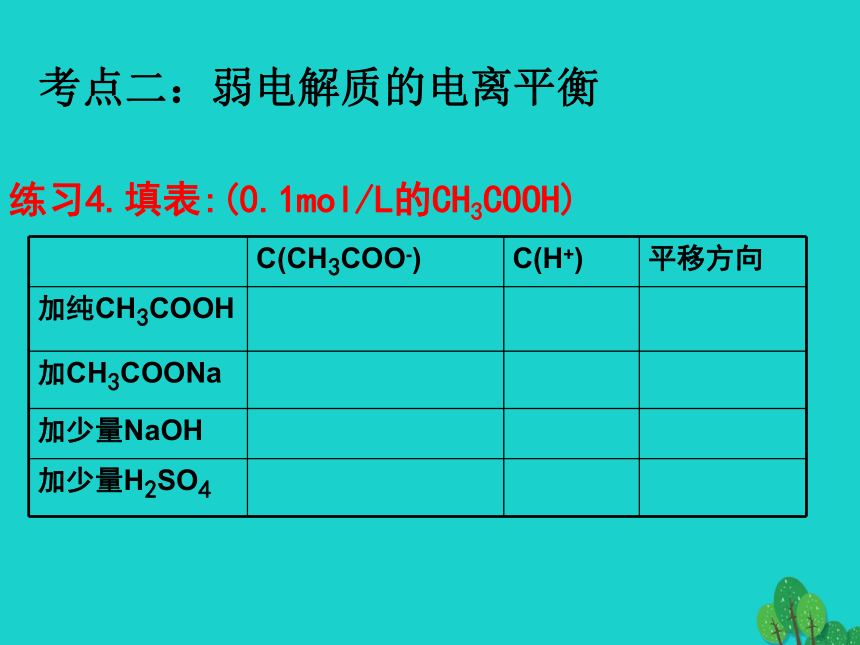
D.HCN溶液的导电性比强酸溶液的弱练习4.填表:(0.1mol/L的CH3COOH)考点二:弱电解质的电离平衡A.两种溶液中,由水电离出的氢离子浓度均为
1×10-11 mol?L-1
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同A练6:在纯水中进行下列实验,其中会影响水的电离平衡的是哪些?如何影响?
① 加入酸溶液或加入碱溶液。
② 加入强酸强碱盐溶液 。
③ 加入强酸弱碱盐溶液或加入强碱弱酸盐溶液。
④ 升高或降低温度。
⑤ 投入金属钠。考点三、水的电离和溶液的pHCA.向水中加入NaHSO4溶液
B.向水中加入Na2CO3溶液
C.向水中加入Al2(SO4)3固体
D.将水加热到100℃,使pH=6思考:1.PH=2的硫酸溶液和PH=12的氢氧化钠溶液等体积混合后溶液的PH__7 2.PH=13的氢氧化钠溶液和0.1mol/L的硫酸等体积混合后溶液的PH__7 3.PH=3的醋酸溶液和PH=11的氢氧化钠溶液等体积混合后溶液的PH__7 4.PH=3的盐酸和PH=11的氨水等体积混合后溶液的PH__7 =<<>考点四:盐类的水解练8.下列物质能否水解,为什么?a.Ba(NO3)2 b.ZnSO4 c.NaHSO4 d.CH3COONH4 练9.判断其溶液的酸碱性并写出水解反应的离子方程式:a.AlCl3 b.Na2CO3 c.KClO练10:将下列物质(浓度均为0.1mol/L)按pH值由大到小排列:①H2SO4、②NaHCO3、③Ba(NO3)2、④CH3COOH、⑤NH4Cl、⑥KOH、⑦HCl、⑧Na2CO3、⑨NH3?H2O、⑩Ba(OH)2
练11:常温下一种PH=3的酸溶液和一种PH=11的碱溶液等体积混合后测得溶液的PH=5.6其原因可能是:
A.浓的强酸和稀的弱碱溶液反应
B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸弱碱盐A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+
c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>
c(CO32-)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:
c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D.0.2mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)D练(双选)用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)>c(Na+),对该混合溶液的下列判断正确的是( )
A、c(H+)>c(OH-)
B、c(CH3COOH)+c(CH3COO-)=0.2 mol/L
C、c(CH3COOH)>c(CH3COO-)
D、c(CH3COO-)+c(OH-)=0.2 mol/LAB考点五、酸碱中和滴定 :用已知物质的量的浓度的酸或碱(标准溶液)来测定未知物质的量浓度的碱或酸(待测溶液或未知溶液)的方法叫做酸碱中和滴定。 :中和滴定以酸碱中和反应为基础,
H++OH-=H2O 在滴定达到终点(即酸碱恰好反应)时: 有n(H+)=n(OH-)1.定义 2.原理4.操作步骤:3.主要仪器:( 酸、碱 )滴定管、锥形瓶、
滴定管夹、烧杯等 洗涤→ 检漏 → 蒸馏水洗 → 溶液润洗 → 装液 → 排气泡→ 调整液面并记录 → 放出待测液 → 加入指示剂 → 滴定 → 记录 → 计算。 酸碱中和滴定读数误差分析先偏大后偏小先仰后俯V=V(后)-V(前),偏小实际读数正确读数先俯后仰先偏小后偏大V=V(后)-V(前),偏大实际读数正确读数练习:
分析下列各种情况的误差
(1)未用标准液(HCl)润洗酸式滴定管 ( )
(2)滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠( )
(3)滴定管尖嘴处有气泡,滴定后气泡消失( )
(4)滴定操作时,有少量盐酸滴于锥形瓶外( )
(5)滴定前仰视刻度,滴定后俯视刻度( )
(6)锥形瓶内用蒸馏水洗涤后,再用待测氢氧化钠润洗 2-3次,将润洗液倒掉,再装NaOH溶液( )
(7)锥形瓶用蒸馏水洗后未倒尽即装NaOH溶液( )偏高偏高偏高偏高偏低偏高无影响(8)滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分( )
(9)指示剂滴加过多( )
(10)碱式滴定管用水洗后,未用待测液润洗 ( )偏低偏低偏低(11)取待测液时,未将盛待测液的碱式滴定管尖嘴的气泡排除。取液后滴定管尖嘴充满溶液( )偏低
质的电离水的离子积
常数水的电离
平衡水的电离溶液的
酸碱性影响因素定性判断测定定量计算盐类的
水解实质规律特点水解方程式书写应用影响因素思维导图考点一:强弱电解质的概念及判断练1.请将下列物质分类:①HCl ②H2S
③NaHCO3 ④CO2 ⑤Al2(SO4)3 ⑥Cl2
⑦NH3 ⑧CH4 ⑨BaSO4 ⑩Fe(OH)3 (1)属于强电解质的是_______ (2)属于弱电解质的是______ (3)属于非电解质的是______练2: 通过那些事实(或实验)可以证明CH3COOH是弱电解质?方法一、取同浓度的HCl和CH3COOH,进行溶液导 电性实验方法二、测定CH3COONa的水溶液应呈碱性。方法三、测定0.1mol/L CH3COOH 的pH值。方法四、相同浓度的HCl 和 CH3COOH 和相同大 小颗粒的锌粒比较反应速率。方法五、相同 pH值,相同体积 的HCl 和 CH3COOH, 和 足量的锌粒反应, CH3COOH产生的氢气多。方法六、取相同浓度的HCl 和 CH3COOH ,稀释 100倍,pH值变化小的是 CH3COOH 。A.HCN易溶于水
B.1 mol?L-1氢氰酸溶液的pH约为3
C.10 mL1mol?L-1 HCN恰好与10mL1mol?L-1
NaOH溶液完全反应
D.HCN溶液的导电性比强酸溶液的弱练习4.填表:(0.1mol/L的CH3COOH)考点二:弱电解质的电离平衡A.两种溶液中,由水电离出的氢离子浓度均为
1×10-11 mol?L-1
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同A练6:在纯水中进行下列实验,其中会影响水的电离平衡的是哪些?如何影响?
① 加入酸溶液或加入碱溶液。
② 加入强酸强碱盐溶液 。
③ 加入强酸弱碱盐溶液或加入强碱弱酸盐溶液。
④ 升高或降低温度。
⑤ 投入金属钠。考点三、水的电离和溶液的pHCA.向水中加入NaHSO4溶液
B.向水中加入Na2CO3溶液
C.向水中加入Al2(SO4)3固体
D.将水加热到100℃,使pH=6思考:1.PH=2的硫酸溶液和PH=12的氢氧化钠溶液等体积混合后溶液的PH__7 2.PH=13的氢氧化钠溶液和0.1mol/L的硫酸等体积混合后溶液的PH__7 3.PH=3的醋酸溶液和PH=11的氢氧化钠溶液等体积混合后溶液的PH__7 4.PH=3的盐酸和PH=11的氨水等体积混合后溶液的PH__7 =<<>考点四:盐类的水解练8.下列物质能否水解,为什么?a.Ba(NO3)2 b.ZnSO4 c.NaHSO4 d.CH3COONH4 练9.判断其溶液的酸碱性并写出水解反应的离子方程式:a.AlCl3 b.Na2CO3 c.KClO练10:将下列物质(浓度均为0.1mol/L)按pH值由大到小排列:①H2SO4、②NaHCO3、③Ba(NO3)2、④CH3COOH、⑤NH4Cl、⑥KOH、⑦HCl、⑧Na2CO3、⑨NH3?H2O、⑩Ba(OH)2
练11:常温下一种PH=3的酸溶液和一种PH=11的碱溶液等体积混合后测得溶液的PH=5.6其原因可能是:
A.浓的强酸和稀的弱碱溶液反应
B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸弱碱盐A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+
c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>
c(CO32-)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:
c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D.0.2mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)D练(双选)用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)>c(Na+),对该混合溶液的下列判断正确的是( )
A、c(H+)>c(OH-)
B、c(CH3COOH)+c(CH3COO-)=0.2 mol/L
C、c(CH3COOH)>c(CH3COO-)
D、c(CH3COO-)+c(OH-)=0.2 mol/LAB考点五、酸碱中和滴定 :用已知物质的量的浓度的酸或碱(标准溶液)来测定未知物质的量浓度的碱或酸(待测溶液或未知溶液)的方法叫做酸碱中和滴定。 :中和滴定以酸碱中和反应为基础,
H++OH-=H2O 在滴定达到终点(即酸碱恰好反应)时: 有n(H+)=n(OH-)1.定义 2.原理4.操作步骤:3.主要仪器:( 酸、碱 )滴定管、锥形瓶、
滴定管夹、烧杯等 洗涤→ 检漏 → 蒸馏水洗 → 溶液润洗 → 装液 → 排气泡→ 调整液面并记录 → 放出待测液 → 加入指示剂 → 滴定 → 记录 → 计算。 酸碱中和滴定读数误差分析先偏大后偏小先仰后俯V=V(后)-V(前),偏小实际读数正确读数先俯后仰先偏小后偏大V=V(后)-V(前),偏大实际读数正确读数练习:
分析下列各种情况的误差
(1)未用标准液(HCl)润洗酸式滴定管 ( )
(2)滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠( )
(3)滴定管尖嘴处有气泡,滴定后气泡消失( )
(4)滴定操作时,有少量盐酸滴于锥形瓶外( )
(5)滴定前仰视刻度,滴定后俯视刻度( )
(6)锥形瓶内用蒸馏水洗涤后,再用待测氢氧化钠润洗 2-3次,将润洗液倒掉,再装NaOH溶液( )
(7)锥形瓶用蒸馏水洗后未倒尽即装NaOH溶液( )偏高偏高偏高偏高偏低偏高无影响(8)滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分( )
(9)指示剂滴加过多( )
(10)碱式滴定管用水洗后,未用待测液润洗 ( )偏低偏低偏低(11)取待测液时,未将盛待测液的碱式滴定管尖嘴的气泡排除。取液后滴定管尖嘴充满溶液( )偏低
