10.2盐的性质 课件 (2)
图片预览








文档简介
课件40张PPT。 盐的化学性质
你能写出这些物质的化学式吗?
碳酸钙碳酸钠碳酸氢钠CaCO3Na2CO3NaHCO3快乐记忆
看图说用途华表人民大会堂中南海酒店大厅大理石地面纯碱
苏打小苏打大理石
石灰石用于生产玻璃、造纸、纺织、洗涤剂发酵粉的主要成分之一,
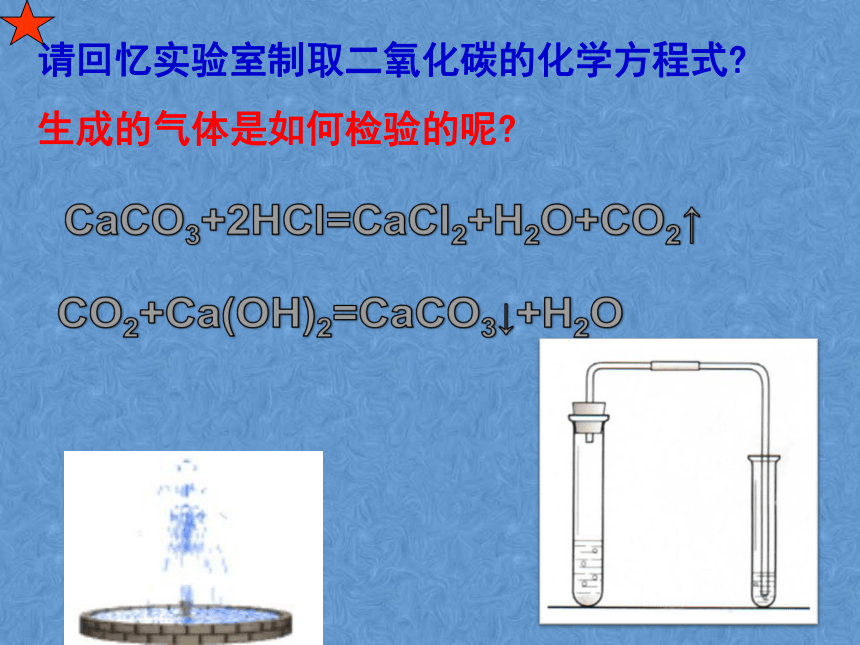
治疗胃酸过多症的药剂可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料请回忆实验室制取二氧化碳的化学方程式?
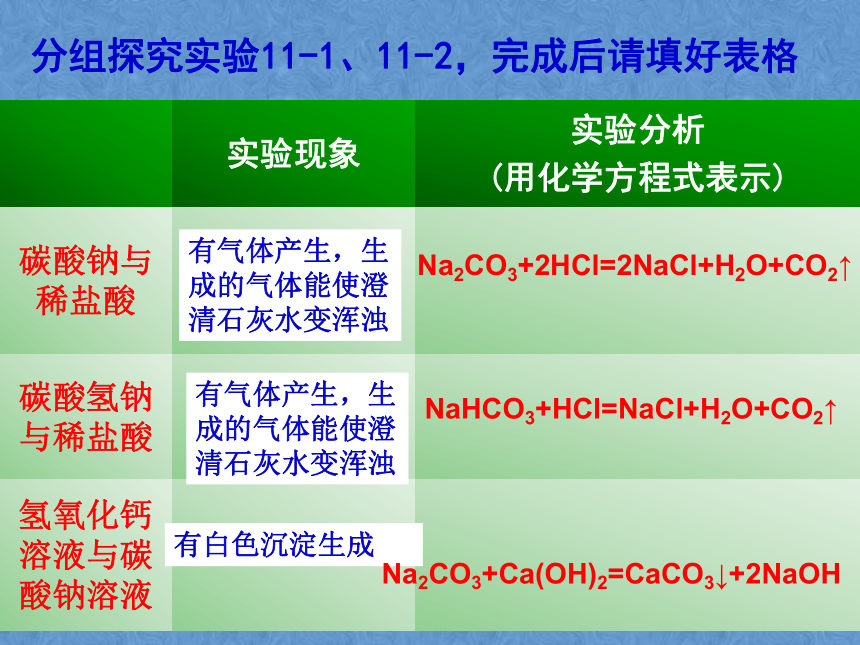
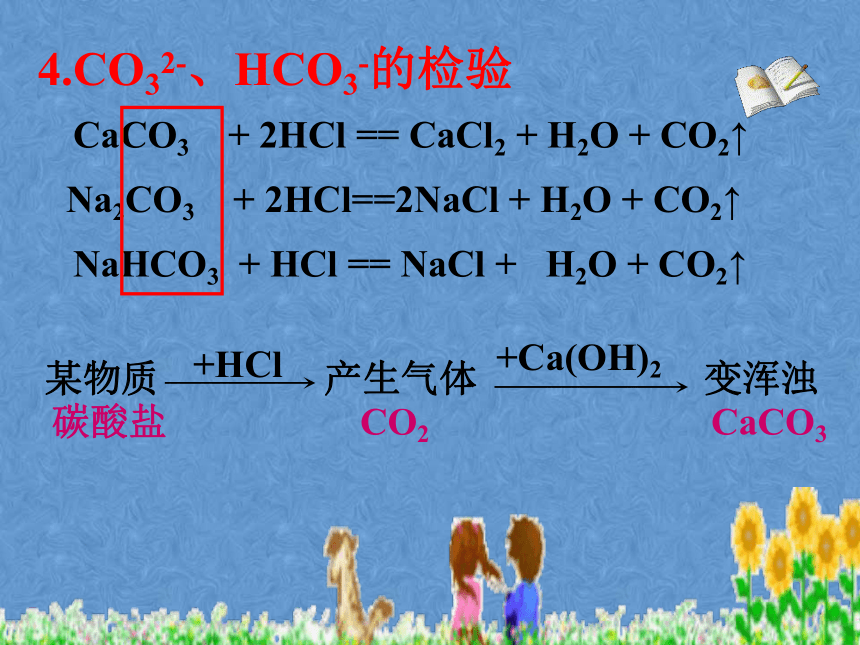
生成的气体是如何检验的呢?分组探究实验11-1、11-2,完成后请填好表格有气体产生,生成的气体能使澄清石灰水变浑浊有气体产生,生成的气体能使澄清石灰水变浑浊有白色沉淀生成Na2CO3+2HCl=2NaCl+H2O+CO2↑NaHCO3+HCl=NaCl+H2O+CO2↑Na2CO3+Ca(OH)2=CaCO3↓+2NaOH4.CO32-、HCO3-的检验CaCO3 + 2HCl == CaCl2 + H2O + CO2↑Na2CO3 + 2HCl==2NaCl + H2O + CO2↑NaHCO3 + HCl == NaCl + H2O + CO2↑某物质产生气体变浑浊CO2CaCO3碳酸盐某同学往一无色溶液中滴加稀盐酸,发现生成一种无色气体,将生成的气体通入澄清石灰水,发现石灰水变浑浊,于是他得出了该溶液中含有碳酸根离子,你认为他的结论正确么?为什么?请小结碳酸根或碳酸氢根离子检验方法?拓展探究一实验11-2 向盛有少量碳酸钠溶液的试管里滴入澄清的石灰水,观察现象。溶液变浑浊Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOHNaOH的工业制取
纯碱Na2CO3和熟石灰Ca(OH)2制取烧碱Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOH由纯碱制烧碱纯碱烧碱大家结合这些化学反应看能发现有什么共同点?
拓展探究二(1)HCl+ NaOH== H2O + NaCl
(2)CaCO3 +2HCl==CaCl2 + H2O+CO2↑
(3)Na2CO3 + 2HCl==2NaCl + H2O+CO2↑
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓H2CO3H2CO3复分解反应 两种化合物在反应时互相交换成分生成另外两种化合物的反应。复分解反应的条件(1)生成水;(2)生成气体;(3)生成沉淀。(1)HCl+ NaOH== H2O + NaCl
(2)CaCO3 +2HCl==CaCl2 + H2O+CO2↑
(3)Na2CO3 + 2HCl==2NaCl + H2O+CO2↑
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓H2CO3H2CO3AB+CD → AD+CB特点:双交换、价不变酸+碱——盐+水HClNaOH+HClNa=+H2OH2SO4+Cu(OH)2=HSO4CuOHHOH+2H2O酸和碱反应的其他例子① HNO3+ Fe(OH)3
② HCl +Ca(OH)2
=Fe(NO3)3+ H2O33= CaCl2 + H2O22酸+盐——新酸+新盐HCl + AgNO3HClNO3Ag=↓+酸+盐——新酸+新盐① HNO3+CaCO3
② H2SO4+BaCl2
③ H2SO4+MgCO3
=Ca(NO3)2+H2O+CO2↑2=BaSO4↓+ 2 HCl=MgSO4+H2O+CO2↑练习一:判断下列反应能否发生,如能发生请写出相应的化学方程式(1)NaOH+CuSO4
(2)NaCl+AgNO3
(3)CaCO3+HNO3
(4)NaCl+KNO3(1)2NaOH+CuSO4=Na2SO4+Cu(OH)2 ↓
(2)NaCl+AgNO3=AgCl↓+NaNO3
(3)CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑(4)NaCl+KNO3 ×
P109说出酸、碱、盐的溶解性规律(20℃)物质溶解性口诀:
酸都溶:
溶碱有五位:钾、钠、铵、钙、钡。
钾、钠、铵、硝酸盐都可溶。
盐酸盐只有氯化银不可溶。
硫酸盐只有硫酸钡不可溶。
碳酸盐只溶钾、钠、铵,剩下都不溶这些你都能记住吗?另外:AgCl、BaSO4不仅不溶于水,
而且不溶于稀硝酸
练习二:下列物质两两之间可以发生多少个反应,并请把相应的化学方程式写出来
Mg H2SO4 ZnSO4 NaOH K2CO3 6个
Mg+ H2SO4 = MgSO4+H2 ↑
Mg + ZnSO4 = MgSO4+Zn
2NaOH+ H2SO4 = Na2SO4+2H2O
H2SO4+ K2CO3 = K2SO4+H2O+CO2↑
2NaOH+ZnSO4 = Zn(OH)2↓+Na2SO4
ZnSO4+ K2CO3 = ZnCO3 ↓ +K2SO4探究五:请归纳盐的化学性质(可溶)(可溶)(可溶)(可溶)(可溶)(至少有一种沉淀)(至少有一种沉淀)1.盐 + 金属 = 新盐 + 新金属 2.盐 + 酸 = 新盐 + 新酸 3.盐 + 碱 = 新盐 + 新碱4.盐 + 盐 = 新盐 + 新盐①金属+盐→新盐+新金属位于前面位于后面盐溶液无可溶性不要用K、Ca、Na置换盐溶液中的金属在金属活动性顺序表中,只有_________ 的金属才能把________的金属从它的___ 中置换出来,与氢的位置 __关;盐必须
是______盐。Zn + CuSO4 = ZnSO4 + Cu
②盐+酸→新盐+新酸条件:生成物中有沉淀或气体或水③盐+碱→新盐+新碱条件:反应物两者均可溶;
生成物有沉淀或气体或水AgNO3 + HCl = AgCl↓+ HNO3
BaCl2 + H2SO4 = BaSO4 ↓ + 2HClNa2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaClAgNO3 + NaCl = AgCl↓ + NaNO3
BaCl2 + Na2SO4 = BaSO4 ↓ + 2NaCl④盐+盐→新盐+新盐条件:反应物两者均可溶;
生成物有沉淀金属、氧化物、酸碱盐之间的反应规律酸盐酸强盐可溶, 碳酸盐遇酸气都生。
碱盐盐盐都应溶, 酸碱接触都反应。
生成物中有限定, 气水沉淀占一种 。
氧化物中有碱性, 投入酸中都反应。
氧化物中有酸性, 与碱反应碱应溶。
金盐盐溶金活泼, 金酸氢前氢气生。浮沉中的鸡蛋将一个新鲜的鸡蛋放在盛有水和足量稀盐酸的烧杯中,观察现象,并解释其中的原因? 因为CaCO3和稀HCl反应生成CO2气体,气泡附着在蛋壳上,使鸡蛋所受的浮力变大,当浮力大于鸡蛋的重力时,鸡蛋上浮;当鸡蛋浮到水面时,气泡破裂,鸡蛋所受浮力变小,浮力小于鸡蛋重力,所以鸡蛋下沉。课堂练习:
现有①碳酸钠, ②碳酸钙、 ③碳酸氢钠、 ④氯化钠、 ⑤盐酸,请用序号完成
(1)人体胃液中存在帮助消化的液体是_____
(2)发酵粉的主要成分之一是_____
(3)日常生活中重要的调味品是_____
(4)天安门前华表的主要成份是_____
(5)广泛用于制造玻璃的原材料是_____①②③④⑤ 小军先将原料放入足量的水中,请写出所发生的化学反应:
______________________________
______________________________
课堂练习:小军购得一包制皮蛋的材料,说明如下原料:碳酸钠,氧化钙,氯化钠
制法:将原料溶于冷开水,再将鲜鸡蛋放在其中,数天后即可CaO+H2O=Ca(OH)2
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH【小组合作】写出下列反应的方程式,并讨论它们是否属于复分解反应。
1.盐酸除铁锈。
2.氢氧化镁中和胃酸
3纯碱制烧碱。
4硫酸铜溶液与氢氧化钠溶液反应。
5.硫酸溶液与碳酸钠反应6HCl+2Fe2O3===2FeCl3+3H2OMg(OH)2+2HCl==MgCl2+2H2OCa(OH)2+Na2CO3==2NaCl+CaCO3↓CuSO4+2NaOH==Cu(OH)2↓+Na2SO4H2SO4+Na2CO3==Na2SO4+H2O+CO2↑几种常见离子的检验:1.碳酸根离子的检验 C032_①滴加稀盐酸,现象:有气泡产生②通入澄清石灰水,现象:生成白色浑浊2.铵根离子的检验 NH4+①滴加氢氧化钠溶液,现象:有气泡产生②用红色石蕊试纸检验,现象:试纸变蓝或用沾有无色酚酞的棉花检验 说到纯碱,我们一定要记得一位我国化学史上的科学家——侯德榜,希望大家课后去查查关于他的资料,碳酸钠为何叫纯碱呢?侯德榜(1890~1974)侯德榜,中国化学家,“侯氏制碱法”的创始人。侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,他为发展小化肥工业所做的贡献。1921年,他在哥伦比亚大学获博士学位后,怀着工业救国的远大抱负,毅然放弃自己热爱的制革专业,回到祖国。(候氏制碱法)反应分三步进行
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3==Na2CO3+H2O+CO2↑△石灰石和石灰岩地区的溶洞溶洞的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2]
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。 CaCO3+H2O+CO2==Ca(HCO3)2
Ca(HCO3)==2CaCO3↓+H2O+CO2↑基本反应类型比较:反应物只有一种而生成物有多种,
即“一变多”
反应物为多种而生成物只有一种,
即“多变一”【课堂练习】【练习1】判断下列物质是否溶于水:Na2CO3 AgCl BaCO3 MgSO4 BaSO4 Cu(OH)2 (NH4)2SO4 Ba(OH)2 Mg(OH)2
AgNO3 Na3PO4 Fe(OH)3 白色↓白色↓白色↓蓝色↓白色↓红褐色↓×√√√×√【练习3】有Ba(OH)2溶液、BaCl2溶液、Na2CO3溶液、H2SO4溶液四种物质,两物质间能发生的化学反应共有( )
A. 3个 B. 4个 C. 5个 D. 6个C【课堂练习】【题4】下列各组离子在酸性溶液中能大量共存的( )
A. Ag+ 、Na+ 、Cl- 、NO3-
B. Na+ 、OH- 、SO42-
C. K+ 、Na+ 、CO32- 、Cl-
D. Ba2+ 、Mg2+ 、Cl- 【课堂练习】D【例5】请将除去下列物质中的杂质的试剂的化学式填在短线上
FeSO4(CuSO4)________
NaOH(Na2CO3)________
NaNO3(NaCl)_______FeCa(OH)2AgNO31、盐是指含有____离子和____离子的化合物
2.食盐的主要成分是____,若误服工业用盐如________(化学式______)就会中毒
3. 碳酸钠的化学式________俗称是___________。碳酸氢钠的化学式是________俗称是_______金属 酸根NaCl亚硝酸钠NaNO2Na2CO3NaHCO3纯碱、苏打小苏打写化学式4、生理盐水的溶质是_____氯化钠我会做5、写出下列物质或主要成分的化学式,并在括号中注明属于酸、碱、盐、单质、氧化物的哪一类?食醋里的醋酸__________( )
调味品中的食盐________( )
建筑上抹墙的熟石灰_______( )治疗胃酸过多的药物碳酸____ ( )
用于人工降雨的物质_____ ( )
具有还原性的固体物质______ ( )CH3COOHNaClCa(OH)2酸盐碱NaHCO3盐CO2C氧化物单质再见
你能写出这些物质的化学式吗?
碳酸钙碳酸钠碳酸氢钠CaCO3Na2CO3NaHCO3快乐记忆
看图说用途华表人民大会堂中南海酒店大厅大理石地面纯碱
苏打小苏打大理石
石灰石用于生产玻璃、造纸、纺织、洗涤剂发酵粉的主要成分之一,
治疗胃酸过多症的药剂可作补钙剂,用于实验室制取二氧化碳,石灰石、大理石用作建筑材料请回忆实验室制取二氧化碳的化学方程式?
生成的气体是如何检验的呢?分组探究实验11-1、11-2,完成后请填好表格有气体产生,生成的气体能使澄清石灰水变浑浊有气体产生,生成的气体能使澄清石灰水变浑浊有白色沉淀生成Na2CO3+2HCl=2NaCl+H2O+CO2↑NaHCO3+HCl=NaCl+H2O+CO2↑Na2CO3+Ca(OH)2=CaCO3↓+2NaOH4.CO32-、HCO3-的检验CaCO3 + 2HCl == CaCl2 + H2O + CO2↑Na2CO3 + 2HCl==2NaCl + H2O + CO2↑NaHCO3 + HCl == NaCl + H2O + CO2↑某物质产生气体变浑浊CO2CaCO3碳酸盐某同学往一无色溶液中滴加稀盐酸,发现生成一种无色气体,将生成的气体通入澄清石灰水,发现石灰水变浑浊,于是他得出了该溶液中含有碳酸根离子,你认为他的结论正确么?为什么?请小结碳酸根或碳酸氢根离子检验方法?拓展探究一实验11-2 向盛有少量碳酸钠溶液的试管里滴入澄清的石灰水,观察现象。溶液变浑浊Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOHNaOH的工业制取
纯碱Na2CO3和熟石灰Ca(OH)2制取烧碱Na2CO3 + Ca(OH)2 == CaCO3↓+ 2NaOH由纯碱制烧碱纯碱烧碱大家结合这些化学反应看能发现有什么共同点?
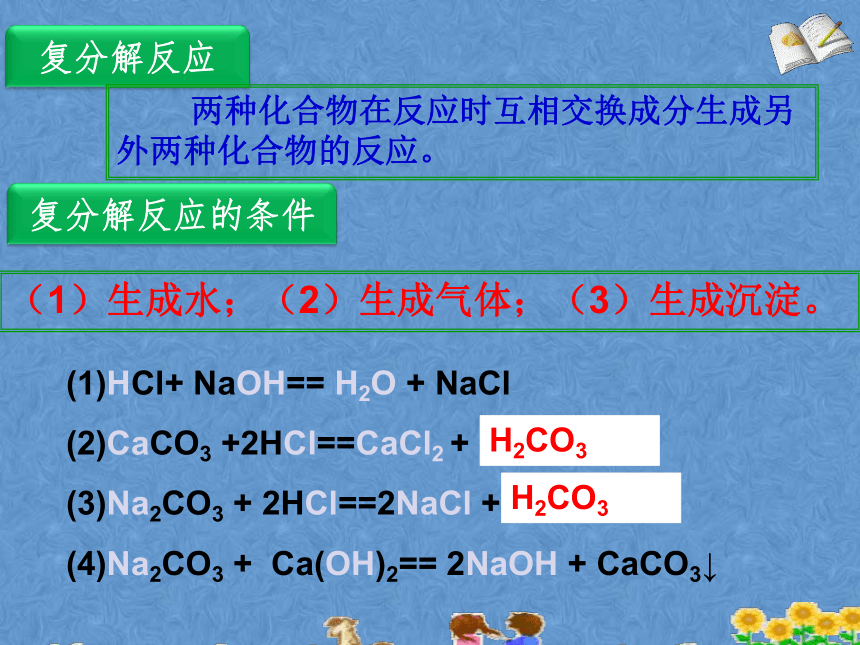
拓展探究二(1)HCl+ NaOH== H2O + NaCl
(2)CaCO3 +2HCl==CaCl2 + H2O+CO2↑
(3)Na2CO3 + 2HCl==2NaCl + H2O+CO2↑
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓H2CO3H2CO3复分解反应 两种化合物在反应时互相交换成分生成另外两种化合物的反应。复分解反应的条件(1)生成水;(2)生成气体;(3)生成沉淀。(1)HCl+ NaOH== H2O + NaCl
(2)CaCO3 +2HCl==CaCl2 + H2O+CO2↑
(3)Na2CO3 + 2HCl==2NaCl + H2O+CO2↑
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓H2CO3H2CO3AB+CD → AD+CB特点:双交换、价不变酸+碱——盐+水HClNaOH+HClNa=+H2OH2SO4+Cu(OH)2=HSO4CuOHHOH+2H2O酸和碱反应的其他例子① HNO3+ Fe(OH)3
② HCl +Ca(OH)2
=Fe(NO3)3+ H2O33= CaCl2 + H2O22酸+盐——新酸+新盐HCl + AgNO3HClNO3Ag=↓+酸+盐——新酸+新盐① HNO3+CaCO3
② H2SO4+BaCl2
③ H2SO4+MgCO3
=Ca(NO3)2+H2O+CO2↑2=BaSO4↓+ 2 HCl=MgSO4+H2O+CO2↑练习一:判断下列反应能否发生,如能发生请写出相应的化学方程式(1)NaOH+CuSO4
(2)NaCl+AgNO3
(3)CaCO3+HNO3
(4)NaCl+KNO3(1)2NaOH+CuSO4=Na2SO4+Cu(OH)2 ↓
(2)NaCl+AgNO3=AgCl↓+NaNO3
(3)CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑(4)NaCl+KNO3 ×
P109说出酸、碱、盐的溶解性规律(20℃)物质溶解性口诀:
酸都溶:
溶碱有五位:钾、钠、铵、钙、钡。
钾、钠、铵、硝酸盐都可溶。
盐酸盐只有氯化银不可溶。
硫酸盐只有硫酸钡不可溶。
碳酸盐只溶钾、钠、铵,剩下都不溶这些你都能记住吗?另外:AgCl、BaSO4不仅不溶于水,
而且不溶于稀硝酸
练习二:下列物质两两之间可以发生多少个反应,并请把相应的化学方程式写出来
Mg H2SO4 ZnSO4 NaOH K2CO3 6个
Mg+ H2SO4 = MgSO4+H2 ↑
Mg + ZnSO4 = MgSO4+Zn
2NaOH+ H2SO4 = Na2SO4+2H2O
H2SO4+ K2CO3 = K2SO4+H2O+CO2↑
2NaOH+ZnSO4 = Zn(OH)2↓+Na2SO4
ZnSO4+ K2CO3 = ZnCO3 ↓ +K2SO4探究五:请归纳盐的化学性质(可溶)(可溶)(可溶)(可溶)(可溶)(至少有一种沉淀)(至少有一种沉淀)1.盐 + 金属 = 新盐 + 新金属 2.盐 + 酸 = 新盐 + 新酸 3.盐 + 碱 = 新盐 + 新碱4.盐 + 盐 = 新盐 + 新盐①金属+盐→新盐+新金属位于前面位于后面盐溶液无可溶性不要用K、Ca、Na置换盐溶液中的金属在金属活动性顺序表中,只有_________ 的金属才能把________的金属从它的___ 中置换出来,与氢的位置 __关;盐必须
是______盐。Zn + CuSO4 = ZnSO4 + Cu
②盐+酸→新盐+新酸条件:生成物中有沉淀或气体或水③盐+碱→新盐+新碱条件:反应物两者均可溶;
生成物有沉淀或气体或水AgNO3 + HCl = AgCl↓+ HNO3
BaCl2 + H2SO4 = BaSO4 ↓ + 2HClNa2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaClAgNO3 + NaCl = AgCl↓ + NaNO3
BaCl2 + Na2SO4 = BaSO4 ↓ + 2NaCl④盐+盐→新盐+新盐条件:反应物两者均可溶;
生成物有沉淀金属、氧化物、酸碱盐之间的反应规律酸盐酸强盐可溶, 碳酸盐遇酸气都生。
碱盐盐盐都应溶, 酸碱接触都反应。
生成物中有限定, 气水沉淀占一种 。
氧化物中有碱性, 投入酸中都反应。
氧化物中有酸性, 与碱反应碱应溶。
金盐盐溶金活泼, 金酸氢前氢气生。浮沉中的鸡蛋将一个新鲜的鸡蛋放在盛有水和足量稀盐酸的烧杯中,观察现象,并解释其中的原因? 因为CaCO3和稀HCl反应生成CO2气体,气泡附着在蛋壳上,使鸡蛋所受的浮力变大,当浮力大于鸡蛋的重力时,鸡蛋上浮;当鸡蛋浮到水面时,气泡破裂,鸡蛋所受浮力变小,浮力小于鸡蛋重力,所以鸡蛋下沉。课堂练习:
现有①碳酸钠, ②碳酸钙、 ③碳酸氢钠、 ④氯化钠、 ⑤盐酸,请用序号完成
(1)人体胃液中存在帮助消化的液体是_____
(2)发酵粉的主要成分之一是_____
(3)日常生活中重要的调味品是_____
(4)天安门前华表的主要成份是_____
(5)广泛用于制造玻璃的原材料是_____①②③④⑤ 小军先将原料放入足量的水中,请写出所发生的化学反应:
______________________________
______________________________
课堂练习:小军购得一包制皮蛋的材料,说明如下原料:碳酸钠,氧化钙,氯化钠
制法:将原料溶于冷开水,再将鲜鸡蛋放在其中,数天后即可CaO+H2O=Ca(OH)2
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH【小组合作】写出下列反应的方程式,并讨论它们是否属于复分解反应。
1.盐酸除铁锈。
2.氢氧化镁中和胃酸
3纯碱制烧碱。
4硫酸铜溶液与氢氧化钠溶液反应。
5.硫酸溶液与碳酸钠反应6HCl+2Fe2O3===2FeCl3+3H2OMg(OH)2+2HCl==MgCl2+2H2OCa(OH)2+Na2CO3==2NaCl+CaCO3↓CuSO4+2NaOH==Cu(OH)2↓+Na2SO4H2SO4+Na2CO3==Na2SO4+H2O+CO2↑几种常见离子的检验:1.碳酸根离子的检验 C032_①滴加稀盐酸,现象:有气泡产生②通入澄清石灰水,现象:生成白色浑浊2.铵根离子的检验 NH4+①滴加氢氧化钠溶液,现象:有气泡产生②用红色石蕊试纸检验,现象:试纸变蓝或用沾有无色酚酞的棉花检验 说到纯碱,我们一定要记得一位我国化学史上的科学家——侯德榜,希望大家课后去查查关于他的资料,碳酸钠为何叫纯碱呢?侯德榜(1890~1974)侯德榜,中国化学家,“侯氏制碱法”的创始人。侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,他为发展小化肥工业所做的贡献。1921年,他在哥伦比亚大学获博士学位后,怀着工业救国的远大抱负,毅然放弃自己热爱的制革专业,回到祖国。(候氏制碱法)反应分三步进行
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3==Na2CO3+H2O+CO2↑△石灰石和石灰岩地区的溶洞溶洞的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2]
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。 CaCO3+H2O+CO2==Ca(HCO3)2
Ca(HCO3)==2CaCO3↓+H2O+CO2↑基本反应类型比较:反应物只有一种而生成物有多种,
即“一变多”
反应物为多种而生成物只有一种,
即“多变一”【课堂练习】【练习1】判断下列物质是否溶于水:Na2CO3 AgCl BaCO3 MgSO4 BaSO4 Cu(OH)2 (NH4)2SO4 Ba(OH)2 Mg(OH)2
AgNO3 Na3PO4 Fe(OH)3 白色↓白色↓白色↓蓝色↓白色↓红褐色↓×√√√×√【练习3】有Ba(OH)2溶液、BaCl2溶液、Na2CO3溶液、H2SO4溶液四种物质,两物质间能发生的化学反应共有( )
A. 3个 B. 4个 C. 5个 D. 6个C【课堂练习】【题4】下列各组离子在酸性溶液中能大量共存的( )
A. Ag+ 、Na+ 、Cl- 、NO3-
B. Na+ 、OH- 、SO42-
C. K+ 、Na+ 、CO32- 、Cl-
D. Ba2+ 、Mg2+ 、Cl- 【课堂练习】D【例5】请将除去下列物质中的杂质的试剂的化学式填在短线上
FeSO4(CuSO4)________
NaOH(Na2CO3)________
NaNO3(NaCl)_______FeCa(OH)2AgNO31、盐是指含有____离子和____离子的化合物
2.食盐的主要成分是____,若误服工业用盐如________(化学式______)就会中毒
3. 碳酸钠的化学式________俗称是___________。碳酸氢钠的化学式是________俗称是_______金属 酸根NaCl亚硝酸钠NaNO2Na2CO3NaHCO3纯碱、苏打小苏打写化学式4、生理盐水的溶质是_____氯化钠我会做5、写出下列物质或主要成分的化学式,并在括号中注明属于酸、碱、盐、单质、氧化物的哪一类?食醋里的醋酸__________( )
调味品中的食盐________( )
建筑上抹墙的熟石灰_______( )治疗胃酸过多的药物碳酸____ ( )
用于人工降雨的物质_____ ( )
具有还原性的固体物质______ ( )CH3COOHNaClCa(OH)2酸盐碱NaHCO3盐CO2C氧化物单质再见
