重庆市人教版高中化学必修一学案-第二章化学物质及其变化章末复习
文档属性
| 名称 | 重庆市人教版高中化学必修一学案-第二章化学物质及其变化章末复习 |

|
|
| 格式 | zip | ||
| 文件大小 | 161.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-10 00:00:00 | ||
图片预览


文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
第二章 章末复习
一、知识整合
1.以组成为标准对物质进行分类
21世纪教育网21世纪教育网物质
21世纪教育网21世纪教育网纯净物
单质
金属:Na
、Mg
、Al
21世纪教育网
非金属:S、N2
、O2
化合物
氧化物
酸性氧化物:SO2、SO3、P2O5、
碱性氧化物:Na2O、CaO、Fe2O3
两性氧化物:Al2O3
不成盐氧化物:CO、NO
酸
按酸根分
含氧酸:HNO3、H2SO4
无氧酸:HCl
按电离出的H+
数分
一元酸:HCl、HNO3
二元酸:H2SO4、H2SO3
多元酸:H3PO4
碱
按强弱分
强碱:NaOH、Ba(OH)2
弱碱:NH3·H2O
、Fe(OH)3
按电离出OH―
数分
一元碱:NaOH
二元碱:Ba(OH)2
多元碱:Fe(OH)3
盐
正盐:Na2CO3
酸式盐:NaHCO3
碱式盐:Cu2(OH)2CO3
混合物
2.化学反应的分类
化学反应
根据反应物和生成物的类别以及反应前后物质种类的多少
化合反应:A+B==AB
分解反应:AB==A+B
置换反应:A+
BC==AC+B
复分解反应:AB+CD==AD+CB
根据反应中是否有电子转移
氧化还原反应
实质:有电子转移(得失或偏移)
特征:反应前后元素的化合价有变化
基本概念相互关系
氧化剂-有氧化性-得电子-化合价降低-发生还原反应-还原产物
还原剂-有还原性-失电子-化合价升高-发生氧化反应-氧化产物
非氧化还原反应
根据反应中是否有离子参加
离子反应
定义:有离子参加的一类反应,主要包括复分解反应、有离子参加的氧化还原反应。
离子方程式
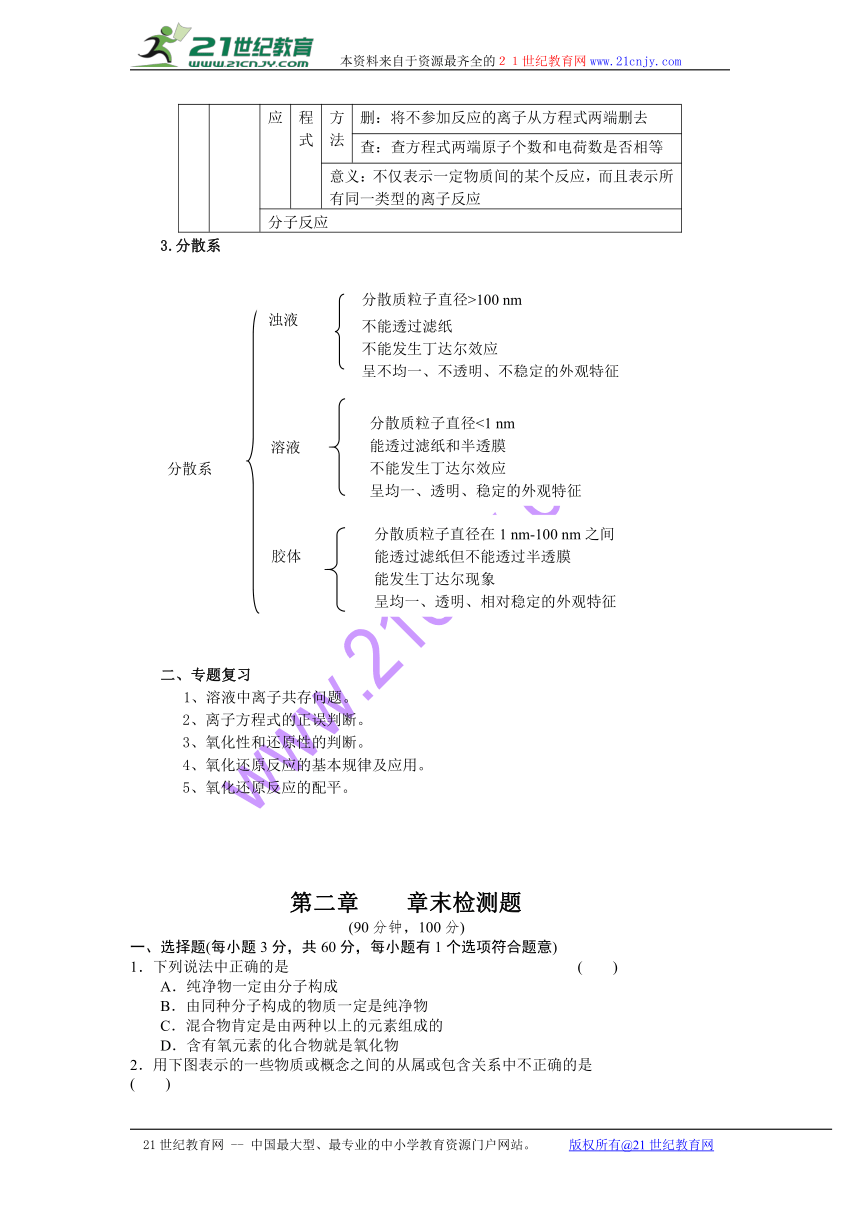
定义:用实际参加反应的离子符号来表示离子反应的式子
书写方法
写:写出反应的化学方程式
拆:把易溶于水、易电离的物质拆写成离子形式
删:将不参加反应的离子从方程式两端删去
查:查方程式两端原子个数和电荷数是否相等
意义:不仅表示一定物质间的某个反应,而且表示所有同一类型的离子反应
分子反应
3.分散系
二、专题复习
1、溶液中离子共存问题。
2、离子方程式的正误判断。
3、氧化性和还原性的判断。
4、氧化还原反应的基本规律及应用。
5、氧化还原反应的配平。
第二章 章末检测题
(90分钟,100分)
一、选择题(每小题3分,共60分,每小题有1个选项符合题意)
1.下列说法中正确的是
( )
A.纯净物一定由分子构成
B.由同种分子构成的物质一定是纯净物
C.混合物肯定是由两种以上的元素组成的
D.含有氧元素的化合物就是氧化物
2.用下图表示的一些物质或概念之间的从属或包含关系中不正确的是
( )21教育网
X
Y
Z
例
氧化物
化合物
纯净物
A
含氧酸
酸
化合物
B
溶液
分散系
混合物
C
强电解质
电解质
化合物
D
置换反应
氧化还原反应
离子反应
3.下列物质的分类合理的是
( )
A.氧化物:CO2、NO、SO2、H2O
B.碱:NaOH、KOH、Ba(OH)2、Na2CO3
C.铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D.碱性氧化物:Na2O、CaO、Mn2O7、Al2O3
4.下列说法正确的是
( )
A.可用丁达尔效应区分溶液与胶体
B.生石灰与水混合的过程只发生物理变化
C.O3是由3个氧原子构成的化合物
D.CuSO4·5H2O是一种混合物
5.氯化铁溶液与氢氧化铁胶体具有的共同性质是
( )
A.分散质粒子大小都在1~100nm之间
B.有丁达尔效应
C.加热蒸干、灼烧后都有氧化铁生成
D.呈红褐色
6.离子方程式H++OH-===H2O所表示的反应是
( )
A.所有酸和碱之间的中和反应
B.所有强酸和强碱之间的中和反应
C.所有可溶性酸和可溶性碱之间的中和反应
D.强酸溶液与强碱溶液生成可溶性盐和水的反应
7.下列化学方程式中,能用离子方程式SO+Ba2+===BaSO4↓来表示的是( )
A.BaCO3+H2SO4===BaSO4↓+H2O+CO2↑
B.BaCl2+Na2CO3===BaCO3↓+2NaCl
C.Ba(OH)2+CuSO4===Cu(OH)2↓+BaSO4↓
D.BaCl2+Na2SO4===BaSO4↓+2NaCl
8.下列各组离子因为生成难溶物而不能大量共存的是
( )
A.Cl-、Na+、NO、OH-
B.HCO、Cl-、Na+、H+
C.Ba2+、Cl-、CO、K+
D.NH、K+、OH-、Cl-
9.下列离子方程式中书写正确的是
( )
A.铁和稀硫酸反应: 2Fe+6H+===2Fe3++3H2↑
B.碳酸钙和稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
C.铜和硝酸银溶液反应:Cu+Ag+===Cu2++Ag
D.硫酸镁溶液与氢氧化钡溶液反应: Mg2++2OH-===Mg(OH)2↓
10.离子检验的常用方法有三种:
检验方法
沉淀法
显色法
气体法
含义
反应中有沉淀产生或溶解
反应中有颜色变化
反应中有气体产生
下列离子检验的方法不合理的是
( )
A.NH—气体法
B.I-—沉淀法
C.Fe3+—显色法
D.Ca2+—气体法
11.下列关于氧化还原反应说法正确的是
( )
A.肯定一种元素被氧化,另一种元素被还原
B.某元素从化合态变成游离态,该元素一定被还原
C.在反应中不一定所有元素的化合价都发生变化
D.在氧化还原反应中非金属单质一定是氧化剂
12.向含有下列离子的溶液中分别加入烧碱固体(溶液体积变化可忽略),能引起下列离子浓度减小的是
( )
A.HCO
B.Cl-
C.OH-
D.CO
13.下列叙述正确的是
( )
A.元素的单质一定由氧化或还原该元素的化合物制得
B.在化学反应中,得电子越多的氧化剂,其氧化性就越强
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.含有最高价元素的化合物不一定具有很强的氧化性
14.下列反应的现象描述与离子方程式都正确的是
( )
A.金属镁与稀盐酸反应:有气泡逸出 Mg+2H++2Cl-===MgCl2+H2↑
B.氯化钡溶液与稀硫酸反应:有白色沉淀生成 Ba2++SO===BaSO4↓
C.碳酸钠溶液与盐酸反应:有气泡逸出 Na2CO3+2H+===2Na++CO2↑+H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生
2HCO+Ba2++2OH-===BaCO3↓+2H2O+CO
15.下列反应完成后有沉淀生成的是
( )
A.BaCl2溶液与Na2CO3溶液加足量CH3COOH溶液
B.Ba(OH)2溶液与KNO3溶液加足量稀硫酸
C.AgNO3溶液与Na2CO3溶液加足量稀硝酸
D.Ca(OH)2溶液与FeCl3溶液加足量稀硝酸
16.下列各组微粒中,在一定条件下均可以作氧化剂的是
( )
A.Fe、H2O、CO2
B.Fe3+、MnO、NO
C.Cl2、HClO、Mg
D.ClO-、Cl-、Ag+
17.根据反应①2FeCl3+2KI===2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
( )
A.Fe3+>Cl2>I2
B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+
D.Cl2>Fe3+>I2
18.将下列离子方程式改写成化学方程式,正确的是
( )
A.Cu2++2OH-===Cu(OH)2↓ CuCO3+2NaOH===Cu(OH)2↓+Na2CO3
B.CO+2H+===H2O+CO2↑ BaCO3+2HCl===BaCl2+H2O+CO2↑
C.Ca2++CO===CaCO3↓ Ca(OH)2+BaCO3===CaCO3↓+Ba(OH)2
D.H++OH-===H2O 2KOH+H2SO4===K2SO4+2H2O
19.已知有如下反应:①2Fe3++2I-===2Fe2++I2
②2Fe2++Br2===2Fe3++2Br-
③2Fe(CN)+I2===2Fe(CN)+2I-,试判断氧化性强弱顺序正确的是( )
A.Fe3+>Br2>I2>Fe(CN)
B.Br2>I2>Fe3+>Fe(CN)
C.Br2>Fe3+>I2>Fe(CN)
D.Fe(CN)>Fe3+>Br2>I2
20.实验室制取少量N2常利用的反应是NaNO2+NH4ClNaCl+N2↑+2H2O,关于该反应的说法正确的是
( )
A.NaNO2是氧化剂
B.生成1molN2时转移的电子为6mol
C.NH4Cl中的N元素被还原
D.N2既是氧化剂又是还原剂
二、非选择题(本题包括6个小题,共40分)
21.(6分)某溶液中可能含有大量下列阴离子:OH-、SO、CO、Cl-。
(1)当溶液中存在大量H+时,则溶液中不可能有________________。
(2)当溶液中有大量的Ba2+存在时,则溶液中不可能有________________。
22.(6分)已知离子反应:RO+6I-+6H+===R-+3I2+3H2O,试根据离子方程式必须“质量守恒,电荷守恒”等判断:n=______________,R元素在RO中的化合价是______________。21世纪教育网版权所有
23.(8分)将1mol·L-1的FeCl3溶液逐滴滴入沸水中,液体变为____________色,得到的是____________;反应的化学方程式为________________。用此分散系进行实验:
(1)将其装入U形管内,用石墨棒做电极,接通直流电源,通电一段时间后发现阴极附近颜色________________,这表明__________________________,这种现象称为
________________。
(2)向其中加入饱和(NH4)2SO4溶液,发生的现象是________________,原因是
__________________________________________________________。
(3)向其中逐滴加入过量稀硫酸,现象是________________;原因是
____________________________________________。
(4)提纯此分散系的方法叫________________,要保证全部的杂质分子和离子完全除去,实验中必须________________。21cnjy.com
24.(8分)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10AL+6NaNO3+4NaOH==10NaALO2+3N2
↑
+2H2O。请回答下列问题:
⑴上述反应中,
元素的化合价升高,则该元素的原子
(填“得到”或“失去”)电子,其中N2是
产物(填“氧化”或“还原”)。21·cn·jy·com
⑵上述反应中,若有10个铝原子参与反应,则转移的电子总数为
,用“双线桥法”表示反应中电子转移的方向和数目:www.21-cn-jy.com
10
AL
+
6
NaNO3
+
4
NaOH
==
10
NaALO2
+
3
N2
↑
+
2
H2O
25.(6分)有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各盛少量多次进行两两混合反应,反应现象为:A与B、A与E产生沉淀,B与D、B与E产生沉淀,C与E、D与E产生气体,而C与D无反应现象。2·1·c·n·j·y
由此,可判定各试剂瓶中所盛试剂为
A____________、B____________、C、____________、D____________、E____________。
另外,请写出下面要求的离子方程式:
(1)A与E:
________________________________________________________________________。
(2)B与E:
________________________________________________________________________。
(3)C与E:
________________________________________________________________________。
26.(6分)试样X由氧化亚铁和氧化铜组成。取质量相等的两份试样进行下图所示实验:
(1)写出步骤③发生的全部反应的离子方程式。
(2)若Y和Z充分反应,生成的不溶物的质量是m,则每份试样X中氧化铜为多少(用m表示)。
第二章
章末检测
1-5.BDAAC;
6-10.DDCBD
11-15.CADBB
16-20.BDDCA
21.
【答案】 (1)CO、OH- (2)SO、CO
22.
【答案】 1 +5价
23.
【答案】 红褐 Fe(OH)3胶体 FeCl3+3H2OFe(OH)3(胶体)+3HCl (1)逐渐变深Fe(OH)3胶粒带正电荷 胶体的电泳 (2)形成红褐色沉淀 硫酸铵电离出的SO中和Fe(OH)3胶粒所带正电荷,使其以沉淀形式析出 (3)先出现红褐色沉淀,后沉淀消失 H2SO4电离出的SO使Fe(OH)3胶体发生聚沉,H+使Fe(OH)3沉淀溶解 (4)渗析 多次更换水或放入流动水中,直至检验不到Cl-【来源:21·世纪·教育·网】
24(1)AL;失去;N;还原(各1分)
(2)30(2分);
25.【答案】 BaCl2 AgNO3 HNO3 盐酸 K2CO3 (1)Ba2++CO===BaCO3↓
(2)2Ag++CO===Ag2CO3↓
(3)CO+2H+===CO2↑+H2O
【点拨】 根据题意,E与A、B分别产生沉淀,与C、D分别产生气体,可推断E为K2CO3溶液,A、B可能为AgNO3和BaCl2中的一种,可判断C、D必为稀硝酸和盐酸中的一种,而B与D能产生沉淀,可确定B为AgNO3溶液,D为盐酸,因此A为BaCl2溶液,C为稀硝酸。
找出现象最多最特殊的物质,如生成沉淀或生成气体的,或两者兼有的,确定了这种物质以后,其他的物质便可顺利找出。21·世纪
教育网
26.【解析】 (1)粉未Z的成分是Fe、Cu的混合物。Y溶液为FeCl2、CuCl2、HCl的混合溶液,所以③反应中必有Fe+2HCl===FeCl2+H2↑,又根据最后强酸性溶液不含Fe+CuCl2===FeCl2+Cu。www-2-1-cnjy-com
(2)设全部Cu的质量为m
Cu~CuO
64 80
m
x
x=m=m
则每份试样中CuO的质量为m×=m。
【答案】 (1)Fe+2H+===Fe2++H2↑
Fe+Cu2+===Cu+Fe2+ (2)m
分散系
浊液
分散质粒子直径>100
nm
不能透过滤纸
不能发生丁达尔效应
呈不均一、不透明、不稳定的外观特征
溶液
分散质粒子直径<1
nm
能透过滤纸和半透膜
不能发生丁达尔效应
呈均一、透明、稳定的外观特征
胶体
分散质粒子直径在1
nm-100
nm之间
能透过滤纸但不能透过半透膜
能发生丁达尔现象
呈均一、透明、相对稳定的外观特征
21世纪教育网
--
中国最大型、最专业的中小学教育资源门户网站。
版权所有@21世纪教育网
第二章 章末复习
一、知识整合
1.以组成为标准对物质进行分类
21世纪教育网21世纪教育网物质
21世纪教育网21世纪教育网纯净物
单质
金属:Na
、Mg
、Al
21世纪教育网
非金属:S、N2
、O2
化合物
氧化物
酸性氧化物:SO2、SO3、P2O5、
碱性氧化物:Na2O、CaO、Fe2O3
两性氧化物:Al2O3
不成盐氧化物:CO、NO
酸
按酸根分
含氧酸:HNO3、H2SO4
无氧酸:HCl
按电离出的H+
数分
一元酸:HCl、HNO3
二元酸:H2SO4、H2SO3
多元酸:H3PO4
碱
按强弱分
强碱:NaOH、Ba(OH)2
弱碱:NH3·H2O
、Fe(OH)3
按电离出OH―
数分
一元碱:NaOH
二元碱:Ba(OH)2
多元碱:Fe(OH)3
盐
正盐:Na2CO3
酸式盐:NaHCO3
碱式盐:Cu2(OH)2CO3
混合物
2.化学反应的分类
化学反应
根据反应物和生成物的类别以及反应前后物质种类的多少
化合反应:A+B==AB
分解反应:AB==A+B
置换反应:A+
BC==AC+B
复分解反应:AB+CD==AD+CB
根据反应中是否有电子转移
氧化还原反应
实质:有电子转移(得失或偏移)
特征:反应前后元素的化合价有变化
基本概念相互关系
氧化剂-有氧化性-得电子-化合价降低-发生还原反应-还原产物
还原剂-有还原性-失电子-化合价升高-发生氧化反应-氧化产物
非氧化还原反应
根据反应中是否有离子参加
离子反应
定义:有离子参加的一类反应,主要包括复分解反应、有离子参加的氧化还原反应。
离子方程式
定义:用实际参加反应的离子符号来表示离子反应的式子
书写方法
写:写出反应的化学方程式
拆:把易溶于水、易电离的物质拆写成离子形式
删:将不参加反应的离子从方程式两端删去
查:查方程式两端原子个数和电荷数是否相等
意义:不仅表示一定物质间的某个反应,而且表示所有同一类型的离子反应
分子反应
3.分散系
二、专题复习
1、溶液中离子共存问题。
2、离子方程式的正误判断。
3、氧化性和还原性的判断。
4、氧化还原反应的基本规律及应用。
5、氧化还原反应的配平。
第二章 章末检测题
(90分钟,100分)
一、选择题(每小题3分,共60分,每小题有1个选项符合题意)
1.下列说法中正确的是
( )
A.纯净物一定由分子构成
B.由同种分子构成的物质一定是纯净物
C.混合物肯定是由两种以上的元素组成的
D.含有氧元素的化合物就是氧化物
2.用下图表示的一些物质或概念之间的从属或包含关系中不正确的是
( )21教育网
X
Y
Z
例
氧化物
化合物
纯净物
A
含氧酸
酸
化合物
B
溶液
分散系
混合物
C
强电解质
电解质
化合物
D
置换反应
氧化还原反应
离子反应
3.下列物质的分类合理的是
( )
A.氧化物:CO2、NO、SO2、H2O
B.碱:NaOH、KOH、Ba(OH)2、Na2CO3
C.铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D.碱性氧化物:Na2O、CaO、Mn2O7、Al2O3
4.下列说法正确的是
( )
A.可用丁达尔效应区分溶液与胶体
B.生石灰与水混合的过程只发生物理变化
C.O3是由3个氧原子构成的化合物
D.CuSO4·5H2O是一种混合物
5.氯化铁溶液与氢氧化铁胶体具有的共同性质是
( )
A.分散质粒子大小都在1~100nm之间
B.有丁达尔效应
C.加热蒸干、灼烧后都有氧化铁生成
D.呈红褐色
6.离子方程式H++OH-===H2O所表示的反应是
( )
A.所有酸和碱之间的中和反应
B.所有强酸和强碱之间的中和反应
C.所有可溶性酸和可溶性碱之间的中和反应
D.强酸溶液与强碱溶液生成可溶性盐和水的反应
7.下列化学方程式中,能用离子方程式SO+Ba2+===BaSO4↓来表示的是( )
A.BaCO3+H2SO4===BaSO4↓+H2O+CO2↑
B.BaCl2+Na2CO3===BaCO3↓+2NaCl
C.Ba(OH)2+CuSO4===Cu(OH)2↓+BaSO4↓
D.BaCl2+Na2SO4===BaSO4↓+2NaCl
8.下列各组离子因为生成难溶物而不能大量共存的是
( )
A.Cl-、Na+、NO、OH-
B.HCO、Cl-、Na+、H+
C.Ba2+、Cl-、CO、K+
D.NH、K+、OH-、Cl-
9.下列离子方程式中书写正确的是
( )
A.铁和稀硫酸反应: 2Fe+6H+===2Fe3++3H2↑
B.碳酸钙和稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
C.铜和硝酸银溶液反应:Cu+Ag+===Cu2++Ag
D.硫酸镁溶液与氢氧化钡溶液反应: Mg2++2OH-===Mg(OH)2↓
10.离子检验的常用方法有三种:
检验方法
沉淀法
显色法
气体法
含义
反应中有沉淀产生或溶解
反应中有颜色变化
反应中有气体产生
下列离子检验的方法不合理的是
( )
A.NH—气体法
B.I-—沉淀法
C.Fe3+—显色法
D.Ca2+—气体法
11.下列关于氧化还原反应说法正确的是
( )
A.肯定一种元素被氧化,另一种元素被还原
B.某元素从化合态变成游离态,该元素一定被还原
C.在反应中不一定所有元素的化合价都发生变化
D.在氧化还原反应中非金属单质一定是氧化剂
12.向含有下列离子的溶液中分别加入烧碱固体(溶液体积变化可忽略),能引起下列离子浓度减小的是
( )
A.HCO
B.Cl-
C.OH-
D.CO
13.下列叙述正确的是
( )
A.元素的单质一定由氧化或还原该元素的化合物制得
B.在化学反应中,得电子越多的氧化剂,其氧化性就越强
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.含有最高价元素的化合物不一定具有很强的氧化性
14.下列反应的现象描述与离子方程式都正确的是
( )
A.金属镁与稀盐酸反应:有气泡逸出 Mg+2H++2Cl-===MgCl2+H2↑
B.氯化钡溶液与稀硫酸反应:有白色沉淀生成 Ba2++SO===BaSO4↓
C.碳酸钠溶液与盐酸反应:有气泡逸出 Na2CO3+2H+===2Na++CO2↑+H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生
2HCO+Ba2++2OH-===BaCO3↓+2H2O+CO
15.下列反应完成后有沉淀生成的是
( )
A.BaCl2溶液与Na2CO3溶液加足量CH3COOH溶液
B.Ba(OH)2溶液与KNO3溶液加足量稀硫酸
C.AgNO3溶液与Na2CO3溶液加足量稀硝酸
D.Ca(OH)2溶液与FeCl3溶液加足量稀硝酸
16.下列各组微粒中,在一定条件下均可以作氧化剂的是
( )
A.Fe、H2O、CO2
B.Fe3+、MnO、NO
C.Cl2、HClO、Mg
D.ClO-、Cl-、Ag+
17.根据反应①2FeCl3+2KI===2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是
( )
A.Fe3+>Cl2>I2
B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+
D.Cl2>Fe3+>I2
18.将下列离子方程式改写成化学方程式,正确的是
( )
A.Cu2++2OH-===Cu(OH)2↓ CuCO3+2NaOH===Cu(OH)2↓+Na2CO3
B.CO+2H+===H2O+CO2↑ BaCO3+2HCl===BaCl2+H2O+CO2↑
C.Ca2++CO===CaCO3↓ Ca(OH)2+BaCO3===CaCO3↓+Ba(OH)2
D.H++OH-===H2O 2KOH+H2SO4===K2SO4+2H2O
19.已知有如下反应:①2Fe3++2I-===2Fe2++I2
②2Fe2++Br2===2Fe3++2Br-
③2Fe(CN)+I2===2Fe(CN)+2I-,试判断氧化性强弱顺序正确的是( )
A.Fe3+>Br2>I2>Fe(CN)
B.Br2>I2>Fe3+>Fe(CN)
C.Br2>Fe3+>I2>Fe(CN)
D.Fe(CN)>Fe3+>Br2>I2
20.实验室制取少量N2常利用的反应是NaNO2+NH4ClNaCl+N2↑+2H2O,关于该反应的说法正确的是
( )
A.NaNO2是氧化剂
B.生成1molN2时转移的电子为6mol
C.NH4Cl中的N元素被还原
D.N2既是氧化剂又是还原剂
二、非选择题(本题包括6个小题,共40分)
21.(6分)某溶液中可能含有大量下列阴离子:OH-、SO、CO、Cl-。
(1)当溶液中存在大量H+时,则溶液中不可能有________________。
(2)当溶液中有大量的Ba2+存在时,则溶液中不可能有________________。
22.(6分)已知离子反应:RO+6I-+6H+===R-+3I2+3H2O,试根据离子方程式必须“质量守恒,电荷守恒”等判断:n=______________,R元素在RO中的化合价是______________。21世纪教育网版权所有
23.(8分)将1mol·L-1的FeCl3溶液逐滴滴入沸水中,液体变为____________色,得到的是____________;反应的化学方程式为________________。用此分散系进行实验:
(1)将其装入U形管内,用石墨棒做电极,接通直流电源,通电一段时间后发现阴极附近颜色________________,这表明__________________________,这种现象称为
________________。
(2)向其中加入饱和(NH4)2SO4溶液,发生的现象是________________,原因是
__________________________________________________________。
(3)向其中逐滴加入过量稀硫酸,现象是________________;原因是
____________________________________________。
(4)提纯此分散系的方法叫________________,要保证全部的杂质分子和离子完全除去,实验中必须________________。21cnjy.com
24.(8分)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10AL+6NaNO3+4NaOH==10NaALO2+3N2
↑
+2H2O。请回答下列问题:
⑴上述反应中,
元素的化合价升高,则该元素的原子
(填“得到”或“失去”)电子,其中N2是
产物(填“氧化”或“还原”)。21·cn·jy·com
⑵上述反应中,若有10个铝原子参与反应,则转移的电子总数为
,用“双线桥法”表示反应中电子转移的方向和数目:www.21-cn-jy.com
10
AL
+
6
NaNO3
+
4
NaOH
==
10
NaALO2
+
3
N2
↑
+
2
H2O
25.(6分)有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各盛少量多次进行两两混合反应,反应现象为:A与B、A与E产生沉淀,B与D、B与E产生沉淀,C与E、D与E产生气体,而C与D无反应现象。2·1·c·n·j·y
由此,可判定各试剂瓶中所盛试剂为
A____________、B____________、C、____________、D____________、E____________。
另外,请写出下面要求的离子方程式:
(1)A与E:
________________________________________________________________________。
(2)B与E:
________________________________________________________________________。
(3)C与E:
________________________________________________________________________。
26.(6分)试样X由氧化亚铁和氧化铜组成。取质量相等的两份试样进行下图所示实验:
(1)写出步骤③发生的全部反应的离子方程式。
(2)若Y和Z充分反应,生成的不溶物的质量是m,则每份试样X中氧化铜为多少(用m表示)。
第二章
章末检测
1-5.BDAAC;
6-10.DDCBD
11-15.CADBB
16-20.BDDCA
21.
【答案】 (1)CO、OH- (2)SO、CO
22.
【答案】 1 +5价
23.
【答案】 红褐 Fe(OH)3胶体 FeCl3+3H2OFe(OH)3(胶体)+3HCl (1)逐渐变深Fe(OH)3胶粒带正电荷 胶体的电泳 (2)形成红褐色沉淀 硫酸铵电离出的SO中和Fe(OH)3胶粒所带正电荷,使其以沉淀形式析出 (3)先出现红褐色沉淀,后沉淀消失 H2SO4电离出的SO使Fe(OH)3胶体发生聚沉,H+使Fe(OH)3沉淀溶解 (4)渗析 多次更换水或放入流动水中,直至检验不到Cl-【来源:21·世纪·教育·网】
24(1)AL;失去;N;还原(各1分)
(2)30(2分);
25.【答案】 BaCl2 AgNO3 HNO3 盐酸 K2CO3 (1)Ba2++CO===BaCO3↓
(2)2Ag++CO===Ag2CO3↓
(3)CO+2H+===CO2↑+H2O
【点拨】 根据题意,E与A、B分别产生沉淀,与C、D分别产生气体,可推断E为K2CO3溶液,A、B可能为AgNO3和BaCl2中的一种,可判断C、D必为稀硝酸和盐酸中的一种,而B与D能产生沉淀,可确定B为AgNO3溶液,D为盐酸,因此A为BaCl2溶液,C为稀硝酸。
找出现象最多最特殊的物质,如生成沉淀或生成气体的,或两者兼有的,确定了这种物质以后,其他的物质便可顺利找出。21·世纪
教育网
26.【解析】 (1)粉未Z的成分是Fe、Cu的混合物。Y溶液为FeCl2、CuCl2、HCl的混合溶液,所以③反应中必有Fe+2HCl===FeCl2+H2↑,又根据最后强酸性溶液不含Fe+CuCl2===FeCl2+Cu。www-2-1-cnjy-com
(2)设全部Cu的质量为m
Cu~CuO
64 80
m
x
x=m=m
则每份试样中CuO的质量为m×=m。
【答案】 (1)Fe+2H+===Fe2++H2↑
Fe+Cu2+===Cu+Fe2+ (2)m
分散系
浊液
分散质粒子直径>100
nm
不能透过滤纸
不能发生丁达尔效应
呈不均一、不透明、不稳定的外观特征
溶液
分散质粒子直径<1
nm
能透过滤纸和半透膜
不能发生丁达尔效应
呈均一、透明、稳定的外观特征
胶体
分散质粒子直径在1
nm-100
nm之间
能透过滤纸但不能透过半透膜
能发生丁达尔现象
呈均一、透明、相对稳定的外观特征
21世纪教育网
--
中国最大型、最专业的中小学教育资源门户网站。
版权所有@21世纪教育网
