重庆市人教版高中化学必修一学案-4.2富集在海水中的元素——氯
文档属性
| 名称 | 重庆市人教版高中化学必修一学案-4.2富集在海水中的元素——氯 |

|
|
| 格式 | zip | ||
| 文件大小 | 424.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-10 00:00:00 | ||
图片预览


文档简介
第二节
富集在海水中的元素——氯
第一课时
【考纲要求】
能够正确说出氯元素的存在形式,熟练运用氯气的物理性质、化学性质,实验室制法。
能够正确说出次氯酸及次氯酸盐的主要性质及对应的反应方程式。
掌握氯离子的检验方法。
【自主学习】
一.氯元素的存在
氯元素在自然界中以
态存在,是重要的____元素,主要以
形式存在于海水和陆地的盐矿中。氯的原子结构示意图________________表现典型的____________。二.氯气的性质
1.氯气的物理性质
(1)氯气在通常情况下呈
色,是一种有
气味的
气体。密度比空气
,
溶于水。氯气在低温和加压的条件下可转变为
。易
。液氯保存在
中。
思考1:实验室中如何闻氯气的气味?
思考2:实验室中可以用什么方法来收集氯气?
2.氯气的化学性质
(1)与金属反应
氯气是活泼的非金属单质,具有很强的
性.能与大多数金属化合,生成金属氯化物。
①Na和Cl2实验现象:
化学方程式:
②Fe和Cl2实验现象:
化学方程式:
产物溶于水所得溶液颜色:
③Cu和Cl2实验现象:
化学方程式:
产物溶于水所得溶液颜色:
思考:为什么可以用钢瓶储运液氯?
注意:氯气有强
性,氯气与变价金属反应时生成
价金属氯化物。
(
2
)
与非金属反应
H2和Cl2点燃实验现象
化学方程式
H2和Cl2的混合气体光照时实验现象:
H2和Cl2的化合产物HCl气体易溶于水(1体积水溶解同条件下500体积的HCl气体)。溶于水得到的溶液即为
,此为工业制盐酸的原理。
思考:工业制盐酸选择哪种反应条件呢?从环保的角度考虑,还应注意什么?
已知磷可以在氯气中燃烧,氯气不足时生成PCl 3,氯气过量时生成PCl5。试写出方程式。
(3)氯气和水的反应
氯气的水溶液叫
,饱和氯水中因溶有
而呈
色有
气味。在常温下,溶于水中的部分Cl2与水发生反应,化学方程式:
离子方程式:
思考:为什么氯水能使有色布条褪色,而干燥的氯气不能使有色布条褪色?真正起漂白作用的是什么物质?
次氯酸的性质
(1)
性:杀菌、消毒、漂白
(2)
酸性;比碳酸酸性
;Ca(ClO)2+CO2+H2O=
(3)不稳定性:只存在于
,在光照下易分解放出氧气,写出次氯酸分解的方程式
思考1:氯气用于自来水的杀菌,消毒的原因。
思考2:用自来水养金鱼时,为何要将水在阳光下晒一段时间?
思考3:新制氯水的成分有哪些?这些成分决定了氯水的哪些性质?
氯水的成份:
种分子,分别为
种离子,分别为
氯水的性质:
液氯和氯水有什么区别?
氯水可以保存在钢瓶中吗?
思考4:若氯水在空气中久置后,成份有何改变?溶液的酸碱性如何变?
思考5:实验室中新制氯水应如何保存?
思考6:氯气用于自来水的杀菌消毒,使用氯气对自来水消毒时可能产一些负面影响。如何改进?
练习:用新制氯水进行下列实验,将可能发生的现象以及解释或离子方程式填入下表
实验现象
解释或离子方程式
滴入AgNO3溶液
通入紫色石蕊溶液中
滴入红墨水
Na2CO3固体
【考点突破】
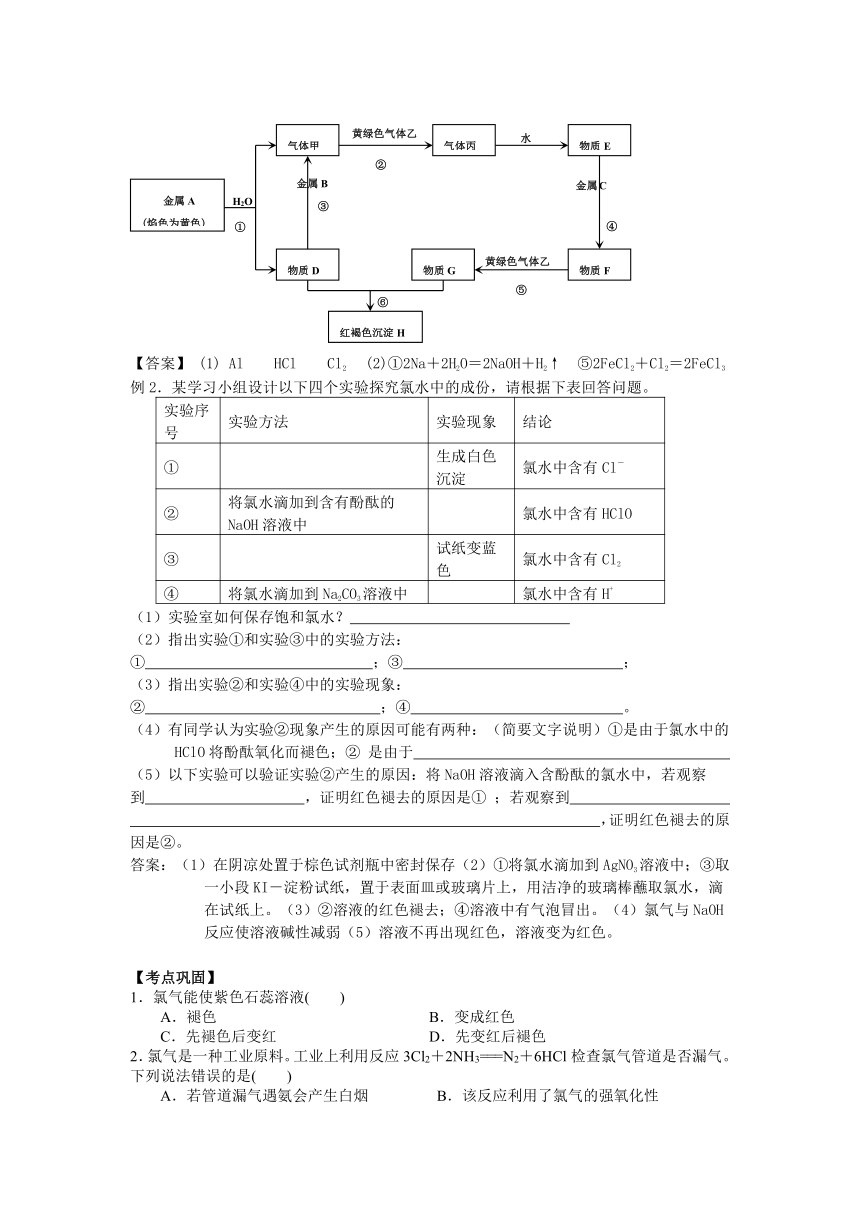
现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:B
、丙
、乙
。
(2)写出下列反应的化学方程式:
反应①
反应⑤
反应⑥
【答案】
(1)
Al
HCl
Cl2
(2)①2Na+2H2O=2NaOH+H2↑
⑤2FeCl2+Cl2=2FeCl3
例2.某学习小组设计以下四个实验探究氯水中的成份,请根据下表回答问题。
实验序号
实验方法
实验现象
结论
①
生成白色沉淀
氯水中含有Cl-
②
将氯水滴加到含有酚酞的NaOH溶液中
氯水中含有HClO
③
试纸变蓝色
氯水中含有Cl2
④
将氯水滴加到Na2CO3溶液中
氯水中含有H+
(1)实验室如何保存饱和氯水?
(2)指出实验①和实验③中的实验方法:
①
;③
;
(3)指出实验②和实验④中的实验现象:
②
;④
。
(4)有同学认为实验②现象产生的原因可能有两种:(简要文字说明)①是由于氯水中的HClO将酚酞氧化而褪色;②
是由于
(5)以下实验可以验证实验②产生的原因:将NaOH溶液滴入含酚酞的氯水中,若观察到
,证明红色褪去的原因是①
;若观察到
,证明红色褪去的原因是②。
答案:(1)在阴凉处置于棕色试剂瓶中密封保存(2)①将氯水滴加到AgNO3溶液中;③取一小段KI-淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上。(3)②溶液的红色褪去;④溶液中有气泡冒出。(4)氯气与NaOH反应使溶液碱性减弱(5)溶液不再出现红色,溶液变为红色。
【考点巩固】
1.氯气能使紫色石蕊溶液( )
A.褪色
B.变成红色
C.先褪色后变红
D.先变红后褪色
2.氯气是一种工业原料。工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A.若管道漏气遇氨会产生白烟
B.该反应利用了氯气的强氧化性
C.该反应属于复分解反应
D.生成1
mol
N2有6
mol电子转移
3.G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):
①G―→Q+NaCl ②Q+H2O―→X+H2 ③Y+NaOH―→G+Q+H2O ④Z+NaOH―→Q+X+H2O
则G、Q、X、Y、Z这五种化合物中氯元素的化合价由低到高的顺序为( )
A.QGZYX
B.GYQZX
C.GYZQX
D.ZXGYQ
4.如下图所示,A处通入湿润的Cl2,关闭B阀时,C处干燥的红布条看不到明显现象;当打开B阀后,C处红布条逐渐褪色,则D瓶中装的是( )
A.浓H2SO4
B.饱和NaCl溶液
C.稀盐酸
D.H2O
5.已知①2FeCl3+2KI=
2FeCl2+2KCl+I2
②2FeCl2+Cl2=
2FeCl3据此判断下列物质氧化能力由强到弱的顺序是(
)
A.Fe3+>Cl2>I2
B.Cl2>Fe3+>I2
C.I2>Cl2>Fe3+
D.Cl2>I2>Fe3+
6.A、B、C、D、E五种
物质转化关系如图所示:
(1)A、B、C、D、E各为
什么物质(填化学式):
A
B
C
D
E
(2)写出下列过程的方程式(是离子反应的只写离子方程式):
C→D:____________________________
D→E:__________________________
E→A:_____________________________
C→A:__________________________
第二课时
【考纲要求】
1.能够正确说出次氯酸及次氯酸盐的主要性质及对应的反应方程式。
2.掌握氯离子的检验方法。
【自主学习】
(4)
氯气和碱溶液的反应
(1)制漂白液
化学方程式:
离子方程:
思考1:日常生活用品中,你知道什么的主要成份与漂白液同?
思考2:漂白液优于氯的地方是什么?
(2)制漂白粉
原料:
反应原理:
漂白粉的主要成份是
有效成份是
思考1:漂白粉是如何发生效用的?
思考2:漂白粉或漂粉精中Ca(ClO)2能与空气中的CO2和水蒸气发生反应,你认为购买和存放
漂白粉或漂粉精时应注意哪些问题?
思考3:若漂白粉在空气中久置,发生的反应有:
这个过程我们可以看作漂白粉的
过程。
思考4:氯气有毒,实验室制取氯气应该如何尾气吸收?
三.氯离子的检验
实验现象
解释或离子方程式
加入AgNO3溶液后
加入稀硝酸后
稀盐酸
NaCl溶液
Na2CO3溶液
自来水
思考:检验Cl-时,为什么滴加AgNO3溶液后还要再加稀硝酸?
四.成盐元素——卤素
卤素包括的元素有
卤素的单质都有
性,该性质按由强到弱的排列为:
海水中的成盐元素还有
,分别存在于
。
科学视野:一、原子结构
在元素周期表中,与氯元素处于同一纵行——第ⅦA族。
氟(F)、溴(r)、碘(I)、砹(At)。这些元素的原子最外层都有
个电子,由于
所以统称为卤素(成盐元素)。
二、物理性质:
(1)溴在常温下为深红棕色液体,是唯一的液态非金属单质,液溴易挥发,极易产生有毒的溴蒸气,实验室通常将溴密闭保存于阴冷处,不能用胶塞,且试剂瓶内加水,以减弱溴的挥发。
(2)碘是紫黑色固体,具有金属光泽,易升华(常用与分离和提纯),遇淀粉变蓝,通常用于碘
与淀粉的互相鉴别
;碘在水中的溶解度很小,但易溶于酒精。
三、化学性质
(1)相似性:
氟、氯、溴、碘的原子其最外层都具有
个电子,决定了这些原子在化学反应中易
于
,这就决定了单质分子在化学反应中主要表现
性,均能与金属、非金属、水、碱溶液的反应。
(2)递变性:
随着卤素核电荷数的增加,电子层数的增多,下列性质的递变规律是:按氟、氯、溴、碘的
顺序,氧化性渐弱。
a、.与非金属反应:
b、与金属反应:
c、与水反应:d、与碱反应,写出通式(除F2外均类似与氯气和碱的反应)
(3)卤离子(Br-、I-)的检验:
所用试剂:AgNO3溶液和稀硝酸
AgBr:浅黄色不溶于水不溶于酸的沉淀。
AgI:黄色不溶于水不溶于酸的沉淀。
【考点突破】
例1.化工厂常用浓氨水检验管道是否漏氯气,其反应为:3Cl2+8NH36NH4Cl+N2当有160.5g
NH4Cl产生时,被氧化的氨是(
)
A.214g
B.53.5
g
C.17
g
D.68
g
答案:C
例2:实验室用下列有关装置先制取干燥、纯净的氯气,后进行有关性质实验。试回答下列问题。
(1)上述装置中各仪器从左至右的连接顺序为________接__________接__________接________接________接________接________。
(2)E装置的作用是________________,G装置的作用是____________,D中的现象为__________,B中的现象为______________________________________________。
(3)写出下列反应的离子方程式:B中______________,G中________________。
解析:浓盐酸与二氧化锰反应生成的氯气中含有氯化氢气体和水蒸气,饱和食盐水除去氯化氯气体,浓硫酸除去水蒸气,然后通过干燥的红色布条,干燥的红色布条不褪色,湿润的红色布条褪色,说明次氯酸起到漂白作用;再通过碘化钾溶液置换出单质碘,最后多余的氯气用氢氧化钠溶液处理吸收,防止污染空气。
答案:(1)A E F C D B G(2)吸收Cl2中的HCl气体 吸收尾气Cl2,防止污染环境 红色褪去 溶液由无色变为棕黄色(3)2I-+Cl2===I2+2Cl- Cl2+2OH-===Cl-+ClO-+H2O
反馈训练:
1.向NaBr、NaI、Na2SO3混合液中,通入过量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成是( )
A.NaCl、Na2SO4
B.NaCl、NaBr、Na2SO4
C.NaCl、Na2SO4、I2
D.NaCl、NaI、Na2SO4
2.用氯气消毒过的自来水配制下列溶液时,会使所配溶液的溶质发生变化的是( )
①NaOH
②AgNO3
③Na2CO3
④NaBr
⑤FeCl2
A.只有①②
B.只有①④⑤
C.只有②④⑤
D.①②③④⑤
【考点巩固】
1.下列物质露置于空气中易变质的是:①
氯水
②
水玻璃
③
烧碱
④
漂白粉
⑤
绿矾(FeSO4·
7H2O)
⑥
Na2CO3·10H2O
(
)
A.除⑤外
B.除②③外
C.除②③⑥外
D.全部
2.自来水是用氯气杀菌消毒的,不法商贩用自来水冒充纯净水出售,为辨真伪,可用下列哪一种试剂鉴别(
)
A.酚酞试液
B.氯化铁溶液
C.硝酸银溶液
D.氢氧化钠溶液
3.下列离子方程式中,正确的是(
)
A.向氯化亚铁溶液中通入氯气:
Fe2++Cl2
Fe3++2Cl
B.氯气通入冷的氢氧化钠溶液中:
Cl2+2OH
Cl+ClO+H2O
C.氯气与H2O反应:Cl2+H2O=Cl-+ClO-+2H+
D.金属铝溶于盐酸中:
Al+2H
+=Al3++H2↑
4.溴(Br)与氯同属“卤族”元素,其单质在性质上具有很大的相似性,但Cl2比Br2的活泼性强,下面是根据的氯性质对溴的性质的预测,其中不正确的是(
)
A.溴单质常温下为液态,但极容易挥发为溴蒸气
B.溴单质只具有氧化性
C.溴原子外层有7个电子,在化学反应中容易得1个电子,表现氧化性
D.溴离子可以用酸性AgNO3溶液来检验
5.下面(1)至(3)记录了对太空某星球外层空间取回的气体样品进行分析的过程:
①将样品溶于水,发现其主要成分气体A极易溶于水,水溶液呈酸性。
②将A的浓溶液与MnO2在一定条件下反应产生一种黄绿色气体单质B,将B通入石灰乳可生成两种钙盐的混合物D。
③A的稀溶液与锌粒反应生成气体C,C与B的气体充分混合经光照发生爆炸又生成气体A,实验测得反应前后气体体积不变。
请回答下列有关问题:
(1)A的化学式是
。
(2)A的浓溶液与MnO2反应生成B的离子方程式:
(3)气体B与Ca(OH)2
反应的化学方程式是
混合物D的俗名是_
______________
。
(4)混合物D中的有效成分在空气中放置失效的化学方程式是_______________________
6.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关反应的化学方程式为:
_______________________________(2)装置B中饱和食盐水的作用是_______________________________同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_________________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
编号
a
b
c
d
Ⅰ
干燥的有色布条
干燥的有色布条
湿润的有色布条
湿润的有色布条
Ⅱ
碱石灰
硅胶
浓硫酸
无水氯化钙
Ⅲ
湿润的有色布条
湿润的有色布条
干燥的有色布条
干燥的有色布条
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________________。该现象________(填“能”或“不能”)说明溴的非金属性强于碘,原因是________________________________________________________________________。
(5)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:
________________________________________请判断改用NaHSO3溶液是否可行?________(填“是”或“否”)。
第二节
富集在海水中的元素——氯
第一课时
【考点巩固】1.D
2.C
3.B
4.A5
.B
6..(1)Cu
CuCl2
Cu(OH)2
CuO
(2)
Cu2++2OH-=
Cu(OH)2↓,
Cu(OH)2CuO+H2O,
CuO+H2Cu+H2O,
Cu2++Fe=Fe2++Cu
第二课时
反馈训练:1
.A
2.D
【考点巩固】1.D
2.C
3.B
4.B
5.(1)HCl
(2)MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉
(4)Ca(ClO)2+H2O+
CO2=CaCO3↓+2
HClO
2HClO
光照
2HCl
+
O2↑
6.【解析】 本题考查氯气的制备及性质检验实验,意在考查考生对化学实验的设计、分析及评价能力。(1)漂粉精固体的主要成分为Ca(ClO)2和CaCl2,利用Ca(ClO)2氧化浓盐酸制取氯气,反应的化学方程式为Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O。(3)氯气与水反应生成的HClO具有漂白性,而干燥的氯气没有漂白性,通过装置B后氯气中含有水蒸气,因此先通过湿润的有色布条,再通过干燥装置(选择固体干燥剂),后通过干燥的有色布条。(5)HCO具有还原性,可以与Cl2发生氧化还原反应,可能产生SO2,污染大气,因此该方案不可行。
【答案】 (1)Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
(2)除去Cl2中的HCl 装置B中长颈漏斗中液面上升,形成一段水柱
(3)d
(4)E中溶液分为两层,上层(苯层)为紫红色 不能 过量的Cl2也可将I-氧化为I2
(5)HSO+Cl2+H2O===SO+2Cl-+3H+(或4HSO+Cl2===SO+2Cl-+3SO2+2H2O) 否
金属A
(焰色为黄色)
气体甲
气体丙
物质E
物质D
物质G
物质F
红褐色沉淀H
④
黄绿色气体乙
黄绿色气体乙
金属B
①
金属C
②
⑤
③
⑥
水
H2O
富集在海水中的元素——氯
第一课时
【考纲要求】
能够正确说出氯元素的存在形式,熟练运用氯气的物理性质、化学性质,实验室制法。
能够正确说出次氯酸及次氯酸盐的主要性质及对应的反应方程式。
掌握氯离子的检验方法。
【自主学习】
一.氯元素的存在
氯元素在自然界中以
态存在,是重要的____元素,主要以
形式存在于海水和陆地的盐矿中。氯的原子结构示意图________________表现典型的____________。二.氯气的性质
1.氯气的物理性质
(1)氯气在通常情况下呈
色,是一种有
气味的
气体。密度比空气
,
溶于水。氯气在低温和加压的条件下可转变为
。易
。液氯保存在
中。
思考1:实验室中如何闻氯气的气味?
思考2:实验室中可以用什么方法来收集氯气?
2.氯气的化学性质
(1)与金属反应
氯气是活泼的非金属单质,具有很强的
性.能与大多数金属化合,生成金属氯化物。
①Na和Cl2实验现象:
化学方程式:
②Fe和Cl2实验现象:
化学方程式:
产物溶于水所得溶液颜色:
③Cu和Cl2实验现象:
化学方程式:
产物溶于水所得溶液颜色:
思考:为什么可以用钢瓶储运液氯?
注意:氯气有强
性,氯气与变价金属反应时生成
价金属氯化物。
(
2
)
与非金属反应
H2和Cl2点燃实验现象
化学方程式
H2和Cl2的混合气体光照时实验现象:
H2和Cl2的化合产物HCl气体易溶于水(1体积水溶解同条件下500体积的HCl气体)。溶于水得到的溶液即为
,此为工业制盐酸的原理。
思考:工业制盐酸选择哪种反应条件呢?从环保的角度考虑,还应注意什么?
已知磷可以在氯气中燃烧,氯气不足时生成PCl 3,氯气过量时生成PCl5。试写出方程式。
(3)氯气和水的反应
氯气的水溶液叫
,饱和氯水中因溶有
而呈
色有
气味。在常温下,溶于水中的部分Cl2与水发生反应,化学方程式:
离子方程式:
思考:为什么氯水能使有色布条褪色,而干燥的氯气不能使有色布条褪色?真正起漂白作用的是什么物质?
次氯酸的性质
(1)
性:杀菌、消毒、漂白
(2)
酸性;比碳酸酸性
;Ca(ClO)2+CO2+H2O=
(3)不稳定性:只存在于
,在光照下易分解放出氧气,写出次氯酸分解的方程式
思考1:氯气用于自来水的杀菌,消毒的原因。
思考2:用自来水养金鱼时,为何要将水在阳光下晒一段时间?
思考3:新制氯水的成分有哪些?这些成分决定了氯水的哪些性质?
氯水的成份:
种分子,分别为
种离子,分别为
氯水的性质:
液氯和氯水有什么区别?
氯水可以保存在钢瓶中吗?
思考4:若氯水在空气中久置后,成份有何改变?溶液的酸碱性如何变?
思考5:实验室中新制氯水应如何保存?
思考6:氯气用于自来水的杀菌消毒,使用氯气对自来水消毒时可能产一些负面影响。如何改进?
练习:用新制氯水进行下列实验,将可能发生的现象以及解释或离子方程式填入下表
实验现象
解释或离子方程式
滴入AgNO3溶液
通入紫色石蕊溶液中
滴入红墨水
Na2CO3固体
【考点突破】
现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:B
、丙
、乙
。
(2)写出下列反应的化学方程式:
反应①
反应⑤
反应⑥
【答案】
(1)
Al
HCl
Cl2
(2)①2Na+2H2O=2NaOH+H2↑
⑤2FeCl2+Cl2=2FeCl3
例2.某学习小组设计以下四个实验探究氯水中的成份,请根据下表回答问题。
实验序号
实验方法
实验现象
结论
①
生成白色沉淀
氯水中含有Cl-
②
将氯水滴加到含有酚酞的NaOH溶液中
氯水中含有HClO
③
试纸变蓝色
氯水中含有Cl2
④
将氯水滴加到Na2CO3溶液中
氯水中含有H+
(1)实验室如何保存饱和氯水?
(2)指出实验①和实验③中的实验方法:
①
;③
;
(3)指出实验②和实验④中的实验现象:
②
;④
。
(4)有同学认为实验②现象产生的原因可能有两种:(简要文字说明)①是由于氯水中的HClO将酚酞氧化而褪色;②
是由于
(5)以下实验可以验证实验②产生的原因:将NaOH溶液滴入含酚酞的氯水中,若观察到
,证明红色褪去的原因是①
;若观察到
,证明红色褪去的原因是②。
答案:(1)在阴凉处置于棕色试剂瓶中密封保存(2)①将氯水滴加到AgNO3溶液中;③取一小段KI-淀粉试纸,置于表面皿或玻璃片上,用洁净的玻璃棒蘸取氯水,滴在试纸上。(3)②溶液的红色褪去;④溶液中有气泡冒出。(4)氯气与NaOH反应使溶液碱性减弱(5)溶液不再出现红色,溶液变为红色。
【考点巩固】
1.氯气能使紫色石蕊溶液( )
A.褪色
B.变成红色
C.先褪色后变红
D.先变红后褪色
2.氯气是一种工业原料。工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A.若管道漏气遇氨会产生白烟
B.该反应利用了氯气的强氧化性
C.该反应属于复分解反应
D.生成1
mol
N2有6
mol电子转移
3.G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):
①G―→Q+NaCl ②Q+H2O―→X+H2 ③Y+NaOH―→G+Q+H2O ④Z+NaOH―→Q+X+H2O
则G、Q、X、Y、Z这五种化合物中氯元素的化合价由低到高的顺序为( )
A.QGZYX
B.GYQZX
C.GYZQX
D.ZXGYQ
4.如下图所示,A处通入湿润的Cl2,关闭B阀时,C处干燥的红布条看不到明显现象;当打开B阀后,C处红布条逐渐褪色,则D瓶中装的是( )
A.浓H2SO4
B.饱和NaCl溶液
C.稀盐酸
D.H2O
5.已知①2FeCl3+2KI=
2FeCl2+2KCl+I2
②2FeCl2+Cl2=
2FeCl3据此判断下列物质氧化能力由强到弱的顺序是(
)
A.Fe3+>Cl2>I2
B.Cl2>Fe3+>I2
C.I2>Cl2>Fe3+
D.Cl2>I2>Fe3+
6.A、B、C、D、E五种
物质转化关系如图所示:
(1)A、B、C、D、E各为
什么物质(填化学式):
A
B
C
D
E
(2)写出下列过程的方程式(是离子反应的只写离子方程式):
C→D:____________________________
D→E:__________________________
E→A:_____________________________
C→A:__________________________
第二课时
【考纲要求】
1.能够正确说出次氯酸及次氯酸盐的主要性质及对应的反应方程式。
2.掌握氯离子的检验方法。
【自主学习】
(4)
氯气和碱溶液的反应
(1)制漂白液
化学方程式:
离子方程:
思考1:日常生活用品中,你知道什么的主要成份与漂白液同?
思考2:漂白液优于氯的地方是什么?
(2)制漂白粉
原料:
反应原理:
漂白粉的主要成份是
有效成份是
思考1:漂白粉是如何发生效用的?
思考2:漂白粉或漂粉精中Ca(ClO)2能与空气中的CO2和水蒸气发生反应,你认为购买和存放
漂白粉或漂粉精时应注意哪些问题?
思考3:若漂白粉在空气中久置,发生的反应有:
这个过程我们可以看作漂白粉的
过程。
思考4:氯气有毒,实验室制取氯气应该如何尾气吸收?
三.氯离子的检验
实验现象
解释或离子方程式
加入AgNO3溶液后
加入稀硝酸后
稀盐酸
NaCl溶液
Na2CO3溶液
自来水
思考:检验Cl-时,为什么滴加AgNO3溶液后还要再加稀硝酸?
四.成盐元素——卤素
卤素包括的元素有
卤素的单质都有
性,该性质按由强到弱的排列为:
海水中的成盐元素还有
,分别存在于
。
科学视野:一、原子结构
在元素周期表中,与氯元素处于同一纵行——第ⅦA族。
氟(F)、溴(r)、碘(I)、砹(At)。这些元素的原子最外层都有
个电子,由于
所以统称为卤素(成盐元素)。
二、物理性质:
(1)溴在常温下为深红棕色液体,是唯一的液态非金属单质,液溴易挥发,极易产生有毒的溴蒸气,实验室通常将溴密闭保存于阴冷处,不能用胶塞,且试剂瓶内加水,以减弱溴的挥发。
(2)碘是紫黑色固体,具有金属光泽,易升华(常用与分离和提纯),遇淀粉变蓝,通常用于碘
与淀粉的互相鉴别
;碘在水中的溶解度很小,但易溶于酒精。
三、化学性质
(1)相似性:
氟、氯、溴、碘的原子其最外层都具有
个电子,决定了这些原子在化学反应中易
于
,这就决定了单质分子在化学反应中主要表现
性,均能与金属、非金属、水、碱溶液的反应。
(2)递变性:
随着卤素核电荷数的增加,电子层数的增多,下列性质的递变规律是:按氟、氯、溴、碘的
顺序,氧化性渐弱。
a、.与非金属反应:
b、与金属反应:
c、与水反应:d、与碱反应,写出通式(除F2外均类似与氯气和碱的反应)
(3)卤离子(Br-、I-)的检验:
所用试剂:AgNO3溶液和稀硝酸
AgBr:浅黄色不溶于水不溶于酸的沉淀。
AgI:黄色不溶于水不溶于酸的沉淀。
【考点突破】
例1.化工厂常用浓氨水检验管道是否漏氯气,其反应为:3Cl2+8NH36NH4Cl+N2当有160.5g
NH4Cl产生时,被氧化的氨是(
)
A.214g
B.53.5
g
C.17
g
D.68
g
答案:C
例2:实验室用下列有关装置先制取干燥、纯净的氯气,后进行有关性质实验。试回答下列问题。
(1)上述装置中各仪器从左至右的连接顺序为________接__________接__________接________接________接________接________。
(2)E装置的作用是________________,G装置的作用是____________,D中的现象为__________,B中的现象为______________________________________________。
(3)写出下列反应的离子方程式:B中______________,G中________________。
解析:浓盐酸与二氧化锰反应生成的氯气中含有氯化氢气体和水蒸气,饱和食盐水除去氯化氯气体,浓硫酸除去水蒸气,然后通过干燥的红色布条,干燥的红色布条不褪色,湿润的红色布条褪色,说明次氯酸起到漂白作用;再通过碘化钾溶液置换出单质碘,最后多余的氯气用氢氧化钠溶液处理吸收,防止污染空气。
答案:(1)A E F C D B G(2)吸收Cl2中的HCl气体 吸收尾气Cl2,防止污染环境 红色褪去 溶液由无色变为棕黄色(3)2I-+Cl2===I2+2Cl- Cl2+2OH-===Cl-+ClO-+H2O
反馈训练:
1.向NaBr、NaI、Na2SO3混合液中,通入过量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成是( )
A.NaCl、Na2SO4
B.NaCl、NaBr、Na2SO4
C.NaCl、Na2SO4、I2
D.NaCl、NaI、Na2SO4
2.用氯气消毒过的自来水配制下列溶液时,会使所配溶液的溶质发生变化的是( )
①NaOH
②AgNO3
③Na2CO3
④NaBr
⑤FeCl2
A.只有①②
B.只有①④⑤
C.只有②④⑤
D.①②③④⑤
【考点巩固】
1.下列物质露置于空气中易变质的是:①
氯水
②
水玻璃
③
烧碱
④
漂白粉
⑤
绿矾(FeSO4·
7H2O)
⑥
Na2CO3·10H2O
(
)
A.除⑤外
B.除②③外
C.除②③⑥外
D.全部
2.自来水是用氯气杀菌消毒的,不法商贩用自来水冒充纯净水出售,为辨真伪,可用下列哪一种试剂鉴别(
)
A.酚酞试液
B.氯化铁溶液
C.硝酸银溶液
D.氢氧化钠溶液
3.下列离子方程式中,正确的是(
)
A.向氯化亚铁溶液中通入氯气:
Fe2++Cl2
Fe3++2Cl
B.氯气通入冷的氢氧化钠溶液中:
Cl2+2OH
Cl+ClO+H2O
C.氯气与H2O反应:Cl2+H2O=Cl-+ClO-+2H+
D.金属铝溶于盐酸中:
Al+2H
+=Al3++H2↑
4.溴(Br)与氯同属“卤族”元素,其单质在性质上具有很大的相似性,但Cl2比Br2的活泼性强,下面是根据的氯性质对溴的性质的预测,其中不正确的是(
)
A.溴单质常温下为液态,但极容易挥发为溴蒸气
B.溴单质只具有氧化性
C.溴原子外层有7个电子,在化学反应中容易得1个电子,表现氧化性
D.溴离子可以用酸性AgNO3溶液来检验
5.下面(1)至(3)记录了对太空某星球外层空间取回的气体样品进行分析的过程:
①将样品溶于水,发现其主要成分气体A极易溶于水,水溶液呈酸性。
②将A的浓溶液与MnO2在一定条件下反应产生一种黄绿色气体单质B,将B通入石灰乳可生成两种钙盐的混合物D。
③A的稀溶液与锌粒反应生成气体C,C与B的气体充分混合经光照发生爆炸又生成气体A,实验测得反应前后气体体积不变。
请回答下列有关问题:
(1)A的化学式是
。
(2)A的浓溶液与MnO2反应生成B的离子方程式:
(3)气体B与Ca(OH)2
反应的化学方程式是
混合物D的俗名是_
______________
。
(4)混合物D中的有效成分在空气中放置失效的化学方程式是_______________________
6.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关反应的化学方程式为:
_______________________________(2)装置B中饱和食盐水的作用是_______________________________同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_________________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
编号
a
b
c
d
Ⅰ
干燥的有色布条
干燥的有色布条
湿润的有色布条
湿润的有色布条
Ⅱ
碱石灰
硅胶
浓硫酸
无水氯化钙
Ⅲ
湿润的有色布条
湿润的有色布条
干燥的有色布条
干燥的有色布条
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________________。该现象________(填“能”或“不能”)说明溴的非金属性强于碘,原因是________________________________________________________________________。
(5)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:
________________________________________请判断改用NaHSO3溶液是否可行?________(填“是”或“否”)。
第二节
富集在海水中的元素——氯
第一课时
【考点巩固】1.D
2.C
3.B
4.A5
.B
6..(1)Cu
CuCl2
Cu(OH)2
CuO
(2)
Cu2++2OH-=
Cu(OH)2↓,
Cu(OH)2CuO+H2O,
CuO+H2Cu+H2O,
Cu2++Fe=Fe2++Cu
第二课时
反馈训练:1
.A
2.D
【考点巩固】1.D
2.C
3.B
4.B
5.(1)HCl
(2)MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉
(4)Ca(ClO)2+H2O+
CO2=CaCO3↓+2
HClO
2HClO
光照
2HCl
+
O2↑
6.【解析】 本题考查氯气的制备及性质检验实验,意在考查考生对化学实验的设计、分析及评价能力。(1)漂粉精固体的主要成分为Ca(ClO)2和CaCl2,利用Ca(ClO)2氧化浓盐酸制取氯气,反应的化学方程式为Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O。(3)氯气与水反应生成的HClO具有漂白性,而干燥的氯气没有漂白性,通过装置B后氯气中含有水蒸气,因此先通过湿润的有色布条,再通过干燥装置(选择固体干燥剂),后通过干燥的有色布条。(5)HCO具有还原性,可以与Cl2发生氧化还原反应,可能产生SO2,污染大气,因此该方案不可行。
【答案】 (1)Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
(2)除去Cl2中的HCl 装置B中长颈漏斗中液面上升,形成一段水柱
(3)d
(4)E中溶液分为两层,上层(苯层)为紫红色 不能 过量的Cl2也可将I-氧化为I2
(5)HSO+Cl2+H2O===SO+2Cl-+3H+(或4HSO+Cl2===SO+2Cl-+3SO2+2H2O) 否
金属A
(焰色为黄色)
气体甲
气体丙
物质E
物质D
物质G
物质F
红褐色沉淀H
④
黄绿色气体乙
黄绿色气体乙
金属B
①
金属C
②
⑤
③
⑥
水
H2O
