2017高考化学一轮复习 专题十 水的电离和溶液的酸碱性 考点一 水的电离平衡及影响因素教学案
文档属性
| 名称 | 2017高考化学一轮复习 专题十 水的电离和溶液的酸碱性 考点一 水的电离平衡及影响因素教学案 |  | |
| 格式 | zip | ||
| 文件大小 | 446.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-12 15:05:02 | ||
图片预览


文档简介
专题十 水的电离和溶液的酸碱性
纲展示 命题探究
1 水的电离平衡
水是一种极弱的电解质,能发生微弱的电离:H2O+H2O??H3O++OH-,可简写为H2O??H++OH-。
2 水的离子积常数
(1)概念:在一定温度下,c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积。
(2)表达式:Kw=c(H+)·c(OH-)。
(3)数值:室温下:Kw=1×10-14。
(4)影响因素:只与温度有关,水的电离是吸热过程,升高温度,Kw增大。
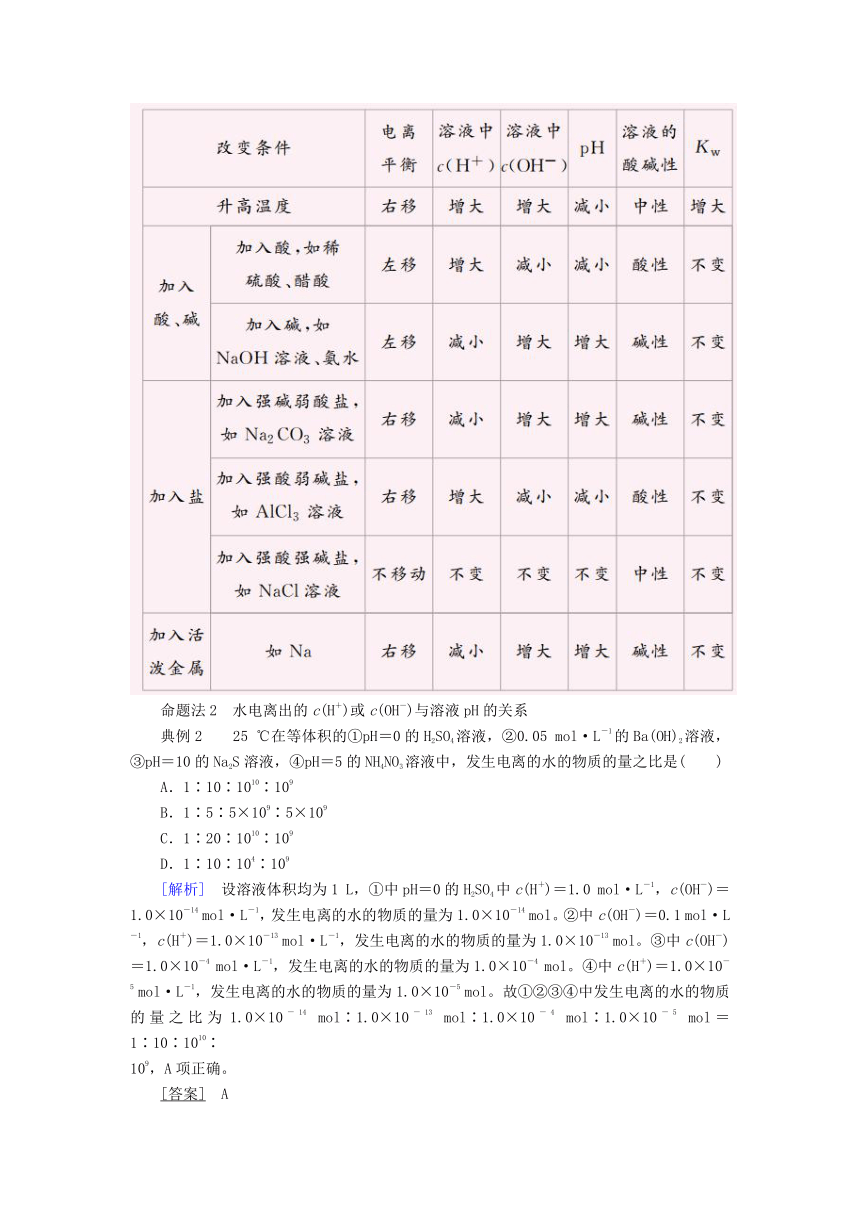
3 水的电离平衡的影响因素
(1)加热,促进水的电离,Kw增大。
(2)加入酸或碱,抑制水的电离,Kw不变。
(3)①加入强酸强碱的正盐,不影响水的电离。
②加入强酸的酸式盐,抑制水的电离。
③加入可水解的盐(如FeCl3、Na2CO3、NH4Cl),促进水的电离。
(4)加入与水反应的活泼金属(如Na、K),促进水的电离。
学霸巧学卡 水的电离平衡注意事项
(1)水的离子积常数Kw=c(H+)·c(OH-),其实质是水溶液中的H+和OH-浓度的乘积,不一定是水电离出的H+和OH-浓度的乘积,所以与其说Kw是水的离子积常数,不如说是水溶液中的H+和OH-的离子积常数。即Kw不仅适用于水,还适用于酸性或碱性的稀溶液。不管哪种溶液均有c(H+)H2O=c(OH-)H2O。
(2)水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。
(3)水的电离是吸热过程,升高温度,水的电离平衡向电离方向移动,c(H+)和c(OH-)都增大,故Kw增大,但溶液仍呈中性;对于Kw,若未注明温度,一般认为在常温下(25
℃)。
(4)水中加酸或碱对水的电离均有抑制作用,因此,室温下,若由水电离出的c(H+)<1×10-7
mol·L-1,该溶液可能显酸性,也可能显碱性。
1.思维辨析
(1)温度一定时,水的电离常数与水的离子积常数相等。( )
(2)水的离子积常数的数值大小与温度和稀水溶液的浓度有关。( )
(3)水的电离平衡移动符合勒夏特列原理。( )
(4)升高温度,水电离平衡右移,H+浓度增大,呈酸性。( )
(5)将纯水加热到95
℃时,Kw变大,pH不变,水仍呈中性。( )
(6)向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小。( )
答案 (1)× (2)× (3)√ (4)× (5)× (6)×
2.向纯水中加入少量下列物质或改变下列条件,能促进水的电离,并能使溶液中c(OH-)>c(H+)的操作是( )
①稀硫酸 ②金属钠 ③氨气 ④FeCl3固体
⑤NaClO固体 ⑥将水加热煮沸
A.②⑤
B.①④
C.③④⑥
D.④
答案 A
解析 稀硫酸、氨气抑制水的电离,金属钠、FeCl3固体、NaClO固体、将水加热煮沸促进水的电离,但FeCl3固体使溶液显酸性,将水加热煮沸,水仍呈中性。
[考法综述]
高考对本考点主要围绕水的电离平衡进行考查,考生除掌握基本概念外,还要理解外界条件对水的电离平衡的影响。要学会判断各种条件下平衡移动方向,c(H+)、c(OH-)变化情况,Kw的变化及溶液的性质。
命题法1 影响水电离平衡的因素及结果判断
典例1 水中加入下列溶液对水的电离平衡不产生影响的是( )
A.NaHSO4溶液
B.KF溶液
C.KAl(SO4)2溶液
D.NaI溶液
[解析] NaHSO4电离生成的H+能抑制水的电离,A项错误;KF电离生成的F-水解生成弱电解质HF,从而促进水的电离,B项错误;KAl(SO4)2电离出的Al3+水解生成Al(OH)3,从而促进水的电离,C项错误;NaI是强酸强碱盐,不水解,且电离出的Na+和I-对水的电离平衡没有影响,D项正确。
[答案] D
【解题法】 外界因素对水电离的影响
命题法2 水电离出的c(H+)或c(OH-)与溶液pH的关系
典例2 25
℃在等体积的①pH=0的H2SO4溶液,②0.05
mol·L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1∶10∶1010∶109
B.1∶5∶5×109∶5×109
C.1∶20∶1010∶109
D.1∶10∶104∶109
[解析] 设溶液体积均为1
L,①中pH=0的H2SO4中c(H+)=1.0
mol·L-1,c(OH-)=1.0×10-14
mol·L-1,发生电离的水的物质的量为1.0×10-14
mol。②中c(OH-)=0.1
mol·L-1,c(H+)=1.0×10-13
mol·L-1,发生电离的水的物质的量为1.0×10-13
mol。③中c(OH-)=1.0×10-4
mol·L-1,发生电离的水的物质的量为1.0×10-4
mol。④中c(H+)=1.0×10-5
mol·L-1,发生电离的水的物质的量为1.0×10-5
mol。故①②③④中发生电离的水的物质的量之比为1.0×10-14
mol∶1.0×10-13
mol∶1.0×10-4
mol∶1.0×10-5
mol=1∶10∶1010∶
109,A项正确。
[答案] A
【解题法】 水电离出的c(H+)或c(OH-)的计算(25
℃时)
(1)常温下,中性溶液c(OH-)=c(H+)=10-7
mol·L-1。
(2)溶质为酸的溶液,OH-全部来自水的电离,水电离产生的c(H+)=c(OH-)。
如计算pH=2的盐酸溶液中由水电离出的c(H+),方法是先求出溶液的c(OH-)==10-12
mol·L-1,即水电离出的c(H+)=c(OH-)=10-12
mol·L-1。
(3)溶质为碱的溶液,H+全部来自水的电离,水电离产生的c(OH-)=c(H+)。
如计算pH=12的NaOH溶液中由水电离出的c(OH-),方法是先求出溶液的c(H+)==10-12
mol·L-1,即水电离出的c(OH-)=c(H+)=10-12
mol·L-1。
(4)水解呈酸性或碱性的盐溶液中
①pH=5的NH4Cl溶液中H+全部来自水的电离,由水电离出的c(H+)=10-5
mol·L-1,c(OH-)=10-9
mol·L-1,是因为部分OH-与部分NH结合;
②pH=12的Na2CO3溶液中OH-全部来自水的电离,由水电离出的c(OH-)=10-2
mol·L-1。
1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
答案 C
解析 升温促进水的电离,升温后溶液不能由碱性变为中性,A项错误;根据c(H+)和c(OH-)可求出Kw=1.0×10-14,B项错误;加入FeCl3,Fe3+水解溶液呈酸性,可引起由b向a变化,C项正确;温度不变,稀释后,c(OH-)减小,c(H+)增大,但仍在该曲线上,不可能到达d点,D项错误。
2.室温下,将0.05
mol
Na2CO3固体溶于水配成100
mL溶液,向溶液中加入下列物质,有关结论正确的是( )
答案 B
解析 0.05
mol
Na2CO3与50
mL
1
mol·L-1
H2SO4恰好完全反应生成Na2SO4,c(Na+)=2c(SO),A项错误;0.05
mol
Na2CO3与0.05
mol
CaO二者完全反应:Na2CO3+CaO+H2O===CaCO3↓+2NaOH。原Na2CO3溶液中:CO+H2O??HCO+OH-平衡逆向移动,使c(HCO)减小,溶液中c(OH-)增大,二者比值增大,B项正确;在碳酸钠溶液中加水,水的电离程度减小,由水电离出的c(H+)·c(OH-)将减小,C项错误;在碳酸钠溶液中加入NaHSO4固体,溶液中c(Na+)必然增大,D项错误。
3.短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2-、X+
B.X+、Y3+
C.Y3+、Z2-
D.X+、Z2-
答案 C
解析 根据“短周期元素”、“原子序数依次增大”、“简单离子”和选项中离子所带的电荷数,可以判断出四种元素对应的离子分别是O2-、Na+、Al3+和S2-,其中Na+对水的电离平衡无影响,故排除A、B、D,选C。
4.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有c(H+)C.图中T1D.XZ线上任意点均有pH=7
答案 D
解析 由水的离子积的定义知两条曲线间任意点均有c(H+)×c(OH-)=Kw,A正确;由图中纵横轴的大小可知M区域内任意点均有c(H+)T1,C正确;由pH=-lgc(H+)可知只有当c(H+)=10-7mol·L-1时,才有pH=7,D错误。
5.下列有关电解质溶液的说法正确的是( )
A.在蒸馏水中滴加浓H2SO4,Kw不变
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
答案 C
解析 浓H2SO4加入蒸馏水中时会放热,使Kw变大,A项错误;CaCO3可以溶于醋酸的原因是(CH3COO)2Ca能溶于水,而CaSO4是微溶物,不能类推,B项错误;C项,该式为Na2S溶液中的质子守恒式,正确;NaCl是强酸强碱盐,对水的电离不产生影响,而CH3COONH4是弱酸弱碱盐,对水的电离起促进作用,两者影响不相同,D项错误。
6.下列有关叙述不正确的是( )
A.若根据反应“H2+Cl2===2HCl”设计成燃料电池,既可发电同时还可用于制备盐酸
B.氯气溶于水达到平衡后,若其他条件不变,加入少量水,水的电离平衡向正向移动
C.任何稀溶液中由水电离出的c(H+)和c(OH-)的乘积都为1×10-14
D.冰醋酸中逐滴加水,则溶液的导电性先增大后减小
答案 C
解析 A中反应为自发放热反应,可设计成燃料电池,正确;氯水呈酸性,稀释后H+浓度减小,对水的电离抑制能力减弱,B项正确;水的离子积常数与温度有关,C项错;D中加水时冰醋酸电离,导电性增强,达到电离平衡后,继续加水,离子浓度减小,导电性减弱,D项正确。
纲展示 命题探究
1 水的电离平衡
水是一种极弱的电解质,能发生微弱的电离:H2O+H2O??H3O++OH-,可简写为H2O??H++OH-。
2 水的离子积常数
(1)概念:在一定温度下,c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积。
(2)表达式:Kw=c(H+)·c(OH-)。
(3)数值:室温下:Kw=1×10-14。
(4)影响因素:只与温度有关,水的电离是吸热过程,升高温度,Kw增大。
3 水的电离平衡的影响因素
(1)加热,促进水的电离,Kw增大。
(2)加入酸或碱,抑制水的电离,Kw不变。
(3)①加入强酸强碱的正盐,不影响水的电离。
②加入强酸的酸式盐,抑制水的电离。
③加入可水解的盐(如FeCl3、Na2CO3、NH4Cl),促进水的电离。
(4)加入与水反应的活泼金属(如Na、K),促进水的电离。
学霸巧学卡 水的电离平衡注意事项
(1)水的离子积常数Kw=c(H+)·c(OH-),其实质是水溶液中的H+和OH-浓度的乘积,不一定是水电离出的H+和OH-浓度的乘积,所以与其说Kw是水的离子积常数,不如说是水溶液中的H+和OH-的离子积常数。即Kw不仅适用于水,还适用于酸性或碱性的稀溶液。不管哪种溶液均有c(H+)H2O=c(OH-)H2O。
(2)水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有H+和OH-共存,只是相对含量不同而已。
(3)水的电离是吸热过程,升高温度,水的电离平衡向电离方向移动,c(H+)和c(OH-)都增大,故Kw增大,但溶液仍呈中性;对于Kw,若未注明温度,一般认为在常温下(25
℃)。
(4)水中加酸或碱对水的电离均有抑制作用,因此,室温下,若由水电离出的c(H+)<1×10-7
mol·L-1,该溶液可能显酸性,也可能显碱性。
1.思维辨析
(1)温度一定时,水的电离常数与水的离子积常数相等。( )
(2)水的离子积常数的数值大小与温度和稀水溶液的浓度有关。( )
(3)水的电离平衡移动符合勒夏特列原理。( )
(4)升高温度,水电离平衡右移,H+浓度增大,呈酸性。( )
(5)将纯水加热到95
℃时,Kw变大,pH不变,水仍呈中性。( )
(6)向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小。( )
答案 (1)× (2)× (3)√ (4)× (5)× (6)×
2.向纯水中加入少量下列物质或改变下列条件,能促进水的电离,并能使溶液中c(OH-)>c(H+)的操作是( )
①稀硫酸 ②金属钠 ③氨气 ④FeCl3固体
⑤NaClO固体 ⑥将水加热煮沸
A.②⑤
B.①④
C.③④⑥
D.④
答案 A
解析 稀硫酸、氨气抑制水的电离,金属钠、FeCl3固体、NaClO固体、将水加热煮沸促进水的电离,但FeCl3固体使溶液显酸性,将水加热煮沸,水仍呈中性。
[考法综述]
高考对本考点主要围绕水的电离平衡进行考查,考生除掌握基本概念外,还要理解外界条件对水的电离平衡的影响。要学会判断各种条件下平衡移动方向,c(H+)、c(OH-)变化情况,Kw的变化及溶液的性质。
命题法1 影响水电离平衡的因素及结果判断
典例1 水中加入下列溶液对水的电离平衡不产生影响的是( )
A.NaHSO4溶液
B.KF溶液
C.KAl(SO4)2溶液
D.NaI溶液
[解析] NaHSO4电离生成的H+能抑制水的电离,A项错误;KF电离生成的F-水解生成弱电解质HF,从而促进水的电离,B项错误;KAl(SO4)2电离出的Al3+水解生成Al(OH)3,从而促进水的电离,C项错误;NaI是强酸强碱盐,不水解,且电离出的Na+和I-对水的电离平衡没有影响,D项正确。
[答案] D
【解题法】 外界因素对水电离的影响
命题法2 水电离出的c(H+)或c(OH-)与溶液pH的关系
典例2 25
℃在等体积的①pH=0的H2SO4溶液,②0.05
mol·L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1∶10∶1010∶109
B.1∶5∶5×109∶5×109
C.1∶20∶1010∶109
D.1∶10∶104∶109
[解析] 设溶液体积均为1
L,①中pH=0的H2SO4中c(H+)=1.0
mol·L-1,c(OH-)=1.0×10-14
mol·L-1,发生电离的水的物质的量为1.0×10-14
mol。②中c(OH-)=0.1
mol·L-1,c(H+)=1.0×10-13
mol·L-1,发生电离的水的物质的量为1.0×10-13
mol。③中c(OH-)=1.0×10-4
mol·L-1,发生电离的水的物质的量为1.0×10-4
mol。④中c(H+)=1.0×10-5
mol·L-1,发生电离的水的物质的量为1.0×10-5
mol。故①②③④中发生电离的水的物质的量之比为1.0×10-14
mol∶1.0×10-13
mol∶1.0×10-4
mol∶1.0×10-5
mol=1∶10∶1010∶
109,A项正确。
[答案] A
【解题法】 水电离出的c(H+)或c(OH-)的计算(25
℃时)
(1)常温下,中性溶液c(OH-)=c(H+)=10-7
mol·L-1。
(2)溶质为酸的溶液,OH-全部来自水的电离,水电离产生的c(H+)=c(OH-)。
如计算pH=2的盐酸溶液中由水电离出的c(H+),方法是先求出溶液的c(OH-)==10-12
mol·L-1,即水电离出的c(H+)=c(OH-)=10-12
mol·L-1。
(3)溶质为碱的溶液,H+全部来自水的电离,水电离产生的c(OH-)=c(H+)。
如计算pH=12的NaOH溶液中由水电离出的c(OH-),方法是先求出溶液的c(H+)==10-12
mol·L-1,即水电离出的c(OH-)=c(H+)=10-12
mol·L-1。
(4)水解呈酸性或碱性的盐溶液中
①pH=5的NH4Cl溶液中H+全部来自水的电离,由水电离出的c(H+)=10-5
mol·L-1,c(OH-)=10-9
mol·L-1,是因为部分OH-与部分NH结合;
②pH=12的Na2CO3溶液中OH-全部来自水的电离,由水电离出的c(OH-)=10-2
mol·L-1。
1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
答案 C
解析 升温促进水的电离,升温后溶液不能由碱性变为中性,A项错误;根据c(H+)和c(OH-)可求出Kw=1.0×10-14,B项错误;加入FeCl3,Fe3+水解溶液呈酸性,可引起由b向a变化,C项正确;温度不变,稀释后,c(OH-)减小,c(H+)增大,但仍在该曲线上,不可能到达d点,D项错误。
2.室温下,将0.05
mol
Na2CO3固体溶于水配成100
mL溶液,向溶液中加入下列物质,有关结论正确的是( )
答案 B
解析 0.05
mol
Na2CO3与50
mL
1
mol·L-1
H2SO4恰好完全反应生成Na2SO4,c(Na+)=2c(SO),A项错误;0.05
mol
Na2CO3与0.05
mol
CaO二者完全反应:Na2CO3+CaO+H2O===CaCO3↓+2NaOH。原Na2CO3溶液中:CO+H2O??HCO+OH-平衡逆向移动,使c(HCO)减小,溶液中c(OH-)增大,二者比值增大,B项正确;在碳酸钠溶液中加水,水的电离程度减小,由水电离出的c(H+)·c(OH-)将减小,C项错误;在碳酸钠溶液中加入NaHSO4固体,溶液中c(Na+)必然增大,D项错误。
3.短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是( )
A.W2-、X+
B.X+、Y3+
C.Y3+、Z2-
D.X+、Z2-
答案 C
解析 根据“短周期元素”、“原子序数依次增大”、“简单离子”和选项中离子所带的电荷数,可以判断出四种元素对应的离子分别是O2-、Na+、Al3+和S2-,其中Na+对水的电离平衡无影响,故排除A、B、D,选C。
4.如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有c(H+)
答案 D
解析 由水的离子积的定义知两条曲线间任意点均有c(H+)×c(OH-)=Kw,A正确;由图中纵横轴的大小可知M区域内任意点均有c(H+)
5.下列有关电解质溶液的说法正确的是( )
A.在蒸馏水中滴加浓H2SO4,Kw不变
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
答案 C
解析 浓H2SO4加入蒸馏水中时会放热,使Kw变大,A项错误;CaCO3可以溶于醋酸的原因是(CH3COO)2Ca能溶于水,而CaSO4是微溶物,不能类推,B项错误;C项,该式为Na2S溶液中的质子守恒式,正确;NaCl是强酸强碱盐,对水的电离不产生影响,而CH3COONH4是弱酸弱碱盐,对水的电离起促进作用,两者影响不相同,D项错误。
6.下列有关叙述不正确的是( )
A.若根据反应“H2+Cl2===2HCl”设计成燃料电池,既可发电同时还可用于制备盐酸
B.氯气溶于水达到平衡后,若其他条件不变,加入少量水,水的电离平衡向正向移动
C.任何稀溶液中由水电离出的c(H+)和c(OH-)的乘积都为1×10-14
D.冰醋酸中逐滴加水,则溶液的导电性先增大后减小
答案 C
解析 A中反应为自发放热反应,可设计成燃料电池,正确;氯水呈酸性,稀释后H+浓度减小,对水的电离抑制能力减弱,B项正确;水的离子积常数与温度有关,C项错;D中加水时冰醋酸电离,导电性增强,达到电离平衡后,继续加水,离子浓度减小,导电性减弱,D项正确。
同课章节目录
