课题3 二氧化碳和一氧化碳(37张ppt)
文档属性
| 名称 | 课题3 二氧化碳和一氧化碳(37张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-14 00:00:00 | ||
图片预览










文档简介
课件44张PPT。二氧化碳和一氧化碳碳的氧化物有哪几种?
标出碳元素化合价。+2 +4CO(一氧化碳)CO2(二氧化碳)一、二氧化碳1、二氧化碳的性质想一想?1)为什么能用向上排气法收集CO2,用排水法好不好?
2)用什么方法检验集气瓶是否集满CO2?
3)用什么方法来检验收集的气体是CO2?
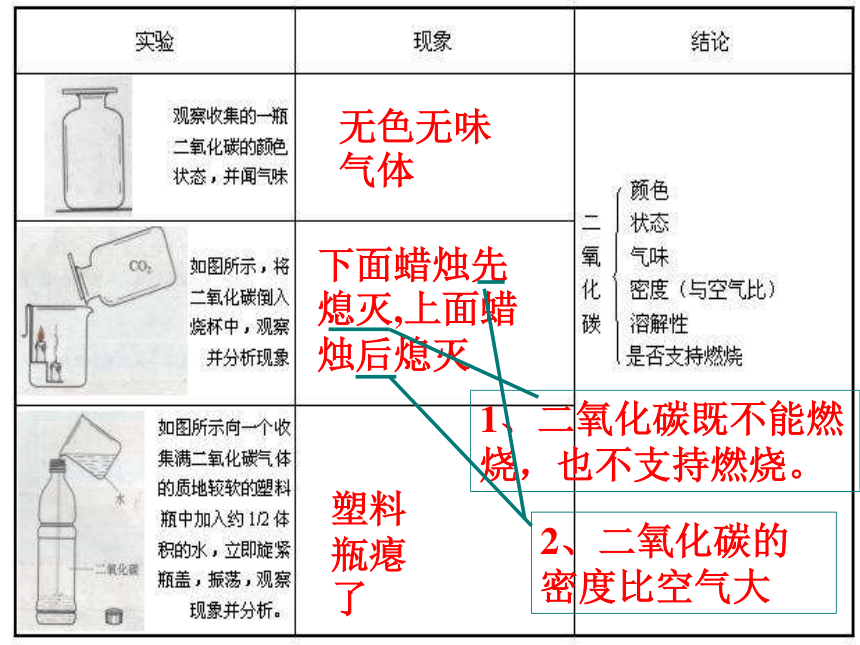
你了解CO2有那些性质? 1)常温下无色、无味气体;
2)ρCO2>ρ空气;
3)CO2能溶于水;
4)CO2不支持燃烧;
5)CO2能使澄清的石灰水变浑浊。 (1)、CO2的密度比空气大。 哪些实验证明CO2的密度比空气大?
(1)收集满CO2集气瓶放置方法
收集满CO2集气瓶要正放在桌面上。
(2)纸筒天平比较CO2和空气的密度。
(3)CO2吹肥皂泡或充CO2的气体球和充空气的气球比较下沉速度。
(4)向燃着的蜡烛倾倒二氧化碳气体:观察现象,蜡烛由低到高依次熄灭
分析:1)ρCO2>ρ空气 2)CO2不支持燃烧,也不可燃烧。
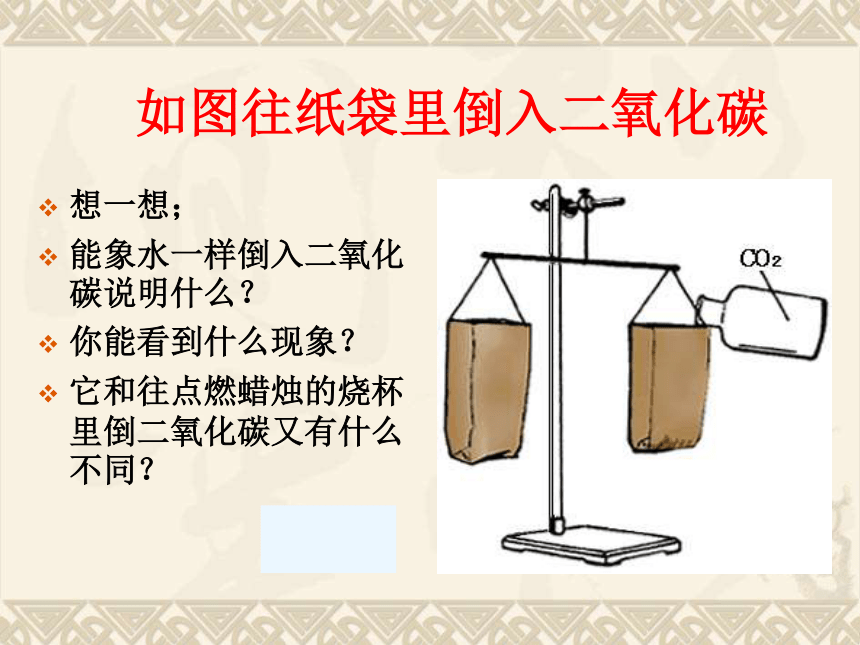
如图往纸袋里倒入二氧化碳想一想;
能象水一样倒入二氧化碳说明什么?
你能看到什么现象?
它和往点燃蜡烛的烧杯里倒二氧化碳又有什么不同?CO2不可燃,也不支持燃烧,且密度比空气大CO2的密度比空气大。 分析原因(2).CO2能溶于水。
请你设计一个实验,证明CO2能溶于水。
观察现象:塑料瓶变瘪。分析解释:CO2能溶于水,造成塑料瓶
内外气压差…
思考?想想生活中还有什么事实说明CO2能溶于水。
在通常情况下,1体积水约能溶解1体积的CO2。无色无味气体下面蜡烛先熄灭,上面蜡烛后熄灭塑料瓶瘪了1、二氧化碳既不能燃烧,也不支持燃烧。2、二氧化碳的密度比空气大 1.物理性质: 通常情况下,二氧化碳是一种没有颜色、没有气味的气体,能溶于水(1:1),密度比空气大。
2.化学性质: ①不能燃烧,一般也不支持燃烧。(不供给呼吸)
CO2在溶于水过程的变化思考
CO2在溶于水的过程中,有没有发生化学变化呢,也就是说有没有和水反应生成新的物质呢?
[提供信息]石蕊是一种紫色色素,遇酸性溶液变为红色。 是什么物质使石蕊变红? 请你猜一猜?2)是水(H2O)?1)是CO2 ?3)是CO2和 H2O反应生成的新物质?
CO2溶于水变化的探究1)酸溶液能使紫色石蕊变红。
2)CO2、水各自都不能使紫色石蕊变红。
3)CO2和水结合之后生成了一种酸,
能使紫色石蕊变红。
CO2+H2O===H2CO3(碳酸)。
所以也可以把汽水称之为“碳酸饮料”。将变红的溶液加热观察变化 观察现象:变红的溶液加热后又褪成紫色。
碳酸不稳定 H2CO3===H2O+CO2↑
常温下就可以缓慢分解,加热分解速率更快。检验CO2的方法用软塑料管向盛有澄清石灰水的试管中呼气。
现象:澄清石灰水变浑浊CO2+Ca(OH)2==CaCO3↓+H2O
(检验CO2的方法)
本节课的学习,你知道了CO2的哪些性质 1.物理性质:
1)通常情况下,是无色、无味的气体;
2)ρCO2>ρ空气 ;(能用向上排空气法收集)
3)CO2能溶于水(1:1);(不能用排水取气法收集)
4)干冰易升华.(固体CO2叫干冰)
2.化学性质 :
1)不支持燃烧,也不可燃烧
2)不支持呼吸;
3)能与水反应 CO2+H2O===H2CO3
H2CO3 === CO2↑ +H2O (碳酸不稳定性)
4)能与石灰水反应 CO2+Ca(OH)2===CaCO3↓+H2O
(此反应常用于检验CO2)
一、二氧化碳(CO2)的性质高温
5) CO2+C === 2CO(吸热反应) CO2气体无色液体雪花状固体干冰加压
降温降温压缩101KPa- 78.5C0升华 干 冰 的 形 成2、二氧化碳(CO2)对生活和环境的影响 CO2是一种很重要的气体,CO2在工农业生产生活中有很重要的用途。它的用途由什么决定呢
1、用途:
干冰(固态CO2):用于人工降雨、作制冷剂、灭火等;
CO2(气态):光合作用、灭火、化工产品原料、气体肥料等。 人工降雨灭火工业原料致冷剂温室肥料CO2 的 用 途CO2在自然界的循环1)CO2在自然界中是怎样完成它的的循环的呢??
2)如果CO2含量减少或增多各有什么影响??
3)提供数据介绍CO2含量增高对人体的影响。
探险者进入一个久无人至的山洞考察,要注意什么?
进入菜窖前的“灯火试验”
蜡烛燃烧不旺或者熄灭 辨证看待二氧化碳的利与弊 干冰用于人工降雨
和用作制冷剂空气里二氧化碳含量过
高会使人窒息甚至死亡二氧化碳可做温室肥料大量排放会引起
温室效应二氧化碳可用做灭火剂
干冰灭火剂使用不当
会使人造成冻伤
1、向蔬菜温室大棚里施放适量的二氧化碳,其目的是( ? ) A、使害虫窒息死亡,有效防治病虫害? B、避免发生火灾 C、促进植物的光合作用? D、使温室内的温度稳中有升 C2、检验某无色气体是否是二氧化碳的方法是(? )
A、将气体通入紫色石蕊溶液中??
B、将气体从一个容器倒入另一容器中
C、将点燃的木条伸入集气瓶中??
D、将气体通入澄清的石灰水中
D【巩固练习】3、两支试管中各注入5 mL滴有石蕊试液的蒸馏水,通入二氧化碳气体,然后一支加热,另一支撒入少量的活性炭,其颜色变化为:①红—紫—无②紫—红—紫③紫—红—无④无—红—无;其中正确的是( ) A、①②? B、②④? C、②③ ?D、①③ C4、下列物质的用途中既利用了物质的物理性质,又利用物质的化学性质的是(? )
A、二氧化碳用于灭火?
B、石墨用作电极? C、干冰用于人工降雨?
D、焦炭用于冶金工业 A6.以下的事实或实验中,能证明二氧化碳的密度比空气大的有( ) A、在一定条件下,二氧化碳气体会变成固体; B、?收集满二氧化碳的集气瓶要正放在桌面上 C、?一个两端(均挂有纸袋)平衡的天平,往一端纸袋中倾倒二氧化碳气体,天平向倒入二氧化碳的纸袋一端倾斜; D、? 用二氧化碳气流吹肥皂泡,肥皂泡在空气中下沉。 BCD7. 敞口久置的石灰水表面会“长出”一层“白膜”,该“白膜”其实是 ,其产生 原理是 。 CaCO3CO2+Ca(OH)2=CaCO3↓+H2O8.为了让用石灰浆[Ca(OH)2]抹的墙壁快点干燥,人们常在室内生个炭火盆,这是为什么?为什么开始放炭火盆时,墙壁反而变潮湿了?
第二课时据报道:在短短的两年内,安徽芜湖市大约有五十人死于煤气中毒。请归纳出一氧化碳的物理性质 一氧化碳和二氧化碳一样,都是没有颜色、没有气味的气体。不同的是,一氧化碳的密度比空气的略小。在标准状况下,它的密度为1.250g/L。一氧化碳难溶于水,在通常状况下,1体积的水仅能溶解约0.02体积的一氧化碳。思考你知道煤气的主要成分吗?一氧化碳二、一氧化碳1、一氧化碳的可燃性 (可作燃料)发出蓝色火焰,放热,烧杯壁上的澄清石灰水变浑浊生成 了二氧化碳 特别指出:和其他可燃气体一样,点燃CO之前必须先验纯。若CO不纯,点燃时可能发生爆炸,因CO的爆炸极限是12.5%~74%。煤炉中的化学CO 2 + C 2 CO2CO + O2 2 CO22、一氧化碳有毒现象:血液由深红色变成鲜红色一氧化碳中毒原理:因为CO能跟血液里的血红蛋白结合,使血红蛋白的输氧功能受到破坏,从而导致体内缺氧,产生头痛、昏迷,严重时发生死亡。好香啊!哦嗬!栽了 煤气中毒就是CO中毒。CO剧毒!!使用时必须注意安全。 使用煤炉取暖时应注意通风、排气。在人工煤气中添加具有特殊臭味的物质能帮助人们判断是否发生了煤气泄漏,避免中毒、爆炸事故的发生。小资料想一想:如发生煤气泄漏应当怎么办?3、一氧化碳的还原性CO + Cu O△ CO2 + Cu 结论:CO和木炭一样,能使CuO还原成Cu,同时生成CO2。在该反应中,CO是还原剂,表现出还原性。 一氧化碳的还原性可用于冶金工业。例如:可利用一氧化碳的还原性来炼铁。COCO一氧化碳与氧化铜反应实验实验装置图先通入CO
→澄清石灰水变混浊后加热CO早出晚归,酒精灯迟到早退.CuO黑色粉末逐渐变成红色,澄清石灰水变浑浊现象:分析:实验步骤: ①先通一会儿CO气体; ②点燃酒精灯加热;
③停止加热 ④通一氧化碳直到试管冷却。生成了铜和二氧化碳(CO早出晚归,酒精灯迟到早退。) 赶跑玻璃管内的空气,防止CO不纯而引起试管爆炸。 防止灼热的铜再被氧化成氧化铜。1、为什么实验时要先通一会儿纯净的一氧化碳,后对氧化铜加热?2、为什么氧化铜全部被还原成铜后要先停止加热,继续通一氧化碳直到试管冷却?3、为什么要用气球收集尾气? 为了赶跑玻璃管内的空气,以免因一氧化碳不纯而引起试管爆炸。 为了防止灼热的铜重新被氧化成氧化铜。为了防止尾气污染空气。想一想4、两份质量相同的碳酸钙,一份与足量的盐酸反应,一份充分锻烧,它们所生成的二氧化碳的量是( )
A.与盐酸反应的多 B.高温分解多
C.一样多 D.以上情况都有CCaCO3+2HCl=CaCl2+H2O+CO2↑ 还原性联系主要用途毒性与石灰水反应与水反应 氧化性可燃性水溶性 密度色 态 味物质 CO 和 CO2 的 比 较物理性质化 学 性 质二氧化碳一氧化碳小结学完本课题你应该知道1、二氧化碳不燃烧,也不支持燃烧,并能与水反应。3、一氧化碳能够燃烧,具有还原性和毒性。
2、二氧化碳能使澄清的石灰水变浑浊,这个反应可以用来检验二氧化碳。4、温室效应及防止温室效应增强应采取的措施。
2)用什么方法检验集气瓶是否集满CO2?
3)用什么方法来检验收集的气体是CO2?
你了解CO2有那些性质? 1)常温下无色、无味气体;
2)ρCO2>ρ空气;
3)CO2能溶于水;
4)CO2不支持燃烧;
5)CO2能使澄清的石灰水变浑浊。 (1)、CO2的密度比空气大。 哪些实验证明CO2的密度比空气大?
(1)收集满CO2集气瓶放置方法
收集满CO2集气瓶要正放在桌面上。
(2)纸筒天平比较CO2和空气的密度。
(3)CO2吹肥皂泡或充CO2的气体球和充空气的气球比较下沉速度。
(4)向燃着的蜡烛倾倒二氧化碳气体:观察现象,蜡烛由低到高依次熄灭
分析:1)ρCO2>ρ空气 2)CO2不支持燃烧,也不可燃烧。
如图往纸袋里倒入二氧化碳想一想;
能象水一样倒入二氧化碳说明什么?
你能看到什么现象?
它和往点燃蜡烛的烧杯里倒二氧化碳又有什么不同?CO2不可燃,也不支持燃烧,且密度比空气大CO2的密度比空气大。 分析原因(2).CO2能溶于水。
请你设计一个实验,证明CO2能溶于水。
观察现象:塑料瓶变瘪。分析解释:CO2能溶于水,造成塑料瓶
内外气压差…
思考?想想生活中还有什么事实说明CO2能溶于水。
在通常情况下,1体积水约能溶解1体积的CO2。无色无味气体下面蜡烛先熄灭,上面蜡烛后熄灭塑料瓶瘪了1、二氧化碳既不能燃烧,也不支持燃烧。2、二氧化碳的密度比空气大 1.物理性质: 通常情况下,二氧化碳是一种没有颜色、没有气味的气体,能溶于水(1:1),密度比空气大。
2.化学性质: ①不能燃烧,一般也不支持燃烧。(不供给呼吸)
CO2在溶于水过程的变化思考
CO2在溶于水的过程中,有没有发生化学变化呢,也就是说有没有和水反应生成新的物质呢?
[提供信息]石蕊是一种紫色色素,遇酸性溶液变为红色。 是什么物质使石蕊变红? 请你猜一猜?2)是水(H2O)?1)是CO2 ?3)是CO2和 H2O反应生成的新物质?
CO2溶于水变化的探究1)酸溶液能使紫色石蕊变红。
2)CO2、水各自都不能使紫色石蕊变红。
3)CO2和水结合之后生成了一种酸,
能使紫色石蕊变红。
CO2+H2O===H2CO3(碳酸)。
所以也可以把汽水称之为“碳酸饮料”。将变红的溶液加热观察变化 观察现象:变红的溶液加热后又褪成紫色。
碳酸不稳定 H2CO3===H2O+CO2↑
常温下就可以缓慢分解,加热分解速率更快。检验CO2的方法用软塑料管向盛有澄清石灰水的试管中呼气。
现象:澄清石灰水变浑浊CO2+Ca(OH)2==CaCO3↓+H2O
(检验CO2的方法)
本节课的学习,你知道了CO2的哪些性质 1.物理性质:
1)通常情况下,是无色、无味的气体;
2)ρCO2>ρ空气 ;(能用向上排空气法收集)
3)CO2能溶于水(1:1);(不能用排水取气法收集)
4)干冰易升华.(固体CO2叫干冰)
2.化学性质 :
1)不支持燃烧,也不可燃烧
2)不支持呼吸;
3)能与水反应 CO2+H2O===H2CO3
H2CO3 === CO2↑ +H2O (碳酸不稳定性)
4)能与石灰水反应 CO2+Ca(OH)2===CaCO3↓+H2O
(此反应常用于检验CO2)
一、二氧化碳(CO2)的性质高温
5) CO2+C === 2CO(吸热反应) CO2气体无色液体雪花状固体干冰加压
降温降温压缩101KPa- 78.5C0升华 干 冰 的 形 成2、二氧化碳(CO2)对生活和环境的影响 CO2是一种很重要的气体,CO2在工农业生产生活中有很重要的用途。它的用途由什么决定呢
1、用途:
干冰(固态CO2):用于人工降雨、作制冷剂、灭火等;
CO2(气态):光合作用、灭火、化工产品原料、气体肥料等。 人工降雨灭火工业原料致冷剂温室肥料CO2 的 用 途CO2在自然界的循环1)CO2在自然界中是怎样完成它的的循环的呢??
2)如果CO2含量减少或增多各有什么影响??
3)提供数据介绍CO2含量增高对人体的影响。
探险者进入一个久无人至的山洞考察,要注意什么?
进入菜窖前的“灯火试验”
蜡烛燃烧不旺或者熄灭 辨证看待二氧化碳的利与弊 干冰用于人工降雨
和用作制冷剂空气里二氧化碳含量过
高会使人窒息甚至死亡二氧化碳可做温室肥料大量排放会引起
温室效应二氧化碳可用做灭火剂
干冰灭火剂使用不当
会使人造成冻伤
1、向蔬菜温室大棚里施放适量的二氧化碳,其目的是( ? ) A、使害虫窒息死亡,有效防治病虫害? B、避免发生火灾 C、促进植物的光合作用? D、使温室内的温度稳中有升 C2、检验某无色气体是否是二氧化碳的方法是(? )
A、将气体通入紫色石蕊溶液中??
B、将气体从一个容器倒入另一容器中
C、将点燃的木条伸入集气瓶中??
D、将气体通入澄清的石灰水中
D【巩固练习】3、两支试管中各注入5 mL滴有石蕊试液的蒸馏水,通入二氧化碳气体,然后一支加热,另一支撒入少量的活性炭,其颜色变化为:①红—紫—无②紫—红—紫③紫—红—无④无—红—无;其中正确的是( ) A、①②? B、②④? C、②③ ?D、①③ C4、下列物质的用途中既利用了物质的物理性质,又利用物质的化学性质的是(? )
A、二氧化碳用于灭火?
B、石墨用作电极? C、干冰用于人工降雨?
D、焦炭用于冶金工业 A6.以下的事实或实验中,能证明二氧化碳的密度比空气大的有( ) A、在一定条件下,二氧化碳气体会变成固体; B、?收集满二氧化碳的集气瓶要正放在桌面上 C、?一个两端(均挂有纸袋)平衡的天平,往一端纸袋中倾倒二氧化碳气体,天平向倒入二氧化碳的纸袋一端倾斜; D、? 用二氧化碳气流吹肥皂泡,肥皂泡在空气中下沉。 BCD7. 敞口久置的石灰水表面会“长出”一层“白膜”,该“白膜”其实是 ,其产生 原理是 。 CaCO3CO2+Ca(OH)2=CaCO3↓+H2O8.为了让用石灰浆[Ca(OH)2]抹的墙壁快点干燥,人们常在室内生个炭火盆,这是为什么?为什么开始放炭火盆时,墙壁反而变潮湿了?
第二课时据报道:在短短的两年内,安徽芜湖市大约有五十人死于煤气中毒。请归纳出一氧化碳的物理性质 一氧化碳和二氧化碳一样,都是没有颜色、没有气味的气体。不同的是,一氧化碳的密度比空气的略小。在标准状况下,它的密度为1.250g/L。一氧化碳难溶于水,在通常状况下,1体积的水仅能溶解约0.02体积的一氧化碳。思考你知道煤气的主要成分吗?一氧化碳二、一氧化碳1、一氧化碳的可燃性 (可作燃料)发出蓝色火焰,放热,烧杯壁上的澄清石灰水变浑浊生成 了二氧化碳 特别指出:和其他可燃气体一样,点燃CO之前必须先验纯。若CO不纯,点燃时可能发生爆炸,因CO的爆炸极限是12.5%~74%。煤炉中的化学CO 2 + C 2 CO2CO + O2 2 CO22、一氧化碳有毒现象:血液由深红色变成鲜红色一氧化碳中毒原理:因为CO能跟血液里的血红蛋白结合,使血红蛋白的输氧功能受到破坏,从而导致体内缺氧,产生头痛、昏迷,严重时发生死亡。好香啊!哦嗬!栽了 煤气中毒就是CO中毒。CO剧毒!!使用时必须注意安全。 使用煤炉取暖时应注意通风、排气。在人工煤气中添加具有特殊臭味的物质能帮助人们判断是否发生了煤气泄漏,避免中毒、爆炸事故的发生。小资料想一想:如发生煤气泄漏应当怎么办?3、一氧化碳的还原性CO + Cu O△ CO2 + Cu 结论:CO和木炭一样,能使CuO还原成Cu,同时生成CO2。在该反应中,CO是还原剂,表现出还原性。 一氧化碳的还原性可用于冶金工业。例如:可利用一氧化碳的还原性来炼铁。COCO一氧化碳与氧化铜反应实验实验装置图先通入CO
→澄清石灰水变混浊后加热CO早出晚归,酒精灯迟到早退.CuO黑色粉末逐渐变成红色,澄清石灰水变浑浊现象:分析:实验步骤: ①先通一会儿CO气体; ②点燃酒精灯加热;
③停止加热 ④通一氧化碳直到试管冷却。生成了铜和二氧化碳(CO早出晚归,酒精灯迟到早退。) 赶跑玻璃管内的空气,防止CO不纯而引起试管爆炸。 防止灼热的铜再被氧化成氧化铜。1、为什么实验时要先通一会儿纯净的一氧化碳,后对氧化铜加热?2、为什么氧化铜全部被还原成铜后要先停止加热,继续通一氧化碳直到试管冷却?3、为什么要用气球收集尾气? 为了赶跑玻璃管内的空气,以免因一氧化碳不纯而引起试管爆炸。 为了防止灼热的铜重新被氧化成氧化铜。为了防止尾气污染空气。想一想4、两份质量相同的碳酸钙,一份与足量的盐酸反应,一份充分锻烧,它们所生成的二氧化碳的量是( )
A.与盐酸反应的多 B.高温分解多
C.一样多 D.以上情况都有CCaCO3+2HCl=CaCl2+H2O+CO2↑ 还原性联系主要用途毒性与石灰水反应与水反应 氧化性可燃性水溶性 密度色 态 味物质 CO 和 CO2 的 比 较物理性质化 学 性 质二氧化碳一氧化碳小结学完本课题你应该知道1、二氧化碳不燃烧,也不支持燃烧,并能与水反应。3、一氧化碳能够燃烧,具有还原性和毒性。
2、二氧化碳能使澄清的石灰水变浑浊,这个反应可以用来检验二氧化碳。4、温室效应及防止温室效应增强应采取的措施。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
