课题3金属资源的利用和保护(39张幻灯片)
文档属性
| 名称 | 课题3金属资源的利用和保护(39张幻灯片) |  | |
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-22 14:34:03 | ||
图片预览






文档简介
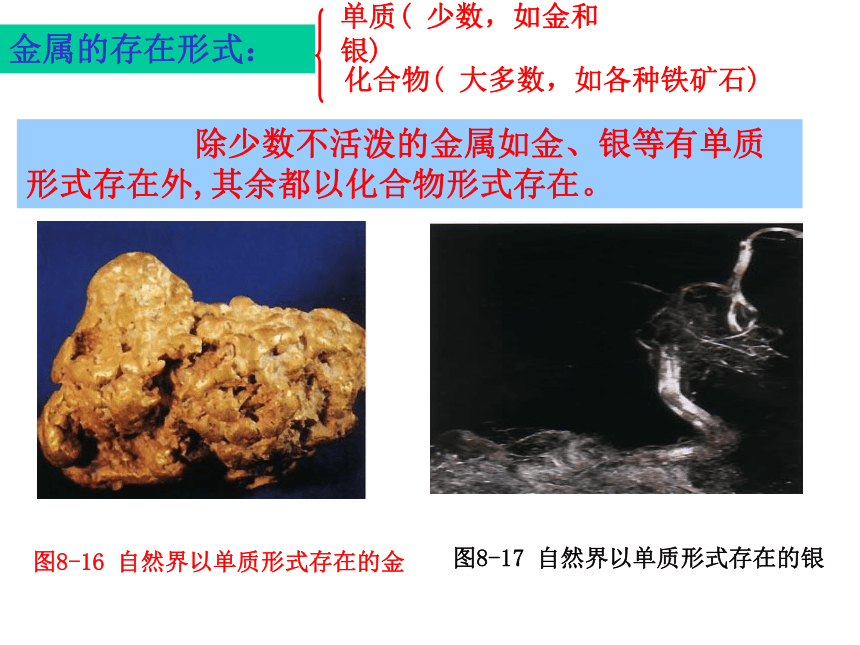
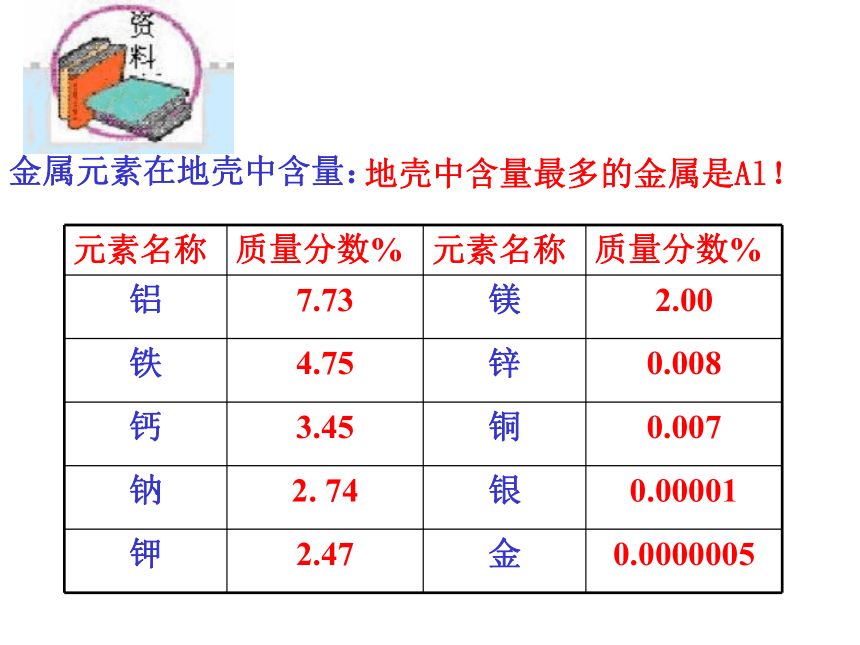
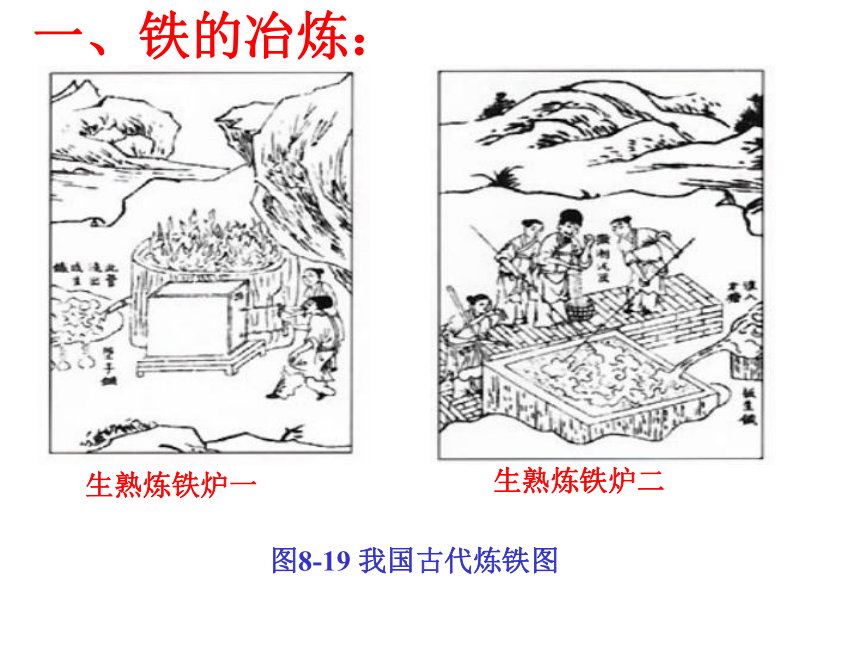
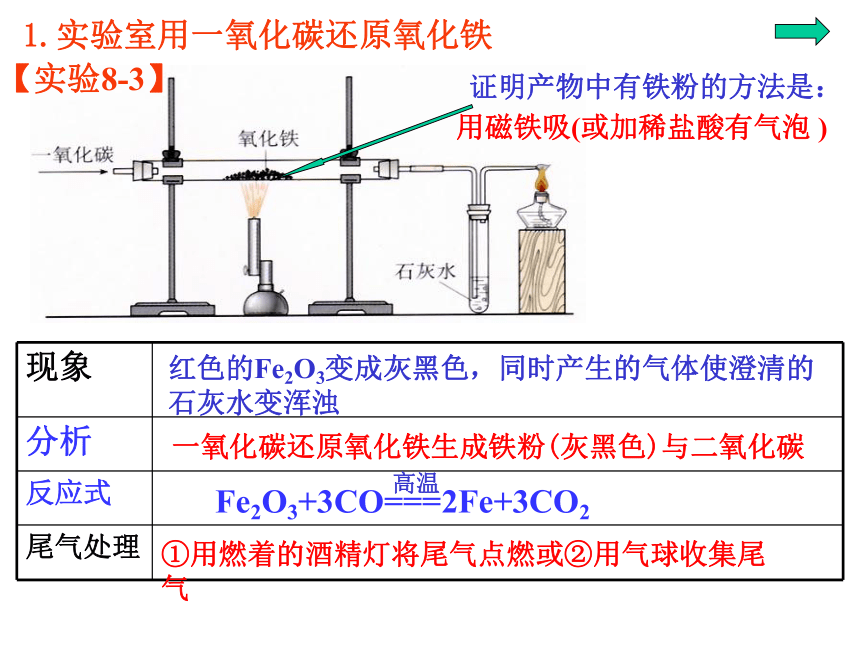
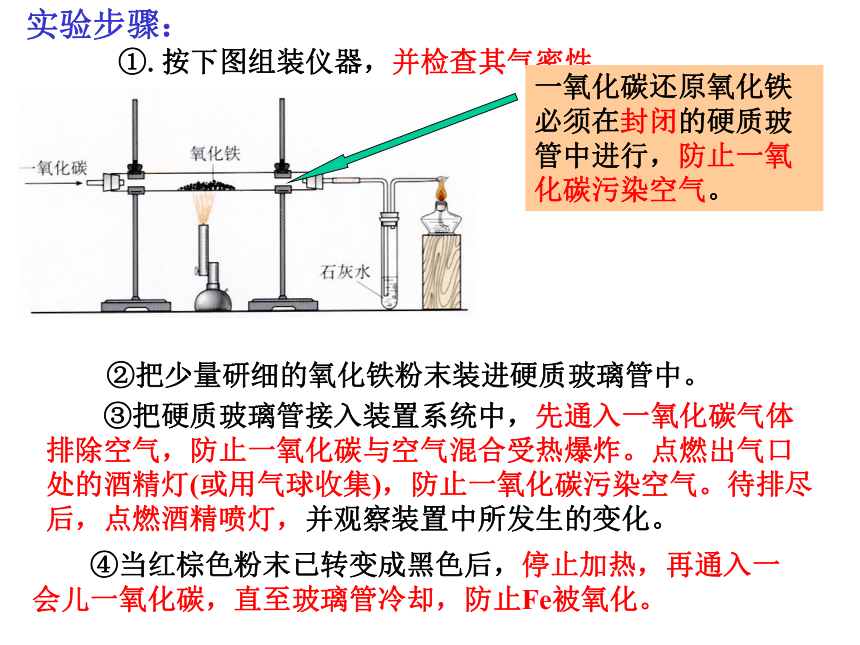
课件39张PPT。第八单元 金属和金属材料课题3 金属资源的利用和保护第一课时P15教师:罗廷芬图8-16 自然界以单质形式存在的金图8-17 自然界以单质形式存在的银 除少数不活泼的金属如金、银等有单质形式存在外,其余都以化合物形式存在。金属的存在形式:单质( 少数,如金和银)化合物( 大多数,如各种铁矿石)赤铁矿(主要成分是Fe2O3 )菱铁矿(主要成分是FeCO3 )图8-18 常见的矿石磁铁矿(主要成分是Fe3O4)图8-18 常见的矿石辉铜矿(主要成分是Cu2S) 黄铜矿(主要成分是CuFeS2) 铝土矿主要成分是Al2O3 地壳中含量最多的金属是Al!金属元素在地壳中含量:一、铁的冶炼:生熟炼铁炉一生熟炼铁炉二?图8-19 我国古代炼铁图图8-20 上海宝山钢铁公司炼铁高炉图8-21 为纪念1996年中国钢产量突破1亿吨而发行的邮票红色的Fe2O3变成灰黑色,同时产生的气体使澄清的石灰水变浑浊一氧化碳还原氧化铁生成铁粉(灰黑色)与二氧化碳1.实验室用一氧化碳还原氧化铁①用燃着的酒精灯将尾气点燃或②用气球收集尾气【实验8-3】实验步骤: ①.按下图组装仪器,并检查其气密性。②把少量研细的氧化铁粉末装进硬质玻璃管中。 ③把硬质玻璃管接入装置系统中,先通入一氧化碳气体排除空气,防止一氧化碳与空气混合受热爆炸。点燃出气口处的酒精灯(或用气球收集),防止一氧化碳污染空气。待排尽后,点燃酒精喷灯,并观察装置中所发生的变化。 ④当红棕色粉末已转变成黑色后,停止加热,再通入一会儿一氧化碳,直至玻璃管冷却,防止Fe被氧化。原料:铁矿石、焦炭、石灰石2.工业炼铁:反应的化学方程式:CO是还原剂;Fe2O3是氧化剂⑴原理:
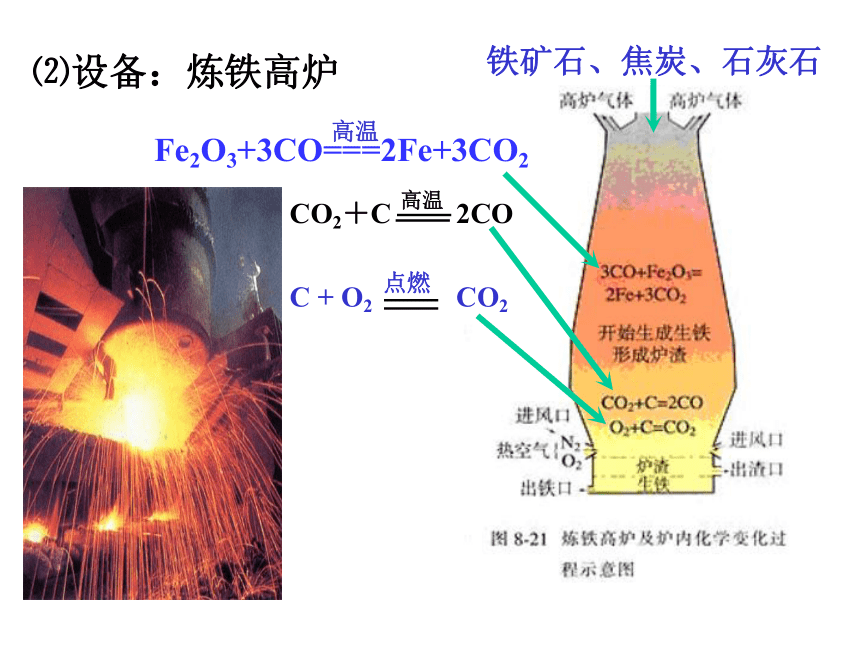
焦炭在高温条件下跟O2反应生成CO, CO作还原剂,在高温条件下把铁矿石中
的铁还原出来。⑵设备:炼铁高炉铁矿石、焦炭、石灰石 在实际生产时,所用的原料或产物一般都含有杂质,在计算用料时和产量时,应考虑到杂质问题。不纯物质、纯物质、纯度之间的关系:列比例时,一定要用纯量。3.含杂质的物质的化学方程式的计算:m(纯) = m(不纯 )×纯度m(不纯) = m(纯) ÷ 纯度例题:用1000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼含铁96%的生铁多少吨?解:1000t赤铁矿石中含氧化铁的质量为1000t ×80%=800t。
设800t氧化铁理论上可以炼出铁的质量为X。160 112800t XX=560t折合含铁96%的生铁的质量为560t÷ 96%=583t (纯化杂)答: 1000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼出含铁96%的生铁为583t。或设800t氧化铁理论上可以炼含铁96%的生铁质量为X。160 112
800t X×96%160 :112=800t :X×96% X=583t (杂化纯)⑵设需含Fe2O3质量分数为85%的赤铁矿石的质量为x。解:⑴生铁中含纯铁:3000t×(1-5%)=2850t.X≈4790t答:⑴该3000 t生铁中含纯铁2850t。
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石为4790t。 1.【06自贡】某炼钢厂日产含杂质5%的生铁3000t,试计算:
⑴该3000 t生铁中含纯铁多少吨?
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多
少吨?(计算结果保留整数)练习:第八单元 金属和金属材料课题3 金属资源的利用和保护第二课时P18~21为什么要保护金属资源?二、金属资源保护保护金属资源的原因:⑴每年大量开采(数以亿吨计)⑵每年大量的金属被腐蚀(相当于年产量的20%~40%)P181.金属的腐蚀和防护人们采取了许多措施,但每年全世界因生锈而损失的钢铁约 占世界年产量的四分之一!如何防锈?——a.在干燥空气中
b.浸没在水中
c.半截浸没在水中铁的生锈过程哪种条件下,铁最易生锈?为什么?不生锈(有水无O2) 不生锈 (有O2无水)在水与空气的交界面最易生锈 ————植物油 a b c请思考:用橡皮塞塞紧管口(有水和O2)铁与空气中的氧气、水蒸气发生化学反应。铁锈的成份很复杂,主要为氧化铁Fe2O3 · XH2O。(Fe2O3 · XH2O很疏松,易吸水,不能阻碍里层的铁继续与氧气、水蒸气反应,如不及时除去,会加快铁制品的生锈,使铁全部被腐蚀。而铝不同,铝与氧气反应生成致密的Al2O3薄膜,覆盖在铝的表面,从而保护里层的铝不再与氧气反应,所以铝耐腐蚀。)铁生锈的条件:⑴要有能够发生反应的物质(Fe、H2O、O2);铁制品锈蚀的条件:⑵反应物要能相互接触;⑶生成物不会对反应起阻碍作用。4Fe+3O2+2XH2O=2Fe2O3 · XH2O (缓慢氧化)防止铁生锈的方法(破坏铁生锈的条件即可):P20表1.保持铁制品表面的洁净和干燥。 2.在铁制品表面涂油、刷漆、搪瓷、镀上 耐腐蚀的金属、烤蓝(即表面生成致密的氧化膜保护层),使铁制品与空气隔绝。 3.制成耐腐蚀的合金,如不锈钢,就是在钢中加入一点镍和铬而制成的合金。⑴三角架:⑵钢线(辐条):⑷链条:刷漆镀一层耐腐蚀的金属涂油等平时要保持自行车的洁净与干燥(或涂油)!自行车防锈措施有哪些?讨论:⑶钢圈:图8-25 据估计一些矿物可供开采的年限2.金属资源保护⑴为什么要保护金属资源?矿物的储量是有限的,而且不能再生。2、怎样保护金属资源呢? ⑴防止金属的腐蚀。⑵金属的回收与利用。 ⑶有计划,合理地开采矿物,严禁不顾国家利益的乱采矿。⑷寻找金属代用品。如以塑代钢。图8-26 金属的回收利用 回收一个铝制的易拉罐比制造一个新的铝制的易拉罐要便宜20%,而且还可以节约金属资源和95%能源。目前世界上有50%以上的铁和90%以上的金得到回收利用。反馈练习 1.在下列情况下,埋在地下的铸铁管道腐蚀最快的是 ( )
A.在潮湿、致密的土壤中
B.在干燥、致密的土壤中
C.在潮湿、疏松的土壤中
D.在干燥、疏松的土壤中 2.某运输用铁船,在水中行驶,最易生锈的部位是( )CBA.水面上的船头部分
B.水面附近的船体部分
C.水面下的船底部分
D.各部分都一样速度生锈 3.日常生活中的一些铁制品经常会被锈蚀。
下列做法中不能起防锈作用的是( )
①在铁制品表面镀锌
②在铁制品表面涂油脂
③保留铁件表面的铁锈作保护层
④在铁器表面刷油漆
⑤自行车脏了用清水冲洗
⑥用废酸液冲洗铁制污水管道
⑦切完咸菜后,尽快将菜刀洗净擦干
A.②⑤ B.③⑤⑥
C.①③⑦ D.②⑥⑦ B 4.全世界每年因生锈损失的钢铁约占世界
钢铁年产量的1/4。某学生想探究铁生锈的条件,他将
干净的铁钉分别同时入放A、B、C三支试管中进行研究。
⑴请你帮助该学生完成下列实验设计的内容:加热烘干试管,小心放入铁钉,塞上塞子 探究铁在有水而无空气
(氧气)时的生锈情况小心放入铁钉,注入蒸馏水,使铁钉部分浸入水中 ⑵一周后,编号为________的试管中的铁钉最易生锈。
⑶用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在南方比安装在北方更易生锈,其原因是
___________________________________。C南方比北方天气潮湿,铁更易生锈A B C铁在干燥空气中铁在有水而无空气(氧气)时铁在有空气和水时4.某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。实验数据如下表:
请你认真分析数据,回答下列问题:
⑴哪位同学所取用的稀硫酸与铁样品恰好完全反应;
⑵计算样品中铁的质量分数;
⑶若生产1000 t这种纯度的铁,至少需要含氧化铁(Fe2O3)80%的赤铁矿多少吨? 改正:(烧杯的质量为25.4g;计算结果精确到0.1%) 解:⑴分析表中数据可知,甲、乙、丙三人的实验生成气的质量都是0.3g(如甲为200g+9g-208.7g=0.3g),即各人的实验中都有一种反应物完全反应。由甲、乙数据可知,9g铁样品中的铁完全反应,甲中的酸过量。由乙、丙数据可知,(150g- 25.4g)=124.6g的稀硫酸中的H2SO4完全反应,丙中的金属过量。综合分析可知乙同学所取用的稀硫酸与铁样品恰好完全反应。解:⑵乙反应生成氢气的质量为150g+9g-158.7g=0.3g。
设Fe的质量为X。
Fe + H2SO4 = FeSO4 + H2↑
2
X 0.3g⑵计算样品中铁的质量分数;答:样品中铁的质量分数为93.3%。⑶若生产1000 t这种纯度的铁,至少需要含氧化铁(Fe2O3)80%的赤铁矿多少吨?解:⑶需要含氧化铁80%的赤铁矿的质量为Y。
1000 t这种纯度的铁含纯铁的质量为1000t×93.3%=930t。160 112
Y×80% 930t160:112=Y×80%: 930t Y=1666.1t答:生产1000 t这种纯度的铁,至少需要含氧化铁(Fe2O3)80%的赤铁矿为1666.1t。 1.把铁矿石冶炼成铁是一个复杂的过程,其主要反应原理是在高温条件下CO作还原剂,夺取铁矿石里的氧,将铁还原出来。 2.在实际生产时,所用的原料或产物一般都含有杂质,在计算用料时和产量时,应考虑到杂质问题。 3.铁生锈的条件是铁与空气中的氧气、水(或水蒸气)直接接触,如果隔绝了空气和水,就能在一定程度上防止钢铁生锈。在铁表面涂油、刷漆、镀上耐磨和 耐腐蚀的铬及制造耐腐蚀的合金,如不锈钢等,就能防止钢铁生锈。 4. 保护金属资源的有效途径是防止金属的腐蚀、回收与利用废旧金属、合理有效地地开采矿物,以及寻找金属代用品等。列比例时,一定要用纯量。m(纯) = m(不纯 )×纯度4Fe+3O2+2XH2O=2Fe2O3 · XH2O本单元小结:一、金属和金属材料金属与非金属物理性质的比较: 2.金属材料包括纯金属和合金。把两种或两种以上的金属熔合在一起,或者把金属和非金属熔合在一起,就可以得到具有金属特性的合金 。由于合金的很多性能一般比组成它们的纯金属更好,因此,在实际中大量使用的金属材料是合金。二、金属的化学性质 1.很多金属都能与氧气、盐酸和稀硫酸等起反应,但反应的难易和剧烈程度不同。)以Fe、Al、Cu为例,写出它与氧气、稀硫酸反应的化学方程式。 ,
。 Fe?+?H2SO4?=?FeSO4?+?H2↑2Al?+3H2SO4?=?Al2 (SO4) 3?+3H2↑Cu?+?H2SO4→不反应 2.由一种单质 和一种 化合物反应,生成另一种单质 和另一种 化合物的反应叫做置换反应。例如 如果用A+B → C来表示化合反应的话,请用相似的方法来表示分解反应和置换反应。置换反应:A +BC → B + AC分解反应:AB→A + B ,
。 Zn?+?H2SO4?=ZnSO4?+?H2↑Fe?+?CuSO4?=?FeSO4?+?Cu3.常见金属活动性顺序如下: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性,由强逐渐减弱举例说明金属活动性顺序可以给你哪些判断的依据: 。
。 ⑴只有排在H前面的才能置换酸中的氢。 ⑵只有排在前面的金属才能把排在后面的金属从它们的化合物的溶液中置换出来。(K Ca Na 特殊、反应复杂)三、金属资源保护1.把铁矿石冶炼成铁的主要反应原理是:在实际生产时,还会遇到有关杂质的计算问题。2.铁锈蚀的主要条件以及防止铁锈蚀的主要措施是: 铁锈蚀的主要条件是铁与空气中的氧气、水蒸气等发生化学反应。防止铁锈蚀的主要措施是在铁表面涂油、刷漆、镀上耐磨和 耐腐蚀的铬及制造耐腐蚀的合金,如不锈钢等,就能防止钢铁生锈。 防止金属的腐蚀、回收与利用废旧金属、合理有效地地开采矿物,以及寻找金属代用品等。4. 保护金属资源的有效途径是:列比例时,一定要用纯量。m(纯) = m(不纯 )×纯度
焦炭在高温条件下跟O2反应生成CO, CO作还原剂,在高温条件下把铁矿石中
的铁还原出来。⑵设备:炼铁高炉铁矿石、焦炭、石灰石 在实际生产时,所用的原料或产物一般都含有杂质,在计算用料时和产量时,应考虑到杂质问题。不纯物质、纯物质、纯度之间的关系:列比例时,一定要用纯量。3.含杂质的物质的化学方程式的计算:m(纯) = m(不纯 )×纯度m(不纯) = m(纯) ÷ 纯度例题:用1000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼含铁96%的生铁多少吨?解:1000t赤铁矿石中含氧化铁的质量为1000t ×80%=800t。
设800t氧化铁理论上可以炼出铁的质量为X。160 112800t XX=560t折合含铁96%的生铁的质量为560t÷ 96%=583t (纯化杂)答: 1000t含氧化铁(Fe2O3) 80%的赤铁矿石,理论上可炼出含铁96%的生铁为583t。或设800t氧化铁理论上可以炼含铁96%的生铁质量为X。160 112
800t X×96%160 :112=800t :X×96% X=583t (杂化纯)⑵设需含Fe2O3质量分数为85%的赤铁矿石的质量为x。解:⑴生铁中含纯铁:3000t×(1-5%)=2850t.X≈4790t答:⑴该3000 t生铁中含纯铁2850t。
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石为4790t。 1.【06自贡】某炼钢厂日产含杂质5%的生铁3000t,试计算:
⑴该3000 t生铁中含纯铁多少吨?
⑵该炼钢厂每天需含Fe2O3质量分数为85%的赤铁矿石多
少吨?(计算结果保留整数)练习:第八单元 金属和金属材料课题3 金属资源的利用和保护第二课时P18~21为什么要保护金属资源?二、金属资源保护保护金属资源的原因:⑴每年大量开采(数以亿吨计)⑵每年大量的金属被腐蚀(相当于年产量的20%~40%)P181.金属的腐蚀和防护人们采取了许多措施,但每年全世界因生锈而损失的钢铁约 占世界年产量的四分之一!如何防锈?——a.在干燥空气中
b.浸没在水中
c.半截浸没在水中铁的生锈过程哪种条件下,铁最易生锈?为什么?不生锈(有水无O2) 不生锈 (有O2无水)在水与空气的交界面最易生锈 ————植物油 a b c请思考:用橡皮塞塞紧管口(有水和O2)铁与空气中的氧气、水蒸气发生化学反应。铁锈的成份很复杂,主要为氧化铁Fe2O3 · XH2O。(Fe2O3 · XH2O很疏松,易吸水,不能阻碍里层的铁继续与氧气、水蒸气反应,如不及时除去,会加快铁制品的生锈,使铁全部被腐蚀。而铝不同,铝与氧气反应生成致密的Al2O3薄膜,覆盖在铝的表面,从而保护里层的铝不再与氧气反应,所以铝耐腐蚀。)铁生锈的条件:⑴要有能够发生反应的物质(Fe、H2O、O2);铁制品锈蚀的条件:⑵反应物要能相互接触;⑶生成物不会对反应起阻碍作用。4Fe+3O2+2XH2O=2Fe2O3 · XH2O (缓慢氧化)防止铁生锈的方法(破坏铁生锈的条件即可):P20表1.保持铁制品表面的洁净和干燥。 2.在铁制品表面涂油、刷漆、搪瓷、镀上 耐腐蚀的金属、烤蓝(即表面生成致密的氧化膜保护层),使铁制品与空气隔绝。 3.制成耐腐蚀的合金,如不锈钢,就是在钢中加入一点镍和铬而制成的合金。⑴三角架:⑵钢线(辐条):⑷链条:刷漆镀一层耐腐蚀的金属涂油等平时要保持自行车的洁净与干燥(或涂油)!自行车防锈措施有哪些?讨论:⑶钢圈:图8-25 据估计一些矿物可供开采的年限2.金属资源保护⑴为什么要保护金属资源?矿物的储量是有限的,而且不能再生。2、怎样保护金属资源呢? ⑴防止金属的腐蚀。⑵金属的回收与利用。 ⑶有计划,合理地开采矿物,严禁不顾国家利益的乱采矿。⑷寻找金属代用品。如以塑代钢。图8-26 金属的回收利用 回收一个铝制的易拉罐比制造一个新的铝制的易拉罐要便宜20%,而且还可以节约金属资源和95%能源。目前世界上有50%以上的铁和90%以上的金得到回收利用。反馈练习 1.在下列情况下,埋在地下的铸铁管道腐蚀最快的是 ( )
A.在潮湿、致密的土壤中
B.在干燥、致密的土壤中
C.在潮湿、疏松的土壤中
D.在干燥、疏松的土壤中 2.某运输用铁船,在水中行驶,最易生锈的部位是( )CBA.水面上的船头部分
B.水面附近的船体部分
C.水面下的船底部分
D.各部分都一样速度生锈 3.日常生活中的一些铁制品经常会被锈蚀。
下列做法中不能起防锈作用的是( )
①在铁制品表面镀锌
②在铁制品表面涂油脂
③保留铁件表面的铁锈作保护层
④在铁器表面刷油漆
⑤自行车脏了用清水冲洗
⑥用废酸液冲洗铁制污水管道
⑦切完咸菜后,尽快将菜刀洗净擦干
A.②⑤ B.③⑤⑥
C.①③⑦ D.②⑥⑦ B 4.全世界每年因生锈损失的钢铁约占世界
钢铁年产量的1/4。某学生想探究铁生锈的条件,他将
干净的铁钉分别同时入放A、B、C三支试管中进行研究。
⑴请你帮助该学生完成下列实验设计的内容:加热烘干试管,小心放入铁钉,塞上塞子 探究铁在有水而无空气
(氧气)时的生锈情况小心放入铁钉,注入蒸馏水,使铁钉部分浸入水中 ⑵一周后,编号为________的试管中的铁钉最易生锈。
⑶用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在南方比安装在北方更易生锈,其原因是
___________________________________。C南方比北方天气潮湿,铁更易生锈A B C铁在干燥空气中铁在有水而无空气(氧气)时铁在有空气和水时4.某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。实验数据如下表:
请你认真分析数据,回答下列问题:
⑴哪位同学所取用的稀硫酸与铁样品恰好完全反应;
⑵计算样品中铁的质量分数;
⑶若生产1000 t这种纯度的铁,至少需要含氧化铁(Fe2O3)80%的赤铁矿多少吨? 改正:(烧杯的质量为25.4g;计算结果精确到0.1%) 解:⑴分析表中数据可知,甲、乙、丙三人的实验生成气的质量都是0.3g(如甲为200g+9g-208.7g=0.3g),即各人的实验中都有一种反应物完全反应。由甲、乙数据可知,9g铁样品中的铁完全反应,甲中的酸过量。由乙、丙数据可知,(150g- 25.4g)=124.6g的稀硫酸中的H2SO4完全反应,丙中的金属过量。综合分析可知乙同学所取用的稀硫酸与铁样品恰好完全反应。解:⑵乙反应生成氢气的质量为150g+9g-158.7g=0.3g。
设Fe的质量为X。
Fe + H2SO4 = FeSO4 + H2↑
2
X 0.3g⑵计算样品中铁的质量分数;答:样品中铁的质量分数为93.3%。⑶若生产1000 t这种纯度的铁,至少需要含氧化铁(Fe2O3)80%的赤铁矿多少吨?解:⑶需要含氧化铁80%的赤铁矿的质量为Y。
1000 t这种纯度的铁含纯铁的质量为1000t×93.3%=930t。160 112
Y×80% 930t160:112=Y×80%: 930t Y=1666.1t答:生产1000 t这种纯度的铁,至少需要含氧化铁(Fe2O3)80%的赤铁矿为1666.1t。 1.把铁矿石冶炼成铁是一个复杂的过程,其主要反应原理是在高温条件下CO作还原剂,夺取铁矿石里的氧,将铁还原出来。 2.在实际生产时,所用的原料或产物一般都含有杂质,在计算用料时和产量时,应考虑到杂质问题。 3.铁生锈的条件是铁与空气中的氧气、水(或水蒸气)直接接触,如果隔绝了空气和水,就能在一定程度上防止钢铁生锈。在铁表面涂油、刷漆、镀上耐磨和 耐腐蚀的铬及制造耐腐蚀的合金,如不锈钢等,就能防止钢铁生锈。 4. 保护金属资源的有效途径是防止金属的腐蚀、回收与利用废旧金属、合理有效地地开采矿物,以及寻找金属代用品等。列比例时,一定要用纯量。m(纯) = m(不纯 )×纯度4Fe+3O2+2XH2O=2Fe2O3 · XH2O本单元小结:一、金属和金属材料金属与非金属物理性质的比较: 2.金属材料包括纯金属和合金。把两种或两种以上的金属熔合在一起,或者把金属和非金属熔合在一起,就可以得到具有金属特性的合金 。由于合金的很多性能一般比组成它们的纯金属更好,因此,在实际中大量使用的金属材料是合金。二、金属的化学性质 1.很多金属都能与氧气、盐酸和稀硫酸等起反应,但反应的难易和剧烈程度不同。)以Fe、Al、Cu为例,写出它与氧气、稀硫酸反应的化学方程式。 ,
。 Fe?+?H2SO4?=?FeSO4?+?H2↑2Al?+3H2SO4?=?Al2 (SO4) 3?+3H2↑Cu?+?H2SO4→不反应 2.由一种单质 和一种 化合物反应,生成另一种单质 和另一种 化合物的反应叫做置换反应。例如 如果用A+B → C来表示化合反应的话,请用相似的方法来表示分解反应和置换反应。置换反应:A +BC → B + AC分解反应:AB→A + B ,
。 Zn?+?H2SO4?=ZnSO4?+?H2↑Fe?+?CuSO4?=?FeSO4?+?Cu3.常见金属活动性顺序如下: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性,由强逐渐减弱举例说明金属活动性顺序可以给你哪些判断的依据: 。
。 ⑴只有排在H前面的才能置换酸中的氢。 ⑵只有排在前面的金属才能把排在后面的金属从它们的化合物的溶液中置换出来。(K Ca Na 特殊、反应复杂)三、金属资源保护1.把铁矿石冶炼成铁的主要反应原理是:在实际生产时,还会遇到有关杂质的计算问题。2.铁锈蚀的主要条件以及防止铁锈蚀的主要措施是: 铁锈蚀的主要条件是铁与空气中的氧气、水蒸气等发生化学反应。防止铁锈蚀的主要措施是在铁表面涂油、刷漆、镀上耐磨和 耐腐蚀的铬及制造耐腐蚀的合金,如不锈钢等,就能防止钢铁生锈。 防止金属的腐蚀、回收与利用废旧金属、合理有效地地开采矿物,以及寻找金属代用品等。4. 保护金属资源的有效途径是:列比例时,一定要用纯量。m(纯) = m(不纯 )×纯度
同课章节目录
