江苏省连云港市灌云县四队中学2016-2017学年高二(上)期中化学试卷(解析版)
文档属性
| 名称 | 江苏省连云港市灌云县四队中学2016-2017学年高二(上)期中化学试卷(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 214.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-12-26 19:42:58 | ||
图片预览




文档简介
2016-2017学年江苏省连云港市灌云县四队中学高二(上)期中化学试卷
一、单项选择题:在每题的4个选项中,只有1个选项符合要求(本部分23题,每题3分,共69分)
1.新能源的开发利用是人类社会可持续发展的重要课题.下列属于新能源的是( )
A.氢气
B.煤炭
C.天然气
D.石油
2.下列物质中,属于盐类的是( )
A.Na2O
B.CaCO3
C.Ca(OH)2
D.C2H12O6
3.下列变化属于物理变化的是( )
A.食醋除水垢
B.食物腐烂
C.在高温下用黏土烧制陶瓷
D.分液法分离四氯化碳与水
4.下列物质中既含有共价键又含离子键的化合物是( )
A.MgCl2
B.NaOH
C.O2
D.C6H6
5.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
A.小苏打﹣﹣Na2CO3
B.生石灰﹣﹣Ca
(OH)2
C.甲醛﹣﹣CH3OH
D.烧碱﹣﹣NaOH
6.反应2Al+Fe2O3Al2O3+2Fe可用于铁轨的焊接,该反应属于( )
A.化合反应
B.复分解反应
C.置换反应
D.分解反应
7.下列物质属于纯净物的是( )
A.冰水混合物
B.玻璃
C.空气
D.漂白粉
8.
I是一种人工放射性核素.下列关于I的说法正确的是( )
A.质量数为78
B.质子数为53
C.核外电子数为131
D.中子数为53
9.下列关于乙酸的说法正确的是( )
A.难溶于水
B.是一种无色无味的液体
C.能发生酯化反应
D.酸性比碳酸弱
10.下列物质属于天然有机高分子化合物的是( )
A.淀粉
B.天然气
C.聚乙烯
D.葡萄糖
11.下列有关实验的说法正确的是( )
A.加热后溶液颜色变为无色
B.配制100
mL
0.10
mol L﹣1NaCl溶液
C.实验室用该装置制取少量蒸馏水
D.称量25
g
NaOH
12.下列表示物质结构的化学用语或模型正确的是( )
A.硫酸的电离方程式:H2SO4=H2++SO42﹣
B.CO2的电子式:
C.Cl﹣离子的结构示意图:
D.苯的结构简式:C6H6
13.在无色酸性溶液中能大量共存的是( )
A.Cu2+、Mg2+、SO42﹣、NO3﹣
B.K+、Mg2+、SO42+、Cl﹣
C.Ag+、Na+、NO3﹣、Cl﹣
D.NH4+、Ba2+、NO3﹣、OH﹣
14.下列离子方程式书写正确的是( )
A.铜跟浓硝酸反应:3Cu2+
8H++2
NO3﹣═3Cu2++2NO↑+4H2O
B.大理石与醋酸反应:2H++CO32﹣═CO2↑+H2O
C.金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
D.钠与水反应:2Na+2H2O═2Na++2OH﹣+H2↑
15.下列有关物质应用的叙述中,正确的是( )
A.氢氧化钠可用于治疗胃酸过多
B.福尔马林可以用于是食品防腐剂
C.水玻璃浸泡过的木材既能防腐又能耐火
D.Si用于制造光导纤维
16.下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是( )
编号
金属(粉末状)
物质的量
酸的浓度
酸的体积
反应温度
A
Mg
0.1mol
6mol/L硝酸
10mL
60℃
B
Mg
0.1mol
3mol/L盐酸
10mL
30℃
C
Fe
0.1mol
3mol/L盐酸
10mL
60℃
D
Mg
0.1mol
3mol/L盐酸
10mL
60℃
A.A
B.B
C.C
D.D
17.汽车尾气处理装置中发生如下反应,2NO+2CO═N2+2CO2,下列说法正确的是( )
A.NO是氧化剂
B.CO发生还原反应
C.NO失去电子
D.该反应是复分解反应
18.关于化学反应与能量的说法正确的是( )
A.镁条溶于盐酸是吸热反应
B.中和反应是吸热反应
C.铝热反应属于吸热反应
D.碳酸钙分解是吸热反应
19.下列实验方法不正确的是( )
A.用澄清石灰水鉴别Na2CO3和NaHCO3溶液
B.用焰色反应鉴别NaCl和KCl
C.用丁达尔效应鉴别硫酸钠溶液和硅酸胶体
D.用排水集气法收集NO
20.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.18g
H2O含有的氢原子数目为NA
B.标准状况下,22.4L
CO2含有的分子数目为NA
C.1L1mol L﹣1Na2SO4溶液中含有钠离子数目为NA
D.1mol
H2在Cl2中完全燃烧转移的电子数目为NA
21.将锌片和铜片按图示方式插入稀硫酸中,下列结论正确的是( )
A.将电能转换为化学能
B.电子由铜片流出
C.锌片时负极
D.铜片逐渐被腐蚀
22.短周期元素A、B、C、D的原子序数依次增大,A的原子半径在所有原子中最小,B位于第VA族,A和C同主族,D原子最外层电子数与电子层数相等.下列叙述正确的是( )
A.原子半径:C<B
B.元素A、C的氧化物均为共价化合物
C.金属性:D>C
D.元素B、C、D的最高价氧化物对应水化物能相互反应
23.一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V
L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO
12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A.9.0
L
B.13.5
L
C.15.7
L
D.16.8
L
二、非选择题(本部分3题,共31分)《化学与生活》
24.材料是经济和生态文明建设的重要物质基础.
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是 .
②飞机轮胎属于橡胶制品,橡胶属于 (填字母).
A.金属材料
B.有机高分子材料
C.无机非金属材料
③轮船是重要的交通工具.为了保护钢板那不受腐蚀,在船尾钢板上镶嵌的金属块是
(填字母).
A.
铅块
B.锡块
C.锌块
④食品塑料袋要求经济又无毒,这种塑料的原料通常是 (写名称).
⑤光导纤维在信息工程中的应用,是人们可以坐在家里通过信息网路获取信息,联络亲友.光导纤维的主要成分是 (填化学式).
25.防治环境污染,改善生态环境已成为全球共识.
①下列各图中表示我国节能标志的是 (填字母).
②煤矿有时会发生瓦斯爆炸事故,瓦斯的主要成分与天然气相同,写出瓦斯爆炸的化学方程式: .
③环境污染已对人类造成重大威胁.下列名词与环境污染无关的是
A.潮汐B.温室效应C.臭氧层空洞D.工业废水
④减少室内空气污染,下列措施正确的是
A、在室内种植芦荟、常青藤等绿色植物
B、随意对室内装饰,装饰材料可以随意用
C、紧闭门窗
D、室内有异味时,要即时多喷洒香水.
26.保证食品安全、保持营养均衡,是保障人体健康的基础.
①人体所需的元素从食物中摄取不足时,可通过食品添加剂和保健药剂以补充.如制成补钙、补锌的保健药剂或制成加碘食盐等,来增加对这些元素的摄入量.从上面提到的补钙剂、补锌剂和加碘食盐中的钙、锌、碘是指 (填选项字母).
A.单质
B.原子
C.元素
D.离子
②被霉菌污染的粮食会产生黄曲霉素(C17H12O6),人类的特殊基因在黄曲霉素作用下会发生突变,继而诱发癌症.黄曲霉素属于 (填“无机物”或“有机物”),
③由于化学物质使用不当,给人印象不佳的化学名词越来越多:苏丹红、三聚氰胺、….下列做法不会危及人体健康的是 (填字母).
A.用甲醛浸泡海鲜产品
B.用霉变花生压榨食用油
C.用小苏打做糕点的疏松剂
D.用工业盐亚硝酸钠腌渍鱼肉
④碳酸氢钠是常用的疏松剂,它们在加热条件下产生气体,使食品变得疏松.请写出相关反应的化学方程式 .
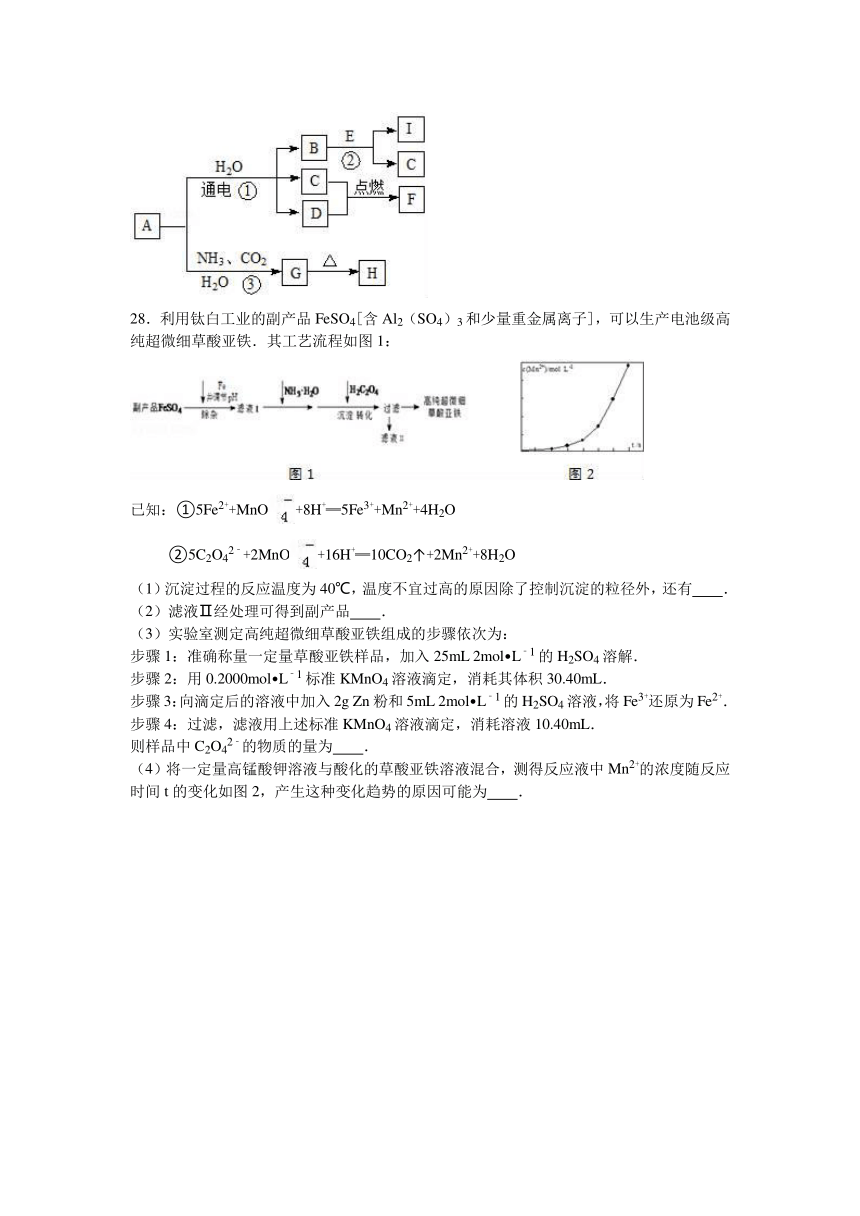
27.中学化学中的一些常见物质有如图转化关系(部分产物未给出).其中A、H的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属.
回答下列问题.
(1)D的电子式为 .
(2)H的化学式为 .
(3)写出反应①的化学方程式 .
(4)写出反应②的离子方程式 .
28.利用钛白工业的副产品FeSO4[含Al2(SO4)3和少量重金属离子],可以生产电池级高纯超微细草酸亚铁.其工艺流程如图1:
已知:①5Fe2++MnO+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 .
(2)滤液Ⅱ经处理可得到副产品 .
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL
2mol L﹣1的H2SO4溶解.
步骤2:用0.2000mol L﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g
Zn粉和5mL
2mol L﹣1的H2SO4溶液,将Fe3+还原为Fe2+.
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为 .
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为 .
2016-2017学年江苏省连云港市灌云县四队中学高二(上)期中化学试卷
参考答案与试题解析
一、单项选择题:在每题的4个选项中,只有1个选项符合要求(本部分23题,每题3分,共69分)
1.新能源的开发利用是人类社会可持续发展的重要课题.下列属于新能源的是( )
A.氢气
B.煤炭
C.天然气
D.石油
【考点】清洁能源.
【分析】新能源包括太阳能、核能、风能、氢能等;煤、石油、天然气是化石燃料.
【解答】解:新能源包括太阳能、核能、风能、氢能等;而煤、石油、天然气是化石燃料,属于常规能源,
故选A.
2.下列物质中,属于盐类的是( )
A.Na2O
B.CaCO3
C.Ca(OH)2
D.C2H12O6
【考点】酸、碱、盐、氧化物的概念及其相互联系.
【分析】阳离子是金属离子或铵根离子、阴离子是酸根离子的化合物为盐,据此分析.
【解答】解:A、氧化钠由两种元素构成、其中一种为氧元素,故为氧化物,不是盐,故A错误;
B、碳酸钙的阳离子是金属离子,阴离子为酸根离子,故为盐,故B正确;
C、氢氧化钙电离出的阴离子全部为氢氧根,故为碱,故C错误;
D、C6H12O6是有机物,不是盐,故D错误.
故选B.
3.下列变化属于物理变化的是( )
A.食醋除水垢
B.食物腐烂
C.在高温下用黏土烧制陶瓷
D.分液法分离四氯化碳与水
【考点】物理变化与化学变化的区别与联系.
【分析】物理变化是指变化过程中无新物质生成的变化,化学变化是指有新物质生成的变化,化学变化和物理变化的本质区别是判断过程中是否生成新的物质.
【解答】解:A.食醋除水垢是利用醋酸酸性大于碳酸,醋酸和碳酸钙反应生成溶于水的醋酸钙除去,发生了化学反应,故A错误;
B.食物腐烂是食物发生了氧化反应生成了新的物质,属于化学变化,故B错误;
C.在高温下黏土烧制陶瓷有新物质生成,属于化学变化,故C错误;
D.分液法分离四氯化碳与水是利用互不相溶的性质分离混合物,过程中无新物质生成,属于物理变化,故D正确;
故选D.
4.下列物质中既含有共价键又含离子键的化合物是( )
A.MgCl2
B.NaOH
C.O2
D.C6H6
【考点】离子化合物的结构特征与性质.
【分析】活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间存在离子键,据此分析解答.
【解答】解:A.氯化镁中镁离子和氯离子之间只存在离子键,故A错误;
B.NaOH中钠离子和氢氧根离子之间存在离子键、O﹣H原子之间存在共价键,故B正确;
C.氧气分子中O﹣O原子之间只存在共价键,故C错误;
D.苯分子中C﹣C、C﹣H原子之间只存在共价键,故D错误;
故选B.
5.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
A.小苏打﹣﹣Na2CO3
B.生石灰﹣﹣Ca
(OH)2
C.甲醛﹣﹣CH3OH
D.烧碱﹣﹣NaOH
【考点】常见元素的名称、符号、离子符号.
【分析】A、小苏打是NaHCO3;
B、生石灰是CaO;
C、甲醛的化学式为HCHO;
D、烧碱为NaOH.
【解答】解:A、小苏打是NaHCO3,Na2CO3俗称苏打,故A错误;
B、生石灰是CaO,Ca
(OH)2俗称熟石灰,故B错误;
C、甲醛的化学式为HCHO,CH3OH为甲醇,俗称蚁醇,故C错误;
D、烧碱为NaOH,又俗称苛性钠和火碱,故D正确.
故选D.
6.反应2Al+Fe2O3Al2O3+2Fe可用于铁轨的焊接,该反应属于( )
A.化合反应
B.复分解反应
C.置换反应
D.分解反应
【考点】铝的化学性质.
【分析】由2Al+Fe2O3Al2O3+2Fe可知,为铝热反应,为单质与化合物反应生成新单质、化合物的反应,以此来解答.
【解答】解:A.生成物不是一种,不属于化合反应,故A不选;
B.反应物、生成物均有单质,不是复分解反应,故B不选;
C.为单质与化合物反应生成新单质、化合物的反应,属于置换反应,故C选;
D.反应物不是一种,不属于分解反应,故D不选;
故选C.
7.下列物质属于纯净物的是( )
A.冰水混合物
B.玻璃
C.空气
D.漂白粉
【考点】混合物和纯净物.
【分析】纯净物是同种物质组成的物质,不同物质组成的为混合物,结合物质组成分析判断.
【解答】解:A.冰水混合物为一种组成的纯净物,故A正确;
B.玻璃是硅酸钠、硅酸钙和二氧化硅组成的混合物,故B错误;
C.空气中含有多种物质组成的混合物,故C错误;
D.漂白粉是氯化钙和次氯酸钙的混合物,故D错误;
故选A.
8.
I是一种人工放射性核素.下列关于I的说法正确的是( )
A.质量数为78
B.质子数为53
C.核外电子数为131
D.中子数为53
【考点】核素.
【分析】原子结构中,核电荷数=质子数=核外电子数,质量数=质子数+中子数,原子符号左上角为质量数,左下角为质子数.
【解答】解:13153I原子中质量数为131,质子数为53,核外电子数为53,中子数=131﹣53=78,故选B.
9.下列关于乙酸的说法正确的是( )
A.难溶于水
B.是一种无色无味的液体
C.能发生酯化反应
D.酸性比碳酸弱
【考点】乙酸的化学性质.
【分析】A.乙酸易溶于水;
B.乙酸是一种无色有刺激性气味的液体;
C.乙酸能与乙醇发生酯化反应生成乙酸乙酯;
D.乙酸酸性比碳酸强.
【解答】解:A.乙酸易溶于水,故A错误;
B.乙酸是一种无色有刺激性气味的液体,故B错误;
C.乙酸能与乙醇发生酯化反应生成乙酸乙酯,故C正确;
D.乙酸是弱酸,但酸性比碳酸强,故D错误;
故选C.
10.下列物质属于天然有机高分子化合物的是( )
A.淀粉
B.天然气
C.聚乙烯
D.葡萄糖
【考点】有机高分子化合物的结构和性质.
【分析】相对分子质量在10000以上的有机化合物为高分子化合物,高分子化合物分为天然高分子化合物、合成高分子化合物,淀粉、纤维素、蛋白质为天然高分子化合物.
【解答】解:A.淀粉的相对分子质量在10000以上,天然存在,为天然有机高分子化合物,故A选;
B.天然气为混合物,主要成分为甲烷,甲烷相对分子质量为16,为小分子,故B不选;
C.聚乙烯可由乙烯发生加聚反应生成,为合成高分子,故C不选;
D.葡萄糖的分子式为C6H12O6,相对分子质量在10000以下,不是高分子,故D不选;
故选A.
11.下列有关实验的说法正确的是( )
A.加热后溶液颜色变为无色
B.配制100
mL
0.10
mol L﹣1NaCl溶液
C.实验室用该装置制取少量蒸馏水
D.称量25
g
NaOH
【考点】化学实验方案的评价.
【分析】A.二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,受热易复原;
B.配制一定物质的量浓度溶液时,转移溶液需要用玻璃棒引流;
C.蒸馏时,温度计测量馏分温度,冷凝管中水应该采用“下进上出”原则;
D.用托盘天平称量药品时应该采取“左物右砝”原则,且具有腐蚀性药品应该放置在烧杯中称量.
【解答】解:A.二氧化硫的漂白性不稳定,加热时易复原,所以加热二氧化硫漂白后的溶液时,溶液由无色变为红色,故A错误;
B.配制一定物质的量浓度溶液时,转移溶液需要用玻璃棒引流,否则易溅出溶液导致配制溶液浓度偏低,故B正确;
C.用蒸馏法制取蒸馏水时,如果馏分急剧冷却会炸裂冷凝管,为防止炸裂冷凝管,所以冷凝管中上口为进水口、下口为出水口,故C错误;
D.用托盘天平称量药品时遵循“左物右砝”原则,且腐蚀性药品要放置在烧杯中称量,NaOH具有强腐蚀性,为防止腐蚀托盘天平,称量氢氧化钠固体时放置在烧杯中,故D错误;
故选B.
12.下列表示物质结构的化学用语或模型正确的是( )
A.硫酸的电离方程式:H2SO4=H2++SO42﹣
B.CO2的电子式:
C.Cl﹣离子的结构示意图:
D.苯的结构简式:C6H6
【考点】电子式、化学式或化学符号及名称的综合.
【分析】A.氢离子符合错误;
B.C、O之间存在两对共用电子对;
C.氯离子的质子数为17,核外电子数为18;
D.苯的分子式为C6H6.
【解答】解:A.硫酸的电离方程式为H2SO4=2H++SO42﹣,故A错误;
B.CO2的电子式为,故B错误;
C.Cl﹣离子的结构示意图为,故C正确;
D.苯的结构简式为,故D错误;
故选C.
13.在无色酸性溶液中能大量共存的是( )
A.Cu2+、Mg2+、SO42﹣、NO3﹣
B.K+、Mg2+、SO42+、Cl﹣
C.Ag+、Na+、NO3﹣、Cl﹣
D.NH4+、Ba2+、NO3﹣、OH﹣
【考点】离子共存问题.
【分析】酸性溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
【解答】解:A.Cu2+为蓝色,与无色不符,故A不选;
B.酸溶液中该组离子之间不反应,可大量共存,且离子均为无色,故B选;
C.Ag+、Cl﹣结合生成沉淀,不能共存,故C不选;
D.酸溶液中不能大量存在OH﹣,且OH﹣、NH4+不能共存,故D不选;
故选B.
14.下列离子方程式书写正确的是( )
A.铜跟浓硝酸反应:3Cu2+
8H++2
NO3﹣═3Cu2++2NO↑+4H2O
B.大理石与醋酸反应:2H++CO32﹣═CO2↑+H2O
C.金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
D.钠与水反应:2Na+2H2O═2Na++2OH﹣+H2↑
【考点】离子方程式的书写.
【分析】A.不符合反应客观事实;
B.碳酸钙为沉淀,应保留化学式;
C.不符合反应客观事实;
D.二者反应生成氢氧化钠和氢气;
【解答】解:A.铜跟浓硝酸反应生成硝酸铜、二氧化氮和水,离子方程式:Cu2++4H++2
NO3﹣═Cu2++2NO2↑+2H2O,故A错误;
B.大理石与醋酸反应,离子方程式:2H++CaCO3═CO2↑+H2O+Ca2+,故B错误;
C.生成硫酸亚铁和氢气,离子方程式:Fe+2H+═Fe2++H2↑,故C错误;
D.钠与水反应,离子方程式:2Na+2H2O═2Na++2OH﹣+H2↑,故D正确;
故选:D.
15.下列有关物质应用的叙述中,正确的是( )
A.氢氧化钠可用于治疗胃酸过多
B.福尔马林可以用于是食品防腐剂
C.水玻璃浸泡过的木材既能防腐又能耐火
D.Si用于制造光导纤维
【考点】物质的组成、结构和性质的关系.
【分析】A.氢氧化钠具有强烈的腐蚀性;
B.福尔马林为甲醛的水溶液,甲醛有毒;
C.硅酸钠具有较高熔沸点,耐高温不易燃烧;
D.二氧化硅具有良好的光学特性,为制造光导纤维主要原料.
【解答】解:A.氢氧化钠具有强烈的腐蚀性,不能用于治疗胃酸过多,故A错误;
B.福尔马林为甲醛的水溶液,甲醛有毒,不能用于食品防腐,故B错误;
C.硅酸钠具有较高熔沸点,耐高温不易燃烧,既能防腐又能耐火材料,故C正确;
D.二氧化硅用于制造光导纤维,故D错误;
故选:C.
16.下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是( )
编号
金属(粉末状)
物质的量
酸的浓度
酸的体积
反应温度
A
Mg
0.1mol
6mol/L硝酸
10mL
60℃
B
Mg
0.1mol
3mol/L盐酸
10mL
30℃
C
Fe
0.1mol
3mol/L盐酸
10mL
60℃
D
Mg
0.1mol
3mol/L盐酸
10mL
60℃
A.A
B.B
C.C
D.D
【考点】化学反应速率的影响因素.
【分析】根据物质本身的性质结合外界条件对化学反应速率的影响判断.
【解答】解:硝酸和镁反应不生成氢气,所以排除.镁的金属性比铁的强,所以在外界条件相同的情况下,镁比铁的反应速率快;在金属、酸相同的条件下,温度越高、酸的浓度越大,化学反应速率越快,故选D.
17.汽车尾气处理装置中发生如下反应,2NO+2CO═N2+2CO2,下列说法正确的是( )
A.NO是氧化剂
B.CO发生还原反应
C.NO失去电子
D.该反应是复分解反应
【考点】氧化还原反应.
【分析】2NO+2CO═N2+2CO2中,C元素的化合价升高,则CO为还原剂,N元素的化合价降低,则NO为氧化剂,结合氧化还原反应基本概念解答.
【解答】解:A.NO中N元素的化合价降低,被还原,则NO为氧化剂,故A正确;
B.C元素的化合价升高,CO为还原剂,发生氧化反应,故B错误;
C.NO中N元素的化合价降低,得电子,故C错误;
D.该反应是氧化还原反应,不是复分解反应,故D错误;
故选A.
18.关于化学反应与能量的说法正确的是( )
A.镁条溶于盐酸是吸热反应
B.中和反应是吸热反应
C.铝热反应属于吸热反应
D.碳酸钙分解是吸热反应
【考点】吸热反应和放热反应.
【分析】常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
【解答】解:A.镁条溶于盐酸是金属与酸的反应属于放热反应,故A错误;
B.中和反应是放热反应,故B错误;
C.铝热反应属于放热反应,故C错误;
D.碳酸钙分解是吸热反应,故D正确.
故选D.
19.下列实验方法不正确的是( )
A.用澄清石灰水鉴别Na2CO3和NaHCO3溶液
B.用焰色反应鉴别NaCl和KCl
C.用丁达尔效应鉴别硫酸钠溶液和硅酸胶体
D.用排水集气法收集NO
【考点】化学实验方案的评价.
【分析】A.二者均与石灰水反应生成白色沉淀;
B.Na、K的焰色反应分别为黄色、紫色;
C.丁达尔现象为胶体特有的性质;
D.NO不溶于水.
【解答】解:A.二者均与石灰水反应生成白色沉淀,现象相同,不能鉴别,故A错误;
B.Na、K的焰色反应分别为黄色、紫色,则用焰色反应鉴别NaCl和KCl,故B正确;
C.丁达尔现象为胶体特有的性质,则用丁达尔效应鉴别硫酸钠溶液和硅酸胶体,故C正确;
D.NO不溶于水,则用排水集气法可收集NO,故D正确;
故选A.
20.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.18g
H2O含有的氢原子数目为NA
B.标准状况下,22.4L
CO2含有的分子数目为NA
C.1L1mol L﹣1Na2SO4溶液中含有钠离子数目为NA
D.1mol
H2在Cl2中完全燃烧转移的电子数目为NA
【考点】阿伏加德罗常数.
【分析】A、求出水的物质的量,然后根据水中含2个氢原子来分析;
B、求出二氧化碳的物质的量,然后根据分子个数N=nNA来分析;
C、求出硫酸钠的物质的量n=CV,然后根据1mol硫酸钠中含2mol钠离子来分析;
D、氢气和氯气反应后变为+1价.
【解答】解:A、18g水的物质的量为1mol,而水中含2个氢原子,故1mol水中含2mol氢原子即2NA个,故A错误;
B、标况下22.4L二氧化碳的物质的量为1mol,而分子个数N=nNA=1mol×NA/mol=NA个,故B正确;
C、溶液中硫酸钠的物质的量n=CV=1mol/L×1L=1mol,而1mol硫酸钠中含2mol钠离子,故1mol硫酸钠中含2mol钠离子即2NA个,故C错误;
D、氢气和氯气反应后变为+1价,故1mol氢气反应转移2NA个电子,故D错误.
故选B.
21.将锌片和铜片按图示方式插入稀硫酸中,下列结论正确的是( )
A.将电能转换为化学能
B.电子由铜片流出
C.锌片时负极
D.铜片逐渐被腐蚀
【考点】原电池和电解池的工作原理.
【分析】锌比铜活泼,锌为负极,发生氧化反应,电极方程式为Zn﹣2e﹣=Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e﹣=H2↑,以此解答.
【解答】解:A.该装置是将化学能转化为电能的装置,为原电池,故A错误;
B.电子从负极锌流向正极铜,故B错误;
C.锌易失电子作负极,铜作正极,故C正确;
D.铜片上电极方程式为2H++2e﹣=H2↑,所以铜片质量不变,故D错误;
故选C.
22.短周期元素A、B、C、D的原子序数依次增大,A的原子半径在所有原子中最小,B位于第VA族,A和C同主族,D原子最外层电子数与电子层数相等.下列叙述正确的是( )
A.原子半径:C<B
B.元素A、C的氧化物均为共价化合物
C.金属性:D>C
D.元素B、C、D的最高价氧化物对应水化物能相互反应
【考点】原子结构与元素周期律的关系.
【分析】短周期元素A、B、C、D的原子序数依次增大,A是原子半径最小的原子,应为H元素,A和C同主族,则C应为Na元素,B位于第VA族,应为N元素,D原子最外层电子数与电子层数相等,应为Al元素,结合对应的单质、化合物的性质以及元素周期律知识解答该题.
【解答】解:短周期元素A、B、C、D的原子序数依次增大,A是原子半径最小的原子,应为H元素,A和C同主族,则C应为Na元素,B位于第VA族,应为N元素,D原子最外层电子数与电子层数相等,应为Al元素,
A.B为N元素,C为Na元素,Na原子半径较大,故A错误;
B.C为Na元素,对应的氧化物为离子化合物,故B错误;
C.同周期元素从左到右元素的金属性逐渐减弱,金属性Na>Al,故C错误;
D.元素B、C、D的最高价氧化物对应水化物分别为HNO3、NaOH、Al(OH)3,其中Al(OH)3为两性氢氧化物,可相互反应,故D正确.
故选D.
23.一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V
L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO
12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A.9.0
L
B.13.5
L
C.15.7
L
D.16.8
L
【考点】有关混合物反应的计算.
【分析】利用极限法解答,假设混合物全是CuS,或混合物全是Cu2S,根据n=计算n(CuO),根据电子转移守恒计算n(CuS)、n(Cu2S),再根据电子转移数目守恒,计算n(NO)、n(NO2),根据V=nVm计算气体体积,实际气体介于二者之间.
【解答】解:若混合物全是CuS,其物质的量n(CuS)=n(CuO)==0.15mol,转移电子物质的量=0.15×(6+2)=1.2mol.NO和NO2的体积相等,设NO的物质的量为x、NO2的物质的量为x,则3x+x=1.2,解得x=0.3,故气体体积V=0.6mol×22.4L/mol=13.44L;
若混合物全是Cu2S,其物质的量n(Cu2S)=n(CuO)=×0.15mol=0.075mol,转移电子物质的量0.075×10=0.75mol,设NO为xmol、NO2为xmol,3x+x=0.75,计算得x=0.1875,气体体积0.1875mol×2×22.4L/mol=8.4L,
故选A.
二、非选择题(本部分3题,共31分)《化学与生活》
24.材料是经济和生态文明建设的重要物质基础.
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是 石灰石 .
②飞机轮胎属于橡胶制品,橡胶属于 B (填字母).
A.金属材料
B.有机高分子材料
C.无机非金属材料
③轮船是重要的交通工具.为了保护钢板那不受腐蚀,在船尾钢板上镶嵌的金属块是 B
(填字母).
A.
铅块
B.锡块
C.锌块
④食品塑料袋要求经济又无毒,这种塑料的原料通常是 聚乙烯 (写名称).
⑤光导纤维在信息工程中的应用,是人们可以坐在家里通过信息网路获取信息,联络亲友.光导纤维的主要成分是 SiO2 (填化学式).
【考点】硅和二氧化硅.
【分析】①水泥的原料是粘土和石灰石,玻璃的原料是纯碱、石灰石和石英,所以原料中均有石灰石;
②飞机轮胎属于橡胶制品,橡胶是有机高分子材料;
③原电池中活泼金属做负极;
④塑料袋的原料是聚乙烯和聚氯乙烯,聚氯乙烯中的增塑剂有毒;
⑤光导纤维的主要成分是二氧化硅.
【解答】解:①生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥;所以在玻璃工业、水泥工业中都用到的原料是石灰石,
故答案为:石灰石;
②飞机轮胎属于橡胶制品,橡胶是有机高分子材料,故选:B;
③原电池中活泼金属做负极,腐蚀锌,保护了铁,故答案为:B;
④塑料袋的原料是聚乙烯和聚氯乙烯,聚氯乙烯中的增塑剂有毒,故答案为:聚乙烯;
⑤光导纤维的主要成分是二氧化硅,化学式为:SiO2,故答案为:SiO2.
25.防治环境污染,改善生态环境已成为全球共识.
①下列各图中表示我国节能标志的是 C (填字母).
②煤矿有时会发生瓦斯爆炸事故,瓦斯的主要成分与天然气相同,写出瓦斯爆炸的化学方程式: CH4+2O2CO2+2H2O 此空删去 .
③环境污染已对人类造成重大威胁.下列名词与环境污染无关的是 A
A.潮汐B.温室效应C.臭氧层空洞D.工业废水
④减少室内空气污染,下列措施正确的是 A
A、在室内种植芦荟、常青藤等绿色植物
B、随意对室内装饰,装饰材料可以随意用
C、紧闭门窗
D、室内有异味时,要即时多喷洒香水.
【考点】"三废"处理与环境保护.
【分析】①中间有艺术字节字的是我国的节能徽记;
②瓦斯的主要成分与天然气相同为甲烷,甲烷燃烧生成二氧化碳和水;
③根据酸雨的形成与产生的二氧化硫有关、臭氧层空洞与破坏臭氧层有关、工业三废包括废水、废气、废渣都与环境污染有关;
④A.在室内种植芦荟、常青藤等绿色植物,可加强光合作用,并吸收室内污染性气体;
B.很多装修材料中含有大量的甲醛、苯等有害物质;
C.居室经常通风,可减小室内有害气体的浓度;
D.室内洒香水,不能减少有害气体的危害.
【解答】解:①中间有艺术字节字的是我国的节能徽记,故答案为:C;
②煤矿有时会发生瓦斯爆炸事故,瓦斯的主要成分与天然气相同为甲烷,瓦斯爆炸的化学方程式为:CH4+2O2CO2+2H2O,故答案为:CH4+2O2CO2+2H2O;
③A、潮汐现象是指是指海水在天体(主要是月球和太阳)引潮力作用下所产生的周期性运动,习惯上把海面垂直方向涨落称为潮汐,与环境污染无关,故A正确;
B、温室效应与二氧化碳的排放有关,导致全球温度升高,故B错误;
C、含氟冰箱能破坏臭氧层,引起臭氧层空洞,所以与环境污染有关,故C错误;
D、空气的污染途径是工厂废气的任意排放,大量燃烧化石燃料,汽车尾气的排放,所以工业工业废水与环境污染有关,故D错误;
故答案为:A;
④A.芦荟吸收室内污染性气体,对人体健康有益,故A正确;
B.很多装修材料中含有大量的甲醛、苯等有害物质,不要随意对室内装饰,故B错误;
C.居室内经常产生一些有害气体,经常通风可降低有害气体的浓度,紧闭门窗有害气体不能排出,故C错误;
D.室内洒香水,不能减少有害气体的危害,是一种掩耳盗铃的做法,对减少有害气体无益,故D错误.
故选A.
26.保证食品安全、保持营养均衡,是保障人体健康的基础.
①人体所需的元素从食物中摄取不足时,可通过食品添加剂和保健药剂以补充.如制成补钙、补锌的保健药剂或制成加碘食盐等,来增加对这些元素的摄入量.从上面提到的补钙剂、补锌剂和加碘食盐中的钙、锌、碘是指 C (填选项字母).
A.单质
B.原子
C.元素
D.离子
②被霉菌污染的粮食会产生黄曲霉素(C17H12O6),人类的特殊基因在黄曲霉素作用下会发生突变,继而诱发癌症.黄曲霉素属于 有机物 (填“无机物”或“有机物”),
③由于化学物质使用不当,给人印象不佳的化学名词越来越多:苏丹红、三聚氰胺、….下列做法不会危及人体健康的是 C (填字母).
A.用甲醛浸泡海鲜产品
B.用霉变花生压榨食用油
C.用小苏打做糕点的疏松剂
D.用工业盐亚硝酸钠腌渍鱼肉
④碳酸氢钠是常用的疏松剂,它们在加热条件下产生气体,使食品变得疏松.请写出相关反应的化学方程式 2NaHCO3Na2CO3+H2O+CO2↑ .
【考点】合理摄入营养物质的重要性.
【分析】①题干中明确指出人体所需的元素;
②有机物是含碳化合物,一氧化碳、二氧化碳、碳酸,碳酸盐等除外;
③A.甲醛有毒;
B.霉变花生中含黄曲霉素;
C.小苏打受热分解产生二氧化碳和水;
D.亚硝酸钠制癌;
④碳酸氢钠在加热的条件下分解产生碳酸钠、二氧化碳和水.
【解答】解:①由题干中人体所需的元素可知补钙剂、补锌剂和加碘食盐这些宏观物质中的钙、锌、碘是指元素,
故答案为:C;
②黄曲霉素(C17H12O6)是含碳、氢、氧的化合物,属于有机物,
故答案为:有机物;
③A.甲醛有毒,不能用甲醛浸泡海鲜产品,故A错误;
B.用霉变花生中含黄曲霉素,有毒,不能压榨食用油,故B错误;
C.小苏打受热分解产生二氧化碳和水,使糕点疏松多孔,则可用小苏打做糕点的疏松剂,故C正确;
D.亚硝酸钠制癌,不能用工业盐亚硝酸钠腌渍鱼肉,故D错误;
故答案为:C;
④碳酸氢钠在加热的条件下分解产生碳酸钠、二氧化碳和水,反应方程式为:2NaHCO3═Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3Na2CO3+H2O+CO2↑.
27.中学化学中的一些常见物质有如图转化关系(部分产物未给出).其中A、H的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属.
回答下列问题.
(1)D的电子式为 .
(2)H的化学式为 Na2CO3 .
(3)写出反应①的化学方程式 2NaCl+2H2O2NaOH+Cl2↑+H2↑ .
(4)写出反应②的离子方程式 2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑ .
【考点】无机物的推断.
【分析】D气体在常温下呈黄绿色,则D为Cl2,A、G的焰色反应为黄色,含有Na元素,反应③为侯氏制碱法反应原理之一,则A为NaCl,G为NaHCO3,H为Na2CO3,电解氯化钠溶液生成氢气、氯气与氢氧化钠,E是常见金属,与B反应达到C与I,则E为Al、B为NaOH、C为H2,I为NaAlO2,F为HCl.
【解答】解:D气体在常温下呈黄绿色,则D为Cl2,A、G的焰色反应为黄色,含有Na元素,反应③为侯氏制碱法反应原理之一,则A为NaCl,G为NaHCO3,H为Na2CO3,电解氯化钠溶液生成氢气、氯气与氢氧化钠,E是常见金属,与B反应达到C与I,则E为Al、B为NaOH、C为H2,I为NaAlO2,F为HCl,
(1)D为氯气,电子式为,故答案为:;
(2)H的化学式为:Na2CO3,故答案为:Na2CO3;
(3)反应①的化学方程式:2NaCl+2H2O2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O2NaOH+Cl2↑+H2↑;
(4)反应②的离子方程式:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,故答案为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑.
28.利用钛白工业的副产品FeSO4[含Al2(SO4)3和少量重金属离子],可以生产电池级高纯超微细草酸亚铁.其工艺流程如图1:
已知:①5Fe2++MnO+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 NH3 H2O受热易分解,挥发出NH3,Fe(OH)2受热也易分解 .
(2)滤液Ⅱ经处理可得到副产品 (NH4)2SO4 .
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL
2mol L﹣1的H2SO4溶解.
步骤2:用0.2000mol L﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g
Zn粉和5mL
2mol L﹣1的H2SO4溶液,将Fe3+还原为Fe2+.
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为 0.01mol .
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为 生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快 .
【考点】制备实验方案的设计;探究物质的组成或测量物质的含量.
【分析】副产品FeSO4(含Al(SO4)3和少量重金属离子)中加入铁粉,将少量重金属离子等除去,得到比较纯净的FeSO4溶液,向FeSO4溶液中加入氨水,生成氢氧化亚铁,氢氧化亚铁和草酸反应生成高纯超微细草酸亚铁沉淀;
(1)温度不宜过高的原因除了控制沉淀的粒径外,还有NH3 H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解;
(2)沉淀前的溶液中含有硫酸亚铁,沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀和硫酸铵;
(3)由题意知氧化C2O42﹣和Fe2+共消耗0.2000
mol L﹣1标准KMnO4溶液体积30.40
mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.00mL,所以C2O42﹣消耗KMnO4溶液体积为(30.40﹣10.00)=20.4mL,由5C2O42﹣+2MnO4﹣+16H+=10CO2↑+2Mn2++8H2O得5C2O42﹣~2MnO4﹣,依据多步反应找关系式计算;
(4)观察图象分析反应速率变大的因素,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中温度不变,随着反应的进行,反应物的浓度变小,而反应速率加快,只能是生成的Mn2+作催化剂.
【解答】解:(1)沉淀过程为一水合氨沉淀亚铁离子的过程,生成氢氧化亚铁,氢氧化亚铁不稳定,受热会分解,另外一水合氨受热也会分解,故反应温度不能太高,所以温度不宜过高的原因除了控制沉淀的粒径外,还有NH3 H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解;
故答案为:NH3 H2O受热易分解,挥发出NH3,Fe(OH)2受热也易分解;
(2)沉淀前的溶液中含有硫酸亚铁,沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀和硫酸铵,所以副产品含有是(NH4)2SO4;
故答案为:(NH4)2SO4;
(3)由题意知氧化C2O42﹣和Fe2+共消耗0.2000
mol L﹣1标准KMnO4溶液体积30.40
mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.40mL,所以C2O42﹣消耗KMnO4溶液体积为(30.40﹣10.40)=20mL,由5C2O42﹣+2MnO4﹣+16H+=10CO2↑+2Mn2++8H2O得5C2O42﹣~2MnO4﹣,所以n(C2O42﹣)=n(MnO4﹣)=20ml×10﹣3×0.2000mol L﹣1×=0.01mol;
故答案为:0.01mol;
(4)从图象上观察,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中温度不变,随着反应的进行,反应物的浓度变小,而反应速率加快,只能是生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快;
故答案为:生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快.
2016年12月14日
一、单项选择题:在每题的4个选项中,只有1个选项符合要求(本部分23题,每题3分,共69分)
1.新能源的开发利用是人类社会可持续发展的重要课题.下列属于新能源的是( )
A.氢气
B.煤炭
C.天然气
D.石油
2.下列物质中,属于盐类的是( )
A.Na2O
B.CaCO3
C.Ca(OH)2
D.C2H12O6
3.下列变化属于物理变化的是( )
A.食醋除水垢
B.食物腐烂
C.在高温下用黏土烧制陶瓷
D.分液法分离四氯化碳与水
4.下列物质中既含有共价键又含离子键的化合物是( )
A.MgCl2
B.NaOH
C.O2
D.C6H6
5.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
A.小苏打﹣﹣Na2CO3
B.生石灰﹣﹣Ca
(OH)2
C.甲醛﹣﹣CH3OH
D.烧碱﹣﹣NaOH
6.反应2Al+Fe2O3Al2O3+2Fe可用于铁轨的焊接,该反应属于( )
A.化合反应
B.复分解反应
C.置换反应
D.分解反应
7.下列物质属于纯净物的是( )
A.冰水混合物
B.玻璃
C.空气
D.漂白粉
8.
I是一种人工放射性核素.下列关于I的说法正确的是( )
A.质量数为78
B.质子数为53
C.核外电子数为131
D.中子数为53
9.下列关于乙酸的说法正确的是( )
A.难溶于水
B.是一种无色无味的液体
C.能发生酯化反应
D.酸性比碳酸弱
10.下列物质属于天然有机高分子化合物的是( )
A.淀粉
B.天然气
C.聚乙烯
D.葡萄糖
11.下列有关实验的说法正确的是( )
A.加热后溶液颜色变为无色
B.配制100
mL
0.10
mol L﹣1NaCl溶液
C.实验室用该装置制取少量蒸馏水
D.称量25
g
NaOH
12.下列表示物质结构的化学用语或模型正确的是( )
A.硫酸的电离方程式:H2SO4=H2++SO42﹣
B.CO2的电子式:
C.Cl﹣离子的结构示意图:
D.苯的结构简式:C6H6
13.在无色酸性溶液中能大量共存的是( )
A.Cu2+、Mg2+、SO42﹣、NO3﹣
B.K+、Mg2+、SO42+、Cl﹣
C.Ag+、Na+、NO3﹣、Cl﹣
D.NH4+、Ba2+、NO3﹣、OH﹣
14.下列离子方程式书写正确的是( )
A.铜跟浓硝酸反应:3Cu2+
8H++2
NO3﹣═3Cu2++2NO↑+4H2O
B.大理石与醋酸反应:2H++CO32﹣═CO2↑+H2O
C.金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
D.钠与水反应:2Na+2H2O═2Na++2OH﹣+H2↑
15.下列有关物质应用的叙述中,正确的是( )
A.氢氧化钠可用于治疗胃酸过多
B.福尔马林可以用于是食品防腐剂
C.水玻璃浸泡过的木材既能防腐又能耐火
D.Si用于制造光导纤维
16.下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是( )
编号
金属(粉末状)
物质的量
酸的浓度
酸的体积
反应温度
A
Mg
0.1mol
6mol/L硝酸
10mL
60℃
B
Mg
0.1mol
3mol/L盐酸
10mL
30℃
C
Fe
0.1mol
3mol/L盐酸
10mL
60℃
D
Mg
0.1mol
3mol/L盐酸
10mL
60℃
A.A
B.B
C.C
D.D
17.汽车尾气处理装置中发生如下反应,2NO+2CO═N2+2CO2,下列说法正确的是( )
A.NO是氧化剂
B.CO发生还原反应
C.NO失去电子
D.该反应是复分解反应
18.关于化学反应与能量的说法正确的是( )
A.镁条溶于盐酸是吸热反应
B.中和反应是吸热反应
C.铝热反应属于吸热反应
D.碳酸钙分解是吸热反应
19.下列实验方法不正确的是( )
A.用澄清石灰水鉴别Na2CO3和NaHCO3溶液
B.用焰色反应鉴别NaCl和KCl
C.用丁达尔效应鉴别硫酸钠溶液和硅酸胶体
D.用排水集气法收集NO
20.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.18g
H2O含有的氢原子数目为NA
B.标准状况下,22.4L
CO2含有的分子数目为NA
C.1L1mol L﹣1Na2SO4溶液中含有钠离子数目为NA
D.1mol
H2在Cl2中完全燃烧转移的电子数目为NA
21.将锌片和铜片按图示方式插入稀硫酸中,下列结论正确的是( )
A.将电能转换为化学能
B.电子由铜片流出
C.锌片时负极
D.铜片逐渐被腐蚀
22.短周期元素A、B、C、D的原子序数依次增大,A的原子半径在所有原子中最小,B位于第VA族,A和C同主族,D原子最外层电子数与电子层数相等.下列叙述正确的是( )
A.原子半径:C<B
B.元素A、C的氧化物均为共价化合物
C.金属性:D>C
D.元素B、C、D的最高价氧化物对应水化物能相互反应
23.一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V
L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO
12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A.9.0
L
B.13.5
L
C.15.7
L
D.16.8
L
二、非选择题(本部分3题,共31分)《化学与生活》
24.材料是经济和生态文明建设的重要物质基础.
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是 .
②飞机轮胎属于橡胶制品,橡胶属于 (填字母).
A.金属材料
B.有机高分子材料
C.无机非金属材料
③轮船是重要的交通工具.为了保护钢板那不受腐蚀,在船尾钢板上镶嵌的金属块是
(填字母).
A.
铅块
B.锡块
C.锌块
④食品塑料袋要求经济又无毒,这种塑料的原料通常是 (写名称).
⑤光导纤维在信息工程中的应用,是人们可以坐在家里通过信息网路获取信息,联络亲友.光导纤维的主要成分是 (填化学式).
25.防治环境污染,改善生态环境已成为全球共识.
①下列各图中表示我国节能标志的是 (填字母).
②煤矿有时会发生瓦斯爆炸事故,瓦斯的主要成分与天然气相同,写出瓦斯爆炸的化学方程式: .
③环境污染已对人类造成重大威胁.下列名词与环境污染无关的是
A.潮汐B.温室效应C.臭氧层空洞D.工业废水
④减少室内空气污染,下列措施正确的是
A、在室内种植芦荟、常青藤等绿色植物
B、随意对室内装饰,装饰材料可以随意用
C、紧闭门窗
D、室内有异味时,要即时多喷洒香水.
26.保证食品安全、保持营养均衡,是保障人体健康的基础.
①人体所需的元素从食物中摄取不足时,可通过食品添加剂和保健药剂以补充.如制成补钙、补锌的保健药剂或制成加碘食盐等,来增加对这些元素的摄入量.从上面提到的补钙剂、补锌剂和加碘食盐中的钙、锌、碘是指 (填选项字母).
A.单质
B.原子
C.元素
D.离子
②被霉菌污染的粮食会产生黄曲霉素(C17H12O6),人类的特殊基因在黄曲霉素作用下会发生突变,继而诱发癌症.黄曲霉素属于 (填“无机物”或“有机物”),
③由于化学物质使用不当,给人印象不佳的化学名词越来越多:苏丹红、三聚氰胺、….下列做法不会危及人体健康的是 (填字母).
A.用甲醛浸泡海鲜产品
B.用霉变花生压榨食用油
C.用小苏打做糕点的疏松剂
D.用工业盐亚硝酸钠腌渍鱼肉
④碳酸氢钠是常用的疏松剂,它们在加热条件下产生气体,使食品变得疏松.请写出相关反应的化学方程式 .
27.中学化学中的一些常见物质有如图转化关系(部分产物未给出).其中A、H的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属.
回答下列问题.
(1)D的电子式为 .
(2)H的化学式为 .
(3)写出反应①的化学方程式 .
(4)写出反应②的离子方程式 .
28.利用钛白工业的副产品FeSO4[含Al2(SO4)3和少量重金属离子],可以生产电池级高纯超微细草酸亚铁.其工艺流程如图1:
已知:①5Fe2++MnO+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 .
(2)滤液Ⅱ经处理可得到副产品 .
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL
2mol L﹣1的H2SO4溶解.
步骤2:用0.2000mol L﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g
Zn粉和5mL
2mol L﹣1的H2SO4溶液,将Fe3+还原为Fe2+.
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为 .
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为 .
2016-2017学年江苏省连云港市灌云县四队中学高二(上)期中化学试卷
参考答案与试题解析
一、单项选择题:在每题的4个选项中,只有1个选项符合要求(本部分23题,每题3分,共69分)
1.新能源的开发利用是人类社会可持续发展的重要课题.下列属于新能源的是( )
A.氢气
B.煤炭
C.天然气
D.石油
【考点】清洁能源.
【分析】新能源包括太阳能、核能、风能、氢能等;煤、石油、天然气是化石燃料.
【解答】解:新能源包括太阳能、核能、风能、氢能等;而煤、石油、天然气是化石燃料,属于常规能源,
故选A.
2.下列物质中,属于盐类的是( )
A.Na2O
B.CaCO3
C.Ca(OH)2
D.C2H12O6
【考点】酸、碱、盐、氧化物的概念及其相互联系.
【分析】阳离子是金属离子或铵根离子、阴离子是酸根离子的化合物为盐,据此分析.
【解答】解:A、氧化钠由两种元素构成、其中一种为氧元素,故为氧化物,不是盐,故A错误;
B、碳酸钙的阳离子是金属离子,阴离子为酸根离子,故为盐,故B正确;
C、氢氧化钙电离出的阴离子全部为氢氧根,故为碱,故C错误;
D、C6H12O6是有机物,不是盐,故D错误.
故选B.
3.下列变化属于物理变化的是( )
A.食醋除水垢
B.食物腐烂
C.在高温下用黏土烧制陶瓷
D.分液法分离四氯化碳与水
【考点】物理变化与化学变化的区别与联系.
【分析】物理变化是指变化过程中无新物质生成的变化,化学变化是指有新物质生成的变化,化学变化和物理变化的本质区别是判断过程中是否生成新的物质.
【解答】解:A.食醋除水垢是利用醋酸酸性大于碳酸,醋酸和碳酸钙反应生成溶于水的醋酸钙除去,发生了化学反应,故A错误;
B.食物腐烂是食物发生了氧化反应生成了新的物质,属于化学变化,故B错误;
C.在高温下黏土烧制陶瓷有新物质生成,属于化学变化,故C错误;
D.分液法分离四氯化碳与水是利用互不相溶的性质分离混合物,过程中无新物质生成,属于物理变化,故D正确;
故选D.
4.下列物质中既含有共价键又含离子键的化合物是( )
A.MgCl2
B.NaOH
C.O2
D.C6H6
【考点】离子化合物的结构特征与性质.
【分析】活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间存在离子键,据此分析解答.
【解答】解:A.氯化镁中镁离子和氯离子之间只存在离子键,故A错误;
B.NaOH中钠离子和氢氧根离子之间存在离子键、O﹣H原子之间存在共价键,故B正确;
C.氧气分子中O﹣O原子之间只存在共价键,故C错误;
D.苯分子中C﹣C、C﹣H原子之间只存在共价键,故D错误;
故选B.
5.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
A.小苏打﹣﹣Na2CO3
B.生石灰﹣﹣Ca
(OH)2
C.甲醛﹣﹣CH3OH
D.烧碱﹣﹣NaOH
【考点】常见元素的名称、符号、离子符号.
【分析】A、小苏打是NaHCO3;
B、生石灰是CaO;
C、甲醛的化学式为HCHO;
D、烧碱为NaOH.
【解答】解:A、小苏打是NaHCO3,Na2CO3俗称苏打,故A错误;
B、生石灰是CaO,Ca
(OH)2俗称熟石灰,故B错误;
C、甲醛的化学式为HCHO,CH3OH为甲醇,俗称蚁醇,故C错误;
D、烧碱为NaOH,又俗称苛性钠和火碱,故D正确.
故选D.
6.反应2Al+Fe2O3Al2O3+2Fe可用于铁轨的焊接,该反应属于( )
A.化合反应
B.复分解反应
C.置换反应
D.分解反应
【考点】铝的化学性质.
【分析】由2Al+Fe2O3Al2O3+2Fe可知,为铝热反应,为单质与化合物反应生成新单质、化合物的反应,以此来解答.
【解答】解:A.生成物不是一种,不属于化合反应,故A不选;
B.反应物、生成物均有单质,不是复分解反应,故B不选;
C.为单质与化合物反应生成新单质、化合物的反应,属于置换反应,故C选;
D.反应物不是一种,不属于分解反应,故D不选;
故选C.
7.下列物质属于纯净物的是( )
A.冰水混合物
B.玻璃
C.空气
D.漂白粉
【考点】混合物和纯净物.
【分析】纯净物是同种物质组成的物质,不同物质组成的为混合物,结合物质组成分析判断.
【解答】解:A.冰水混合物为一种组成的纯净物,故A正确;
B.玻璃是硅酸钠、硅酸钙和二氧化硅组成的混合物,故B错误;
C.空气中含有多种物质组成的混合物,故C错误;
D.漂白粉是氯化钙和次氯酸钙的混合物,故D错误;
故选A.
8.
I是一种人工放射性核素.下列关于I的说法正确的是( )
A.质量数为78
B.质子数为53
C.核外电子数为131
D.中子数为53
【考点】核素.
【分析】原子结构中,核电荷数=质子数=核外电子数,质量数=质子数+中子数,原子符号左上角为质量数,左下角为质子数.
【解答】解:13153I原子中质量数为131,质子数为53,核外电子数为53,中子数=131﹣53=78,故选B.
9.下列关于乙酸的说法正确的是( )
A.难溶于水
B.是一种无色无味的液体
C.能发生酯化反应
D.酸性比碳酸弱
【考点】乙酸的化学性质.
【分析】A.乙酸易溶于水;
B.乙酸是一种无色有刺激性气味的液体;
C.乙酸能与乙醇发生酯化反应生成乙酸乙酯;
D.乙酸酸性比碳酸强.
【解答】解:A.乙酸易溶于水,故A错误;
B.乙酸是一种无色有刺激性气味的液体,故B错误;
C.乙酸能与乙醇发生酯化反应生成乙酸乙酯,故C正确;
D.乙酸是弱酸,但酸性比碳酸强,故D错误;
故选C.
10.下列物质属于天然有机高分子化合物的是( )
A.淀粉
B.天然气
C.聚乙烯
D.葡萄糖
【考点】有机高分子化合物的结构和性质.
【分析】相对分子质量在10000以上的有机化合物为高分子化合物,高分子化合物分为天然高分子化合物、合成高分子化合物,淀粉、纤维素、蛋白质为天然高分子化合物.
【解答】解:A.淀粉的相对分子质量在10000以上,天然存在,为天然有机高分子化合物,故A选;
B.天然气为混合物,主要成分为甲烷,甲烷相对分子质量为16,为小分子,故B不选;
C.聚乙烯可由乙烯发生加聚反应生成,为合成高分子,故C不选;
D.葡萄糖的分子式为C6H12O6,相对分子质量在10000以下,不是高分子,故D不选;
故选A.
11.下列有关实验的说法正确的是( )
A.加热后溶液颜色变为无色
B.配制100
mL
0.10
mol L﹣1NaCl溶液
C.实验室用该装置制取少量蒸馏水
D.称量25
g
NaOH
【考点】化学实验方案的评价.
【分析】A.二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,受热易复原;
B.配制一定物质的量浓度溶液时,转移溶液需要用玻璃棒引流;
C.蒸馏时,温度计测量馏分温度,冷凝管中水应该采用“下进上出”原则;
D.用托盘天平称量药品时应该采取“左物右砝”原则,且具有腐蚀性药品应该放置在烧杯中称量.
【解答】解:A.二氧化硫的漂白性不稳定,加热时易复原,所以加热二氧化硫漂白后的溶液时,溶液由无色变为红色,故A错误;
B.配制一定物质的量浓度溶液时,转移溶液需要用玻璃棒引流,否则易溅出溶液导致配制溶液浓度偏低,故B正确;
C.用蒸馏法制取蒸馏水时,如果馏分急剧冷却会炸裂冷凝管,为防止炸裂冷凝管,所以冷凝管中上口为进水口、下口为出水口,故C错误;
D.用托盘天平称量药品时遵循“左物右砝”原则,且腐蚀性药品要放置在烧杯中称量,NaOH具有强腐蚀性,为防止腐蚀托盘天平,称量氢氧化钠固体时放置在烧杯中,故D错误;
故选B.
12.下列表示物质结构的化学用语或模型正确的是( )
A.硫酸的电离方程式:H2SO4=H2++SO42﹣
B.CO2的电子式:
C.Cl﹣离子的结构示意图:
D.苯的结构简式:C6H6
【考点】电子式、化学式或化学符号及名称的综合.
【分析】A.氢离子符合错误;
B.C、O之间存在两对共用电子对;
C.氯离子的质子数为17,核外电子数为18;
D.苯的分子式为C6H6.
【解答】解:A.硫酸的电离方程式为H2SO4=2H++SO42﹣,故A错误;
B.CO2的电子式为,故B错误;
C.Cl﹣离子的结构示意图为,故C正确;
D.苯的结构简式为,故D错误;
故选C.
13.在无色酸性溶液中能大量共存的是( )
A.Cu2+、Mg2+、SO42﹣、NO3﹣
B.K+、Mg2+、SO42+、Cl﹣
C.Ag+、Na+、NO3﹣、Cl﹣
D.NH4+、Ba2+、NO3﹣、OH﹣
【考点】离子共存问题.
【分析】酸性溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,并结合离子的颜色来解答.
【解答】解:A.Cu2+为蓝色,与无色不符,故A不选;
B.酸溶液中该组离子之间不反应,可大量共存,且离子均为无色,故B选;
C.Ag+、Cl﹣结合生成沉淀,不能共存,故C不选;
D.酸溶液中不能大量存在OH﹣,且OH﹣、NH4+不能共存,故D不选;
故选B.
14.下列离子方程式书写正确的是( )
A.铜跟浓硝酸反应:3Cu2+
8H++2
NO3﹣═3Cu2++2NO↑+4H2O
B.大理石与醋酸反应:2H++CO32﹣═CO2↑+H2O
C.金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
D.钠与水反应:2Na+2H2O═2Na++2OH﹣+H2↑
【考点】离子方程式的书写.
【分析】A.不符合反应客观事实;
B.碳酸钙为沉淀,应保留化学式;
C.不符合反应客观事实;
D.二者反应生成氢氧化钠和氢气;
【解答】解:A.铜跟浓硝酸反应生成硝酸铜、二氧化氮和水,离子方程式:Cu2++4H++2
NO3﹣═Cu2++2NO2↑+2H2O,故A错误;
B.大理石与醋酸反应,离子方程式:2H++CaCO3═CO2↑+H2O+Ca2+,故B错误;
C.生成硫酸亚铁和氢气,离子方程式:Fe+2H+═Fe2++H2↑,故C错误;
D.钠与水反应,离子方程式:2Na+2H2O═2Na++2OH﹣+H2↑,故D正确;
故选:D.
15.下列有关物质应用的叙述中,正确的是( )
A.氢氧化钠可用于治疗胃酸过多
B.福尔马林可以用于是食品防腐剂
C.水玻璃浸泡过的木材既能防腐又能耐火
D.Si用于制造光导纤维
【考点】物质的组成、结构和性质的关系.
【分析】A.氢氧化钠具有强烈的腐蚀性;
B.福尔马林为甲醛的水溶液,甲醛有毒;
C.硅酸钠具有较高熔沸点,耐高温不易燃烧;
D.二氧化硅具有良好的光学特性,为制造光导纤维主要原料.
【解答】解:A.氢氧化钠具有强烈的腐蚀性,不能用于治疗胃酸过多,故A错误;
B.福尔马林为甲醛的水溶液,甲醛有毒,不能用于食品防腐,故B错误;
C.硅酸钠具有较高熔沸点,耐高温不易燃烧,既能防腐又能耐火材料,故C正确;
D.二氧化硅用于制造光导纤维,故D错误;
故选:C.
16.下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是( )
编号
金属(粉末状)
物质的量
酸的浓度
酸的体积
反应温度
A
Mg
0.1mol
6mol/L硝酸
10mL
60℃
B
Mg
0.1mol
3mol/L盐酸
10mL
30℃
C
Fe
0.1mol
3mol/L盐酸
10mL
60℃
D
Mg
0.1mol
3mol/L盐酸
10mL
60℃
A.A
B.B
C.C
D.D
【考点】化学反应速率的影响因素.
【分析】根据物质本身的性质结合外界条件对化学反应速率的影响判断.
【解答】解:硝酸和镁反应不生成氢气,所以排除.镁的金属性比铁的强,所以在外界条件相同的情况下,镁比铁的反应速率快;在金属、酸相同的条件下,温度越高、酸的浓度越大,化学反应速率越快,故选D.
17.汽车尾气处理装置中发生如下反应,2NO+2CO═N2+2CO2,下列说法正确的是( )
A.NO是氧化剂
B.CO发生还原反应
C.NO失去电子
D.该反应是复分解反应
【考点】氧化还原反应.
【分析】2NO+2CO═N2+2CO2中,C元素的化合价升高,则CO为还原剂,N元素的化合价降低,则NO为氧化剂,结合氧化还原反应基本概念解答.
【解答】解:A.NO中N元素的化合价降低,被还原,则NO为氧化剂,故A正确;
B.C元素的化合价升高,CO为还原剂,发生氧化反应,故B错误;
C.NO中N元素的化合价降低,得电子,故C错误;
D.该反应是氧化还原反应,不是复分解反应,故D错误;
故选A.
18.关于化学反应与能量的说法正确的是( )
A.镁条溶于盐酸是吸热反应
B.中和反应是吸热反应
C.铝热反应属于吸热反应
D.碳酸钙分解是吸热反应
【考点】吸热反应和放热反应.
【分析】常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
【解答】解:A.镁条溶于盐酸是金属与酸的反应属于放热反应,故A错误;
B.中和反应是放热反应,故B错误;
C.铝热反应属于放热反应,故C错误;
D.碳酸钙分解是吸热反应,故D正确.
故选D.
19.下列实验方法不正确的是( )
A.用澄清石灰水鉴别Na2CO3和NaHCO3溶液
B.用焰色反应鉴别NaCl和KCl
C.用丁达尔效应鉴别硫酸钠溶液和硅酸胶体
D.用排水集气法收集NO
【考点】化学实验方案的评价.
【分析】A.二者均与石灰水反应生成白色沉淀;
B.Na、K的焰色反应分别为黄色、紫色;
C.丁达尔现象为胶体特有的性质;
D.NO不溶于水.
【解答】解:A.二者均与石灰水反应生成白色沉淀,现象相同,不能鉴别,故A错误;
B.Na、K的焰色反应分别为黄色、紫色,则用焰色反应鉴别NaCl和KCl,故B正确;
C.丁达尔现象为胶体特有的性质,则用丁达尔效应鉴别硫酸钠溶液和硅酸胶体,故C正确;
D.NO不溶于水,则用排水集气法可收集NO,故D正确;
故选A.
20.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.18g
H2O含有的氢原子数目为NA
B.标准状况下,22.4L
CO2含有的分子数目为NA
C.1L1mol L﹣1Na2SO4溶液中含有钠离子数目为NA
D.1mol
H2在Cl2中完全燃烧转移的电子数目为NA
【考点】阿伏加德罗常数.
【分析】A、求出水的物质的量,然后根据水中含2个氢原子来分析;
B、求出二氧化碳的物质的量,然后根据分子个数N=nNA来分析;
C、求出硫酸钠的物质的量n=CV,然后根据1mol硫酸钠中含2mol钠离子来分析;
D、氢气和氯气反应后变为+1价.
【解答】解:A、18g水的物质的量为1mol,而水中含2个氢原子,故1mol水中含2mol氢原子即2NA个,故A错误;
B、标况下22.4L二氧化碳的物质的量为1mol,而分子个数N=nNA=1mol×NA/mol=NA个,故B正确;
C、溶液中硫酸钠的物质的量n=CV=1mol/L×1L=1mol,而1mol硫酸钠中含2mol钠离子,故1mol硫酸钠中含2mol钠离子即2NA个,故C错误;
D、氢气和氯气反应后变为+1价,故1mol氢气反应转移2NA个电子,故D错误.
故选B.
21.将锌片和铜片按图示方式插入稀硫酸中,下列结论正确的是( )
A.将电能转换为化学能
B.电子由铜片流出
C.锌片时负极
D.铜片逐渐被腐蚀
【考点】原电池和电解池的工作原理.
【分析】锌比铜活泼,锌为负极,发生氧化反应,电极方程式为Zn﹣2e﹣=Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e﹣=H2↑,以此解答.
【解答】解:A.该装置是将化学能转化为电能的装置,为原电池,故A错误;
B.电子从负极锌流向正极铜,故B错误;
C.锌易失电子作负极,铜作正极,故C正确;
D.铜片上电极方程式为2H++2e﹣=H2↑,所以铜片质量不变,故D错误;
故选C.
22.短周期元素A、B、C、D的原子序数依次增大,A的原子半径在所有原子中最小,B位于第VA族,A和C同主族,D原子最外层电子数与电子层数相等.下列叙述正确的是( )
A.原子半径:C<B
B.元素A、C的氧化物均为共价化合物
C.金属性:D>C
D.元素B、C、D的最高价氧化物对应水化物能相互反应
【考点】原子结构与元素周期律的关系.
【分析】短周期元素A、B、C、D的原子序数依次增大,A是原子半径最小的原子,应为H元素,A和C同主族,则C应为Na元素,B位于第VA族,应为N元素,D原子最外层电子数与电子层数相等,应为Al元素,结合对应的单质、化合物的性质以及元素周期律知识解答该题.
【解答】解:短周期元素A、B、C、D的原子序数依次增大,A是原子半径最小的原子,应为H元素,A和C同主族,则C应为Na元素,B位于第VA族,应为N元素,D原子最外层电子数与电子层数相等,应为Al元素,
A.B为N元素,C为Na元素,Na原子半径较大,故A错误;
B.C为Na元素,对应的氧化物为离子化合物,故B错误;
C.同周期元素从左到右元素的金属性逐渐减弱,金属性Na>Al,故C错误;
D.元素B、C、D的最高价氧化物对应水化物分别为HNO3、NaOH、Al(OH)3,其中Al(OH)3为两性氢氧化物,可相互反应,故D正确.
故选D.
23.一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V
L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO
12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A.9.0
L
B.13.5
L
C.15.7
L
D.16.8
L
【考点】有关混合物反应的计算.
【分析】利用极限法解答,假设混合物全是CuS,或混合物全是Cu2S,根据n=计算n(CuO),根据电子转移守恒计算n(CuS)、n(Cu2S),再根据电子转移数目守恒,计算n(NO)、n(NO2),根据V=nVm计算气体体积,实际气体介于二者之间.
【解答】解:若混合物全是CuS,其物质的量n(CuS)=n(CuO)==0.15mol,转移电子物质的量=0.15×(6+2)=1.2mol.NO和NO2的体积相等,设NO的物质的量为x、NO2的物质的量为x,则3x+x=1.2,解得x=0.3,故气体体积V=0.6mol×22.4L/mol=13.44L;
若混合物全是Cu2S,其物质的量n(Cu2S)=n(CuO)=×0.15mol=0.075mol,转移电子物质的量0.075×10=0.75mol,设NO为xmol、NO2为xmol,3x+x=0.75,计算得x=0.1875,气体体积0.1875mol×2×22.4L/mol=8.4L,
故选A.
二、非选择题(本部分3题,共31分)《化学与生活》
24.材料是经济和生态文明建设的重要物质基础.
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是 石灰石 .
②飞机轮胎属于橡胶制品,橡胶属于 B (填字母).
A.金属材料
B.有机高分子材料
C.无机非金属材料
③轮船是重要的交通工具.为了保护钢板那不受腐蚀,在船尾钢板上镶嵌的金属块是 B
(填字母).
A.
铅块
B.锡块
C.锌块
④食品塑料袋要求经济又无毒,这种塑料的原料通常是 聚乙烯 (写名称).
⑤光导纤维在信息工程中的应用,是人们可以坐在家里通过信息网路获取信息,联络亲友.光导纤维的主要成分是 SiO2 (填化学式).
【考点】硅和二氧化硅.
【分析】①水泥的原料是粘土和石灰石,玻璃的原料是纯碱、石灰石和石英,所以原料中均有石灰石;
②飞机轮胎属于橡胶制品,橡胶是有机高分子材料;
③原电池中活泼金属做负极;
④塑料袋的原料是聚乙烯和聚氯乙烯,聚氯乙烯中的增塑剂有毒;
⑤光导纤维的主要成分是二氧化硅.
【解答】解:①生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥;所以在玻璃工业、水泥工业中都用到的原料是石灰石,
故答案为:石灰石;
②飞机轮胎属于橡胶制品,橡胶是有机高分子材料,故选:B;
③原电池中活泼金属做负极,腐蚀锌,保护了铁,故答案为:B;
④塑料袋的原料是聚乙烯和聚氯乙烯,聚氯乙烯中的增塑剂有毒,故答案为:聚乙烯;
⑤光导纤维的主要成分是二氧化硅,化学式为:SiO2,故答案为:SiO2.
25.防治环境污染,改善生态环境已成为全球共识.
①下列各图中表示我国节能标志的是 C (填字母).
②煤矿有时会发生瓦斯爆炸事故,瓦斯的主要成分与天然气相同,写出瓦斯爆炸的化学方程式: CH4+2O2CO2+2H2O 此空删去 .
③环境污染已对人类造成重大威胁.下列名词与环境污染无关的是 A
A.潮汐B.温室效应C.臭氧层空洞D.工业废水
④减少室内空气污染,下列措施正确的是 A
A、在室内种植芦荟、常青藤等绿色植物
B、随意对室内装饰,装饰材料可以随意用
C、紧闭门窗
D、室内有异味时,要即时多喷洒香水.
【考点】"三废"处理与环境保护.
【分析】①中间有艺术字节字的是我国的节能徽记;
②瓦斯的主要成分与天然气相同为甲烷,甲烷燃烧生成二氧化碳和水;
③根据酸雨的形成与产生的二氧化硫有关、臭氧层空洞与破坏臭氧层有关、工业三废包括废水、废气、废渣都与环境污染有关;
④A.在室内种植芦荟、常青藤等绿色植物,可加强光合作用,并吸收室内污染性气体;
B.很多装修材料中含有大量的甲醛、苯等有害物质;
C.居室经常通风,可减小室内有害气体的浓度;
D.室内洒香水,不能减少有害气体的危害.
【解答】解:①中间有艺术字节字的是我国的节能徽记,故答案为:C;
②煤矿有时会发生瓦斯爆炸事故,瓦斯的主要成分与天然气相同为甲烷,瓦斯爆炸的化学方程式为:CH4+2O2CO2+2H2O,故答案为:CH4+2O2CO2+2H2O;
③A、潮汐现象是指是指海水在天体(主要是月球和太阳)引潮力作用下所产生的周期性运动,习惯上把海面垂直方向涨落称为潮汐,与环境污染无关,故A正确;
B、温室效应与二氧化碳的排放有关,导致全球温度升高,故B错误;
C、含氟冰箱能破坏臭氧层,引起臭氧层空洞,所以与环境污染有关,故C错误;
D、空气的污染途径是工厂废气的任意排放,大量燃烧化石燃料,汽车尾气的排放,所以工业工业废水与环境污染有关,故D错误;
故答案为:A;
④A.芦荟吸收室内污染性气体,对人体健康有益,故A正确;
B.很多装修材料中含有大量的甲醛、苯等有害物质,不要随意对室内装饰,故B错误;
C.居室内经常产生一些有害气体,经常通风可降低有害气体的浓度,紧闭门窗有害气体不能排出,故C错误;
D.室内洒香水,不能减少有害气体的危害,是一种掩耳盗铃的做法,对减少有害气体无益,故D错误.
故选A.
26.保证食品安全、保持营养均衡,是保障人体健康的基础.
①人体所需的元素从食物中摄取不足时,可通过食品添加剂和保健药剂以补充.如制成补钙、补锌的保健药剂或制成加碘食盐等,来增加对这些元素的摄入量.从上面提到的补钙剂、补锌剂和加碘食盐中的钙、锌、碘是指 C (填选项字母).
A.单质
B.原子
C.元素
D.离子
②被霉菌污染的粮食会产生黄曲霉素(C17H12O6),人类的特殊基因在黄曲霉素作用下会发生突变,继而诱发癌症.黄曲霉素属于 有机物 (填“无机物”或“有机物”),
③由于化学物质使用不当,给人印象不佳的化学名词越来越多:苏丹红、三聚氰胺、….下列做法不会危及人体健康的是 C (填字母).
A.用甲醛浸泡海鲜产品
B.用霉变花生压榨食用油
C.用小苏打做糕点的疏松剂
D.用工业盐亚硝酸钠腌渍鱼肉
④碳酸氢钠是常用的疏松剂,它们在加热条件下产生气体,使食品变得疏松.请写出相关反应的化学方程式 2NaHCO3Na2CO3+H2O+CO2↑ .
【考点】合理摄入营养物质的重要性.
【分析】①题干中明确指出人体所需的元素;
②有机物是含碳化合物,一氧化碳、二氧化碳、碳酸,碳酸盐等除外;
③A.甲醛有毒;
B.霉变花生中含黄曲霉素;
C.小苏打受热分解产生二氧化碳和水;
D.亚硝酸钠制癌;
④碳酸氢钠在加热的条件下分解产生碳酸钠、二氧化碳和水.
【解答】解:①由题干中人体所需的元素可知补钙剂、补锌剂和加碘食盐这些宏观物质中的钙、锌、碘是指元素,
故答案为:C;
②黄曲霉素(C17H12O6)是含碳、氢、氧的化合物,属于有机物,
故答案为:有机物;
③A.甲醛有毒,不能用甲醛浸泡海鲜产品,故A错误;
B.用霉变花生中含黄曲霉素,有毒,不能压榨食用油,故B错误;
C.小苏打受热分解产生二氧化碳和水,使糕点疏松多孔,则可用小苏打做糕点的疏松剂,故C正确;
D.亚硝酸钠制癌,不能用工业盐亚硝酸钠腌渍鱼肉,故D错误;
故答案为:C;
④碳酸氢钠在加热的条件下分解产生碳酸钠、二氧化碳和水,反应方程式为:2NaHCO3═Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3Na2CO3+H2O+CO2↑.
27.中学化学中的一些常见物质有如图转化关系(部分产物未给出).其中A、H的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属.
回答下列问题.
(1)D的电子式为 .
(2)H的化学式为 Na2CO3 .
(3)写出反应①的化学方程式 2NaCl+2H2O2NaOH+Cl2↑+H2↑ .
(4)写出反应②的离子方程式 2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑ .
【考点】无机物的推断.
【分析】D气体在常温下呈黄绿色,则D为Cl2,A、G的焰色反应为黄色,含有Na元素,反应③为侯氏制碱法反应原理之一,则A为NaCl,G为NaHCO3,H为Na2CO3,电解氯化钠溶液生成氢气、氯气与氢氧化钠,E是常见金属,与B反应达到C与I,则E为Al、B为NaOH、C为H2,I为NaAlO2,F为HCl.
【解答】解:D气体在常温下呈黄绿色,则D为Cl2,A、G的焰色反应为黄色,含有Na元素,反应③为侯氏制碱法反应原理之一,则A为NaCl,G为NaHCO3,H为Na2CO3,电解氯化钠溶液生成氢气、氯气与氢氧化钠,E是常见金属,与B反应达到C与I,则E为Al、B为NaOH、C为H2,I为NaAlO2,F为HCl,
(1)D为氯气,电子式为,故答案为:;
(2)H的化学式为:Na2CO3,故答案为:Na2CO3;
(3)反应①的化学方程式:2NaCl+2H2O2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O2NaOH+Cl2↑+H2↑;
(4)反应②的离子方程式:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,故答案为:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑.
28.利用钛白工业的副产品FeSO4[含Al2(SO4)3和少量重金属离子],可以生产电池级高纯超微细草酸亚铁.其工艺流程如图1:
已知:①5Fe2++MnO+8H+═5Fe3++Mn2++4H2O
②5C2O42﹣+2MnO+16H+═10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 NH3 H2O受热易分解,挥发出NH3,Fe(OH)2受热也易分解 .
(2)滤液Ⅱ经处理可得到副产品 (NH4)2SO4 .
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25mL
2mol L﹣1的H2SO4溶解.
步骤2:用0.2000mol L﹣1标准KMnO4溶液滴定,消耗其体积30.40mL.
步骤3:向滴定后的溶液中加入2g
Zn粉和5mL
2mol L﹣1的H2SO4溶液,将Fe3+还原为Fe2+.
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.40mL.
则样品中C2O42﹣的物质的量为 0.01mol .
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图2,产生这种变化趋势的原因可能为 生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快 .
【考点】制备实验方案的设计;探究物质的组成或测量物质的含量.
【分析】副产品FeSO4(含Al(SO4)3和少量重金属离子)中加入铁粉,将少量重金属离子等除去,得到比较纯净的FeSO4溶液,向FeSO4溶液中加入氨水,生成氢氧化亚铁,氢氧化亚铁和草酸反应生成高纯超微细草酸亚铁沉淀;
(1)温度不宜过高的原因除了控制沉淀的粒径外,还有NH3 H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解;
(2)沉淀前的溶液中含有硫酸亚铁,沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀和硫酸铵;
(3)由题意知氧化C2O42﹣和Fe2+共消耗0.2000
mol L﹣1标准KMnO4溶液体积30.40
mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.00mL,所以C2O42﹣消耗KMnO4溶液体积为(30.40﹣10.00)=20.4mL,由5C2O42﹣+2MnO4﹣+16H+=10CO2↑+2Mn2++8H2O得5C2O42﹣~2MnO4﹣,依据多步反应找关系式计算;
(4)观察图象分析反应速率变大的因素,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中温度不变,随着反应的进行,反应物的浓度变小,而反应速率加快,只能是生成的Mn2+作催化剂.
【解答】解:(1)沉淀过程为一水合氨沉淀亚铁离子的过程,生成氢氧化亚铁,氢氧化亚铁不稳定,受热会分解,另外一水合氨受热也会分解,故反应温度不能太高,所以温度不宜过高的原因除了控制沉淀的粒径外,还有NH3 H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解;
故答案为:NH3 H2O受热易分解,挥发出NH3,Fe(OH)2受热也易分解;
(2)沉淀前的溶液中含有硫酸亚铁,沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀和硫酸铵,所以副产品含有是(NH4)2SO4;
故答案为:(NH4)2SO4;
(3)由题意知氧化C2O42﹣和Fe2+共消耗0.2000
mol L﹣1标准KMnO4溶液体积30.40
mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.40mL,所以C2O42﹣消耗KMnO4溶液体积为(30.40﹣10.40)=20mL,由5C2O42﹣+2MnO4﹣+16H+=10CO2↑+2Mn2++8H2O得5C2O42﹣~2MnO4﹣,所以n(C2O42﹣)=n(MnO4﹣)=20ml×10﹣3×0.2000mol L﹣1×=0.01mol;
故答案为:0.01mol;
(4)从图象上观察,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中温度不变,随着反应的进行,反应物的浓度变小,而反应速率加快,只能是生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快;
故答案为:生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快.
2016年12月14日
