江西省宜春市2016届高考化学二模试卷(解析版)
文档属性
| 名称 | 江西省宜春市2016届高考化学二模试卷(解析版) |

|
|
| 格式 | zip | ||
| 文件大小 | 298.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-01-03 00:00:00 | ||
图片预览




文档简介
2016年江西省宜春市高考化学二模试卷
一、选择题(共7小题,每小题6分,满分42分)
1.“化学﹣我们的生活、我们的未来”.下列有关知识叙述正确的是( )
A.Na+、Fe3+是人体所需微量元素
B.苯酚不能用于杀菌消毒
C.氢气是未来的一种理想燃料
D.乙醇是不可再生的生物质能源
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.常温常压下,2.8gCO与N2混合气体中含有的原子总数为0.2NA
B.标准状况下,2.24L乙烷含有分子的数目为0.1NA
C.1L1mol L﹣1的CuCl2溶液中含有Cu2+的数目为NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
3.现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离子平衡.六种元素的原子半径与原序数的关系如图所示.下列推断正确的是( )
A.原子半径和离子半径均满足:Y<Z
B.与同主族元素的氢化物相比较,R和Y的氢化物最稳定
C.最高价氧化物对应的水化物的酸性:T<R
D.由X、Y、Z、T四种元素组成的化合物水溶液一定显碱性
4.下列解释实验事实的方程式正确的是( )
A.氨水中滴入酚酞溶液,溶液变红:NH3 H2O=NH4++OH﹣
B.90℃时,测得纯水中c(H+) c(OH﹣)=3.8×10﹣13:H2O(l) H+(aq)+OH﹣(aq)△H<0
C.向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3
D.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2
+2H2O=2Fe2++SO42﹣+4H+
5.分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )
A.7种
B.8种
C.9种
D.10种
6.下列实验方案、现象和结论均正确的是( )
选项
A
B
C
D
实验方案
现象
导管中有红色柱
注射器的活塞往外推
高锰酸钾酸性溶液褪色
带火星的木条复燃
结论或作用
证明铁钉发生吸氧腐蚀
可用于测定反应物浓度对反应速率的影响
溴乙烷与NaOH乙醇溶液反应生成的气体是乙烯
MnO2可与H2O2反应生成O2
A.A
B.B
C.C
D.D
7.一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
A.K+移向催化剂b
B.催化剂a表面发生的化学反应:[Fe(CN)6]4﹣﹣e﹣═[Fe(CN)6]3﹣
C.Fe(CN)63﹣在催化剂b表面被氧化
D.电解池溶液中的[Fe(CN)6]4﹣和[Fe(CN)6]3﹣浓度基本保持不变
二、解答题(共3小题,满分43分)
8.新型无机非金属材料甲和乙均是高温陶瓷材料,硬度大、熔点高、化学性质稳定.甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成.甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g L﹣1,在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解.Z元素的氧化物是制造光导纤维的主要材料,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙.请回答下列问题:(1)乙的化学式为 ;丙的电子式为 .
(2)甲与NaOH浓溶液共热的化学方程式为 .
(3)丁溶液中通入少量CO2的离子方程式为 .
(4)高温条件下,丙与Fe2O3反应生成Fe和X单质,写出该反应的化学方程式为 ,有人提出生成的产物Fe中可能还有FeO,请设计实验方案验证之(用化学方法) .
(5)工业上在X单质的气氛下将Z的氧化物和焦炭加热到1400℃~1450℃的条件下以制备乙,反应中还生成一种常见的可燃性气体戊,该反应的化学方程式为 .
9.查阅资料:无水醋酸钠是无色无味的结晶体,在空气中可被风化,可燃.用无水醋酸钠与碱石灰加热可以制得X气体,并进行相应的实验:
(1)装置E中反应方程式是CH3COONa+NaOHNa2CO3+X↑,X的化学式是 .
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①C装置所盛放液体试剂是 ;
②B装置的作用是 ;光照后所得产物有 种;
③装置D的作用是 ;
(3)某学生为了测定X的组成进行实验探究,选用了F、G、H仪器:
①该同学依次连接的合理顺序是E、 ;
②该同学测定的相关数据是:
装置
实验前的质量/g
实验后的质量/g
F
22.5
33.6
H
42.4
51.4
数据是否完全,说明原因 ;
由以上数据可知X中碳氢两种原子的物质的量之比 (选填“>”、“<”)1:4,造成这种结果的原因是 .
10.随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2OC6H12O6
b.CO2+3H2CH3OH+H2O
c.CO2+CH4CH3COOH
d.2CO2+6H2CH2=CH2+4H2O
在以上属于人工转化的反应中,原子利用率最高的是 (填序号).
(2)CO2制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ mol﹣1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图1所示.
①该反应化学平衡常数K的表达式是 .
②0~9min时间内,该反应的平均反应速率v(H2)= .
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是 (填字母序号).
a.0<Q<29.5kJ
b.29.5kJ<Q<36.75kJ
c.36.75kJ<Q<49kJ
d.49kJ<Q<98kJ
④在一定条件下,体系中CO2的平衡转化率(a)与L和X的关系如图2所示,L和X分别表示温度或压强.
i.X压强的物理量是 .
ii.L1和L2的大小关系是 ,简述理由: .
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.工业上利用水煤气合成二甲醚的三步反应如下:
a.2H2(g)+CO(g) CH3OH(g)△H1=﹣90.8kJ mol﹣1
b.2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=﹣23.5kJ mol﹣1
c.CO(g)+H2O(g) CO2(g)+H2(g)△H3=﹣41.3kJ mol﹣1
①对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是 (填字母).
a.n(CH3OH)=n(CH3OCH3)=n(H2O)
b.容器内压强保持不变
c.H2O(g)的浓度保持不变
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
②总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= .
(4)以KOH溶液为电解质溶液,用二甲醚﹣空气组成燃料,其中负极的电极反应式为 .
(5)C1化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质.写出CO与氮氧化物(NOx)在有催化剂的条件下反应的化学方程式 .
三、解答题(共1小题,满分15分)【化学-选修5有机化学基础】
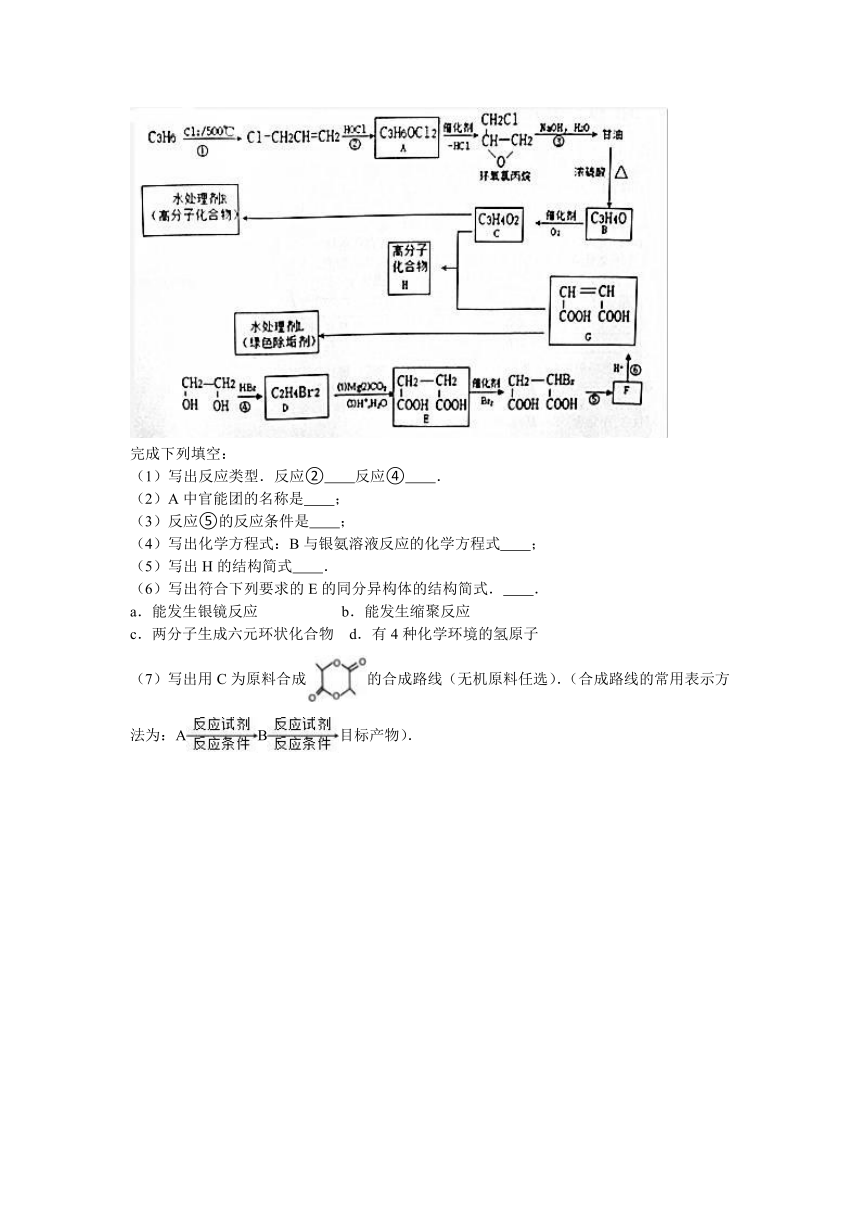
11.水处理剂能使工业循环冷却系统保持良好状态.以下是两种新型水处理剂的合成方法
完成下列填空:
(1)写出反应类型.反应② 反应④ .
(2)A中官能团的名称是 ;
(3)反应⑤的反应条件是 ;
(4)写出化学方程式:B与银氨溶液反应的化学方程式 ;
(5)写出H的结构简式 .
(6)写出符合下列要求的E的同分异构体的结构简式. .
a.能发生银镜反应
b.能发生缩聚反应
c.两分子生成六元环状化合物
d.有4种化学环境的氢原子
(7)写出用C为原料合成的合成路线(无机原料任选).(合成路线的常用表示方法为:AB目标产物).
2016年江西省宜春市高考化学二模试卷
参考答案与试题解析
一、选择题(共7小题,每小题6分,满分42分)
1.“化学﹣我们的生活、我们的未来”.下列有关知识叙述正确的是( )
A.Na+、Fe3+是人体所需微量元素
B.苯酚不能用于杀菌消毒
C.氢气是未来的一种理想燃料
D.乙醇是不可再生的生物质能源
【考点】有机物的结构和性质;物质的组成、结构和性质的关系.
【分析】A.Na不是微量元素;
B.苯酚可使蛋白质变性;
C.氢气燃烧产物为水;
D.乙醇可由淀粉和纤维素制取.
【解答】解:A.人体中的常量元素主要有:氧、碳、氢、氮、钙、磷、钾、硫、钠、氯、镁;微量元素主要有:铁、钴、铜、锌、铬、锰、钼、氟、碘、硒,Na不是微量元素,故A错误;
B.苯酚可使蛋白质变性,可用于杀菌消毒,故B错误;
C.氢气燃烧产物为水,对环境无污染,为清洁燃料,故C正确;
D.乙醇可由淀粉和纤维素制取,乙醇是可再生的生物质能源,故D错误.
故选C.
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.常温常压下,2.8gCO与N2混合气体中含有的原子总数为0.2NA
B.标准状况下,2.24L乙烷含有分子的数目为0.1NA
C.1L1mol L﹣1的CuCl2溶液中含有Cu2+的数目为NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
【考点】阿伏加德罗常数.
【分析】A、CO和氮气的摩尔质量均为28g/mol,且均为双原子分子;
B、分子个数N=;
C、铜离子为弱碱阳离子,在溶液中会水解;
D、过氧化钠与氧气反应时,氧元素的价态由﹣1价变为0价.
【解答】解:A、CO和氮气的摩尔质量均为28g/mol,故2.8g混合物的物质的量为0.1mol,且两者均为双原子分子,故0.1mol混合物中含0.2NA个原子,故A正确;
B、分子个数N===0.1NA个,故B正确;
C、铜离子为弱碱阳离子,在溶液中会水解,故溶液中的铜离子的个数小于NA个,故C错误;
D、过氧化钠与氧气反应时,氧元素的价态由﹣1价变为0价,故当生成0.1mol氧气时,转移0.2NA个电子,故D错误.
故选AB.
3.现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离子平衡.六种元素的原子半径与原序数的关系如图所示.下列推断正确的是( )
A.原子半径和离子半径均满足:Y<Z
B.与同主族元素的氢化物相比较,R和Y的氢化物最稳定
C.最高价氧化物对应的水化物的酸性:T<R
D.由X、Y、Z、T四种元素组成的化合物水溶液一定显碱性
【考点】原子结构与元素周期律的关系.
【分析】R原子最外层电子数是电子层数的2倍,可能为C或S,由于图示原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2,则Y为O,Z为Na;Z与T形成的Z2T化合物能破坏水的电离平衡,T应为S,Na2S水解呈碱性,可促进水的电离;X的原子半径最小,原子序数最小,应为H元素,结合对应单质、化合物的性质以及题目要求解答该题.
【解答】解:R原子最外层电子数是电子层数的2倍,可能为C或S,由于图示原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2,则Y为O,Z为Na;Z与T形成的Z2T化合物能破坏水的电离平衡,T应为S,Na2S水解呈碱性,可促进水的电离;X的原子半径最小,原子序数最小,应为H元素.
A.原子半径O>Na,离子半径O2﹣>Na+,故A错误;
B.R为碳元素,Y为O元素,同主族中二者非金属性最强,同主族元素的氢化物相比较,R和Y的氢化物最稳定,故B正确;
C.T、R元素最高价含氧酸分别为硫酸、碳酸,碳酸为弱酸,硫酸为强酸,故C错误;
D.由H、O、Na、S四种元素组成的化合物可以为NaHSO4,其溶液呈酸性,故D错误.
故选B.
4.下列解释实验事实的方程式正确的是( )
A.氨水中滴入酚酞溶液,溶液变红:NH3 H2O=NH4++OH﹣
B.90℃时,测得纯水中c(H+) c(OH﹣)=3.8×10﹣13:H2O(l) H+(aq)+OH﹣(aq)△H<0
C.向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3
D.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2
+2H2O=2Fe2++SO42﹣+4H+
【考点】弱电解质在水溶液中的电离平衡;二氧化硫的化学性质.
【分析】A、一水合氨是弱电解质;
B、弱电解质的电离是吸热过程;
C、酸性强弱是H2CO3>C6H5OH>HCO3﹣;
D、向FeCl3溶液中通入一定量的SO2气体,溶液由黄色变为浅绿色,发生2Fe3++SO2+2H2O═2Fe2++SO42﹣+4H+;
【解答】解:A、一水合氨是弱电解质,所以电离用可逆符号,电离方程式为:NH3 H2O=NH4++OH﹣,故A错误;
B、弱电解质的电离是吸热过程,所以△H>0,故B错误;
C、酸性强弱是H2CO3>C6H5OH>HCO3﹣,所以反应方程式为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,故C错误
D、向FeCl3溶液中通入一定量的SO2气体,溶液由黄色变为浅绿色,发生2Fe3++SO2+2H2O═2Fe2++SO42﹣+4H+,故D正确;
故选D.
5.分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )
A.7种
B.8种
C.9种
D.10种
【考点】有机化合物的异构现象.
【分析】有机物A的分子式为C9H18O2,在酸性条件下水解为B和C两种有机物,则有机物A为酯,由于B与C相对分子质量相同,因此酸比醇少一个C原子,说明水解后得到的羧酸含有4个C原子,而得到的醇含有5个C原子,判断5个碳原子醇属于醇的同分异构体,其中能被氧化成羧酸,说明羟基所连碳上有2个氢原子,4个碳原子羧酸属于羧酸的异构体数目,据此判断有机物A的同分异构体数目.
【解答】解:有机物A的分子式为C9H18O2,在酸性条件下水解为B和C两种有机物,则有机物A为酯,由于B与C相对分子质量相同,因此酸比醇少一个C原子,说明水解后得到的羧酸含有4个C原子,而得到的醇含有5个C原子,含有4个C原子的羧酸有2种同分异构体:CH3CH2CH2COOH,CH3CH(CH3)COOH;
含有5个C原子的醇的有8种同分异构体:CH3CH2CH2CH2CH2OH,CH3CH2CH2CH(OH)CH3,CH3CH2CH(OH)CH2CH3;CH3CH2CH(CH3)CH2OH,CH3CH2C(OH)(CH3)CH3,CH3CH(OH)CH(CH3)CH3,CH2(OH)CH2CH(CH3)CH3;CH3C(CH3)2CH2OH,其中醇能能被氧化成羧酸,说明羟基所连碳上有2个氢原子,共有4种,所以有机物甲的同分异构体数目有2×4=8;
故选B.
6.下列实验方案、现象和结论均正确的是( )
选项
A
B
C
D
实验方案
现象
导管中有红色柱
注射器的活塞往外推
高锰酸钾酸性溶液褪色
带火星的木条复燃
结论或作用
证明铁钉发生吸氧腐蚀
可用于测定反应物浓度对反应速率的影响
溴乙烷与NaOH乙醇溶液反应生成的气体是乙烯
MnO2可与H2O2反应生成O2
A.A
B.B
C.C
D.D
【考点】化学实验方案的评价.
【分析】A.中性条件下,钢铁发生吸氧腐蚀,导致导气管中水液面上升;
B.应该用分液漏斗;
C.乙醇也能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
D.二氧化锰作催化剂.
【解答】解:A.中性条件下,钢铁发生吸氧腐蚀,导致导气管中水液面上升,所以可以实现实验目的,故A选;
B.应该用分液漏斗,否则生成的氢气逸出,故B不选;
C.乙醇也能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,应该用溴水检验乙烯,故C不选;
D.二氧化锰作催化剂,能加快反应速率,故D不选;
故选A.
7.一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
A.K+移向催化剂b
B.催化剂a表面发生的化学反应:[Fe(CN)6]4﹣﹣e﹣═[Fe(CN)6]3﹣
C.Fe(CN)63﹣在催化剂b表面被氧化
D.电解池溶液中的[Fe(CN)6]4﹣和[Fe(CN)6]3﹣浓度基本保持不变
【考点】原电池和电解池的工作原理.
【分析】由图可知,电子从负极流向正极,则a为负极,b为正极,负极发生氧化反应,正极发生还原反应,阳离子向正极移动,以此来解答.
【解答】解:由图可知,电子从负极流向正极,则a为负极,b为正极,
A.b为正极,则K+移向催化剂b,故A正确;
B.a为负极,发生氧化反应,则催化剂a表面发生反应:Fe(CN)64﹣﹣e﹣═Fe(CN)63﹣,故B正确;
C.b上发生还原反应,发生Fe(CN)63﹣+e﹣═Fe(CN)64﹣,Fe(CN)63﹣在催化剂b表面被还原,故C错误;
D.由B、C中的电极反应可知,二者以1:1相互转化,电解质溶液中Fe(CN)63﹣和Fe(CN)64﹣浓度基本保持不变,故D正确;
故选C.
二、解答题(共3小题,满分43分)
8.新型无机非金属材料甲和乙均是高温陶瓷材料,硬度大、熔点高、化学性质稳定.甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成.甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g L﹣1,在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解.Z元素的氧化物是制造光导纤维的主要材料,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙.请回答下列问题:(1)乙的化学式为 Si3N4 ;丙的电子式为 .
(2)甲与NaOH浓溶液共热的化学方程式为 AlN+NaOH+H2O=NaAlO2+NH3↑; .
(3)丁溶液中通入少量CO2的离子方程式为 2AlO2﹣+3H2O+CO2=2Al(OH)3↓+CO32﹣; .
(4)高温条件下,丙与Fe2O3反应生成Fe和X单质,写出该反应的化学方程式为 2NH3+Fe2O32Fe+3H2O+N2 ,有人提出生成的产物Fe中可能还有FeO,请设计实验方案验证之(用化学方法) 取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成 .
(5)工业上在X单质的气氛下将Z的氧化物和焦炭加热到1400℃~1450℃的条件下以制备乙,反应中还生成一种常见的可燃性气体戊,该反应的化学方程式为 3SiO2+2N2+6CSi3N4+6CO .
【考点】位置结构性质的相互关系应用.
【分析】根据丙在标准状况下的密度为0.76g L﹣1,可知丙的摩尔质量为:M=ρVm=0.76g L﹣1×22.4L/mol≈17g/mol,丙为NH3,则甲中含有N元素;在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,说明丁中含有铝元素,则甲中含有Al元素,所以甲为AlN;丙为铝的化合物,又是与氢氧化钠溶液生成的化合物,所以丙为NaAlO2;Z元素的氧化物是制造光导纤维的主要材料,所以Z为Si元素,而X、Y、Z三种短周期元素且原子序数依次增大,所以X为N、Y为Al,Z为Si;在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙,即:0.1mol氮气与0.15molSi反应,生成的乙中氮原子与硅原子个数之比为:0.2:0.15=4:3,所以乙的化学式为:Si3N4;根据以上分析进行解答.
【解答】解:丙在标准状况下的密度为0.76g L﹣1,根据M=ρVm=0.76g L﹣1×22.4L/mol≈17g/mol,所以丙为NH3,甲中含有N元素;在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,说明丁中含有铝元素,则甲中含有Al元素,故甲为AlN;丙为铝的化合物,又是与氢氧化钠溶液生成的化合物,所以丙为NaAlO2;Z元素的氧化物是制造光导纤维的主要材料,所以Z为Si元素,而X、Y、Z三种短周期元素且原子序数依次增大,所以X为N、Y为Al,Z为Si;在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙,即:0.1mol氮气与0.15molSi反应,生成的乙中氮原子与硅原子个数之比为:0.2:0.15=4:3,所以乙的化学式为:Si3N4;
(1)根据以上分析可知,乙的化学式为:Si3N4;丙为氨气,氨气为共价化合物,氨气的电子式为:,
故答案为:Si3N4;;
(2)甲为AlN,AlN与NaOH浓溶液共热生成了氨气和偏铝酸钠,反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)丁溶液为偏铝酸钠溶液,偏铝酸根离子与二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为:2AlO2﹣+3H2O+CO2=2Al(OH)3↓+CO32﹣,
故答案为:2AlO2﹣+3H2O+CO2=2Al(OH)3↓+CO32﹣;
(4)丙为氨气,X的单质为氮气,高温条件下,氨气与Fe2O3反应生成Fe和氮气单质,反应的化学方程式为:2NH3+Fe2O32Fe+3H2O+N2;产物Fe中可能还有FeO,需要先除掉铁,然后用盐酸溶解,再检验是否含有亚铁离子,方法为:取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成,
故答案为:取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成;
故答案为:2NH3+Fe2O32Fe+3H2O+N2;取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成;
(5)X的单质为N2,Z的氧化物为SiO2,工业上在N2的气氛下将Z的氧化物SiO2和焦炭加热到1400℃~1450℃的条件下以制备乙,乙为Si3N4,反应中还生成一种常见的可燃性气体戊,根据原子守恒,可燃性气体中含有C,所以为CO,该反应的化学方程式为:3SiO2+2N2+6CSi3N4+6CO,
故答案为:3SiO2+2N2+6CSi3N4+6CO.
9.查阅资料:无水醋酸钠是无色无味的结晶体,在空气中可被风化,可燃.用无水醋酸钠与碱石灰加热可以制得X气体,并进行相应的实验:
(1)装置E中反应方程式是CH3COONa+NaOHNa2CO3+X↑,X的化学式是 CH4 .
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①C装置所盛放液体试剂是 饱和食盐水 ;
②B装置的作用是 除去Cl2中含有的HCl ;光照后所得产物有 5 种;
③装置D的作用是 连通大气,平衡压强;接收可能溢出的液体 ;
(3)某学生为了测定X的组成进行实验探究,选用了F、G、H仪器:
①该同学依次连接的合理顺序是E、 G、H、F ;
②该同学测定的相关数据是:
装置
实验前的质量/g
实验后的质量/g
F
22.5
33.6
H
42.4
51.4
数据是否完全,说明原因 数据是不完全,因为只能确定有机物中的碳氢元素含量,不能确定是否含有氧元素,应称取C
装置实验前后的质量 ;
由以上数据可知X中碳氢两种原子的物质的量之比 > (选填“>”、“<”)1:4,造成这种结果的原因是 F
装置后面与空气接触,空气中的水蒸气和CO2进入了F
装置,造成含碳量偏大 .
【考点】制备实验方案的设计.
【分析】(1)依据原子守恒判断产物的化学式;
(2)装置A是氯气发生装置,生成的氯气中含氯化氢气体,需要通过饱和食盐水除去,装置E是甲烷气体发生装置,氯气和甲烷按照1:1体积混合光照发生取代反应,装置C中是饱和食盐水减少氯气的溶解,使甲烷和氯气混合均匀,反应得到四种取代产物和氯化氢气体,通过D使C连通大气,平衡压强,接收可能溢出的液体;
(3)①为了测定X为CH4的组成,利用装置E制备甲烷,得到气体通过装置G中的氧化铜反应,用浓硫酸吸收生成水,用碱石灰吸收生成的二氧化碳;
②实验数据只能计算碳和氢元素物质的量之比,不能确定是否含氧元素;
F中吸收的是CO2,CO2质量33.6g﹣22.5g=11.1g,n(C)==0.252mol;H
中吸收的是水蒸气,H2O质量5
1.4g﹣42.4g=9.0g,n(H)=×2=1.0mol;故n(C):n(H)>1:4,碱石灰会吸收空气中二氧化碳、水蒸气导致误差产生.
【解答】解:(1)装置E中反应方程式是CH3COONa+NaOHNa2CO3+X↑,由原子守恒,可知X的化学式是CH4,
故答案为:CH4;
(2)装置A是氯气发生装置,生成的氯气中含氯化氢气体,需要通过饱和食盐水除去,装置E是甲烷气体发生装置,氯气和甲烷按照1:1体积混合光照发生取代反应,装置C中是饱和食盐水减少氯气的溶解,使甲烷和氯气混合均匀,反应得到四种取代产物和氯化氢气体,通过D使C连通大气,平衡压强,接收可能溢出的液体;
①C装置中盛有饱和食盐水,故答案为:饱和食盐水;
②B装置的作用是除去Cl2中含有的HCl,光照后氯气和甲烷发生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷和氯化氢,故答案为:除去Cl2中含有的HCl;5;
③装置D的作用是:连通大气,平衡压强;接收可能溢出的液体,故答案为:连通大气,平衡压强;接收可能溢出的液体;
(3)①为了测定X为CH4的组成,利用装置E制备甲烷,得到气体通过装置G中的氧化铜反应,生成水和二氧化碳,用浓硫酸吸收生成水,用碱石灰吸收生成的二氧化碳,装置连接顺序为EGHF,
故答案为:G、H、F;
②实验数据只能计算碳和氢元素物质的量之比,不能确定是否含氧元素,所以应依据质量守恒分析判断是否含氧元素,需要称取C装置实验前后的质量;
F中吸收的是CO2,CO2质量33.6g﹣22.5g=11.1g,n(C)==0.252mol;H
中吸收的是水蒸气,H2O质量5
1.4g﹣42.4g=9.0g,n(H)=×2=1.0mol;故n(C):n(H)>1:4,所以计算结果可知测得有误差,原因是F
装置后面与空气接触,空气中的水蒸气和CO2
进入了F
装置,造成含碳量偏大,
故答案为:数据是不完全,因为只能确定有机物中的碳氢元素含量,不能确定是否含有氧元素,应称取C
装置实验前后的质量;F
装置后面与空气接触,空气中的水蒸气和CO2进入了F
装置,造成含碳量偏大.
10.随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2OC6H12O6
b.CO2+3H2CH3OH+H2O
c.CO2+CH4CH3COOH
d.2CO2+6H2CH2=CH2+4H2O
在以上属于人工转化的反应中,原子利用率最高的是 c (填序号).
(2)CO2制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ mol﹣1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图1所示.
①该反应化学平衡常数K的表达式是 .
②0~9min时间内,该反应的平均反应速率v(H2)= 0.25mol/L min .
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是 c (填字母序号).
a.0<Q<29.5kJ
b.29.5kJ<Q<36.75kJ
c.36.75kJ<Q<49kJ
d.49kJ<Q<98kJ
④在一定条件下,体系中CO2的平衡转化率(a)与L和X的关系如图2所示,L和X分别表示温度或压强.
i.X压强的物理量是 温度 .
ii.L1和L2的大小关系是 L1>L2 ,简述理由: 温度一定时,增大压强,CO2平衡转化率增大 .
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.工业上利用水煤气合成二甲醚的三步反应如下:
a.2H2(g)+CO(g) CH3OH(g)△H1=﹣90.8kJ mol﹣1
b.2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=﹣23.5kJ mol﹣1
c.CO(g)+H2O(g) CO2(g)+H2(g)△H3=﹣41.3kJ mol﹣1
①对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是 cd (填字母).
a.n(CH3OH)=n(CH3OCH3)=n(H2O)
b.容器内压强保持不变
c.H2O(g)的浓度保持不变
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
②总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= ﹣246.4kJ mol﹣1 .
(4)以KOH溶液为电解质溶液,用二甲醚﹣空气组成燃料,其中负极的电极反应式为 CH3OCH3﹣12e﹣+16OH﹣=2CO32﹣+11H2O .
(5)C1化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质.写出CO与氮氧化物(NOx)在有催化剂的条件下反应的化学方程式 2xCO+2NOx2xCO2+N2 .
【考点】化学平衡的计算;化学平衡的影响因素;化学平衡状态的判断.
【分析】(1)原子利用率最高,力求反应物分子中的所有原子全都转化到目标产物中,理想状态的原子利用率为100%;
(2)①平衡常数K=;
②图象读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率,依据反应速率之比等于化学方程式计量数之比得到氢气反应速率;
③反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49KJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49KJ,结合图象中二氧化碳转化率计算此时达到平衡放出的热量,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多;
④反应是气体体积减小的放热反应,升温平衡逆向进行,增大压强平衡正向进行,据此分析图象确定表示的物理量;
(3)①当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,
a、是某一时刻的特殊值,不能说明反应已达到平衡;
b、任意时刻该反应的压强都不变;不能说明反应已达到平衡;某一物质的浓度保持不变说明达到平衡;
c、浓度不变时为平衡的标志;
d、消耗速率得出CH3OH的正、逆反应速率相等,说明反应达到平衡;
②利用热化学方程式和盖斯定律计算所需热化学方程式,热化学方程式2a+b+c计算得到;
(4)根据燃料电池为燃料作负极失电子发生氧化反应,结合电解质溶液书写负极电极反应式;
(5)氮氧化物和一氧化碳反应生成氮气和二氧化碳,根据化合价升降相等配平.
【解答】解:(1)a.6CO2+6H2OC6H12O6,是自然界中实现的转化,原子利用率100%,但不是人工转化,故a不符合;
b.CO2=3H2CH3OH+H2O,反应中原子利用率不是100%,故b不符合;
c.CO2+CH4CH3COOH,反应后原子利用率为100%,故c符合;
d.2CO2+6H2CH2=CH2+4H2反应中原子利用率不是100%,故d不符合
故答案为:c;
(2)①CO2(g)+3H2(g) CH3OH(g)+H2O(g),该反应的平衡常数K=,
故答案为:;
②图象读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率=,反应速率之比等于化学方程式计量数之比,V(H2)=3V(CH3OH(g)=3×=0.25mol/L min,
故答案为:0.25mol/L min;
③CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ mol﹣1,反应达到平衡状态消耗二氧化碳物质的量浓度=1mol/L﹣0.25mol/L=0.75mol/L,物质的量为0.75mol,反应放出热量=49KJ/mol×0.75mol=36.75KJ,反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49KJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49KJ,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多,大于36.75KJ,则36.75<Q<49,
故答案为:c;
④CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ mol﹣1,反应是气体体积减小的放热反应,
i.温度升高,平衡逆向进行,二氧化碳转化率减小,所以X为温度,L为压强,
故答案为:温度;
ii.温度一定压强增大平衡正向进行二氧化碳转化率增大,所以L1>L2,
故答案为:L1>L2;温度一定时,增大压强,CO2平衡转化率增大;
(3)①a.达到平衡时,物质的量不变,不是相等,故a错误;
b.该反应是一个反应前后气体体积不变的反应,无论该反应是否达到平衡状态,压强始终不变,所以不能根据平衡体系的总压判断是否达到平衡状态,故b错误;
c.平衡时各物质的浓度不变,故c正确;
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1,符合正逆反应速率相等,故d正确;
故选cd,
故答案为:cd;
②a、2H2(g)+CO(g) CH3OH(g)△H=﹣90.8kJ mol﹣1
b、2CH3OH(g) CH3OCH3(g)+H2O(g)△H=﹣23.5kJ mol﹣1
c、CO(g)+H2O(g) CO2(g)+H2(g)△H=﹣41.3kJ mol﹣1
由盖斯定律可知,通过a×2+b+c可得所求热反应方程式,3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)△H=﹣90.8kJ mol﹣1×2﹣23.5kJ mol﹣1﹣41.3kJ mol﹣1=﹣246.4kJ mol﹣1;
故答案为:﹣246.4kJ mol﹣1;
(4)燃料电池为燃料作负极失电子发生氧化反应,又电解质溶液为KOH,所以负极电极反应式为:CH3OCH3﹣12e﹣+16OH﹣=2CO32﹣+11H2O,
故答案为:CH3OCH3﹣12e﹣+16OH﹣=2CO32﹣+11H2O;
(5)氮氧化物和一氧化碳反应生成氮气和二氧化碳,根据氮元素化合价变化,配平反应的方程式,反应的化学方程式为:2xCO+2NOx2xCO2+N2,
故答案为:2xCO+2NOx2xCO2+N2;
三、解答题(共1小题,满分15分)【化学-选修5有机化学基础】
11.水处理剂能使工业循环冷却系统保持良好状态.以下是两种新型水处理剂的合成方法
完成下列填空:
(1)写出反应类型.反应② 加成反应 反应④ 取代反应 .
(2)A中官能团的名称是 羟基、氯原子 ;
(3)反应⑤的反应条件是 氢氧化钠醇溶液、加热 ;
(4)写出化学方程式:B与银氨溶液反应的化学方程式 CH2=CH﹣CHO+2[Ag(NH3)2]OHCH2=CH﹣COONH4+2Ag+3NH3↑+H2O ;
(5)写出H的结构简式 .
(6)写出符合下列要求的E的同分异构体的结构简式. .
a.能发生银镜反应
b.能发生缩聚反应
c.两分子生成六元环状化合物
d.有4种化学环境的氢原子
(7)写出用C为原料合成的合成路线(无机原料任选).(合成路线的常用表示方法为:AB目标产物).
【考点】有机物的合成.
【分析】在500℃条件下,丙烯和氯气发生取代反应生成3﹣氯丙烯,3﹣氯丙烯和HOCl发生加成反应生成A,A发生消去反应生成环氧氯丙烷,可知A为ClCH2CH(OH)CH2OH.环氧氯丙烷和氢氧化钠的水溶液反应生成丙三醇,在浓硫酸作催化剂、加热条件下,丙三醇反应生成B,B能被氧化生成C,C比B中多一个氧原子,则B中含有醛基,C中含有羧基,B的不饱和度==2,所以B是CH2=CHCHO,C是CH2=CHCOOH,C发生加聚反应得到水处理剂R为.C和G发生加聚反应生成高分子化合物H为:;G发生加聚反应生成L结构简式为:,乙二醇和氢溴酸发生取代反应生成1,2﹣二溴乙烷,1,2﹣二溴乙烷反应生成1,4﹣丁二酸,1,4﹣丁二酸和溴发生取代反应生成HOOCCH2CHBrCOOH,HOOCCH2CHBrCOOH和氢氧化钠的醇溶液发生消去反应生成NaOOCCH=CHCOONa,然后酸化生成G.
(7)C是丙烯酸,用C为原料合成,可以先用丙烯酸与水加成生成2﹣羟基丙酸,再用2﹣羟基丙酸发生酯化可得.
【解答】解:在500℃条件下,丙烯和氯气发生取代反应生成3﹣氯丙烯,3﹣氯丙烯和HOCl发生加成反应生成A,A发生消去反应生成环氧氯丙烷,可知A为ClCH2CH(OH)CH2OH.环氧氯丙烷和氢氧化钠的水溶液反应生成丙三醇,在浓硫酸作催化剂、加热条件下,丙三醇反应生成B,B能被氧化生成C,C比B中多一个氧原子,则B中含有醛基,C中含有羧基,B的不饱和度==2,所以B是CH2=CHCHO,C是CH2=CHCOOH,C发生加聚反应得到水处理剂R为.C和G发生加聚反应生成高分子化合物H为:;G发生加聚反应生成L结构简式为:,乙二醇和氢溴酸发生取代反应生成1,2﹣二溴乙烷,1,2﹣二溴乙烷反应生成1,4﹣丁二酸,1,4﹣丁二酸和溴发生取代反应生成HOOCCH2CHBrCOOH,HOOCCH2CHBrCOOH和氢氧化钠的醇溶液发生消去反应生成NaOOCCH=CHCOONa,然后酸化生成G.
(1)反应②发生加成反应,反应④发生取代反应,故答案为:加成反应;取代反应;
(2)A为ClCH2CH(OH)CH2OH,官能团的名称是:羟基、氯原子,故答案为:羟基、氯原子;
(3)反应⑤发生卤代烃的消去反应,的反应条件是:氢氧化钠醇溶液、加热,故答案为:氢氧化钠醇溶液、加热;
(4)B是丙烯醛,丙烯醛和银氨溶液反应方程式为:CH2=CH﹣CHO+2[Ag(NH3)2]OHCH2=CH﹣COONH4+2Ag+3NH3↑+H2O,
故答案为:CH2=CH﹣CHO+2[Ag(NH3)2]OHCH2=CH﹣COONH4+2Ag+3NH3↑+H2O;
(5)H的结构简式为:,故答案为:;
(6)符合下列要求的E的同分异构体:a.能发生银镜反应,说明含有醛基,b.能发生缩聚反应,说明含有醇羟基和羧基,c.两分子生成六元环状化合物
d.有4种化学环境的氢原子,则符合条件的E的同分异构体结构简式为,
故答案为:;
(7)C是丙烯酸,用C为原料合成,可以先用丙烯酸与水加成生成2﹣羟基丙酸,再用2﹣羟基丙酸发生酯化可得,合成路线流程图为:,
故答案为:.
2016年12月18日
一、选择题(共7小题,每小题6分,满分42分)
1.“化学﹣我们的生活、我们的未来”.下列有关知识叙述正确的是( )
A.Na+、Fe3+是人体所需微量元素
B.苯酚不能用于杀菌消毒
C.氢气是未来的一种理想燃料
D.乙醇是不可再生的生物质能源
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.常温常压下,2.8gCO与N2混合气体中含有的原子总数为0.2NA
B.标准状况下,2.24L乙烷含有分子的数目为0.1NA
C.1L1mol L﹣1的CuCl2溶液中含有Cu2+的数目为NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
3.现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离子平衡.六种元素的原子半径与原序数的关系如图所示.下列推断正确的是( )
A.原子半径和离子半径均满足:Y<Z
B.与同主族元素的氢化物相比较,R和Y的氢化物最稳定
C.最高价氧化物对应的水化物的酸性:T<R
D.由X、Y、Z、T四种元素组成的化合物水溶液一定显碱性
4.下列解释实验事实的方程式正确的是( )
A.氨水中滴入酚酞溶液,溶液变红:NH3 H2O=NH4++OH﹣
B.90℃时,测得纯水中c(H+) c(OH﹣)=3.8×10﹣13:H2O(l) H+(aq)+OH﹣(aq)△H<0
C.向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3
D.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2
+2H2O=2Fe2++SO42﹣+4H+
5.分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )
A.7种
B.8种
C.9种
D.10种
6.下列实验方案、现象和结论均正确的是( )
选项
A
B
C
D
实验方案
现象
导管中有红色柱
注射器的活塞往外推
高锰酸钾酸性溶液褪色
带火星的木条复燃
结论或作用
证明铁钉发生吸氧腐蚀
可用于测定反应物浓度对反应速率的影响
溴乙烷与NaOH乙醇溶液反应生成的气体是乙烯
MnO2可与H2O2反应生成O2
A.A
B.B
C.C
D.D
7.一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
A.K+移向催化剂b
B.催化剂a表面发生的化学反应:[Fe(CN)6]4﹣﹣e﹣═[Fe(CN)6]3﹣
C.Fe(CN)63﹣在催化剂b表面被氧化
D.电解池溶液中的[Fe(CN)6]4﹣和[Fe(CN)6]3﹣浓度基本保持不变
二、解答题(共3小题,满分43分)
8.新型无机非金属材料甲和乙均是高温陶瓷材料,硬度大、熔点高、化学性质稳定.甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成.甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g L﹣1,在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解.Z元素的氧化物是制造光导纤维的主要材料,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙.请回答下列问题:(1)乙的化学式为 ;丙的电子式为 .
(2)甲与NaOH浓溶液共热的化学方程式为 .
(3)丁溶液中通入少量CO2的离子方程式为 .
(4)高温条件下,丙与Fe2O3反应生成Fe和X单质,写出该反应的化学方程式为 ,有人提出生成的产物Fe中可能还有FeO,请设计实验方案验证之(用化学方法) .
(5)工业上在X单质的气氛下将Z的氧化物和焦炭加热到1400℃~1450℃的条件下以制备乙,反应中还生成一种常见的可燃性气体戊,该反应的化学方程式为 .
9.查阅资料:无水醋酸钠是无色无味的结晶体,在空气中可被风化,可燃.用无水醋酸钠与碱石灰加热可以制得X气体,并进行相应的实验:
(1)装置E中反应方程式是CH3COONa+NaOHNa2CO3+X↑,X的化学式是 .
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①C装置所盛放液体试剂是 ;
②B装置的作用是 ;光照后所得产物有 种;
③装置D的作用是 ;
(3)某学生为了测定X的组成进行实验探究,选用了F、G、H仪器:
①该同学依次连接的合理顺序是E、 ;
②该同学测定的相关数据是:
装置
实验前的质量/g
实验后的质量/g
F
22.5
33.6
H
42.4
51.4
数据是否完全,说明原因 ;
由以上数据可知X中碳氢两种原子的物质的量之比 (选填“>”、“<”)1:4,造成这种结果的原因是 .
10.随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2OC6H12O6
b.CO2+3H2CH3OH+H2O
c.CO2+CH4CH3COOH
d.2CO2+6H2CH2=CH2+4H2O
在以上属于人工转化的反应中,原子利用率最高的是 (填序号).
(2)CO2制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ mol﹣1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图1所示.
①该反应化学平衡常数K的表达式是 .
②0~9min时间内,该反应的平均反应速率v(H2)= .
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是 (填字母序号).
a.0<Q<29.5kJ
b.29.5kJ<Q<36.75kJ
c.36.75kJ<Q<49kJ
d.49kJ<Q<98kJ
④在一定条件下,体系中CO2的平衡转化率(a)与L和X的关系如图2所示,L和X分别表示温度或压强.
i.X压强的物理量是 .
ii.L1和L2的大小关系是 ,简述理由: .
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.工业上利用水煤气合成二甲醚的三步反应如下:
a.2H2(g)+CO(g) CH3OH(g)△H1=﹣90.8kJ mol﹣1
b.2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=﹣23.5kJ mol﹣1
c.CO(g)+H2O(g) CO2(g)+H2(g)△H3=﹣41.3kJ mol﹣1
①对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是 (填字母).
a.n(CH3OH)=n(CH3OCH3)=n(H2O)
b.容器内压强保持不变
c.H2O(g)的浓度保持不变
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
②总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= .
(4)以KOH溶液为电解质溶液,用二甲醚﹣空气组成燃料,其中负极的电极反应式为 .
(5)C1化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质.写出CO与氮氧化物(NOx)在有催化剂的条件下反应的化学方程式 .
三、解答题(共1小题,满分15分)【化学-选修5有机化学基础】
11.水处理剂能使工业循环冷却系统保持良好状态.以下是两种新型水处理剂的合成方法
完成下列填空:
(1)写出反应类型.反应② 反应④ .
(2)A中官能团的名称是 ;
(3)反应⑤的反应条件是 ;
(4)写出化学方程式:B与银氨溶液反应的化学方程式 ;
(5)写出H的结构简式 .
(6)写出符合下列要求的E的同分异构体的结构简式. .
a.能发生银镜反应
b.能发生缩聚反应
c.两分子生成六元环状化合物
d.有4种化学环境的氢原子
(7)写出用C为原料合成的合成路线(无机原料任选).(合成路线的常用表示方法为:AB目标产物).
2016年江西省宜春市高考化学二模试卷
参考答案与试题解析
一、选择题(共7小题,每小题6分,满分42分)
1.“化学﹣我们的生活、我们的未来”.下列有关知识叙述正确的是( )
A.Na+、Fe3+是人体所需微量元素
B.苯酚不能用于杀菌消毒
C.氢气是未来的一种理想燃料
D.乙醇是不可再生的生物质能源
【考点】有机物的结构和性质;物质的组成、结构和性质的关系.
【分析】A.Na不是微量元素;
B.苯酚可使蛋白质变性;
C.氢气燃烧产物为水;
D.乙醇可由淀粉和纤维素制取.
【解答】解:A.人体中的常量元素主要有:氧、碳、氢、氮、钙、磷、钾、硫、钠、氯、镁;微量元素主要有:铁、钴、铜、锌、铬、锰、钼、氟、碘、硒,Na不是微量元素,故A错误;
B.苯酚可使蛋白质变性,可用于杀菌消毒,故B错误;
C.氢气燃烧产物为水,对环境无污染,为清洁燃料,故C正确;
D.乙醇可由淀粉和纤维素制取,乙醇是可再生的生物质能源,故D错误.
故选C.
2.设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.常温常压下,2.8gCO与N2混合气体中含有的原子总数为0.2NA
B.标准状况下,2.24L乙烷含有分子的数目为0.1NA
C.1L1mol L﹣1的CuCl2溶液中含有Cu2+的数目为NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
【考点】阿伏加德罗常数.
【分析】A、CO和氮气的摩尔质量均为28g/mol,且均为双原子分子;
B、分子个数N=;
C、铜离子为弱碱阳离子,在溶液中会水解;
D、过氧化钠与氧气反应时,氧元素的价态由﹣1价变为0价.
【解答】解:A、CO和氮气的摩尔质量均为28g/mol,故2.8g混合物的物质的量为0.1mol,且两者均为双原子分子,故0.1mol混合物中含0.2NA个原子,故A正确;
B、分子个数N===0.1NA个,故B正确;
C、铜离子为弱碱阳离子,在溶液中会水解,故溶液中的铜离子的个数小于NA个,故C错误;
D、过氧化钠与氧气反应时,氧元素的价态由﹣1价变为0价,故当生成0.1mol氧气时,转移0.2NA个电子,故D错误.
故选AB.
3.现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离子平衡.六种元素的原子半径与原序数的关系如图所示.下列推断正确的是( )
A.原子半径和离子半径均满足:Y<Z
B.与同主族元素的氢化物相比较,R和Y的氢化物最稳定
C.最高价氧化物对应的水化物的酸性:T<R
D.由X、Y、Z、T四种元素组成的化合物水溶液一定显碱性
【考点】原子结构与元素周期律的关系.
【分析】R原子最外层电子数是电子层数的2倍,可能为C或S,由于图示原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2,则Y为O,Z为Na;Z与T形成的Z2T化合物能破坏水的电离平衡,T应为S,Na2S水解呈碱性,可促进水的电离;X的原子半径最小,原子序数最小,应为H元素,结合对应单质、化合物的性质以及题目要求解答该题.
【解答】解:R原子最外层电子数是电子层数的2倍,可能为C或S,由于图示原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2,则Y为O,Z为Na;Z与T形成的Z2T化合物能破坏水的电离平衡,T应为S,Na2S水解呈碱性,可促进水的电离;X的原子半径最小,原子序数最小,应为H元素.
A.原子半径O>Na,离子半径O2﹣>Na+,故A错误;
B.R为碳元素,Y为O元素,同主族中二者非金属性最强,同主族元素的氢化物相比较,R和Y的氢化物最稳定,故B正确;
C.T、R元素最高价含氧酸分别为硫酸、碳酸,碳酸为弱酸,硫酸为强酸,故C错误;
D.由H、O、Na、S四种元素组成的化合物可以为NaHSO4,其溶液呈酸性,故D错误.
故选B.
4.下列解释实验事实的方程式正确的是( )
A.氨水中滴入酚酞溶液,溶液变红:NH3 H2O=NH4++OH﹣
B.90℃时,测得纯水中c(H+) c(OH﹣)=3.8×10﹣13:H2O(l) H+(aq)+OH﹣(aq)△H<0
C.向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3
D.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2
+2H2O=2Fe2++SO42﹣+4H+
【考点】弱电解质在水溶液中的电离平衡;二氧化硫的化学性质.
【分析】A、一水合氨是弱电解质;
B、弱电解质的电离是吸热过程;
C、酸性强弱是H2CO3>C6H5OH>HCO3﹣;
D、向FeCl3溶液中通入一定量的SO2气体,溶液由黄色变为浅绿色,发生2Fe3++SO2+2H2O═2Fe2++SO42﹣+4H+;
【解答】解:A、一水合氨是弱电解质,所以电离用可逆符号,电离方程式为:NH3 H2O=NH4++OH﹣,故A错误;
B、弱电解质的电离是吸热过程,所以△H>0,故B错误;
C、酸性强弱是H2CO3>C6H5OH>HCO3﹣,所以反应方程式为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,故C错误
D、向FeCl3溶液中通入一定量的SO2气体,溶液由黄色变为浅绿色,发生2Fe3++SO2+2H2O═2Fe2++SO42﹣+4H+,故D正确;
故选D.
5.分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )
A.7种
B.8种
C.9种
D.10种
【考点】有机化合物的异构现象.
【分析】有机物A的分子式为C9H18O2,在酸性条件下水解为B和C两种有机物,则有机物A为酯,由于B与C相对分子质量相同,因此酸比醇少一个C原子,说明水解后得到的羧酸含有4个C原子,而得到的醇含有5个C原子,判断5个碳原子醇属于醇的同分异构体,其中能被氧化成羧酸,说明羟基所连碳上有2个氢原子,4个碳原子羧酸属于羧酸的异构体数目,据此判断有机物A的同分异构体数目.
【解答】解:有机物A的分子式为C9H18O2,在酸性条件下水解为B和C两种有机物,则有机物A为酯,由于B与C相对分子质量相同,因此酸比醇少一个C原子,说明水解后得到的羧酸含有4个C原子,而得到的醇含有5个C原子,含有4个C原子的羧酸有2种同分异构体:CH3CH2CH2COOH,CH3CH(CH3)COOH;
含有5个C原子的醇的有8种同分异构体:CH3CH2CH2CH2CH2OH,CH3CH2CH2CH(OH)CH3,CH3CH2CH(OH)CH2CH3;CH3CH2CH(CH3)CH2OH,CH3CH2C(OH)(CH3)CH3,CH3CH(OH)CH(CH3)CH3,CH2(OH)CH2CH(CH3)CH3;CH3C(CH3)2CH2OH,其中醇能能被氧化成羧酸,说明羟基所连碳上有2个氢原子,共有4种,所以有机物甲的同分异构体数目有2×4=8;
故选B.
6.下列实验方案、现象和结论均正确的是( )
选项
A
B
C
D
实验方案
现象
导管中有红色柱
注射器的活塞往外推
高锰酸钾酸性溶液褪色
带火星的木条复燃
结论或作用
证明铁钉发生吸氧腐蚀
可用于测定反应物浓度对反应速率的影响
溴乙烷与NaOH乙醇溶液反应生成的气体是乙烯
MnO2可与H2O2反应生成O2
A.A
B.B
C.C
D.D
【考点】化学实验方案的评价.
【分析】A.中性条件下,钢铁发生吸氧腐蚀,导致导气管中水液面上升;
B.应该用分液漏斗;
C.乙醇也能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
D.二氧化锰作催化剂.
【解答】解:A.中性条件下,钢铁发生吸氧腐蚀,导致导气管中水液面上升,所以可以实现实验目的,故A选;
B.应该用分液漏斗,否则生成的氢气逸出,故B不选;
C.乙醇也能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,应该用溴水检验乙烯,故C不选;
D.二氧化锰作催化剂,能加快反应速率,故D不选;
故选A.
7.一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
A.K+移向催化剂b
B.催化剂a表面发生的化学反应:[Fe(CN)6]4﹣﹣e﹣═[Fe(CN)6]3﹣
C.Fe(CN)63﹣在催化剂b表面被氧化
D.电解池溶液中的[Fe(CN)6]4﹣和[Fe(CN)6]3﹣浓度基本保持不变
【考点】原电池和电解池的工作原理.
【分析】由图可知,电子从负极流向正极,则a为负极,b为正极,负极发生氧化反应,正极发生还原反应,阳离子向正极移动,以此来解答.
【解答】解:由图可知,电子从负极流向正极,则a为负极,b为正极,
A.b为正极,则K+移向催化剂b,故A正确;
B.a为负极,发生氧化反应,则催化剂a表面发生反应:Fe(CN)64﹣﹣e﹣═Fe(CN)63﹣,故B正确;
C.b上发生还原反应,发生Fe(CN)63﹣+e﹣═Fe(CN)64﹣,Fe(CN)63﹣在催化剂b表面被还原,故C错误;
D.由B、C中的电极反应可知,二者以1:1相互转化,电解质溶液中Fe(CN)63﹣和Fe(CN)64﹣浓度基本保持不变,故D正确;
故选C.
二、解答题(共3小题,满分43分)
8.新型无机非金属材料甲和乙均是高温陶瓷材料,硬度大、熔点高、化学性质稳定.甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成.甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g L﹣1,在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解.Z元素的氧化物是制造光导纤维的主要材料,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙.请回答下列问题:(1)乙的化学式为 Si3N4 ;丙的电子式为 .
(2)甲与NaOH浓溶液共热的化学方程式为 AlN+NaOH+H2O=NaAlO2+NH3↑; .
(3)丁溶液中通入少量CO2的离子方程式为 2AlO2﹣+3H2O+CO2=2Al(OH)3↓+CO32﹣; .
(4)高温条件下,丙与Fe2O3反应生成Fe和X单质,写出该反应的化学方程式为 2NH3+Fe2O32Fe+3H2O+N2 ,有人提出生成的产物Fe中可能还有FeO,请设计实验方案验证之(用化学方法) 取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成 .
(5)工业上在X单质的气氛下将Z的氧化物和焦炭加热到1400℃~1450℃的条件下以制备乙,反应中还生成一种常见的可燃性气体戊,该反应的化学方程式为 3SiO2+2N2+6CSi3N4+6CO .
【考点】位置结构性质的相互关系应用.
【分析】根据丙在标准状况下的密度为0.76g L﹣1,可知丙的摩尔质量为:M=ρVm=0.76g L﹣1×22.4L/mol≈17g/mol,丙为NH3,则甲中含有N元素;在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,说明丁中含有铝元素,则甲中含有Al元素,所以甲为AlN;丙为铝的化合物,又是与氢氧化钠溶液生成的化合物,所以丙为NaAlO2;Z元素的氧化物是制造光导纤维的主要材料,所以Z为Si元素,而X、Y、Z三种短周期元素且原子序数依次增大,所以X为N、Y为Al,Z为Si;在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙,即:0.1mol氮气与0.15molSi反应,生成的乙中氮原子与硅原子个数之比为:0.2:0.15=4:3,所以乙的化学式为:Si3N4;根据以上分析进行解答.
【解答】解:丙在标准状况下的密度为0.76g L﹣1,根据M=ρVm=0.76g L﹣1×22.4L/mol≈17g/mol,所以丙为NH3,甲中含有N元素;在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,说明丁中含有铝元素,则甲中含有Al元素,故甲为AlN;丙为铝的化合物,又是与氢氧化钠溶液生成的化合物,所以丙为NaAlO2;Z元素的氧化物是制造光导纤维的主要材料,所以Z为Si元素,而X、Y、Z三种短周期元素且原子序数依次增大,所以X为N、Y为Al,Z为Si;在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙,即:0.1mol氮气与0.15molSi反应,生成的乙中氮原子与硅原子个数之比为:0.2:0.15=4:3,所以乙的化学式为:Si3N4;
(1)根据以上分析可知,乙的化学式为:Si3N4;丙为氨气,氨气为共价化合物,氨气的电子式为:,
故答案为:Si3N4;;
(2)甲为AlN,AlN与NaOH浓溶液共热生成了氨气和偏铝酸钠,反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)丁溶液为偏铝酸钠溶液,偏铝酸根离子与二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为:2AlO2﹣+3H2O+CO2=2Al(OH)3↓+CO32﹣,
故答案为:2AlO2﹣+3H2O+CO2=2Al(OH)3↓+CO32﹣;
(4)丙为氨气,X的单质为氮气,高温条件下,氨气与Fe2O3反应生成Fe和氮气单质,反应的化学方程式为:2NH3+Fe2O32Fe+3H2O+N2;产物Fe中可能还有FeO,需要先除掉铁,然后用盐酸溶解,再检验是否含有亚铁离子,方法为:取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成,
故答案为:取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成;
故答案为:2NH3+Fe2O32Fe+3H2O+N2;取样品少许,溶于足量的硫酸铜溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成;
(5)X的单质为N2,Z的氧化物为SiO2,工业上在N2的气氛下将Z的氧化物SiO2和焦炭加热到1400℃~1450℃的条件下以制备乙,乙为Si3N4,反应中还生成一种常见的可燃性气体戊,根据原子守恒,可燃性气体中含有C,所以为CO,该反应的化学方程式为:3SiO2+2N2+6CSi3N4+6CO,
故答案为:3SiO2+2N2+6CSi3N4+6CO.
9.查阅资料:无水醋酸钠是无色无味的结晶体,在空气中可被风化,可燃.用无水醋酸钠与碱石灰加热可以制得X气体,并进行相应的实验:
(1)装置E中反应方程式是CH3COONa+NaOHNa2CO3+X↑,X的化学式是 CH4 .
(2)在C中收集气体X和Cl2为1:1体积混合,然后在光照下反应:
①C装置所盛放液体试剂是 饱和食盐水 ;
②B装置的作用是 除去Cl2中含有的HCl ;光照后所得产物有 5 种;
③装置D的作用是 连通大气,平衡压强;接收可能溢出的液体 ;
(3)某学生为了测定X的组成进行实验探究,选用了F、G、H仪器:
①该同学依次连接的合理顺序是E、 G、H、F ;
②该同学测定的相关数据是:
装置
实验前的质量/g
实验后的质量/g
F
22.5
33.6
H
42.4
51.4
数据是否完全,说明原因 数据是不完全,因为只能确定有机物中的碳氢元素含量,不能确定是否含有氧元素,应称取C
装置实验前后的质量 ;
由以上数据可知X中碳氢两种原子的物质的量之比 > (选填“>”、“<”)1:4,造成这种结果的原因是 F
装置后面与空气接触,空气中的水蒸气和CO2进入了F
装置,造成含碳量偏大 .
【考点】制备实验方案的设计.
【分析】(1)依据原子守恒判断产物的化学式;
(2)装置A是氯气发生装置,生成的氯气中含氯化氢气体,需要通过饱和食盐水除去,装置E是甲烷气体发生装置,氯气和甲烷按照1:1体积混合光照发生取代反应,装置C中是饱和食盐水减少氯气的溶解,使甲烷和氯气混合均匀,反应得到四种取代产物和氯化氢气体,通过D使C连通大气,平衡压强,接收可能溢出的液体;
(3)①为了测定X为CH4的组成,利用装置E制备甲烷,得到气体通过装置G中的氧化铜反应,用浓硫酸吸收生成水,用碱石灰吸收生成的二氧化碳;
②实验数据只能计算碳和氢元素物质的量之比,不能确定是否含氧元素;
F中吸收的是CO2,CO2质量33.6g﹣22.5g=11.1g,n(C)==0.252mol;H
中吸收的是水蒸气,H2O质量5
1.4g﹣42.4g=9.0g,n(H)=×2=1.0mol;故n(C):n(H)>1:4,碱石灰会吸收空气中二氧化碳、水蒸气导致误差产生.
【解答】解:(1)装置E中反应方程式是CH3COONa+NaOHNa2CO3+X↑,由原子守恒,可知X的化学式是CH4,
故答案为:CH4;
(2)装置A是氯气发生装置,生成的氯气中含氯化氢气体,需要通过饱和食盐水除去,装置E是甲烷气体发生装置,氯气和甲烷按照1:1体积混合光照发生取代反应,装置C中是饱和食盐水减少氯气的溶解,使甲烷和氯气混合均匀,反应得到四种取代产物和氯化氢气体,通过D使C连通大气,平衡压强,接收可能溢出的液体;
①C装置中盛有饱和食盐水,故答案为:饱和食盐水;
②B装置的作用是除去Cl2中含有的HCl,光照后氯气和甲烷发生取代反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷和氯化氢,故答案为:除去Cl2中含有的HCl;5;
③装置D的作用是:连通大气,平衡压强;接收可能溢出的液体,故答案为:连通大气,平衡压强;接收可能溢出的液体;
(3)①为了测定X为CH4的组成,利用装置E制备甲烷,得到气体通过装置G中的氧化铜反应,生成水和二氧化碳,用浓硫酸吸收生成水,用碱石灰吸收生成的二氧化碳,装置连接顺序为EGHF,
故答案为:G、H、F;
②实验数据只能计算碳和氢元素物质的量之比,不能确定是否含氧元素,所以应依据质量守恒分析判断是否含氧元素,需要称取C装置实验前后的质量;
F中吸收的是CO2,CO2质量33.6g﹣22.5g=11.1g,n(C)==0.252mol;H
中吸收的是水蒸气,H2O质量5
1.4g﹣42.4g=9.0g,n(H)=×2=1.0mol;故n(C):n(H)>1:4,所以计算结果可知测得有误差,原因是F
装置后面与空气接触,空气中的水蒸气和CO2
进入了F
装置,造成含碳量偏大,
故答案为:数据是不完全,因为只能确定有机物中的碳氢元素含量,不能确定是否含有氧元素,应称取C
装置实验前后的质量;F
装置后面与空气接触,空气中的水蒸气和CO2进入了F
装置,造成含碳量偏大.
10.随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
a.6CO2+6H2OC6H12O6
b.CO2+3H2CH3OH+H2O
c.CO2+CH4CH3COOH
d.2CO2+6H2CH2=CH2+4H2O
在以上属于人工转化的反应中,原子利用率最高的是 c (填序号).
(2)CO2制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ mol﹣1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图1所示.
①该反应化学平衡常数K的表达式是 .
②0~9min时间内,该反应的平均反应速率v(H2)= 0.25mol/L min .
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是 c (填字母序号).
a.0<Q<29.5kJ
b.29.5kJ<Q<36.75kJ
c.36.75kJ<Q<49kJ
d.49kJ<Q<98kJ
④在一定条件下,体系中CO2的平衡转化率(a)与L和X的关系如图2所示,L和X分别表示温度或压强.
i.X压强的物理量是 温度 .
ii.L1和L2的大小关系是 L1>L2 ,简述理由: 温度一定时,增大压强,CO2平衡转化率增大 .
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.工业上利用水煤气合成二甲醚的三步反应如下:
a.2H2(g)+CO(g) CH3OH(g)△H1=﹣90.8kJ mol﹣1
b.2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=﹣23.5kJ mol﹣1
c.CO(g)+H2O(g) CO2(g)+H2(g)△H3=﹣41.3kJ mol﹣1
①对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是 cd (填字母).
a.n(CH3OH)=n(CH3OCH3)=n(H2O)
b.容器内压强保持不变
c.H2O(g)的浓度保持不变
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
②总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= ﹣246.4kJ mol﹣1 .
(4)以KOH溶液为电解质溶液,用二甲醚﹣空气组成燃料,其中负极的电极反应式为 CH3OCH3﹣12e﹣+16OH﹣=2CO32﹣+11H2O .
(5)C1化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质.写出CO与氮氧化物(NOx)在有催化剂的条件下反应的化学方程式 2xCO+2NOx2xCO2+N2 .
【考点】化学平衡的计算;化学平衡的影响因素;化学平衡状态的判断.
【分析】(1)原子利用率最高,力求反应物分子中的所有原子全都转化到目标产物中,理想状态的原子利用率为100%;
(2)①平衡常数K=;
②图象读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率,依据反应速率之比等于化学方程式计量数之比得到氢气反应速率;
③反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49KJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49KJ,结合图象中二氧化碳转化率计算此时达到平衡放出的热量,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多;
④反应是气体体积减小的放热反应,升温平衡逆向进行,增大压强平衡正向进行,据此分析图象确定表示的物理量;
(3)①当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,
a、是某一时刻的特殊值,不能说明反应已达到平衡;
b、任意时刻该反应的压强都不变;不能说明反应已达到平衡;某一物质的浓度保持不变说明达到平衡;
c、浓度不变时为平衡的标志;
d、消耗速率得出CH3OH的正、逆反应速率相等,说明反应达到平衡;
②利用热化学方程式和盖斯定律计算所需热化学方程式,热化学方程式2a+b+c计算得到;
(4)根据燃料电池为燃料作负极失电子发生氧化反应,结合电解质溶液书写负极电极反应式;
(5)氮氧化物和一氧化碳反应生成氮气和二氧化碳,根据化合价升降相等配平.
【解答】解:(1)a.6CO2+6H2OC6H12O6,是自然界中实现的转化,原子利用率100%,但不是人工转化,故a不符合;
b.CO2=3H2CH3OH+H2O,反应中原子利用率不是100%,故b不符合;
c.CO2+CH4CH3COOH,反应后原子利用率为100%,故c符合;
d.2CO2+6H2CH2=CH2+4H2反应中原子利用率不是100%,故d不符合
故答案为:c;
(2)①CO2(g)+3H2(g) CH3OH(g)+H2O(g),该反应的平衡常数K=,
故答案为:;
②图象读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率=,反应速率之比等于化学方程式计量数之比,V(H2)=3V(CH3OH(g)=3×=0.25mol/L min,
故答案为:0.25mol/L min;
③CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ mol﹣1,反应达到平衡状态消耗二氧化碳物质的量浓度=1mol/L﹣0.25mol/L=0.75mol/L,物质的量为0.75mol,反应放出热量=49KJ/mol×0.75mol=36.75KJ,反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49KJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49KJ,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多,大于36.75KJ,则36.75<Q<49,
故答案为:c;
④CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ mol﹣1,反应是气体体积减小的放热反应,
i.温度升高,平衡逆向进行,二氧化碳转化率减小,所以X为温度,L为压强,
故答案为:温度;
ii.温度一定压强增大平衡正向进行二氧化碳转化率增大,所以L1>L2,
故答案为:L1>L2;温度一定时,增大压强,CO2平衡转化率增大;
(3)①a.达到平衡时,物质的量不变,不是相等,故a错误;
b.该反应是一个反应前后气体体积不变的反应,无论该反应是否达到平衡状态,压强始终不变,所以不能根据平衡体系的总压判断是否达到平衡状态,故b错误;
c.平衡时各物质的浓度不变,故c正确;
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1,符合正逆反应速率相等,故d正确;
故选cd,
故答案为:cd;
②a、2H2(g)+CO(g) CH3OH(g)△H=﹣90.8kJ mol﹣1
b、2CH3OH(g) CH3OCH3(g)+H2O(g)△H=﹣23.5kJ mol﹣1
c、CO(g)+H2O(g) CO2(g)+H2(g)△H=﹣41.3kJ mol﹣1
由盖斯定律可知,通过a×2+b+c可得所求热反应方程式,3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)△H=﹣90.8kJ mol﹣1×2﹣23.5kJ mol﹣1﹣41.3kJ mol﹣1=﹣246.4kJ mol﹣1;
故答案为:﹣246.4kJ mol﹣1;
(4)燃料电池为燃料作负极失电子发生氧化反应,又电解质溶液为KOH,所以负极电极反应式为:CH3OCH3﹣12e﹣+16OH﹣=2CO32﹣+11H2O,
故答案为:CH3OCH3﹣12e﹣+16OH﹣=2CO32﹣+11H2O;
(5)氮氧化物和一氧化碳反应生成氮气和二氧化碳,根据氮元素化合价变化,配平反应的方程式,反应的化学方程式为:2xCO+2NOx2xCO2+N2,
故答案为:2xCO+2NOx2xCO2+N2;
三、解答题(共1小题,满分15分)【化学-选修5有机化学基础】
11.水处理剂能使工业循环冷却系统保持良好状态.以下是两种新型水处理剂的合成方法
完成下列填空:
(1)写出反应类型.反应② 加成反应 反应④ 取代反应 .
(2)A中官能团的名称是 羟基、氯原子 ;
(3)反应⑤的反应条件是 氢氧化钠醇溶液、加热 ;
(4)写出化学方程式:B与银氨溶液反应的化学方程式 CH2=CH﹣CHO+2[Ag(NH3)2]OHCH2=CH﹣COONH4+2Ag+3NH3↑+H2O ;
(5)写出H的结构简式 .
(6)写出符合下列要求的E的同分异构体的结构简式. .
a.能发生银镜反应
b.能发生缩聚反应
c.两分子生成六元环状化合物
d.有4种化学环境的氢原子
(7)写出用C为原料合成的合成路线(无机原料任选).(合成路线的常用表示方法为:AB目标产物).
【考点】有机物的合成.
【分析】在500℃条件下,丙烯和氯气发生取代反应生成3﹣氯丙烯,3﹣氯丙烯和HOCl发生加成反应生成A,A发生消去反应生成环氧氯丙烷,可知A为ClCH2CH(OH)CH2OH.环氧氯丙烷和氢氧化钠的水溶液反应生成丙三醇,在浓硫酸作催化剂、加热条件下,丙三醇反应生成B,B能被氧化生成C,C比B中多一个氧原子,则B中含有醛基,C中含有羧基,B的不饱和度==2,所以B是CH2=CHCHO,C是CH2=CHCOOH,C发生加聚反应得到水处理剂R为.C和G发生加聚反应生成高分子化合物H为:;G发生加聚反应生成L结构简式为:,乙二醇和氢溴酸发生取代反应生成1,2﹣二溴乙烷,1,2﹣二溴乙烷反应生成1,4﹣丁二酸,1,4﹣丁二酸和溴发生取代反应生成HOOCCH2CHBrCOOH,HOOCCH2CHBrCOOH和氢氧化钠的醇溶液发生消去反应生成NaOOCCH=CHCOONa,然后酸化生成G.
(7)C是丙烯酸,用C为原料合成,可以先用丙烯酸与水加成生成2﹣羟基丙酸,再用2﹣羟基丙酸发生酯化可得.
【解答】解:在500℃条件下,丙烯和氯气发生取代反应生成3﹣氯丙烯,3﹣氯丙烯和HOCl发生加成反应生成A,A发生消去反应生成环氧氯丙烷,可知A为ClCH2CH(OH)CH2OH.环氧氯丙烷和氢氧化钠的水溶液反应生成丙三醇,在浓硫酸作催化剂、加热条件下,丙三醇反应生成B,B能被氧化生成C,C比B中多一个氧原子,则B中含有醛基,C中含有羧基,B的不饱和度==2,所以B是CH2=CHCHO,C是CH2=CHCOOH,C发生加聚反应得到水处理剂R为.C和G发生加聚反应生成高分子化合物H为:;G发生加聚反应生成L结构简式为:,乙二醇和氢溴酸发生取代反应生成1,2﹣二溴乙烷,1,2﹣二溴乙烷反应生成1,4﹣丁二酸,1,4﹣丁二酸和溴发生取代反应生成HOOCCH2CHBrCOOH,HOOCCH2CHBrCOOH和氢氧化钠的醇溶液发生消去反应生成NaOOCCH=CHCOONa,然后酸化生成G.
(1)反应②发生加成反应,反应④发生取代反应,故答案为:加成反应;取代反应;
(2)A为ClCH2CH(OH)CH2OH,官能团的名称是:羟基、氯原子,故答案为:羟基、氯原子;
(3)反应⑤发生卤代烃的消去反应,的反应条件是:氢氧化钠醇溶液、加热,故答案为:氢氧化钠醇溶液、加热;
(4)B是丙烯醛,丙烯醛和银氨溶液反应方程式为:CH2=CH﹣CHO+2[Ag(NH3)2]OHCH2=CH﹣COONH4+2Ag+3NH3↑+H2O,
故答案为:CH2=CH﹣CHO+2[Ag(NH3)2]OHCH2=CH﹣COONH4+2Ag+3NH3↑+H2O;
(5)H的结构简式为:,故答案为:;
(6)符合下列要求的E的同分异构体:a.能发生银镜反应,说明含有醛基,b.能发生缩聚反应,说明含有醇羟基和羧基,c.两分子生成六元环状化合物
d.有4种化学环境的氢原子,则符合条件的E的同分异构体结构简式为,
故答案为:;
(7)C是丙烯酸,用C为原料合成,可以先用丙烯酸与水加成生成2﹣羟基丙酸,再用2﹣羟基丙酸发生酯化可得,合成路线流程图为:,
故答案为:.
2016年12月18日
同课章节目录
