2016年天津市河西区高考化学三模试卷(解析版)
文档属性
| 名称 | 2016年天津市河西区高考化学三模试卷(解析版) |

|
|
| 格式 | zip | ||
| 文件大小 | 282.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-01-03 00:00:00 | ||
图片预览



文档简介
2016年天津市河西区高考化学三模试卷
一、本卷共6题,每题6分,共计36分.在每题列出的四个选项中,只有一项是最符合题目要求的.
1.化学与生活、生产密切相关,下列说法不正确的是( )
A.食盐可做调味剂、防腐剂
B.硅酸钠可做木材防火剂的原料
C.二氧化硫在葡萄酒中起漂白作用
D.还原铁粉可用于食品包装袋内的脱氧剂
2.常温下,有关下列说法正确的是( )
A.与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣能大量共存
B.
=1×10﹣13
mol L﹣1的溶液中:NH4+、SO42﹣、NO3﹣能大量共存
C.苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O﹣═2C6H5OH+CO32﹣
D.Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O
3.下列实验叙述正确的是( )
A.用饱和食盐水替代水与电石反应,可以减缓乙炔的产生速率
B.配制一定物质的量浓度的溶液定容时,俯视刻度线会使浓度偏低
C.测定中和反应的反应热时,将碱缓慢倒入酸中,不影响测定结果
D.用NaOH标准液滴定待测浓度盐酸,达终点时滴定管尖嘴有悬滴,则测定结果偏小
4.下列物质的制备原理设计步骤合理的是( )
A.SSO3
H2SO4
B.Fe
FeCl2
Fe(OH)2
C.AlCl3(溶液)AlCl3
Al
D.NaCl(饱和溶液)
NaHCO3Na2CO3
5.一定条件下可逆反应X(g)+3Y(g) 2Z(g),X、Y、Z的起始浓度分别为a
mol L﹣1、b
mol L﹣1、c
mol L﹣1(均不为零),反应正向进行达到平衡时,它们的浓度分别为0.2mol L﹣1、0.6mol L﹣1、0.18mol L﹣1,则下列判断正确的是( )
A.a:b=3:1
B.X、Y的转化率相等
C.Y和Z的生成速率之比为2:3可做平衡标志
D.a的取值范围为0
mol L﹣1<a<0.18
mol L﹣1
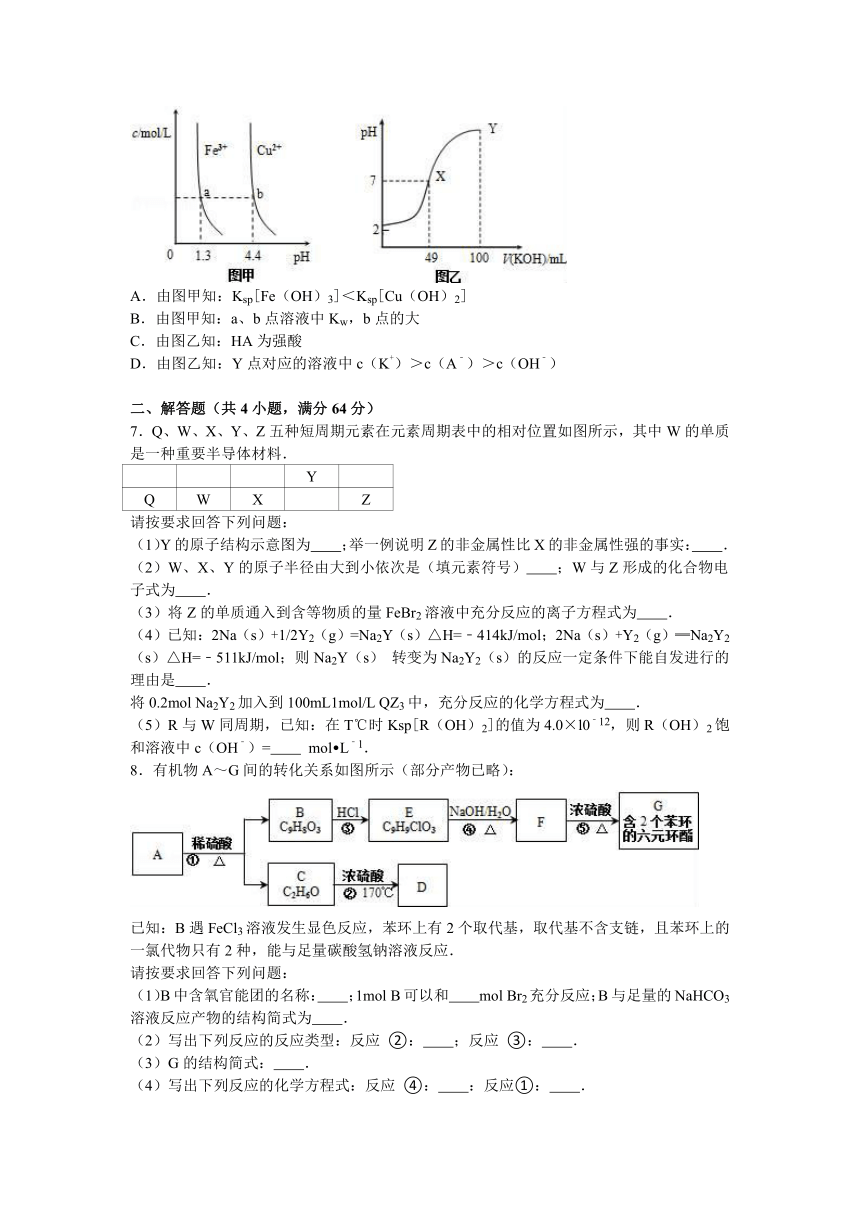
6.已知:图甲是由某温度下Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL
0.1mol L﹣1HA溶液中逐滴加入0.2mol L﹣1KOH溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是( )
A.由图甲知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.由图甲知:a、b点溶液中Kw,b点的大
C.由图乙知:HA为强酸
D.由图乙知:Y点对应的溶液中c(K+)>c(A﹣)>c(OH﹣)
二、解答题(共4小题,满分64分)
7.Q、W、X、Y、Z五种短周期元素在元素周期表中的相对位置如图所示,其中W的单质是一种重要半导体材料.
Y
Q
W
X
Z
请按要求回答下列问题:
(1)Y的原子结构示意图为 ;举一例说明Z的非金属性比X的非金属性强的事实: .
(2)W、X、Y的原子半径由大到小依次是(填元素符号) ;W与Z形成的化合物电子式为 .
(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为 .
(4)已知:2Na(s)+1/2Y2(g)=Na2Y(s)△H=﹣414kJ/mol;2Na(s)+Y2(g)═Na2Y2(s)△H=﹣511kJ/mol;则Na2Y(s)
转变为Na2Y2(s)的反应一定条件下能自发进行的理由是 .
将0.2mol
Na2Y2加入到100mL1mol/L
QZ3中,充分反应的化学方程式为 .
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×l0﹣12,则R(OH)2饱和溶液中c(OH﹣)=
mol L﹣1.
8.有机物A~G间的转化关系如图所示(部分产物已略):
已知:B遇FeCl3溶液发生显色反应,苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种,能与足量碳酸氢钠溶液反应.
请按要求回答下列问题:
(1)B中含氧官能团的名称: ;1mol
B可以和 mol
Br2充分反应;B与足量的NaHCO3溶液反应产物的结构简式为 .
(2)写出下列反应的反应类型:反应
②: ;反应
③: .
(3)G的结构简式: .
(4)写出下列反应的化学方程式:反应
④: :反应①: .
(5)X是C在铜加热条件下的氧化产物,检验X所含官能团的方法是 .Y是C的同系物,比C多2个CH2原子团,Y的同分异构有多种,写出其中核磁共振氢谱仅有两种且吸收峰面积之比为2:3的结构简式: .
9.某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理.已知:0.4mol/L的Fe(NO3)3溶液的pH=l.
请按要求回答下列问题:
(1)检验装置A气密性的操作方法:在B中加入适量水,连接好装置A、B, ,则气密性好.
装置A中反应的化学方程式是 .
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 .
(3)在C处虚线框内画出尾气吸收的装置图(标注试剂).
(4)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性.
(5)猜想B中产生白色沉淀的原因:
猜想1. ;
猜想2:由于SO2与Fe3+反应;
猜想3:由于在酸性条件下SO2与NO3﹣反应.
①若猜想2成立,装置B中依次可能发生反应的离子方程式: , .
②为验证猜想3成立,可在相同条件下进行实验,将装置B中的Fe(NO3)3溶液替换为下列试剂是(填序号) .
a.5mL
2.4mol/L稀硝酸
b.5mL
0.8mol/L
FeCl3溶液
c.2.5mL
0.4mol/L盐酸和2.5mL
4.8mol/L
NaNO3溶液.
10.从海带中提取单质碘及碘的化合物间的转化关系如图所示:
请按要求回答下列问题:
(1)从海带灰浸取液中提取单质碘涉及的反应
①,所用试剂是MnO2、稀硫酸,其离子方程式是 ;实现反应①还可以选用的试剂有(填字母序号) .
a.3%的H2O2、稀硫酸
b.氯水
c.FeCl2溶液
d.NaOH溶液
(2)反应②2HI(g) H2(g)+I2(g)
的能量变化如图1所示;其他条件相同,1mol
HI
在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示.
i.比较
2z (x+y)(填“<”、“>”或“=”),理由是
ii.某温度下该反应的平衡常数=,达平衡时,HI
的转化率= .
iii.只改变该反应的一个条件,能提高
HI
转化率的措施是(填字母序号) .
a.增大HI
浓度
b.加压
c.移走I2
d.升温
(3)反应=③在碱性条件下I2可以转化为IO3﹣.电解KI溶液制备KIO3的工作原理如下图所示.电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅.
i.M连接电源的 极.
ii.结合实验现象和电极反应式说明制备KIO3的原理: .
2016年天津市河西区高考化学三模试卷
参考答案与试题解析
一、本卷共6题,每题6分,共计36分.在每题列出的四个选项中,只有一项是最符合题目要求的.
1.化学与生活、生产密切相关,下列说法不正确的是( )
A.食盐可做调味剂、防腐剂
B.硅酸钠可做木材防火剂的原料
C.二氧化硫在葡萄酒中起漂白作用
D.还原铁粉可用于食品包装袋内的脱氧剂
【考点】钠的重要化合物;二氧化硫的化学性质.
【分析】A.食盐具有咸味是咸味剂.食盐可以作防腐剂;
B.硅酸钠水溶液是水玻璃,水玻璃是矿物胶,不燃烧;
C.二氧化硫具有较强的还原性,故常用作葡萄酒的抗氧化剂;
D.Fe与氧气反应,铁的化合价升高,作还原剂.
【解答】解:A.食盐它可以使细菌细胞脱水死亡,所以可以杀菌,可作为防腐剂,食盐具有咸味是咸味剂,可做调味剂,故A正确;
B.硅酸钠的水溶液呈水玻璃,水玻璃是矿物胶,不燃烧,而将硅酸钠涂在木材表面就阻隔了木材与空气中氧气的直接接触,水玻璃可用作制备木材防火剂的原料,故B正确;
C.二氧化硫具有较强的还原性,故常用作葡萄酒的抗氧化剂,不是漂白性,故C错误;
D.铁粉作食品袋内的脱氧剂,Fe与氧气反应,铁的化合价升高,作还原剂,起到还原作用,故D正确;
故选C.
2.常温下,有关下列说法正确的是( )
A.与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣能大量共存
B.
=1×10﹣13
mol L﹣1的溶液中:NH4+、SO42﹣、NO3﹣能大量共存
C.苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O﹣═2C6H5OH+CO32﹣
D.Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O
【考点】离子共存问题;离子方程式的书写.
【分析】A.与Al反应能放出H2的溶液,为非氧化性酸或强碱溶液;
B.
=1×10﹣13
mol L﹣1的溶液,显酸性;
C.反应生成苯酚和碳酸氢钠;
D.发生氧化还原反应生成硝酸铁、NO和水.
【解答】解:A.与Al反应能放出H2的溶液,为非氧化性酸或强碱溶液,碱溶液中不能存在Fe2+,酸溶液中Fe2+(或Al)、H+、NO3﹣发生氧化还原反应不生成氢气,故A错误;
B.
=1×10﹣13
mol L﹣1的溶液,显酸性,该组离子之间不反应,可大量共存,故B正确;
C.反应生成苯酚和碳酸氢钠,离子反应为CO2+H2O+C6H5O﹣═C6H5OH+HCO3﹣,故C错误;
D.发生氧化还原反应生成硝酸铁、NO和水,离子反应为3Fe3O4+NO3﹣+28H+═9Fe3++NO↑+14H2O,故D错误;
故选B.
3.下列实验叙述正确的是( )
A.用饱和食盐水替代水与电石反应,可以减缓乙炔的产生速率
B.配制一定物质的量浓度的溶液定容时,俯视刻度线会使浓度偏低
C.测定中和反应的反应热时,将碱缓慢倒入酸中,不影响测定结果
D.用NaOH标准液滴定待测浓度盐酸,达终点时滴定管尖嘴有悬滴,则测定结果偏小
【考点】化学实验方案的评价.
【分析】A.用饱和食盐水替代水,可以减慢反应速率;
B.俯视刻度线会使溶液体积偏小,浓度偏大;
C.将碱缓慢倒入酸中,导致热量损失;
D.达终点时滴定管尖嘴有悬滴,消耗的标准液体积偏大.
【解答】解:A.饱和食盐水与电石反应较为平缓,可代替水的反应,故A正确;
B.俯视刻度线会使溶液体积偏小,浓度偏大,故B错误;
C.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失,故C错误;
D.滴定终点时,发现滴定管尖嘴部分有悬滴,则消耗的标准液偏大,则测定酸的浓度偏大,故D错误.
故选A.
4.下列物质的制备原理设计步骤合理的是( )
A.SSO3
H2SO4
B.Fe
FeCl2
Fe(OH)2
C.AlCl3(溶液)AlCl3
Al
D.NaCl(饱和溶液)
NaHCO3Na2CO3
【考点】镁、铝的重要化合物;钠的重要化合物.
【分析】A、硫在氧气中燃烧生成二氧化硫;
B、铁在氯气中燃烧生成氯化铁;
C、氯化铝是共价化合物;
D、依据侯氏制碱法原理解答.
【解答】解:A、硫在氧气中燃烧生成二氧化硫,得不到三氧化硫,故A错误;
B、铁在氯气中燃烧生成氯化铁,而不是氯化亚铁,故B错误;
C、氯化铝是共价化合物,工业上是用电解熔融的氧化铝得到铝,故C错误;
D、首先通入氨气,增加二氧化碳的溶解度,所以选通氨气,再通二氧化碳,得到溶解度极小的碳酸氢钠,碳酸氢钠不稳定,加热得到碳酸钠,故D正确;
故选D.
5.一定条件下可逆反应X(g)+3Y(g) 2Z(g),X、Y、Z的起始浓度分别为a
mol L﹣1、b
mol L﹣1、c
mol L﹣1(均不为零),反应正向进行达到平衡时,它们的浓度分别为0.2mol L﹣1、0.6mol L﹣1、0.18mol L﹣1,则下列判断正确的是( )
A.a:b=3:1
B.X、Y的转化率相等
C.Y和Z的生成速率之比为2:3可做平衡标志
D.a的取值范围为0
mol L﹣1<a<0.18
mol L﹣1
【考点】化学平衡的计算.
【分析】一定条件下可逆反应X(g)+3Y(g) 2Z(g),X、Y、Z的起始浓度分别为a
mol L﹣1、b
mol L﹣1、c
mol L﹣1(均不为零),反应正向进行达到平衡时,它们的浓度分别为0.2mol L﹣1、0.6mol L﹣1、0.18mol L﹣1,利用极值转化;
A.可根据反应转化关系和平衡浓度计算初始浓度关系;
B.起始量相同,平衡量相同,转化率相同;
C.达到平衡状态时,正逆反应速率相等;
D.根据可逆不能完全转化的角度分析.
【解答】解:A.设X转化的浓度为x,
X(g)+3Y(g) 2Z(g)
初始:a
b
c
转化:x
3x
2x
平衡:0.2moL/L
0.6mol/L
0.18mol/L
则:a:b=(x+0.2moL/L):(3x+0.6mol/L)=1:3,故A错误;
B.反应前后X、Y气体的浓度比相同符合反应系数之比,所以达到平衡状态时,转化率相同,故B正确;
C.平衡时,正逆反应速率相等,则Y和Z的生成速率之比为3:2,故C错误;
D.反应为可逆反应,物质不可能完全转化,如反应向正反应分析进行,则0<a,如反应向逆反应分析进行,则a<0.29mol L﹣1,故有0<a<0.29mol L﹣1,故D错误.
故选:B.
6.已知:图甲是由某温度下Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL
0.1mol L﹣1HA溶液中逐滴加入0.2mol L﹣1KOH溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是( )
A.由图甲知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.由图甲知:a、b点溶液中Kw,b点的大
C.由图乙知:HA为强酸
D.由图乙知:Y点对应的溶液中c(K+)>c(A﹣)>c(OH﹣)
【考点】难溶电解质的溶解平衡及沉淀转化的本质.
【分析】A、根据图象找出可用来比较Fe(OH)3与Cu(OH)2溶度积常数点,可用b、a进行计算;
B、a、b点溶液中Kw只和温度有关,温度不变,Kw不变;
C、根据图示可知,0.1mol L﹣1HA溶液的pH=2,说明溶液中
HA在溶液中部分电离;
D、Y点HA与氢氧化钾恰好反应生成KA,A﹣部分水解,溶液显示碱性.
【解答】解:A、由a、b两点对应数据可比较出Ksp[Fe(OH)3]与Ksp[Cu(OH)2]的大小,Ksp[Fe(OH)3]=c(Fe3+) (OH﹣)3=c(Fe3+) (10﹣12.7)3,Ksp[Cu(OH)2]=c(Cu2+) (OH﹣)2=c(Cu2+) (10﹣9.6)2,因c(Fe3+)=c(Cu2+),故Ksp[Fe(OH)3]<Ksp[Cu(OH)2],故A正确;
B、由图甲知:a、b点溶液中Kw一样大,故B错误;
C、HA若是强酸,则0.1mol L﹣1HA溶液的pH=1,而图象中溶液的pH>2,则HA部分电离,则HA为一元弱酸,故C错误;
D、Y点加入100mL氢氧化钾溶液后,100mL
0.1mol L﹣1HA与100mL
0.2mol L﹣1KOH溶液反应生成0.05mol L﹣1KA和0.05mol L﹣1KOH的混合物,氢氧根离子浓度大于0.05mol/L,而A﹣部分水解,溶液中A﹣部分水解的浓度小于0.05mol/L,则溶液中离子浓度大小为:c(K+)>c(OH﹣)>c(A﹣),故D错误;
故选A.
二、解答题(共4小题,满分64分)
7.Q、W、X、Y、Z五种短周期元素在元素周期表中的相对位置如图所示,其中W的单质是一种重要半导体材料.
Y
Q
W
X
Z
请按要求回答下列问题:
(1)Y的原子结构示意图为 ;举一例说明Z的非金属性比X的非金属性强的事实: 酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3 .
(2)W、X、Y的原子半径由大到小依次是(填元素符号) r(Si)>r(P)>r(O) ;W与Z形成的化合物电子式为 .
(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为 2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl﹣ .
(4)已知:2Na(s)+1/2Y2(g)=Na2Y(s)△H=﹣414kJ/mol;2Na(s)+Y2(g)═Na2Y2(s)△H=﹣511kJ/mol;则Na2Y(s)
转变为Na2Y2(s)的反应一定条件下能自发进行的理由是 Na2O(s)+O2(g)=Na2O2(s)△H=﹣97
kJ/mol,而△S<0,△H﹣T△S在低温下小于0,可自发进行 .
将0.2mol
Na2Y2加入到100mL1mol/L
QZ3中,充分反应的化学方程式为 2Na2O2+AlCl3=NaAlO2+3NaCl+O2↑ .
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×l0﹣12,则R(OH)2饱和溶液中c(OH﹣)= 2.0×l0﹣4
mol L﹣1.
【考点】位置结构性质的相互关系应用.
【分析】由短周期元素的相对位置,可知Y处于第二周期,其它处于第三周期,而W的单质是一种重要半导体材料,则W为Si元素,可推知Q为Al,X为P,Y为O,Z为Cl.
(1)根据核外电子排布规律画出原子结构示意图;可以根据最高价含氧酸的酸性强弱,氢化物稳定性等进行判断;
(2)同周期自作而原子半径减小,同主族自上而下原子半径增大;W与Z形成的化合物为SiCl4,Si原子与Cl原子之间形成1对共用电子对;
(3)假设氯气与FeBr2均为1mol,还原性Fe2+>Br﹣,氯气先氧化Fe2+为Fe3+,根据电子转移守恒,1molFe2+消耗0.5mol氯气,而剩余的0.5mol氯气可以氧化1molBr﹣;
(4)根据盖斯定律,可得:Na2O(s)+O2(g)=Na2O2(s)△H=﹣97
kJ/mol,而△H﹣T△S<0时,反应可自发进行;
将0.2mol
Na2O2加入到100mL1mol/L
AlCl3中,AlCl3为0.1mol,过氧化钠与水反应生成0.4molNaOH,氯化铝与氢氧化钠恰好反应生成NaAlO2;
(5)Ksp[R(OH)2]=c(R2+)×c2(OH﹣)=4.0×l0﹣12,而饱和溶液中c(R2+)=c(OH﹣),联立计算饱和溶液中c(OH﹣).
【解答】解:由短周期元素的相对位置,可知Y处于第二周期,其它处于第三周期,而W的单质是一种重要半导体材料,则W为Si元素,可推知Q为Al,X为P,Y为O,Z为Cl.
(1)Y为O元素,原子结构示意图为:,酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3等都可以说明Cl的非金属性比P的强,
故答案为:;酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3;
(2)同周期自作而原子半径减小,同主族自上而下原子半径增大,故原子半径:r(Si)>r(P)>r(O),W与Z形成的化合物为SiCl4,Si原子与Cl原子之间形成1对共用电子对,电子式为:,
故答案为:r(Si)>r(P)>r(O);;
(3)假设氯气与FeBr2均为1mol,还原性Fe2+>Br﹣,氯气先氧化Fe2+为Fe3+,根据电子转移守恒,1molFe2+消耗0.5mol氯气,而剩余的0.5mol氯气可以氧化1molBr﹣,反应离子方程式为:2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl﹣,
故答案为:2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl﹣;
(4)已知:①.2Na(s)+O2(g)=Na2O(s)△H=﹣414kJ/mol;
②.2Na(s)+O2(g)═Na2O2(s)△H=﹣511kJ/mol
根据盖斯定律,②﹣①可得:Na2O(s)+O2(g)=Na2O2(s)△H=﹣97
kJ/mol,该反应△S<0,而△H﹣T△S<0时,反应可自发进行,故低温下可以自发进行,
将0.2mol
Na2O2加入到100mL1mol/L
AlCl3中,AlCl3为0.1mol,过氧化钠与水反应生成0.4molNaOH,氯化铝与氢氧化钠恰好反应生成NaAlO2,故反应方程式为:2Na2O2+AlCl3=NaAlO2+3NaCl+O2↑,
故答案为:Na2O(s)+O2(g)=Na2O2(s)△H=﹣97
kJ/mol,而△S<0,△H﹣T△S在低温下小于0,可自发进行;2Na2O2+AlCl3=NaAlO2+3NaCl+O2↑;
(5)Ksp[R(OH)2]=c(R2+)×c2(OH﹣)=4.0×l0﹣12,而饱和溶液中c(R2+)=c(OH﹣),联立可得饱和溶液中c(OH﹣)=2.0×l0﹣4
mol/L,
故答案为:2.0×l0﹣4.
8.有机物A~G间的转化关系如图所示(部分产物已略):
已知:B遇FeCl3溶液发生显色反应,苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种,能与足量碳酸氢钠溶液反应.
请按要求回答下列问题:
(1)B中含氧官能团的名称: 羧基、羟基 ;1mol
B可以和 3 mol
Br2充分反应;B与足量的NaHCO3溶液反应产物的结构简式为 .
(2)写出下列反应的反应类型:反应
②: 消去反应 ;反应
③: 加成反应 .
(3)G的结构简式: .
(4)写出下列反应的化学方程式:反应
④: :反应①: .
(5)X是C在铜加热条件下的氧化产物,检验X所含官能团的方法是 向盛有新制银氨溶液的试管中滴加适量X,振荡后将试管放在热水浴中温热,观察有银镜产生,证明X含醛基.[或向盛有新制氢氧化铜(氢氧化钠过量)的试管中滴加适量X,振荡后加热,观察有红色沉淀,证明X含醛基] .Y是C的同系物,比C多2个CH2原子团,Y的同分异构有多种,写出其中核磁共振氢谱仅有两种且吸收峰面积之比为2:3的结构简式: CH3CH2OCH2CH3 .
【考点】有机物的推断.
【分析】B遇FeCl3溶液发生显色反应,说明含有酚羟基,且能与足量碳酸氢钠溶液反应,说明含有羧基,B的不饱和度为=6,苯环上有2个取代基,取代基不含支链,说明取代基中含有1个碳碳双键,且苯环上的一氯代物只有2种,两个不同的取代基处于对位,故B的结构简式为,B与HCl发生加成反应生成E,E发生水解反应得到F,F再浓硫酸作用下得到G,G含有2个苯环的六元环酯,则E中﹣COOH、﹣Cl连接同一碳原子上,故E为,F为,G为.A发生水解反应得到B、C,A含有酯基,结合C的分子式可知C为CH3CH2OH,故A的结构简式为:,C发生消去反应生成D为CH2=CH2.
【解答】解:B遇FeCl3溶液发生显色反应,说明含有酚羟基,且能与足量碳酸氢钠溶液反应,说明含有羧基,B的不饱和度为=6,苯环上有2个取代基,取代基不含支链,说明取代基中含有1个碳碳双键,且苯环上的一氯代物只有2种,两个不同的取代基处于对位,故B的结构简式为,B与HCl发生加成反应生成E,E发生水解反应得到F,F再浓硫酸作用下得到G,G含有2个苯环的六元环酯,则E中﹣COOH、﹣Cl连接同一碳原子上,故E为,F为,G为.A发生水解反应得到B、C,A含有酯基,结合C的分子式可知C为CH3CH2OH,故A的结构简式为:,C发生消去反应生成D为CH2=CH2.
(1)B的结构简式为,B中含氧官能团的名称:羧基、羟基,碳碳双键与溴发生加成反应,酚羟基的邻位能与溴发生取代反应,1mol
B可以和3mol
Br2充分反应,羧基能与碳酸氢钠反应,而酚羟基不能与碳酸氢钠反应,B与足量的NaHCO3溶液反应产物的结构简式为,
故答案为:羧基、羟基;3;;
(2)反应
②属于消去反应,反应
③属于加成反应,
故答案为:消去反应;加成反应;
(3)G的结构简式:,
故答案为:;
(4)反应
④的化学方程式为:,
反应①的化学方程式为:,
故答案为:;;
(5)X是C在铜加热条件下的氧化产物,则X为CH3CHO,检验X所含官能团的方法是:向盛有新制银氨溶液的试管中滴加适量X,振荡后将试管放在热水浴中温热,观察有银镜产生,证明X含醛基.[或向盛有新制氢氧化铜(氢氧化钠过量)的试管中滴加适量X,振荡后加热,观察有红色沉淀,证明X含醛基],
Y是C(乙醇)的同系物,比C多2个CH2原子团,Y的同分异构有多种,其中核磁共振氢谱仅有两种且吸收峰面积之比为2:3的结构简式:CH3CH2OCH2CH3,
故答案为:向盛有新制银氨溶液的试管中滴加适量X,振荡后将试管放在热水浴中温热,观察有银镜产生,证明X含醛基.[或向盛有新制氢氧化铜(氢氧化钠过量)的试管中滴加适量X,振荡后加热,观察有红色沉淀,证明X含醛基];CH3CH2OCH2CH3.
9.某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理.已知:0.4mol/L的Fe(NO3)3溶液的pH=l.
请按要求回答下列问题:
(1)检验装置A气密性的操作方法:在B中加入适量水,连接好装置A、B, 关闭弹簧夹及分液漏斗的活塞,将B中导气管深入到B的水液面以下,手握烧瓶,若B导管中有气泡冒出,松开手,B中有液柱回流 ,则气密性好.
装置A中反应的化学方程式是 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O .
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹 .
(3)在C处虚线框内画出尾气吸收的装置图(标注试剂).
(4)装置B中产生了白色沉淀,其成分是 BaSO4 ,说明SO2具有 还原 性.
(5)猜想B中产生白色沉淀的原因:
猜想1. SO2和Fe3+、酸性条件下NO3﹣都反应 ;
猜想2:由于SO2与Fe3+反应;
猜想3:由于在酸性条件下SO2与NO3﹣反应.
①若猜想2成立,装置B中依次可能发生反应的离子方程式: SO2+2Fe3++2H2O=2Fe2++SO42﹣+4H+ , SO42﹣+Ba2+=BaSO4↓ .
②为验证猜想3成立,可在相同条件下进行实验,将装置B中的Fe(NO3)3溶液替换为下列试剂是(填序号) C .
a.5mL
2.4mol/L稀硝酸
b.5mL
0.8mol/L
FeCl3溶液
c.2.5mL
0.4mol/L盐酸和2.5mL
4.8mol/L
NaNO3溶液.
【考点】性质实验方案的设计.
【分析】(1)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;装置A中亚硫酸钠和浓硫酸反应生成二氧化硫和硫酸钠;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出;
(3)尾气主要为二氧化硫,所以C处虚线框内画出尾气吸收的装置中试剂需选择碱性溶液,同时需有防倒吸的装置;
(4)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀;
(5)Fe3+和Fe2+都具有氧化性,都可与二氧化硫反应,可根据反应产物进行判断,装置B中的Fe(NO3)3溶液替换需硝酸根离子浓度相同、溶液的PH相同.
【解答】解:(1)装置气密性的检查一般常用加热法,依据的原理是:通过加热(用酒精灯或热毛巾或体温)密闭容器,使其中的气体受热膨胀,压强变大,导致放入水中的导管口有气泡冒出(导管应先放入水中),移开热源后,由于装置中的气体遇冷收缩、压强变小,又会在导管里形成一段水柱,检验装置A气密性的操作方法:在B中加入适量水,连接好装置A、B,
关闭弹簧夹及分液漏斗的活塞,将B中导气管深入到B的水液面以下,手握烧瓶,若B导管中有气泡冒出,松开手,B中有液柱回流,装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O,
故答案为:关闭弹簧夹及分液漏斗的活塞,将B中导气管深入到B的水液面以下,手握烧瓶,若B导管中有气泡冒出,松开手,B中有液柱回流;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹,
故答案为:打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹;
(3)尾气的主要成分为二氧化硫,通常用氢氧化钠溶液吸收,为防止倒吸,需用倒扣的漏斗,所以装置如图:,
故答案为:
;
(4)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀,
故答案为:BaSO4;还原性;
(5)两种离子都氧化二氧化硫,即SO2和Fe3+、酸性条件下NO3﹣都反应;
故答案为:猜想1:SO2和Fe3+、酸性条件下NO3﹣都反应;
①按观点2,装置B中反应的离子方程式是SO2+2Fe3++2H2O=2Fe2++SO42﹣+4H+,SO42﹣+Ba2+=BaSO4↓,可通过检验是否有Fe2+生成的方法判断,具体做法为取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,观点2合理,也可根据生成白色沉淀判断,
故答案为:SO2+2Fe3++2H2O=2Fe2++SO42﹣+4H+;SO42﹣+Ba2+=BaSO4↓;
②按观点3,在酸性条件下SO2与NO3﹣反应,实验中c(NO3﹣)=1.2mol/L,pH=l,则可用2.5mL
0.4mol/L盐酸和2.5mL
4.8mol/L
NaNO3溶液代替,
故答案为:c.
10.从海带中提取单质碘及碘的化合物间的转化关系如图所示:
请按要求回答下列问题:
(1)从海带灰浸取液中提取单质碘涉及的反应
①,所用试剂是MnO2、稀硫酸,其离子方程式是 MnO2+4H++2I﹣=Mn2++I2+2H2O ;实现反应①还可以选用的试剂有(填字母序号) ab .
a.3%的H2O2、稀硫酸
b.氯水
c.FeCl2溶液
d.NaOH溶液
(2)反应②2HI(g) H2(g)+I2(g)
的能量变化如图1所示;其他条件相同,1mol
HI
在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示.
i.比较
2z > (x+y)(填“<”、“>”或“=”),理由是 根据图2知,升高温度平衡正向移动,该反应正反应为吸热反应,2HI(g) H2(g)+I2(g),△H>0,△H=2z﹣(x+y)>0,所以2z>x+y
ii.某温度下该反应的平衡常数=,达平衡时,HI
的转化率= 20% .
iii.只改变该反应的一个条件,能提高
HI
转化率的措施是(填字母序号) cd .
a.增大HI
浓度
b.加压
c.移走I2
d.升温
(3)反应=③在碱性条件下I2可以转化为IO3﹣.电解KI溶液制备KIO3的工作原理如下图所示.电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅.
i.M连接电源的 正 极.
ii.结合实验现象和电极反应式说明制备KIO3的原理: I﹣在阳极失电子生成I2,使阳极溶液变蓝色,OH﹣通过阴离子交换膜移向阳极,在阳极室I2与OH﹣反应2I2+6OH﹣=5I﹣+IO3﹣+3H2O,使阳极区域蓝色变浅,并获得产品KIO3 .
【考点】化学平衡的计算;原电池和电解池的工作原理;海水资源及其综合利用.
【分析】(1)MnO2具有氧化性、碘离子具有还原性,酸性条件下,MnO2和碘离子发生氧化还原反应生成碘和水;将I﹣氧化成I2的试剂可选双氧水和氯水;
(2)i.根据图2知,升高温度碘含量增大,说明HI的分解反应是吸热反应,则2molHI分解吸收的能量大于1mol碘和1mol氢气分解吸收的能量;
ii.化学平衡常数K=;
iii.能提高HI
转化率的措施降低生成物浓度、升高温度;
(3)根据图知,发现a极变蓝,则a电极上碘离子转化为碘,a为阳极,b为阴极;
i.连接电源正极的为阳极;
ii.碱性条件下碘被氧化生成碘酸根离子.
【解答】解:(1)MnO2具有氧化性、碘离子具有还原性,酸性条件下,MnO2和碘离子发生氧化还原反应生成碘和水,离子方程式为MnO2+4H++2I﹣=Mn2++I2+2H2O;将I﹣氧化成I2的试剂可选双氧水和氯水;
故答案为:MnO2+4H++2I﹣=Mn2++I2+2H2O;ab;
(2)i.根据图2知,升高温度平衡正向移动,该反应正反应为吸热反应,2HI(g) H2(g)+I2(g),△H>0,△H=2z﹣(x+y)>0,所以2z>x+y,
故答案为:>;根据图2知,升高温度平衡正向移动,该反应正反应为吸热反应,2HI(g) H2(g)+I2(g),△H>0,△H=2z﹣(x+y)>0,所以2z>x+y;
ii.化学平衡常数K=,因碘和氢气的计量数相等,则K===,所以=,设平衡时氢气浓度是xmol/L、HI浓度是8xmol/L,生成的碘是参加反应的HI的2倍,则参加反应的HI浓度是2xmol/L,所以HI转化率=×100%=20%,
故答案为:20%;
iii.a.增大HI
浓度平衡正向移动,但HI浓度增大量远远大于HI转化浓度,所以HI转化率降低,故a错误;
b.该反应前后气体计量数之和不变,所以加压平衡不移动,不能提高HI转化率,故b错误;
c.移走I2,平衡正向移动,则提高HI转化率,故c正确;
d.该反应的正反应是吸热反应,升温平衡正向移动,HI转化率提高,故d正确;
故答案为:cd;
(3)根据图知,发现a极变蓝,则a电极上碘离子转化为碘,a为阳极,b为阴极;
i.连接电源正极的为阳极,所以a连接电源正极,
故答案为:正;
ii.I﹣在阳极失电子生成I2,使阳极溶液变蓝色,OH﹣通过阴离子交换膜移向阳极,在阳极室I2与OH﹣反应2I2+6OH﹣=5I﹣+IO3﹣+3H2O,使阳极区域蓝色变浅,
故答案为:I﹣在阳极失电子生成I2,使阳极溶液变蓝色,OH﹣通过阴离子交换膜移向阳极,在阳极室I2与OH﹣反应2I2+6OH﹣=5I﹣+IO3﹣+3H2O,使阳极区域蓝色变浅,并获得产品KIO3.
2016年12月26日
一、本卷共6题,每题6分,共计36分.在每题列出的四个选项中,只有一项是最符合题目要求的.
1.化学与生活、生产密切相关,下列说法不正确的是( )
A.食盐可做调味剂、防腐剂
B.硅酸钠可做木材防火剂的原料
C.二氧化硫在葡萄酒中起漂白作用
D.还原铁粉可用于食品包装袋内的脱氧剂
2.常温下,有关下列说法正确的是( )
A.与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣能大量共存
B.
=1×10﹣13
mol L﹣1的溶液中:NH4+、SO42﹣、NO3﹣能大量共存
C.苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O﹣═2C6H5OH+CO32﹣
D.Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O
3.下列实验叙述正确的是( )
A.用饱和食盐水替代水与电石反应,可以减缓乙炔的产生速率
B.配制一定物质的量浓度的溶液定容时,俯视刻度线会使浓度偏低
C.测定中和反应的反应热时,将碱缓慢倒入酸中,不影响测定结果
D.用NaOH标准液滴定待测浓度盐酸,达终点时滴定管尖嘴有悬滴,则测定结果偏小
4.下列物质的制备原理设计步骤合理的是( )
A.SSO3
H2SO4
B.Fe
FeCl2
Fe(OH)2
C.AlCl3(溶液)AlCl3
Al
D.NaCl(饱和溶液)
NaHCO3Na2CO3
5.一定条件下可逆反应X(g)+3Y(g) 2Z(g),X、Y、Z的起始浓度分别为a
mol L﹣1、b
mol L﹣1、c
mol L﹣1(均不为零),反应正向进行达到平衡时,它们的浓度分别为0.2mol L﹣1、0.6mol L﹣1、0.18mol L﹣1,则下列判断正确的是( )
A.a:b=3:1
B.X、Y的转化率相等
C.Y和Z的生成速率之比为2:3可做平衡标志
D.a的取值范围为0
mol L﹣1<a<0.18
mol L﹣1
6.已知:图甲是由某温度下Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL
0.1mol L﹣1HA溶液中逐滴加入0.2mol L﹣1KOH溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是( )
A.由图甲知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.由图甲知:a、b点溶液中Kw,b点的大
C.由图乙知:HA为强酸
D.由图乙知:Y点对应的溶液中c(K+)>c(A﹣)>c(OH﹣)
二、解答题(共4小题,满分64分)
7.Q、W、X、Y、Z五种短周期元素在元素周期表中的相对位置如图所示,其中W的单质是一种重要半导体材料.
Y
Q
W
X
Z
请按要求回答下列问题:
(1)Y的原子结构示意图为 ;举一例说明Z的非金属性比X的非金属性强的事实: .
(2)W、X、Y的原子半径由大到小依次是(填元素符号) ;W与Z形成的化合物电子式为 .
(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为 .
(4)已知:2Na(s)+1/2Y2(g)=Na2Y(s)△H=﹣414kJ/mol;2Na(s)+Y2(g)═Na2Y2(s)△H=﹣511kJ/mol;则Na2Y(s)
转变为Na2Y2(s)的反应一定条件下能自发进行的理由是 .
将0.2mol
Na2Y2加入到100mL1mol/L
QZ3中,充分反应的化学方程式为 .
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×l0﹣12,则R(OH)2饱和溶液中c(OH﹣)=
mol L﹣1.
8.有机物A~G间的转化关系如图所示(部分产物已略):
已知:B遇FeCl3溶液发生显色反应,苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种,能与足量碳酸氢钠溶液反应.
请按要求回答下列问题:
(1)B中含氧官能团的名称: ;1mol
B可以和 mol
Br2充分反应;B与足量的NaHCO3溶液反应产物的结构简式为 .
(2)写出下列反应的反应类型:反应
②: ;反应
③: .
(3)G的结构简式: .
(4)写出下列反应的化学方程式:反应
④: :反应①: .
(5)X是C在铜加热条件下的氧化产物,检验X所含官能团的方法是 .Y是C的同系物,比C多2个CH2原子团,Y的同分异构有多种,写出其中核磁共振氢谱仅有两种且吸收峰面积之比为2:3的结构简式: .
9.某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理.已知:0.4mol/L的Fe(NO3)3溶液的pH=l.
请按要求回答下列问题:
(1)检验装置A气密性的操作方法:在B中加入适量水,连接好装置A、B, ,则气密性好.
装置A中反应的化学方程式是 .
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 .
(3)在C处虚线框内画出尾气吸收的装置图(标注试剂).
(4)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性.
(5)猜想B中产生白色沉淀的原因:
猜想1. ;
猜想2:由于SO2与Fe3+反应;
猜想3:由于在酸性条件下SO2与NO3﹣反应.
①若猜想2成立,装置B中依次可能发生反应的离子方程式: , .
②为验证猜想3成立,可在相同条件下进行实验,将装置B中的Fe(NO3)3溶液替换为下列试剂是(填序号) .
a.5mL
2.4mol/L稀硝酸
b.5mL
0.8mol/L
FeCl3溶液
c.2.5mL
0.4mol/L盐酸和2.5mL
4.8mol/L
NaNO3溶液.
10.从海带中提取单质碘及碘的化合物间的转化关系如图所示:
请按要求回答下列问题:
(1)从海带灰浸取液中提取单质碘涉及的反应
①,所用试剂是MnO2、稀硫酸,其离子方程式是 ;实现反应①还可以选用的试剂有(填字母序号) .
a.3%的H2O2、稀硫酸
b.氯水
c.FeCl2溶液
d.NaOH溶液
(2)反应②2HI(g) H2(g)+I2(g)
的能量变化如图1所示;其他条件相同,1mol
HI
在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示.
i.比较
2z (x+y)(填“<”、“>”或“=”),理由是
ii.某温度下该反应的平衡常数=,达平衡时,HI
的转化率= .
iii.只改变该反应的一个条件,能提高
HI
转化率的措施是(填字母序号) .
a.增大HI
浓度
b.加压
c.移走I2
d.升温
(3)反应=③在碱性条件下I2可以转化为IO3﹣.电解KI溶液制备KIO3的工作原理如下图所示.电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅.
i.M连接电源的 极.
ii.结合实验现象和电极反应式说明制备KIO3的原理: .
2016年天津市河西区高考化学三模试卷
参考答案与试题解析
一、本卷共6题,每题6分,共计36分.在每题列出的四个选项中,只有一项是最符合题目要求的.
1.化学与生活、生产密切相关,下列说法不正确的是( )
A.食盐可做调味剂、防腐剂
B.硅酸钠可做木材防火剂的原料
C.二氧化硫在葡萄酒中起漂白作用
D.还原铁粉可用于食品包装袋内的脱氧剂
【考点】钠的重要化合物;二氧化硫的化学性质.
【分析】A.食盐具有咸味是咸味剂.食盐可以作防腐剂;
B.硅酸钠水溶液是水玻璃,水玻璃是矿物胶,不燃烧;
C.二氧化硫具有较强的还原性,故常用作葡萄酒的抗氧化剂;
D.Fe与氧气反应,铁的化合价升高,作还原剂.
【解答】解:A.食盐它可以使细菌细胞脱水死亡,所以可以杀菌,可作为防腐剂,食盐具有咸味是咸味剂,可做调味剂,故A正确;
B.硅酸钠的水溶液呈水玻璃,水玻璃是矿物胶,不燃烧,而将硅酸钠涂在木材表面就阻隔了木材与空气中氧气的直接接触,水玻璃可用作制备木材防火剂的原料,故B正确;
C.二氧化硫具有较强的还原性,故常用作葡萄酒的抗氧化剂,不是漂白性,故C错误;
D.铁粉作食品袋内的脱氧剂,Fe与氧气反应,铁的化合价升高,作还原剂,起到还原作用,故D正确;
故选C.
2.常温下,有关下列说法正确的是( )
A.与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣能大量共存
B.
=1×10﹣13
mol L﹣1的溶液中:NH4+、SO42﹣、NO3﹣能大量共存
C.苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O﹣═2C6H5OH+CO32﹣
D.Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O
【考点】离子共存问题;离子方程式的书写.
【分析】A.与Al反应能放出H2的溶液,为非氧化性酸或强碱溶液;
B.
=1×10﹣13
mol L﹣1的溶液,显酸性;
C.反应生成苯酚和碳酸氢钠;
D.发生氧化还原反应生成硝酸铁、NO和水.
【解答】解:A.与Al反应能放出H2的溶液,为非氧化性酸或强碱溶液,碱溶液中不能存在Fe2+,酸溶液中Fe2+(或Al)、H+、NO3﹣发生氧化还原反应不生成氢气,故A错误;
B.
=1×10﹣13
mol L﹣1的溶液,显酸性,该组离子之间不反应,可大量共存,故B正确;
C.反应生成苯酚和碳酸氢钠,离子反应为CO2+H2O+C6H5O﹣═C6H5OH+HCO3﹣,故C错误;
D.发生氧化还原反应生成硝酸铁、NO和水,离子反应为3Fe3O4+NO3﹣+28H+═9Fe3++NO↑+14H2O,故D错误;
故选B.
3.下列实验叙述正确的是( )
A.用饱和食盐水替代水与电石反应,可以减缓乙炔的产生速率
B.配制一定物质的量浓度的溶液定容时,俯视刻度线会使浓度偏低
C.测定中和反应的反应热时,将碱缓慢倒入酸中,不影响测定结果
D.用NaOH标准液滴定待测浓度盐酸,达终点时滴定管尖嘴有悬滴,则测定结果偏小
【考点】化学实验方案的评价.
【分析】A.用饱和食盐水替代水,可以减慢反应速率;
B.俯视刻度线会使溶液体积偏小,浓度偏大;
C.将碱缓慢倒入酸中,导致热量损失;
D.达终点时滴定管尖嘴有悬滴,消耗的标准液体积偏大.
【解答】解:A.饱和食盐水与电石反应较为平缓,可代替水的反应,故A正确;
B.俯视刻度线会使溶液体积偏小,浓度偏大,故B错误;
C.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失,故C错误;
D.滴定终点时,发现滴定管尖嘴部分有悬滴,则消耗的标准液偏大,则测定酸的浓度偏大,故D错误.
故选A.
4.下列物质的制备原理设计步骤合理的是( )
A.SSO3
H2SO4
B.Fe
FeCl2
Fe(OH)2
C.AlCl3(溶液)AlCl3
Al
D.NaCl(饱和溶液)
NaHCO3Na2CO3
【考点】镁、铝的重要化合物;钠的重要化合物.
【分析】A、硫在氧气中燃烧生成二氧化硫;
B、铁在氯气中燃烧生成氯化铁;
C、氯化铝是共价化合物;
D、依据侯氏制碱法原理解答.
【解答】解:A、硫在氧气中燃烧生成二氧化硫,得不到三氧化硫,故A错误;
B、铁在氯气中燃烧生成氯化铁,而不是氯化亚铁,故B错误;
C、氯化铝是共价化合物,工业上是用电解熔融的氧化铝得到铝,故C错误;
D、首先通入氨气,增加二氧化碳的溶解度,所以选通氨气,再通二氧化碳,得到溶解度极小的碳酸氢钠,碳酸氢钠不稳定,加热得到碳酸钠,故D正确;
故选D.
5.一定条件下可逆反应X(g)+3Y(g) 2Z(g),X、Y、Z的起始浓度分别为a
mol L﹣1、b
mol L﹣1、c
mol L﹣1(均不为零),反应正向进行达到平衡时,它们的浓度分别为0.2mol L﹣1、0.6mol L﹣1、0.18mol L﹣1,则下列判断正确的是( )
A.a:b=3:1
B.X、Y的转化率相等
C.Y和Z的生成速率之比为2:3可做平衡标志
D.a的取值范围为0
mol L﹣1<a<0.18
mol L﹣1
【考点】化学平衡的计算.
【分析】一定条件下可逆反应X(g)+3Y(g) 2Z(g),X、Y、Z的起始浓度分别为a
mol L﹣1、b
mol L﹣1、c
mol L﹣1(均不为零),反应正向进行达到平衡时,它们的浓度分别为0.2mol L﹣1、0.6mol L﹣1、0.18mol L﹣1,利用极值转化;
A.可根据反应转化关系和平衡浓度计算初始浓度关系;
B.起始量相同,平衡量相同,转化率相同;
C.达到平衡状态时,正逆反应速率相等;
D.根据可逆不能完全转化的角度分析.
【解答】解:A.设X转化的浓度为x,
X(g)+3Y(g) 2Z(g)
初始:a
b
c
转化:x
3x
2x
平衡:0.2moL/L
0.6mol/L
0.18mol/L
则:a:b=(x+0.2moL/L):(3x+0.6mol/L)=1:3,故A错误;
B.反应前后X、Y气体的浓度比相同符合反应系数之比,所以达到平衡状态时,转化率相同,故B正确;
C.平衡时,正逆反应速率相等,则Y和Z的生成速率之比为3:2,故C错误;
D.反应为可逆反应,物质不可能完全转化,如反应向正反应分析进行,则0<a,如反应向逆反应分析进行,则a<0.29mol L﹣1,故有0<a<0.29mol L﹣1,故D错误.
故选:B.
6.已知:图甲是由某温度下Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL
0.1mol L﹣1HA溶液中逐滴加入0.2mol L﹣1KOH溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是( )
A.由图甲知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.由图甲知:a、b点溶液中Kw,b点的大
C.由图乙知:HA为强酸
D.由图乙知:Y点对应的溶液中c(K+)>c(A﹣)>c(OH﹣)
【考点】难溶电解质的溶解平衡及沉淀转化的本质.
【分析】A、根据图象找出可用来比较Fe(OH)3与Cu(OH)2溶度积常数点,可用b、a进行计算;
B、a、b点溶液中Kw只和温度有关,温度不变,Kw不变;
C、根据图示可知,0.1mol L﹣1HA溶液的pH=2,说明溶液中
HA在溶液中部分电离;
D、Y点HA与氢氧化钾恰好反应生成KA,A﹣部分水解,溶液显示碱性.
【解答】解:A、由a、b两点对应数据可比较出Ksp[Fe(OH)3]与Ksp[Cu(OH)2]的大小,Ksp[Fe(OH)3]=c(Fe3+) (OH﹣)3=c(Fe3+) (10﹣12.7)3,Ksp[Cu(OH)2]=c(Cu2+) (OH﹣)2=c(Cu2+) (10﹣9.6)2,因c(Fe3+)=c(Cu2+),故Ksp[Fe(OH)3]<Ksp[Cu(OH)2],故A正确;
B、由图甲知:a、b点溶液中Kw一样大,故B错误;
C、HA若是强酸,则0.1mol L﹣1HA溶液的pH=1,而图象中溶液的pH>2,则HA部分电离,则HA为一元弱酸,故C错误;
D、Y点加入100mL氢氧化钾溶液后,100mL
0.1mol L﹣1HA与100mL
0.2mol L﹣1KOH溶液反应生成0.05mol L﹣1KA和0.05mol L﹣1KOH的混合物,氢氧根离子浓度大于0.05mol/L,而A﹣部分水解,溶液中A﹣部分水解的浓度小于0.05mol/L,则溶液中离子浓度大小为:c(K+)>c(OH﹣)>c(A﹣),故D错误;
故选A.
二、解答题(共4小题,满分64分)
7.Q、W、X、Y、Z五种短周期元素在元素周期表中的相对位置如图所示,其中W的单质是一种重要半导体材料.
Y
Q
W
X
Z
请按要求回答下列问题:
(1)Y的原子结构示意图为 ;举一例说明Z的非金属性比X的非金属性强的事实: 酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3 .
(2)W、X、Y的原子半径由大到小依次是(填元素符号) r(Si)>r(P)>r(O) ;W与Z形成的化合物电子式为 .
(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为 2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl﹣ .
(4)已知:2Na(s)+1/2Y2(g)=Na2Y(s)△H=﹣414kJ/mol;2Na(s)+Y2(g)═Na2Y2(s)△H=﹣511kJ/mol;则Na2Y(s)
转变为Na2Y2(s)的反应一定条件下能自发进行的理由是 Na2O(s)+O2(g)=Na2O2(s)△H=﹣97
kJ/mol,而△S<0,△H﹣T△S在低温下小于0,可自发进行 .
将0.2mol
Na2Y2加入到100mL1mol/L
QZ3中,充分反应的化学方程式为 2Na2O2+AlCl3=NaAlO2+3NaCl+O2↑ .
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×l0﹣12,则R(OH)2饱和溶液中c(OH﹣)= 2.0×l0﹣4
mol L﹣1.
【考点】位置结构性质的相互关系应用.
【分析】由短周期元素的相对位置,可知Y处于第二周期,其它处于第三周期,而W的单质是一种重要半导体材料,则W为Si元素,可推知Q为Al,X为P,Y为O,Z为Cl.
(1)根据核外电子排布规律画出原子结构示意图;可以根据最高价含氧酸的酸性强弱,氢化物稳定性等进行判断;
(2)同周期自作而原子半径减小,同主族自上而下原子半径增大;W与Z形成的化合物为SiCl4,Si原子与Cl原子之间形成1对共用电子对;
(3)假设氯气与FeBr2均为1mol,还原性Fe2+>Br﹣,氯气先氧化Fe2+为Fe3+,根据电子转移守恒,1molFe2+消耗0.5mol氯气,而剩余的0.5mol氯气可以氧化1molBr﹣;
(4)根据盖斯定律,可得:Na2O(s)+O2(g)=Na2O2(s)△H=﹣97
kJ/mol,而△H﹣T△S<0时,反应可自发进行;
将0.2mol
Na2O2加入到100mL1mol/L
AlCl3中,AlCl3为0.1mol,过氧化钠与水反应生成0.4molNaOH,氯化铝与氢氧化钠恰好反应生成NaAlO2;
(5)Ksp[R(OH)2]=c(R2+)×c2(OH﹣)=4.0×l0﹣12,而饱和溶液中c(R2+)=c(OH﹣),联立计算饱和溶液中c(OH﹣).
【解答】解:由短周期元素的相对位置,可知Y处于第二周期,其它处于第三周期,而W的单质是一种重要半导体材料,则W为Si元素,可推知Q为Al,X为P,Y为O,Z为Cl.
(1)Y为O元素,原子结构示意图为:,酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3等都可以说明Cl的非金属性比P的强,
故答案为:;酸性强弱;HClO4>H3PO4,或稳定性:HCl>PH3;
(2)同周期自作而原子半径减小,同主族自上而下原子半径增大,故原子半径:r(Si)>r(P)>r(O),W与Z形成的化合物为SiCl4,Si原子与Cl原子之间形成1对共用电子对,电子式为:,
故答案为:r(Si)>r(P)>r(O);;
(3)假设氯气与FeBr2均为1mol,还原性Fe2+>Br﹣,氯气先氧化Fe2+为Fe3+,根据电子转移守恒,1molFe2+消耗0.5mol氯气,而剩余的0.5mol氯气可以氧化1molBr﹣,反应离子方程式为:2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl﹣,
故答案为:2Fe2++2Br﹣+2Cl2=2Fe3++Br2+4Cl﹣;
(4)已知:①.2Na(s)+O2(g)=Na2O(s)△H=﹣414kJ/mol;
②.2Na(s)+O2(g)═Na2O2(s)△H=﹣511kJ/mol
根据盖斯定律,②﹣①可得:Na2O(s)+O2(g)=Na2O2(s)△H=﹣97
kJ/mol,该反应△S<0,而△H﹣T△S<0时,反应可自发进行,故低温下可以自发进行,
将0.2mol
Na2O2加入到100mL1mol/L
AlCl3中,AlCl3为0.1mol,过氧化钠与水反应生成0.4molNaOH,氯化铝与氢氧化钠恰好反应生成NaAlO2,故反应方程式为:2Na2O2+AlCl3=NaAlO2+3NaCl+O2↑,
故答案为:Na2O(s)+O2(g)=Na2O2(s)△H=﹣97
kJ/mol,而△S<0,△H﹣T△S在低温下小于0,可自发进行;2Na2O2+AlCl3=NaAlO2+3NaCl+O2↑;
(5)Ksp[R(OH)2]=c(R2+)×c2(OH﹣)=4.0×l0﹣12,而饱和溶液中c(R2+)=c(OH﹣),联立可得饱和溶液中c(OH﹣)=2.0×l0﹣4
mol/L,
故答案为:2.0×l0﹣4.
8.有机物A~G间的转化关系如图所示(部分产物已略):
已知:B遇FeCl3溶液发生显色反应,苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种,能与足量碳酸氢钠溶液反应.
请按要求回答下列问题:
(1)B中含氧官能团的名称: 羧基、羟基 ;1mol
B可以和 3 mol
Br2充分反应;B与足量的NaHCO3溶液反应产物的结构简式为 .
(2)写出下列反应的反应类型:反应
②: 消去反应 ;反应
③: 加成反应 .
(3)G的结构简式: .
(4)写出下列反应的化学方程式:反应
④: :反应①: .
(5)X是C在铜加热条件下的氧化产物,检验X所含官能团的方法是 向盛有新制银氨溶液的试管中滴加适量X,振荡后将试管放在热水浴中温热,观察有银镜产生,证明X含醛基.[或向盛有新制氢氧化铜(氢氧化钠过量)的试管中滴加适量X,振荡后加热,观察有红色沉淀,证明X含醛基] .Y是C的同系物,比C多2个CH2原子团,Y的同分异构有多种,写出其中核磁共振氢谱仅有两种且吸收峰面积之比为2:3的结构简式: CH3CH2OCH2CH3 .
【考点】有机物的推断.
【分析】B遇FeCl3溶液发生显色反应,说明含有酚羟基,且能与足量碳酸氢钠溶液反应,说明含有羧基,B的不饱和度为=6,苯环上有2个取代基,取代基不含支链,说明取代基中含有1个碳碳双键,且苯环上的一氯代物只有2种,两个不同的取代基处于对位,故B的结构简式为,B与HCl发生加成反应生成E,E发生水解反应得到F,F再浓硫酸作用下得到G,G含有2个苯环的六元环酯,则E中﹣COOH、﹣Cl连接同一碳原子上,故E为,F为,G为.A发生水解反应得到B、C,A含有酯基,结合C的分子式可知C为CH3CH2OH,故A的结构简式为:,C发生消去反应生成D为CH2=CH2.
【解答】解:B遇FeCl3溶液发生显色反应,说明含有酚羟基,且能与足量碳酸氢钠溶液反应,说明含有羧基,B的不饱和度为=6,苯环上有2个取代基,取代基不含支链,说明取代基中含有1个碳碳双键,且苯环上的一氯代物只有2种,两个不同的取代基处于对位,故B的结构简式为,B与HCl发生加成反应生成E,E发生水解反应得到F,F再浓硫酸作用下得到G,G含有2个苯环的六元环酯,则E中﹣COOH、﹣Cl连接同一碳原子上,故E为,F为,G为.A发生水解反应得到B、C,A含有酯基,结合C的分子式可知C为CH3CH2OH,故A的结构简式为:,C发生消去反应生成D为CH2=CH2.
(1)B的结构简式为,B中含氧官能团的名称:羧基、羟基,碳碳双键与溴发生加成反应,酚羟基的邻位能与溴发生取代反应,1mol
B可以和3mol
Br2充分反应,羧基能与碳酸氢钠反应,而酚羟基不能与碳酸氢钠反应,B与足量的NaHCO3溶液反应产物的结构简式为,
故答案为:羧基、羟基;3;;
(2)反应
②属于消去反应,反应
③属于加成反应,
故答案为:消去反应;加成反应;
(3)G的结构简式:,
故答案为:;
(4)反应
④的化学方程式为:,
反应①的化学方程式为:,
故答案为:;;
(5)X是C在铜加热条件下的氧化产物,则X为CH3CHO,检验X所含官能团的方法是:向盛有新制银氨溶液的试管中滴加适量X,振荡后将试管放在热水浴中温热,观察有银镜产生,证明X含醛基.[或向盛有新制氢氧化铜(氢氧化钠过量)的试管中滴加适量X,振荡后加热,观察有红色沉淀,证明X含醛基],
Y是C(乙醇)的同系物,比C多2个CH2原子团,Y的同分异构有多种,其中核磁共振氢谱仅有两种且吸收峰面积之比为2:3的结构简式:CH3CH2OCH2CH3,
故答案为:向盛有新制银氨溶液的试管中滴加适量X,振荡后将试管放在热水浴中温热,观察有银镜产生,证明X含醛基.[或向盛有新制氢氧化铜(氢氧化钠过量)的试管中滴加适量X,振荡后加热,观察有红色沉淀,证明X含醛基];CH3CH2OCH2CH3.
9.某研究小组利用如图装置探究SO2和Fe(NO3)3溶液的反应原理.已知:0.4mol/L的Fe(NO3)3溶液的pH=l.
请按要求回答下列问题:
(1)检验装置A气密性的操作方法:在B中加入适量水,连接好装置A、B, 关闭弹簧夹及分液漏斗的活塞,将B中导气管深入到B的水液面以下,手握烧瓶,若B导管中有气泡冒出,松开手,B中有液柱回流 ,则气密性好.
装置A中反应的化学方程式是 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O .
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹 .
(3)在C处虚线框内画出尾气吸收的装置图(标注试剂).
(4)装置B中产生了白色沉淀,其成分是 BaSO4 ,说明SO2具有 还原 性.
(5)猜想B中产生白色沉淀的原因:
猜想1. SO2和Fe3+、酸性条件下NO3﹣都反应 ;
猜想2:由于SO2与Fe3+反应;
猜想3:由于在酸性条件下SO2与NO3﹣反应.
①若猜想2成立,装置B中依次可能发生反应的离子方程式: SO2+2Fe3++2H2O=2Fe2++SO42﹣+4H+ , SO42﹣+Ba2+=BaSO4↓ .
②为验证猜想3成立,可在相同条件下进行实验,将装置B中的Fe(NO3)3溶液替换为下列试剂是(填序号) C .
a.5mL
2.4mol/L稀硝酸
b.5mL
0.8mol/L
FeCl3溶液
c.2.5mL
0.4mol/L盐酸和2.5mL
4.8mol/L
NaNO3溶液.
【考点】性质实验方案的设计.
【分析】(1)装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;装置A中亚硫酸钠和浓硫酸反应生成二氧化硫和硫酸钠;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出;
(3)尾气主要为二氧化硫,所以C处虚线框内画出尾气吸收的装置中试剂需选择碱性溶液,同时需有防倒吸的装置;
(4)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀;
(5)Fe3+和Fe2+都具有氧化性,都可与二氧化硫反应,可根据反应产物进行判断,装置B中的Fe(NO3)3溶液替换需硝酸根离子浓度相同、溶液的PH相同.
【解答】解:(1)装置气密性的检查一般常用加热法,依据的原理是:通过加热(用酒精灯或热毛巾或体温)密闭容器,使其中的气体受热膨胀,压强变大,导致放入水中的导管口有气泡冒出(导管应先放入水中),移开热源后,由于装置中的气体遇冷收缩、压强变小,又会在导管里形成一段水柱,检验装置A气密性的操作方法:在B中加入适量水,连接好装置A、B,
关闭弹簧夹及分液漏斗的活塞,将B中导气管深入到B的水液面以下,手握烧瓶,若B导管中有气泡冒出,松开手,B中有液柱回流,装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O,
故答案为:关闭弹簧夹及分液漏斗的活塞,将B中导气管深入到B的水液面以下,手握烧瓶,若B导管中有气泡冒出,松开手,B中有液柱回流;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出,操作为打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹,
故答案为:打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹;
(3)尾气的主要成分为二氧化硫,通常用氢氧化钠溶液吸收,为防止倒吸,需用倒扣的漏斗,所以装置如图:,
故答案为:
;
(4)二氧化硫具有还原性,可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀,
故答案为:BaSO4;还原性;
(5)两种离子都氧化二氧化硫,即SO2和Fe3+、酸性条件下NO3﹣都反应;
故答案为:猜想1:SO2和Fe3+、酸性条件下NO3﹣都反应;
①按观点2,装置B中反应的离子方程式是SO2+2Fe3++2H2O=2Fe2++SO42﹣+4H+,SO42﹣+Ba2+=BaSO4↓,可通过检验是否有Fe2+生成的方法判断,具体做法为取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液产生蓝色沉淀,则溶液中有Fe2+,观点2合理,也可根据生成白色沉淀判断,
故答案为:SO2+2Fe3++2H2O=2Fe2++SO42﹣+4H+;SO42﹣+Ba2+=BaSO4↓;
②按观点3,在酸性条件下SO2与NO3﹣反应,实验中c(NO3﹣)=1.2mol/L,pH=l,则可用2.5mL
0.4mol/L盐酸和2.5mL
4.8mol/L
NaNO3溶液代替,
故答案为:c.
10.从海带中提取单质碘及碘的化合物间的转化关系如图所示:
请按要求回答下列问题:
(1)从海带灰浸取液中提取单质碘涉及的反应
①,所用试剂是MnO2、稀硫酸,其离子方程式是 MnO2+4H++2I﹣=Mn2++I2+2H2O ;实现反应①还可以选用的试剂有(填字母序号) ab .
a.3%的H2O2、稀硫酸
b.氯水
c.FeCl2溶液
d.NaOH溶液
(2)反应②2HI(g) H2(g)+I2(g)
的能量变化如图1所示;其他条件相同,1mol
HI
在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示.
i.比较
2z > (x+y)(填“<”、“>”或“=”),理由是 根据图2知,升高温度平衡正向移动,该反应正反应为吸热反应,2HI(g) H2(g)+I2(g),△H>0,△H=2z﹣(x+y)>0,所以2z>x+y
ii.某温度下该反应的平衡常数=,达平衡时,HI
的转化率= 20% .
iii.只改变该反应的一个条件,能提高
HI
转化率的措施是(填字母序号) cd .
a.增大HI
浓度
b.加压
c.移走I2
d.升温
(3)反应=③在碱性条件下I2可以转化为IO3﹣.电解KI溶液制备KIO3的工作原理如下图所示.电解过程中观察到阳极液变蓝,一段时间后又逐渐变浅.
i.M连接电源的 正 极.
ii.结合实验现象和电极反应式说明制备KIO3的原理: I﹣在阳极失电子生成I2,使阳极溶液变蓝色,OH﹣通过阴离子交换膜移向阳极,在阳极室I2与OH﹣反应2I2+6OH﹣=5I﹣+IO3﹣+3H2O,使阳极区域蓝色变浅,并获得产品KIO3 .
【考点】化学平衡的计算;原电池和电解池的工作原理;海水资源及其综合利用.
【分析】(1)MnO2具有氧化性、碘离子具有还原性,酸性条件下,MnO2和碘离子发生氧化还原反应生成碘和水;将I﹣氧化成I2的试剂可选双氧水和氯水;
(2)i.根据图2知,升高温度碘含量增大,说明HI的分解反应是吸热反应,则2molHI分解吸收的能量大于1mol碘和1mol氢气分解吸收的能量;
ii.化学平衡常数K=;
iii.能提高HI
转化率的措施降低生成物浓度、升高温度;
(3)根据图知,发现a极变蓝,则a电极上碘离子转化为碘,a为阳极,b为阴极;
i.连接电源正极的为阳极;
ii.碱性条件下碘被氧化生成碘酸根离子.
【解答】解:(1)MnO2具有氧化性、碘离子具有还原性,酸性条件下,MnO2和碘离子发生氧化还原反应生成碘和水,离子方程式为MnO2+4H++2I﹣=Mn2++I2+2H2O;将I﹣氧化成I2的试剂可选双氧水和氯水;
故答案为:MnO2+4H++2I﹣=Mn2++I2+2H2O;ab;
(2)i.根据图2知,升高温度平衡正向移动,该反应正反应为吸热反应,2HI(g) H2(g)+I2(g),△H>0,△H=2z﹣(x+y)>0,所以2z>x+y,
故答案为:>;根据图2知,升高温度平衡正向移动,该反应正反应为吸热反应,2HI(g) H2(g)+I2(g),△H>0,△H=2z﹣(x+y)>0,所以2z>x+y;
ii.化学平衡常数K=,因碘和氢气的计量数相等,则K===,所以=,设平衡时氢气浓度是xmol/L、HI浓度是8xmol/L,生成的碘是参加反应的HI的2倍,则参加反应的HI浓度是2xmol/L,所以HI转化率=×100%=20%,
故答案为:20%;
iii.a.增大HI
浓度平衡正向移动,但HI浓度增大量远远大于HI转化浓度,所以HI转化率降低,故a错误;
b.该反应前后气体计量数之和不变,所以加压平衡不移动,不能提高HI转化率,故b错误;
c.移走I2,平衡正向移动,则提高HI转化率,故c正确;
d.该反应的正反应是吸热反应,升温平衡正向移动,HI转化率提高,故d正确;
故答案为:cd;
(3)根据图知,发现a极变蓝,则a电极上碘离子转化为碘,a为阳极,b为阴极;
i.连接电源正极的为阳极,所以a连接电源正极,
故答案为:正;
ii.I﹣在阳极失电子生成I2,使阳极溶液变蓝色,OH﹣通过阴离子交换膜移向阳极,在阳极室I2与OH﹣反应2I2+6OH﹣=5I﹣+IO3﹣+3H2O,使阳极区域蓝色变浅,
故答案为:I﹣在阳极失电子生成I2,使阳极溶液变蓝色,OH﹣通过阴离子交换膜移向阳极,在阳极室I2与OH﹣反应2I2+6OH﹣=5I﹣+IO3﹣+3H2O,使阳极区域蓝色变浅,并获得产品KIO3.
2016年12月26日
同课章节目录
