甘肃省平凉市静宁县甘沟中学2016-2017学年高二(上)期中化学试卷(解析版)
文档属性
| 名称 | 甘肃省平凉市静宁县甘沟中学2016-2017学年高二(上)期中化学试卷(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 226.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-01-04 20:33:39 | ||
图片预览



文档简介
2016-2017学年甘肃省平凉市静宁县甘沟中学高二(上)期中化学试卷
一、选择题(包括16小题,每小题3分,共48分,每小题只有一个选项符合题意.)
1.化学与人类生活、社会可持续发展密切相关.下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转换技术;
④田间焚烧秸秆;
⑤推广使用节能环保材料.
A.①③⑤
B.②③⑤
C.①②④
D.②④⑤
2.在2A+B 3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5
mol L﹣1 s﹣1
B.v(B)=0.3
mol L﹣1 s﹣1
C.v(C)=0.8
mol L﹣1 s﹣1
D.v(D)=1.6
mol L﹣1 min﹣1
3.下列说法正确的是( )
A.放热反应均是自发反应
B.△S为正值的反应均是自发反应
C.物质的量增加的反应,△S为正值
D.如果△H和△S均为正值,当温度升高时,反应可能自发进行
4.对于可逆反应C(s)+H2O(g) CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式正确的是( )
A.K=
B.K=
C.K=
D.K=
5.沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热最,则下列热化学方程式中正确的是( )
A.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ mol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ mol﹣1
C.CH4(g)+O2(g)═CO2(g)+H2O(l)△H=﹣890kJ mol﹣1
D.2CH4(g)+4O2(g)═2CO2(g)+4H2O(g)△H=+890kJ mol﹣1
6.对于可逆反应:2SO2(g)+O2(g) 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强
B.升高温度
C.使用催化剂
D.多充入O2
7.对可逆应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.化学反应速率关系是:2υ正(NH3)=3υ正(H2O)
B.达到化学平衡时,4υ正(O2)=5υ逆(NO)
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.若单位时间内生成x
mol
NO的同时,消耗x
mol
NH3,则反应达到平衡状态
8.在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g) 2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
A.40%
B.50%
C.60%
D.70%
9.一定条件下,可逆反应C(s)+CO2(g) 2CO(g);△H>0,达到平衡状态,现进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积; ④减少体系中CO的量.
上述措施中一定能使反应的正反应速率显著加快的是( )
A.①②③④
B.①③
C.①②
D.①③④
10.已知:Fe2O3(s)+C(s)═CO2(g)+2Fe(s)△H=+234.1kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
则:2Fe(s)+O2(g)═Fe2O3(s)的△H是( )
A.﹣824.4
kJ/mol
B.﹣627.6
kJ/mol
C.﹣744.7
kJ/mol
D.﹣169.4
kJ/mol
11.下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→C(金刚石);△H=+1.9
kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH﹣(aq)═H2O(l);△H=﹣57.3
kJ/mol,若将含0.5mol
H2SO4的浓硫酸与含1mol
NaOH的稀溶液混合,放出的热量大于57.3
kJ
D.在101kPa、25℃时,2g
H2完全燃烧生成液态水,放出285.8
kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l);△H=﹣285.8
kJ/mol
12.在一定温度下,向一容积不变的密闭容器中加入1mol
X气体和2mol
Y气体,发生如下反应:X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.化学反应速率关系是:2υ正(X)=υ正(Y)
C.容器内气体密度不随时间变化
D.容器内X、Y、Z的浓度之比为l:2:2
13.分别向1L
0.5mol L﹣1的NaOH溶液中加入①浓硫酸、②稀醋酸、③稀硝酸,恰好完全反应时的热效应分别为△H1、△H2、△H3,下列关系中正确的是( )
A.△H1>△H2>△H3
B.△H1<△H3<△H2
C.△H1>△H2=△H3
D.△H1=△H2<△H3
14.某可逆反应:mA(气)+nB(气) pC(气)(焓变为△H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图所示,下列结论正确的是( )
A..m+n>p△H>0
B.m+n<p△H>0
C..m+n>p△H<0
D.m+n<p△H<0
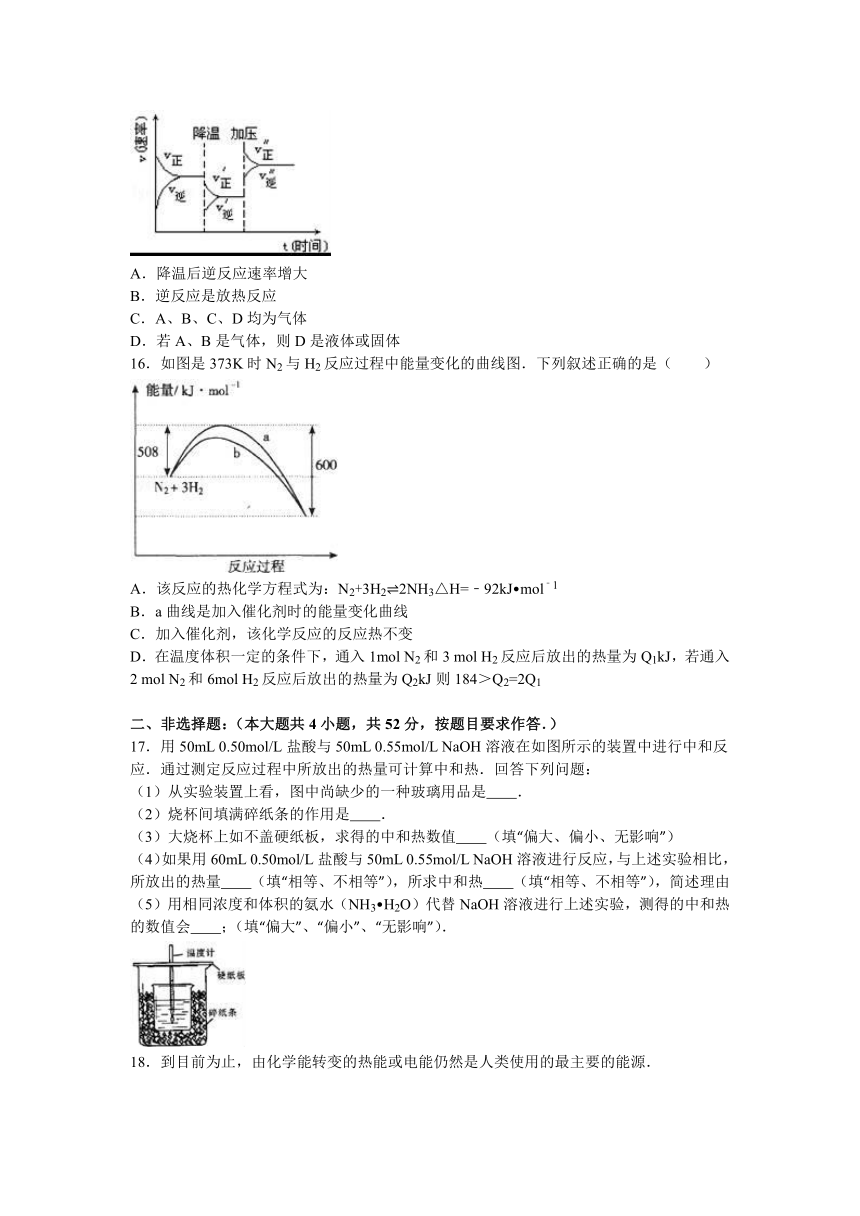
15.如图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
A.降温后逆反应速率增大
B.逆反应是放热反应
C.A、B、C、D均为气体
D.若A、B是气体,则D是液体或固体
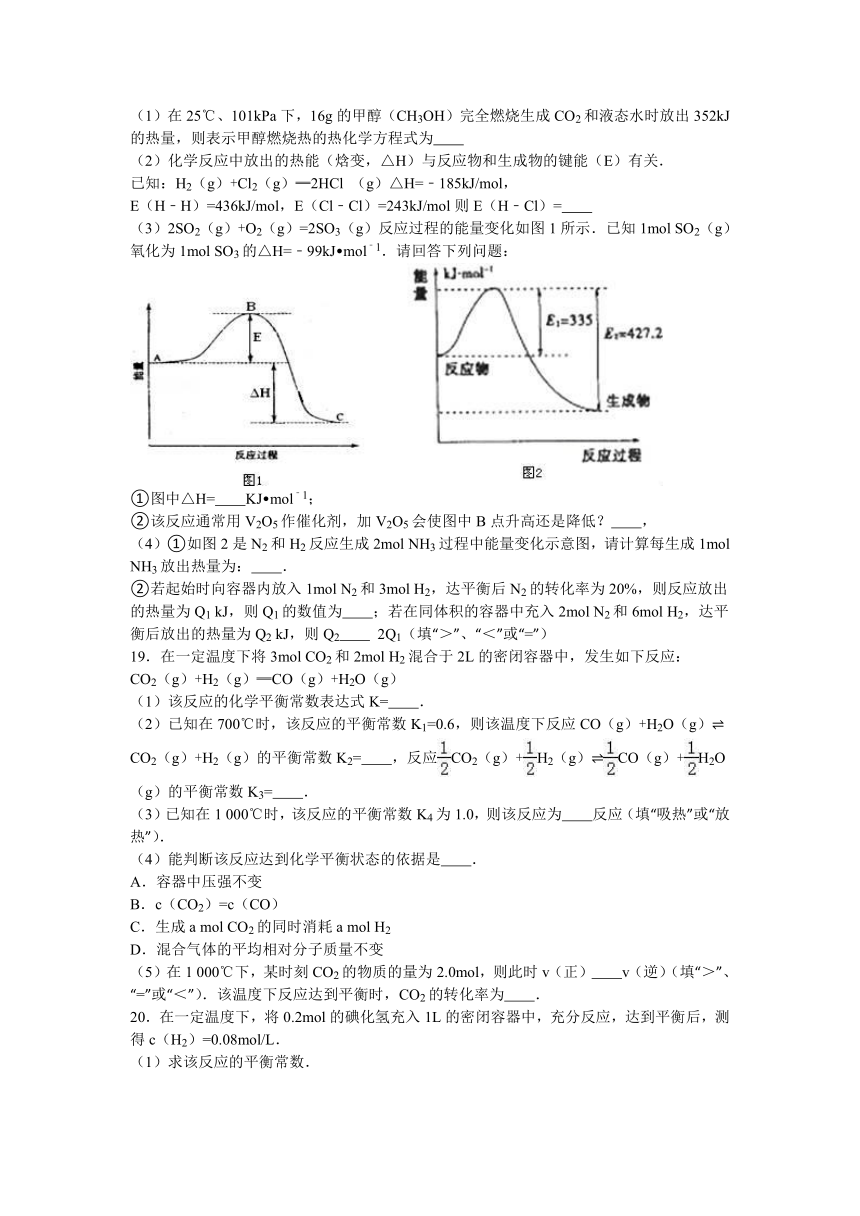
16.如图是373K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
A.该反应的热化学方程式为:N2+3H2 2NH3△H=﹣92kJ mol﹣1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热不变
D.在温度体积一定的条件下,通入1mol
N2和3
mol
H2反应后放出的热量为Q1kJ,若通入
2
mol
N2和6mol
H2反应后放出的热量为Q2kJ则184>Q2=2Q1
二、非选择题:(本大题共4小题,共52分,按题目要求作答.)
17.用50mL
0.50mol/L盐酸与50mL
0.55mol/L
NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL
0.50mol/L盐酸与50mL
0.55mol/L
NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3 H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”).
18.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)═2HCl
(g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图1所示.已知1mol
SO2(g)氧化为1mol
SO3的△H=﹣99kJ mol﹣1.请回答下列问题:
①图中△H= KJ mol﹣1;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,
(4)①如图2是N2和H2反应生成2mol
NH3过程中能量变化示意图,请计算每生成1mol
NH3放出热量为: .
②若起始时向容器内放入1mol
N2和3mol
H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1
kJ,则Q1的数值为 ;若在同体积的容器中充入2mol
N2和6mol
H2,达平衡后放出的热量为Q2
kJ,则Q2
2Q1(填“>”、“<”或“=”)
19.在一定温度下将3mol
CO2和2mol
H2混合于2L的密闭容器中,发生如下反应:
CO2(g)+H2(g)═CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K= .
(2)已知在700℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2= ,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K3= .
(3)已知在1
000℃时,该反应的平衡常数K4为1.0,则该反应为 反应(填“吸热”或“放热”).
(4)能判断该反应达到化学平衡状态的依据是 .
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a
mol
CO2的同时消耗a
mol
H2
D.混合气体的平均相对分子质量不变
(5)在1
000℃下,某时刻CO2的物质的量为2.0mol,则此时v(正) v(逆)(填“>”、
“=”或“<”).该温度下反应达到平衡时,CO2的转化率为 .
20.在一定温度下,将0.2mol的碘化氢充入1L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.08mol/L.
(1)求该反应的平衡常数.
(2)在上述温度下,该容器中若充入碘化氢0.4mol,求达到平衡时碘化氢的转化率和氢气的物质的量浓度.
2016-2017学年甘肃省平凉市静宁县甘沟中学高二(上)期中化学试卷
参考答案与试题解析
一、选择题(包括16小题,每小题3分,共48分,每小题只有一个选项符合题意.)
1.化学与人类生活、社会可持续发展密切相关.下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转换技术;
④田间焚烧秸秆;
⑤推广使用节能环保材料.
A.①③⑤
B.②③⑤
C.①②④
D.②④⑤
【考点】使用化石燃料的利弊及新能源的开发.
【分析】“节能减排,科学发展”的主题是节约能源,减少二氧化碳等温室气体的排放,有计划的发展,科学的发展.
【解答】解:①加快化石燃料的开采与使用会增加污染物的排放量,故不符合题意;
②研发易降解的生物农药能减少污染物的排放,故符合题意;
③应用高效洁净的能源转换技术,可以节约能源,减少二氧化碳的排放,故符合题意;
④田间焚烧秸秆增加二氧化碳的排放,故不符合题意;
⑤推广使用节能环保材料可以节约能源,减少二氧化碳的排放,故符合题意.
即有利于节能减排、保护环境的是②③⑤,
故选B.
2.在2A+B 3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5
mol L﹣1 s﹣1
B.v(B)=0.3
mol L﹣1 s﹣1
C.v(C)=0.8
mol L﹣1 s﹣1
D.v(D)=1.6
mol L﹣1 min﹣1
【考点】反应速率的定量表示方法.
【分析】把单位统一成相同单位,再各物质的反应速率之比等于其计量数之比,先把不同物质的反应速率换算成同一物质的反应速率进行比较,从而确定选项.
【解答】解:对于反应
2A+B 3C+4D,都转化为D表示的速率进行比较,
A.v(A)=0.5
mol/(L s)=30mol/(L min),反应速率之比等于其计量数之比,故V(D)=2V(A)=60mol/(L min);
B.v(B)=0.3
mol/(L s)=18mol/(L min);反应速率之比等于其计量数之比,故V(D)=4V(B)=72mol/(L min);
C.V(C)=0.8
mol/(L s)=48mol/(L min),反应速率之比等于其计量数之比,故V(D)=V(A)=64mol/(L min);
D.V(D)=1.6mol/(L min),
故选:B.
3.下列说法正确的是( )
A.放热反应均是自发反应
B.△S为正值的反应均是自发反应
C.物质的量增加的反应,△S为正值
D.如果△H和△S均为正值,当温度升高时,反应可能自发进行
【考点】反应热和焓变.
【分析】反应能否自发进行,取决于焓变与熵变的综合判据,当△H﹣T △S<0时,反应可自发进行,否则不能,以此解答.
【解答】解:A.放热反应不一定能发生进行,如铝热反应为放热反应,在常温下不能自发进行,故A错误;
B.△S为正值的反应不一定是自发反应,如水的分解,故B错误;
C.只有气体的物质的量增加的反应,△S为正值,故C错误;
D.如果△H和△S均为正值,当温度升高时,可满足△H﹣T △S<0时,反应可自发进行,故D正确.
故选D.
4.对于可逆反应C(s)+H2O(g) CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式正确的是( )
A.K=
B.K=
C.K=
D.K=
【考点】化学平衡常数的含义.
【分析】平衡常数等于生成物浓度的幂次方乘积除以反应物的幂次方乘积,注意固体和纯液体不写在计算式中.
【解答】解:平衡常数等于生成物浓度的幂次方乘积除以反应物的幂次方乘积,注意固体和纯液体不写在计算式中,对于可逆反应C(s)+H2O(g) CO(g)+H2(g),化学平衡常数K=,
故选:D.
5.沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热最,则下列热化学方程式中正确的是( )
A.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ mol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ mol﹣1
C.CH4(g)+O2(g)═CO2(g)+H2O(l)△H=﹣890kJ mol﹣1
D.2CH4(g)+4O2(g)═2CO2(g)+4H2O(g)△H=+890kJ mol﹣1
【考点】热化学方程式.
【分析】根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答.
【解答】解:0.5mol
CH4完全燃烧生成CO2和液态水时,放出445KJ热量,
1molCH4在氧气中燃烧生成CO2和液态水,放出890kJ热量,
则热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890KJ/mol,
故选A.
6.对于可逆反应:2SO2(g)+O2(g) 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强
B.升高温度
C.使用催化剂
D.多充入O2
【考点】化学反应速率的影响因素;化学平衡的影响因素.
【分析】增大反应物中活化分子百分数、化学反应速率,可升高温度或加入催化剂,如平衡常数发生变化,应改变温度,以此解答该题.
【解答】解:A.增大压强,活化分子百分数不变,故A错误;
B.升高温度,反应物中活化分子百分数、化学反应速率都增大,且化学平衡常数发生变化,故B正确;
C.使用催化剂,平衡常数不变,故C错误;
D.多充O2,活化分子百分数、平衡常数不变,故D错误;
故选B.
7.对可逆应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.化学反应速率关系是:2υ正(NH3)=3υ正(H2O)
B.达到化学平衡时,4υ正(O2)=5υ逆(NO)
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.若单位时间内生成x
mol
NO的同时,消耗x
mol
NH3,则反应达到平衡状态
【考点】化学平衡的影响因素.
【分析】反应中反应速率之比等于化学计量数之比,达到平衡时,正逆反应速率相等,增大压强,浓度增大,正逆反应速率都增大,以此解答该题.
【解答】解:A.反应速率之比等于化学计量数之比,应为3υ正(NH3)=2υ正(H2O),故A错误;
B.4υ正(O2)=5υ逆(NO),可说明正逆反应速率相等,达到化学平衡状态,故B正确;
C.增大压强,浓度增大,正逆反应速率都增大,故C错误;
D.无论是否达到平衡状态,都存在单位时间内生成x
mol
NO的同时,消耗x
mol
NH3,故D错误.
故选B.
8.在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g) 2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
A.40%
B.50%
C.60%
D.70%
【考点】化学平衡的计算.
【分析】假定A和B的物质的量都是1mol,根据平衡时A和B的物质的量之和与C的物质的量相等,结合反应方程式,利用三段式解题法,列方程,求出参加反应A的物质的量,再根据转化率的定义计算其转化率.
【解答】解:设参加反应的A的物质的量为xmol,则:
A(气)+2B(气) ?2C(气)
开始(mol)
1
1
0
变化(mol)
x
2x
2x
平衡(mol)(1﹣x)
(1﹣2x)
2x
所以,(1﹣x)mol+(1﹣2x)mol=2xmol;
解得:x=0.4
A的转化率为×100%=40%,
故选A
9.一定条件下,可逆反应C(s)+CO2(g) 2CO(g);△H>0,达到平衡状态,现进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积; ④减少体系中CO的量.
上述措施中一定能使反应的正反应速率显著加快的是( )
A.①②③④
B.①③
C.①②
D.①③④
【考点】化学反应速率的影响因素.
【分析】增加反应速率,则升高温度、增大浓度或增大压强等,注意C为固体的特点,以此解答.
【解答】解:①升高反应体系的温度,能增大反应速率;
②由于碳为固体,增加反应物C的用量,对反应速率没有影响;
③缩小反应体系的体积,压强增大,气体浓度增大,反应速率增大;
④减少体系中CO的量,反应速率减小.
则能使反应的正反应速率显著加快的是①③,
故选:B.
10.已知:Fe2O3(s)+C(s)═CO2(g)+2Fe(s)△H=+234.1kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
则:2Fe(s)+O2(g)═Fe2O3(s)的△H是( )
A.﹣824.4
kJ/mol
B.﹣627.6
kJ/mol
C.﹣744.7
kJ/mol
D.﹣169.4
kJ/mol
【考点】有关反应热的计算.
【分析】根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减,据此判断.
【解答】解:①Fe2O3(s)+C(s)═CO2(g)+2Fe(s)△H=+234.1kJ/mol
②C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
由盖斯定律②×﹣①得:2Fe(s)+O2(g)=Fe2O3(s)△H=(﹣393.5kJ mol﹣1)×﹣234.1kJ mol﹣1
即2Fe(s)+O2(g)=Fe2O3(s)△H=﹣824.4kJ mol﹣1.
故选A.
11.下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→C(金刚石);△H=+1.9
kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH﹣(aq)═H2O(l);△H=﹣57.3
kJ/mol,若将含0.5mol
H2SO4的浓硫酸与含1mol
NaOH的稀溶液混合,放出的热量大于57.3
kJ
D.在101kPa、25℃时,2g
H2完全燃烧生成液态水,放出285.8
kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l);△H=﹣285.8
kJ/mol
【考点】反应热和焓变.
【分析】A、同一物质不同状态能量不同,气态能量高,放出热量多;
B、根据物质的总能量与稳定性关系判断;
C、要注意根据中和热的概念来分析;
D、反应热要与方程式中的计量数对应.
【解答】解:A、等质量的硫蒸气和硫固体分别完全燃烧,由于硫蒸气具有的能量高,所以硫蒸气放出的热量多,故A错误;
B、石墨转化为金刚石是吸热反应,所以石墨具有的能量低,石墨比金刚石稳定,故B错误;
C、若将含0.5mol
H2SO4的浓硫酸与含1mol
NaOH的稀溶液混合,由于反应放热,浓硫酸稀释也放热,故放出的热量大于57.3
kJ,故C正确;
D、在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8KJ热量,则2H2(g)十02(g)=2H2O(l);△H=﹣571.6KJ/mol,故D错误.
故选C.
12.在一定温度下,向一容积不变的密闭容器中加入1mol
X气体和2mol
Y气体,发生如下反应:X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.化学反应速率关系是:2υ正(X)=υ正(Y)
C.容器内气体密度不随时间变化
D.容器内X、Y、Z的浓度之比为l:2:2
【考点】化学平衡状态的判断.
【分析】可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量及由此引起的一系列物理量不变,据此分析解答.
【解答】解:A.反应前后气体物质的量减小,容器内压强减小,当压强不变时,正逆反应速率相等,反应达到平衡状态,故A正确;
B.反应方向一致,不能据此判断平衡状态,故B错误;
C.无论反应是否达到平衡状态,容器内混合气体总质量不变、容器体积不变,则密度始终不变,不能据此判断平衡状态,故C错误;
D.容器内X、Y、Z的浓度之比为l:2:2,该反应不一定达到平衡状态,与反应初始浓度及转化率有关,故D错误;
故选A.
13.分别向1L
0.5mol L﹣1的NaOH溶液中加入①浓硫酸、②稀醋酸、③稀硝酸,恰好完全反应时的热效应分别为△H1、△H2、△H3,下列关系中正确的是( )
A.△H1>△H2>△H3
B.△H1<△H3<△H2
C.△H1>△H2=△H3
D.△H1=△H2<△H3
【考点】反应热的大小比较.
【分析】稀的强酸与强碱生成1molH2O放出的热量为中和热,注意弱电解质的电离吸热,浓硫酸溶于水放热来解答.
【解答】解:强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)十OH﹣(aq)=H2O;△H=一57.3kJ/mol,
分别向1L
0.5mol/L的NaOH溶液中加入:①浓硫酸、②稀醋酸、③稀硝酸,
浓硫酸溶于水放热,醋酸的电离吸热,则
恰好完全反应时的放出的热量为①>③>②,
所以△H1<△H3<△H2,
故选B.
14.某可逆反应:mA(气)+nB(气) pC(气)(焓变为△H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图所示,下列结论正确的是( )
A..m+n>p△H>0
B.m+n<p△H>0
C..m+n>p△H<0
D.m+n<p△H<0
【考点】化学平衡的影响因素.
【分析】根据“先拐先平数值大”知,左图中T2>T1,升高温度C的含量减小,说明平衡向逆反应方向移动,则正反应是放热反应;
根据右图知,升高温度,平衡向逆反应方向移动,平均相对分子质量减小,因为反应前后质量不变,则说明逆反应方向为气体体积增大的方向,据此分析解答.
【解答】解:根据“先拐先平数值大”知,左图中T2>T1,升高温度C的含量减小,说明平衡向逆反应方向移动,则正反应是放热反应,所以△H<0;
根据右图知,升高温度,平衡向逆反应方向移动,平均相对分子质量减小,因为反应前后质量不变,则说明逆反应方向为气体体积增大的方向应,则m+n>p;
故选C.
15.如图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
A.降温后逆反应速率增大
B.逆反应是放热反应
C.A、B、C、D均为气体
D.若A、B是气体,则D是液体或固体
【考点】化学平衡的影响因素.
【分析】A.降低温度正逆反应速率均减小;
B.由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动;
C.若A、B、C、D均为气体,增大压强平衡向逆反应方向移动;
D.增大压强,平衡向正方向移动,即正方向为体积减小的方向.
【解答】解:A.降低温度正逆反应速率均减小,则降温后逆反应速率减小,故A错误;
B.由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动,则该反应的正反应为放热反应,逆反应吸热反应,故B错误;
C.若A、B、C、D均为气体,增大压强平衡向逆反应方向移动,图示增大压强平衡向正反应方向移动,故C错误;
D.增大压强,平衡向正方向移动,即正方向为体积减小的方向,若A、B是气体,则D是液体或固体,故D正确.
故选D.
16.如图是373K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
A.该反应的热化学方程式为:N2+3H2 2NH3△H=﹣92kJ mol﹣1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热不变
D.在温度体积一定的条件下,通入1mol
N2和3
mol
H2反应后放出的热量为Q1kJ,若通入
2
mol
N2和6mol
H2反应后放出的热量为Q2kJ则184>Q2=2Q1
【考点】反应热和焓变.
【分析】A、依据热化学方程式的书写原则,标注物质的聚集状态和反应的热效应,结合断键吸收热量,形成化学键放出热量计算反应的焓变,△H=放出的能量﹣吸收的能量分析;
B、根据催化剂是降低反应的活化能,加快反应速率,不改变平衡分析;
C、根据催化剂不改变化学平衡,催化剂与反应热的关系分析;
D、增大压强平衡正移,反应放出的热量增多.
【解答】解:A、热化学方程式必须标注物质的聚集状态反应的焓变,该反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g),△H=﹣92kJ mol﹣1,故A错误;
B、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故图象中的b曲线是加入正催化剂时的能量变化曲线,故B错误;
C、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,所以该化学反应的反应热不变,故C正确;
D、在相同温度的条件下,通入1mol
N2和3
mol
H2反应后放出的热量为Q1kJ,若通入
2
mol
N2和6mol
H2反应后放出的热量为Q2kJ,如果平衡不移动,则Q2=2Q1,但是增大反应物物质的量器压强增大,平衡正移,所以放出的热量增多,Q2>2Q1,故D错误;
故选:C.
二、非选择题:(本大题共4小题,共52分,按题目要求作答.)
17.用50mL
0.50mol/L盐酸与50mL
0.55mol/L
NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 环形玻璃搅拌棒 .
(2)烧杯间填满碎纸条的作用是 减少实验过程中的热量损失 .
(3)大烧杯上如不盖硬纸板,求得的中和热数值 偏小 (填“偏大、偏小、无影响”)
(4)如果用60mL
0.50mol/L盐酸与50mL
0.55mol/L
NaOH溶液进行反应,与上述实验相比,所放出的热量 不相等 (填“相等、不相等”),所求中和热 相等 (填“相等、不相等”),简述理由 因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关
(5)用相同浓度和体积的氨水(NH3 H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 偏小 ;(填“偏大”、“偏小”、“无影响”).
【考点】中和热的测定.
【分析】(1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据弱电解质电离吸热分析.
【解答】解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌器;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,
故答案为:减少实验过程中的热量损失;
(3))大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol L﹣1H2SO4溶液跟50mL0.55mol L﹣1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所测得中和热数值相等,
故答案为:不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小.
18.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 CH3OH(l)+O2(g)═CO2(g)+2H2O(l)△H=﹣704KJ/mol
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)═2HCl
(g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)= 432kJ/mol
(3)2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图1所示.已知1mol
SO2(g)氧化为1mol
SO3的△H=﹣99kJ mol﹣1.请回答下列问题:
①图中△H= ﹣198 KJ mol﹣1;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? 降低 ,
(4)①如图2是N2和H2反应生成2mol
NH3过程中能量变化示意图,请计算每生成1mol
NH3放出热量为: 46.1kJ .
②若起始时向容器内放入1mol
N2和3mol
H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1
kJ,则Q1的数值为 18.44 ;若在同体积的容器中充入2mol
N2和6mol
H2,达平衡后放出的热量为Q2
kJ,则Q2 >
2Q1(填“>”、“<”或“=”)
【考点】有关反应热的计算.
【分析】(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量书写热化学方程式,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704KJ,标注物质聚集状态和对应焓变写出;
(2)依据反应的焓变△H=反应物键能总和﹣生成物键能总和计算;
(3)①根据反应2SO2(g)+O2(g)=2SO3(g)结合1mol
SO2(g)氧化为1mol
SO3的△H=﹣99kJ mol﹣1计算反应热;
②加入催化剂,可以使得活化能减小,反应速度加快;
(4)①依据图象分析,生成2mol氨气反应焓变=断裂化学键吸收能量﹣形成化学键放出能量计算得到1mol氨气放出热量;
②依据化学平衡计算生成氨气物质的量,结合热化学方程式计算Q1,若在同体积的容器中充入2mol
N2和6mol
H2,可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行计算分析达平衡后放出的热量为Q2
kJ.
【解答】解:(1)16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704KJ,标注物质聚集状态和对应焓变写出热化学方程式为:CH3OH(l)+O2(g)═CO2(g)+2H2O
(l)△H=﹣704KJ/mol;
故答案为:CH3OH(l)+O2(g)═CO2(g)+2H2O
(l)△H=﹣704KJ/mol;
(2)H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol
△H=反应物键能总和﹣生成物键能总和得到:﹣185kJ/mol=436KJ/mol+243KJ/mol﹣2E(H﹣Cl)
则E(H﹣Cl)=432kJ/mol;
故答案为:432kJ/mol;
(3)①因1mol
SO2(g)氧化为1mol
SO3的△H=﹣99kJ mol﹣1,所以2molSO2(g)氧化为2molSO3的△H=﹣198kJ mol﹣1,
则2SO2(g)+O2(g)=2SO3(g)△H=﹣198KJ mol﹣1,故答案为:﹣198;
②因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,加入催化剂,活化能减小,
故答案为:降低;
(4)①如图是N2和H2反应生成2mol
NH3过程中能量变化示意图,反应焓变△H=335KJ/mol﹣427.2KJ/mol=﹣92.2KJ/mol,所以生成1mol氨气放热46.1KJ;
故答案为:46.1
kJ;
②如图是N2和H2反应生成2mol
NH3过程中能量变化示意图,反应焓变△H=335KJ/mol﹣427.2KJ/mol=﹣92.2KJ/mol,
N2(g)+3H2(g)=2NH3(g)△H=﹣92.2KJ/mol
1
3
0
0.2
0.6
0.4
生成0.4mol氨气放热=×92,2KJ=18.44KJ;
若在同体积的容器中充入2mol
N2和6mol
H2,可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行达平衡后放出的热量Q2
大于2Q1;
故答案为:18.44,>.
19.在一定温度下将3mol
CO2和2mol
H2混合于2L的密闭容器中,发生如下反应:
CO2(g)+H2(g)═CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K= .
(2)已知在700℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2= 1.67 ,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K3= 0.77 .
(3)已知在1
000℃时,该反应的平衡常数K4为1.0,则该反应为 吸热 反应(填“吸热”或“放热”).
(4)能判断该反应达到化学平衡状态的依据是 C .
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a
mol
CO2的同时消耗a
mol
H2
D.混合气体的平均相对分子质量不变
(5)在1
000℃下,某时刻CO2的物质的量为2.0mol,则此时v(正) > v(逆)(填“>”、
“=”或“<”).该温度下反应达到平衡时,CO2的转化率为 40% .
【考点】化学平衡常数的含义;化学平衡状态的判断;化学平衡的计算.
【分析】(1)该反应的化学平衡常数表达式K=;
(2)反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2=;
反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K3=;
(3)升高温度,平衡向吸热反应方向移动;
(4)当该反应达到平衡状态时,同一物质的正逆反应速率相等,反应体系中各物质的含量不变;
(5)根据浓度商与平衡常数判断反应方向,根据平衡常数计算反应的二氧化碳的量,再结合转化率计算二氧化碳的转化率.
【解答】解:(1)该反应的化学平衡常数表达式K=,故答案为:;
(2)反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2====1.67;
反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K3===0.77,
故答案为:1.67;0.77;
(3)在1
000℃时,该反应的平衡常数K4为1.0,升高温度平衡常数增大,平衡向正反应方向移动,说明正反应是吸热反应,故答案为:吸热;
(4)A.该反应前后气体的计量数之和不变,则无论是否达到平衡状态,容器中压强始终不变,则不能根据压强判断是否达到平衡状态,故错误;
B.c(CO2)=c(CO),该反应可能达到平衡状态,也可能没有达到平衡状态,与反应物浓度及转化率有关,所以不能判断是否达到平衡状态,故错误;
C.生成a
mol
CO2的同时消耗a
mol
H2,说明同一物质的正逆反应速率相等,该反应达到平衡状态,故正确;
D.混合气体的质量不变、物质的量不变,所以混合气体的平均相对分子质量始终不变,不能据此判断是否达到平衡状态,故错误;
故选C;
(5)CO2(g)+H2(g)═CO(g)+H2O(g)
起始1.5
1
0
0
反应0.5
0.5
0.5
0.5
平衡1
0.5
0.5
0.5
浓度商==0.5<1,则反应向正反应方向移动,所以v(正)>v(逆);
3mol
CO2和2mol
H2混合于2L的密闭容器中,则二氧化碳和氢气的起始浓度分别为1.5mol/L、1mol/L,在1
000℃下,某时刻CO2的物质的量为2.0mol,某时刻二氧化碳的浓度是1mol/L,
设该温度下达到平衡时,反应的二氧化碳的物质的量浓度为x
CO2(g)+H2(g)═CO(g)+H2O(g)
起始1.5
1
0
0
反应x
x
x
x
平衡1.5﹣x
1﹣x
x
x
,x=0.6
二氧化碳的转化率==40%,
故答案为:>;40%.
20.在一定温度下,将0.2mol的碘化氢充入1L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.08mol/L.
(1)求该反应的平衡常数.
(2)在上述温度下,该容器中若充入碘化氢0.4mol,求达到平衡时碘化氢的转化率和氢气的物质的量浓度.
【考点】化学平衡的计算.
【分析】达到平衡时,测得c(H2)=0.08mol/L,则
2HI(g) H2(g)+I2(g)
起始时各物质的浓度(mol L﹣1)
0.2
0
0
各物质的浓度变化量(mol L﹣1)
0.16 0.08
0.08
平衡时各物质的浓度(mol L﹣1)
0.04 0.08
0.08
(1)利用平衡的浓度计算K,K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)设转化的碘化氢为x,利用三段法得出各物质的平衡浓度,平衡常数与(1)相同,以此来计算.
【解答】解:达到平衡时,测得c(H2)=0.08mol/L,则
2HI(g) H2(g)+I2(g)
起始时各物质的浓度(mol L﹣1)
0.2
0
0
各物质的浓度变化量(mol L﹣1)
0.16 0.08
0.08
平衡时各物质的浓度(mol L﹣1)
0.04 0.08
0.08
(1)平衡时c(H2)=c(I2)=0.08mol/L,c(HI)=0.04mol/L,
则K==4,
答:该反应的平衡常数为4;
(2)在上述温度下,该容器中若充入碘化氢0.4mol,设HI转化了x
则
2HI(g) H2(g)+I2(g)
起始时各物质的浓度(mol L﹣1) 0.4
0 0
各物质的浓度变化量(mol L﹣1) x
0.5x
0.5x
平衡时各物质的浓度(mol L﹣1) 0.4﹣x
0.5x
0.5x
K==4,
解得:x=0.32
mol;
碘化氢转化率=×100%=80%
所以平衡时c(H2)==0.16mol/L;
答:平衡时碘化氢的转化率为80%,氢气的物质的量浓度为0.16mol/L.
2017年1月3日
一、选择题(包括16小题,每小题3分,共48分,每小题只有一个选项符合题意.)
1.化学与人类生活、社会可持续发展密切相关.下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转换技术;
④田间焚烧秸秆;
⑤推广使用节能环保材料.
A.①③⑤
B.②③⑤
C.①②④
D.②④⑤
2.在2A+B 3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5
mol L﹣1 s﹣1
B.v(B)=0.3
mol L﹣1 s﹣1
C.v(C)=0.8
mol L﹣1 s﹣1
D.v(D)=1.6
mol L﹣1 min﹣1
3.下列说法正确的是( )
A.放热反应均是自发反应
B.△S为正值的反应均是自发反应
C.物质的量增加的反应,△S为正值
D.如果△H和△S均为正值,当温度升高时,反应可能自发进行
4.对于可逆反应C(s)+H2O(g) CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式正确的是( )
A.K=
B.K=
C.K=
D.K=
5.沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热最,则下列热化学方程式中正确的是( )
A.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ mol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ mol﹣1
C.CH4(g)+O2(g)═CO2(g)+H2O(l)△H=﹣890kJ mol﹣1
D.2CH4(g)+4O2(g)═2CO2(g)+4H2O(g)△H=+890kJ mol﹣1
6.对于可逆反应:2SO2(g)+O2(g) 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强
B.升高温度
C.使用催化剂
D.多充入O2
7.对可逆应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.化学反应速率关系是:2υ正(NH3)=3υ正(H2O)
B.达到化学平衡时,4υ正(O2)=5υ逆(NO)
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.若单位时间内生成x
mol
NO的同时,消耗x
mol
NH3,则反应达到平衡状态
8.在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g) 2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
A.40%
B.50%
C.60%
D.70%
9.一定条件下,可逆反应C(s)+CO2(g) 2CO(g);△H>0,达到平衡状态,现进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积; ④减少体系中CO的量.
上述措施中一定能使反应的正反应速率显著加快的是( )
A.①②③④
B.①③
C.①②
D.①③④
10.已知:Fe2O3(s)+C(s)═CO2(g)+2Fe(s)△H=+234.1kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
则:2Fe(s)+O2(g)═Fe2O3(s)的△H是( )
A.﹣824.4
kJ/mol
B.﹣627.6
kJ/mol
C.﹣744.7
kJ/mol
D.﹣169.4
kJ/mol
11.下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→C(金刚石);△H=+1.9
kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH﹣(aq)═H2O(l);△H=﹣57.3
kJ/mol,若将含0.5mol
H2SO4的浓硫酸与含1mol
NaOH的稀溶液混合,放出的热量大于57.3
kJ
D.在101kPa、25℃时,2g
H2完全燃烧生成液态水,放出285.8
kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l);△H=﹣285.8
kJ/mol
12.在一定温度下,向一容积不变的密闭容器中加入1mol
X气体和2mol
Y气体,发生如下反应:X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.化学反应速率关系是:2υ正(X)=υ正(Y)
C.容器内气体密度不随时间变化
D.容器内X、Y、Z的浓度之比为l:2:2
13.分别向1L
0.5mol L﹣1的NaOH溶液中加入①浓硫酸、②稀醋酸、③稀硝酸,恰好完全反应时的热效应分别为△H1、△H2、△H3,下列关系中正确的是( )
A.△H1>△H2>△H3
B.△H1<△H3<△H2
C.△H1>△H2=△H3
D.△H1=△H2<△H3
14.某可逆反应:mA(气)+nB(气) pC(气)(焓变为△H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图所示,下列结论正确的是( )
A..m+n>p△H>0
B.m+n<p△H>0
C..m+n>p△H<0
D.m+n<p△H<0
15.如图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
A.降温后逆反应速率增大
B.逆反应是放热反应
C.A、B、C、D均为气体
D.若A、B是气体,则D是液体或固体
16.如图是373K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
A.该反应的热化学方程式为:N2+3H2 2NH3△H=﹣92kJ mol﹣1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热不变
D.在温度体积一定的条件下,通入1mol
N2和3
mol
H2反应后放出的热量为Q1kJ,若通入
2
mol
N2和6mol
H2反应后放出的热量为Q2kJ则184>Q2=2Q1
二、非选择题:(本大题共4小题,共52分,按题目要求作答.)
17.用50mL
0.50mol/L盐酸与50mL
0.55mol/L
NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL
0.50mol/L盐酸与50mL
0.55mol/L
NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3 H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”).
18.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)═2HCl
(g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图1所示.已知1mol
SO2(g)氧化为1mol
SO3的△H=﹣99kJ mol﹣1.请回答下列问题:
①图中△H= KJ mol﹣1;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,
(4)①如图2是N2和H2反应生成2mol
NH3过程中能量变化示意图,请计算每生成1mol
NH3放出热量为: .
②若起始时向容器内放入1mol
N2和3mol
H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1
kJ,则Q1的数值为 ;若在同体积的容器中充入2mol
N2和6mol
H2,达平衡后放出的热量为Q2
kJ,则Q2
2Q1(填“>”、“<”或“=”)
19.在一定温度下将3mol
CO2和2mol
H2混合于2L的密闭容器中,发生如下反应:
CO2(g)+H2(g)═CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K= .
(2)已知在700℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2= ,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K3= .
(3)已知在1
000℃时,该反应的平衡常数K4为1.0,则该反应为 反应(填“吸热”或“放热”).
(4)能判断该反应达到化学平衡状态的依据是 .
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a
mol
CO2的同时消耗a
mol
H2
D.混合气体的平均相对分子质量不变
(5)在1
000℃下,某时刻CO2的物质的量为2.0mol,则此时v(正) v(逆)(填“>”、
“=”或“<”).该温度下反应达到平衡时,CO2的转化率为 .
20.在一定温度下,将0.2mol的碘化氢充入1L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.08mol/L.
(1)求该反应的平衡常数.
(2)在上述温度下,该容器中若充入碘化氢0.4mol,求达到平衡时碘化氢的转化率和氢气的物质的量浓度.
2016-2017学年甘肃省平凉市静宁县甘沟中学高二(上)期中化学试卷
参考答案与试题解析
一、选择题(包括16小题,每小题3分,共48分,每小题只有一个选项符合题意.)
1.化学与人类生活、社会可持续发展密切相关.下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转换技术;
④田间焚烧秸秆;
⑤推广使用节能环保材料.
A.①③⑤
B.②③⑤
C.①②④
D.②④⑤
【考点】使用化石燃料的利弊及新能源的开发.
【分析】“节能减排,科学发展”的主题是节约能源,减少二氧化碳等温室气体的排放,有计划的发展,科学的发展.
【解答】解:①加快化石燃料的开采与使用会增加污染物的排放量,故不符合题意;
②研发易降解的生物农药能减少污染物的排放,故符合题意;
③应用高效洁净的能源转换技术,可以节约能源,减少二氧化碳的排放,故符合题意;
④田间焚烧秸秆增加二氧化碳的排放,故不符合题意;
⑤推广使用节能环保材料可以节约能源,减少二氧化碳的排放,故符合题意.
即有利于节能减排、保护环境的是②③⑤,
故选B.
2.在2A+B 3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5
mol L﹣1 s﹣1
B.v(B)=0.3
mol L﹣1 s﹣1
C.v(C)=0.8
mol L﹣1 s﹣1
D.v(D)=1.6
mol L﹣1 min﹣1
【考点】反应速率的定量表示方法.
【分析】把单位统一成相同单位,再各物质的反应速率之比等于其计量数之比,先把不同物质的反应速率换算成同一物质的反应速率进行比较,从而确定选项.
【解答】解:对于反应
2A+B 3C+4D,都转化为D表示的速率进行比较,
A.v(A)=0.5
mol/(L s)=30mol/(L min),反应速率之比等于其计量数之比,故V(D)=2V(A)=60mol/(L min);
B.v(B)=0.3
mol/(L s)=18mol/(L min);反应速率之比等于其计量数之比,故V(D)=4V(B)=72mol/(L min);
C.V(C)=0.8
mol/(L s)=48mol/(L min),反应速率之比等于其计量数之比,故V(D)=V(A)=64mol/(L min);
D.V(D)=1.6mol/(L min),
故选:B.
3.下列说法正确的是( )
A.放热反应均是自发反应
B.△S为正值的反应均是自发反应
C.物质的量增加的反应,△S为正值
D.如果△H和△S均为正值,当温度升高时,反应可能自发进行
【考点】反应热和焓变.
【分析】反应能否自发进行,取决于焓变与熵变的综合判据,当△H﹣T △S<0时,反应可自发进行,否则不能,以此解答.
【解答】解:A.放热反应不一定能发生进行,如铝热反应为放热反应,在常温下不能自发进行,故A错误;
B.△S为正值的反应不一定是自发反应,如水的分解,故B错误;
C.只有气体的物质的量增加的反应,△S为正值,故C错误;
D.如果△H和△S均为正值,当温度升高时,可满足△H﹣T △S<0时,反应可自发进行,故D正确.
故选D.
4.对于可逆反应C(s)+H2O(g) CO(g)+H2(g),在一定温度下达到平衡时,其平衡常数表达式正确的是( )
A.K=
B.K=
C.K=
D.K=
【考点】化学平衡常数的含义.
【分析】平衡常数等于生成物浓度的幂次方乘积除以反应物的幂次方乘积,注意固体和纯液体不写在计算式中.
【解答】解:平衡常数等于生成物浓度的幂次方乘积除以反应物的幂次方乘积,注意固体和纯液体不写在计算式中,对于可逆反应C(s)+H2O(g) CO(g)+H2(g),化学平衡常数K=,
故选:D.
5.沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热最,则下列热化学方程式中正确的是( )
A.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ mol﹣1
B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ mol﹣1
C.CH4(g)+O2(g)═CO2(g)+H2O(l)△H=﹣890kJ mol﹣1
D.2CH4(g)+4O2(g)═2CO2(g)+4H2O(g)△H=+890kJ mol﹣1
【考点】热化学方程式.
【分析】根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答.
【解答】解:0.5mol
CH4完全燃烧生成CO2和液态水时,放出445KJ热量,
1molCH4在氧气中燃烧生成CO2和液态水,放出890kJ热量,
则热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890KJ/mol,
故选A.
6.对于可逆反应:2SO2(g)+O2(g) 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强
B.升高温度
C.使用催化剂
D.多充入O2
【考点】化学反应速率的影响因素;化学平衡的影响因素.
【分析】增大反应物中活化分子百分数、化学反应速率,可升高温度或加入催化剂,如平衡常数发生变化,应改变温度,以此解答该题.
【解答】解:A.增大压强,活化分子百分数不变,故A错误;
B.升高温度,反应物中活化分子百分数、化学反应速率都增大,且化学平衡常数发生变化,故B正确;
C.使用催化剂,平衡常数不变,故C错误;
D.多充O2,活化分子百分数、平衡常数不变,故D错误;
故选B.
7.对可逆应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )
A.化学反应速率关系是:2υ正(NH3)=3υ正(H2O)
B.达到化学平衡时,4υ正(O2)=5υ逆(NO)
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.若单位时间内生成x
mol
NO的同时,消耗x
mol
NH3,则反应达到平衡状态
【考点】化学平衡的影响因素.
【分析】反应中反应速率之比等于化学计量数之比,达到平衡时,正逆反应速率相等,增大压强,浓度增大,正逆反应速率都增大,以此解答该题.
【解答】解:A.反应速率之比等于化学计量数之比,应为3υ正(NH3)=2υ正(H2O),故A错误;
B.4υ正(O2)=5υ逆(NO),可说明正逆反应速率相等,达到化学平衡状态,故B正确;
C.增大压强,浓度增大,正逆反应速率都增大,故C错误;
D.无论是否达到平衡状态,都存在单位时间内生成x
mol
NO的同时,消耗x
mol
NH3,故D错误.
故选B.
8.在一密闭容器中,用等物质的量的A和B发生如下反应:A(g)+2B(g) 2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
A.40%
B.50%
C.60%
D.70%
【考点】化学平衡的计算.
【分析】假定A和B的物质的量都是1mol,根据平衡时A和B的物质的量之和与C的物质的量相等,结合反应方程式,利用三段式解题法,列方程,求出参加反应A的物质的量,再根据转化率的定义计算其转化率.
【解答】解:设参加反应的A的物质的量为xmol,则:
A(气)+2B(气) ?2C(气)
开始(mol)
1
1
0
变化(mol)
x
2x
2x
平衡(mol)(1﹣x)
(1﹣2x)
2x
所以,(1﹣x)mol+(1﹣2x)mol=2xmol;
解得:x=0.4
A的转化率为×100%=40%,
故选A
9.一定条件下,可逆反应C(s)+CO2(g) 2CO(g);△H>0,达到平衡状态,现进行如下操作:
①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积; ④减少体系中CO的量.
上述措施中一定能使反应的正反应速率显著加快的是( )
A.①②③④
B.①③
C.①②
D.①③④
【考点】化学反应速率的影响因素.
【分析】增加反应速率,则升高温度、增大浓度或增大压强等,注意C为固体的特点,以此解答.
【解答】解:①升高反应体系的温度,能增大反应速率;
②由于碳为固体,增加反应物C的用量,对反应速率没有影响;
③缩小反应体系的体积,压强增大,气体浓度增大,反应速率增大;
④减少体系中CO的量,反应速率减小.
则能使反应的正反应速率显著加快的是①③,
故选:B.
10.已知:Fe2O3(s)+C(s)═CO2(g)+2Fe(s)△H=+234.1kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
则:2Fe(s)+O2(g)═Fe2O3(s)的△H是( )
A.﹣824.4
kJ/mol
B.﹣627.6
kJ/mol
C.﹣744.7
kJ/mol
D.﹣169.4
kJ/mol
【考点】有关反应热的计算.
【分析】根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减,据此判断.
【解答】解:①Fe2O3(s)+C(s)═CO2(g)+2Fe(s)△H=+234.1kJ/mol
②C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
由盖斯定律②×﹣①得:2Fe(s)+O2(g)=Fe2O3(s)△H=(﹣393.5kJ mol﹣1)×﹣234.1kJ mol﹣1
即2Fe(s)+O2(g)=Fe2O3(s)△H=﹣824.4kJ mol﹣1.
故选A.
11.下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→C(金刚石);△H=+1.9
kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH﹣(aq)═H2O(l);△H=﹣57.3
kJ/mol,若将含0.5mol
H2SO4的浓硫酸与含1mol
NaOH的稀溶液混合,放出的热量大于57.3
kJ
D.在101kPa、25℃时,2g
H2完全燃烧生成液态水,放出285.8
kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l);△H=﹣285.8
kJ/mol
【考点】反应热和焓变.
【分析】A、同一物质不同状态能量不同,气态能量高,放出热量多;
B、根据物质的总能量与稳定性关系判断;
C、要注意根据中和热的概念来分析;
D、反应热要与方程式中的计量数对应.
【解答】解:A、等质量的硫蒸气和硫固体分别完全燃烧,由于硫蒸气具有的能量高,所以硫蒸气放出的热量多,故A错误;
B、石墨转化为金刚石是吸热反应,所以石墨具有的能量低,石墨比金刚石稳定,故B错误;
C、若将含0.5mol
H2SO4的浓硫酸与含1mol
NaOH的稀溶液混合,由于反应放热,浓硫酸稀释也放热,故放出的热量大于57.3
kJ,故C正确;
D、在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8KJ热量,则2H2(g)十02(g)=2H2O(l);△H=﹣571.6KJ/mol,故D错误.
故选C.
12.在一定温度下,向一容积不变的密闭容器中加入1mol
X气体和2mol
Y气体,发生如下反应:X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.化学反应速率关系是:2υ正(X)=υ正(Y)
C.容器内气体密度不随时间变化
D.容器内X、Y、Z的浓度之比为l:2:2
【考点】化学平衡状态的判断.
【分析】可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量及由此引起的一系列物理量不变,据此分析解答.
【解答】解:A.反应前后气体物质的量减小,容器内压强减小,当压强不变时,正逆反应速率相等,反应达到平衡状态,故A正确;
B.反应方向一致,不能据此判断平衡状态,故B错误;
C.无论反应是否达到平衡状态,容器内混合气体总质量不变、容器体积不变,则密度始终不变,不能据此判断平衡状态,故C错误;
D.容器内X、Y、Z的浓度之比为l:2:2,该反应不一定达到平衡状态,与反应初始浓度及转化率有关,故D错误;
故选A.
13.分别向1L
0.5mol L﹣1的NaOH溶液中加入①浓硫酸、②稀醋酸、③稀硝酸,恰好完全反应时的热效应分别为△H1、△H2、△H3,下列关系中正确的是( )
A.△H1>△H2>△H3
B.△H1<△H3<△H2
C.△H1>△H2=△H3
D.△H1=△H2<△H3
【考点】反应热的大小比较.
【分析】稀的强酸与强碱生成1molH2O放出的热量为中和热,注意弱电解质的电离吸热,浓硫酸溶于水放热来解答.
【解答】解:强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)十OH﹣(aq)=H2O;△H=一57.3kJ/mol,
分别向1L
0.5mol/L的NaOH溶液中加入:①浓硫酸、②稀醋酸、③稀硝酸,
浓硫酸溶于水放热,醋酸的电离吸热,则
恰好完全反应时的放出的热量为①>③>②,
所以△H1<△H3<△H2,
故选B.
14.某可逆反应:mA(气)+nB(气) pC(气)(焓变为△H),其温度T、时间t与生成物C的体积百分数C%、平衡混合气体的平均相对分子质量M的关系如图所示,下列结论正确的是( )
A..m+n>p△H>0
B.m+n<p△H>0
C..m+n>p△H<0
D.m+n<p△H<0
【考点】化学平衡的影响因素.
【分析】根据“先拐先平数值大”知,左图中T2>T1,升高温度C的含量减小,说明平衡向逆反应方向移动,则正反应是放热反应;
根据右图知,升高温度,平衡向逆反应方向移动,平均相对分子质量减小,因为反应前后质量不变,则说明逆反应方向为气体体积增大的方向,据此分析解答.
【解答】解:根据“先拐先平数值大”知,左图中T2>T1,升高温度C的含量减小,说明平衡向逆反应方向移动,则正反应是放热反应,所以△H<0;
根据右图知,升高温度,平衡向逆反应方向移动,平均相对分子质量减小,因为反应前后质量不变,则说明逆反应方向为气体体积增大的方向应,则m+n>p;
故选C.
15.如图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
A.降温后逆反应速率增大
B.逆反应是放热反应
C.A、B、C、D均为气体
D.若A、B是气体,则D是液体或固体
【考点】化学平衡的影响因素.
【分析】A.降低温度正逆反应速率均减小;
B.由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动;
C.若A、B、C、D均为气体,增大压强平衡向逆反应方向移动;
D.增大压强,平衡向正方向移动,即正方向为体积减小的方向.
【解答】解:A.降低温度正逆反应速率均减小,则降温后逆反应速率减小,故A错误;
B.由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动,则该反应的正反应为放热反应,逆反应吸热反应,故B错误;
C.若A、B、C、D均为气体,增大压强平衡向逆反应方向移动,图示增大压强平衡向正反应方向移动,故C错误;
D.增大压强,平衡向正方向移动,即正方向为体积减小的方向,若A、B是气体,则D是液体或固体,故D正确.
故选D.
16.如图是373K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
A.该反应的热化学方程式为:N2+3H2 2NH3△H=﹣92kJ mol﹣1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热不变
D.在温度体积一定的条件下,通入1mol
N2和3
mol
H2反应后放出的热量为Q1kJ,若通入
2
mol
N2和6mol
H2反应后放出的热量为Q2kJ则184>Q2=2Q1
【考点】反应热和焓变.
【分析】A、依据热化学方程式的书写原则,标注物质的聚集状态和反应的热效应,结合断键吸收热量,形成化学键放出热量计算反应的焓变,△H=放出的能量﹣吸收的能量分析;
B、根据催化剂是降低反应的活化能,加快反应速率,不改变平衡分析;
C、根据催化剂不改变化学平衡,催化剂与反应热的关系分析;
D、增大压强平衡正移,反应放出的热量增多.
【解答】解:A、热化学方程式必须标注物质的聚集状态反应的焓变,该反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g),△H=﹣92kJ mol﹣1,故A错误;
B、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,故图象中的b曲线是加入正催化剂时的能量变化曲线,故B错误;
C、催化剂能改变反应的路径,使发生反应所需的活化能降低,但不改变化学平衡,反应的热效应不变,所以该化学反应的反应热不变,故C正确;
D、在相同温度的条件下,通入1mol
N2和3
mol
H2反应后放出的热量为Q1kJ,若通入
2
mol
N2和6mol
H2反应后放出的热量为Q2kJ,如果平衡不移动,则Q2=2Q1,但是增大反应物物质的量器压强增大,平衡正移,所以放出的热量增多,Q2>2Q1,故D错误;
故选:C.
二、非选择题:(本大题共4小题,共52分,按题目要求作答.)
17.用50mL
0.50mol/L盐酸与50mL
0.55mol/L
NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 环形玻璃搅拌棒 .
(2)烧杯间填满碎纸条的作用是 减少实验过程中的热量损失 .
(3)大烧杯上如不盖硬纸板,求得的中和热数值 偏小 (填“偏大、偏小、无影响”)
(4)如果用60mL
0.50mol/L盐酸与50mL
0.55mol/L
NaOH溶液进行反应,与上述实验相比,所放出的热量 不相等 (填“相等、不相等”),所求中和热 相等 (填“相等、不相等”),简述理由 因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关
(5)用相同浓度和体积的氨水(NH3 H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 偏小 ;(填“偏大”、“偏小”、“无影响”).
【考点】中和热的测定.
【分析】(1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据弱电解质电离吸热分析.
【解答】解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌器;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,
故答案为:减少实验过程中的热量损失;
(3))大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25mol L﹣1H2SO4溶液跟50mL0.55mol L﹣1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所测得中和热数值相等,
故答案为:不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小.
18.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 CH3OH(l)+O2(g)═CO2(g)+2H2O(l)△H=﹣704KJ/mol
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)═2HCl
(g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)= 432kJ/mol
(3)2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图1所示.已知1mol
SO2(g)氧化为1mol
SO3的△H=﹣99kJ mol﹣1.请回答下列问题:
①图中△H= ﹣198 KJ mol﹣1;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? 降低 ,
(4)①如图2是N2和H2反应生成2mol
NH3过程中能量变化示意图,请计算每生成1mol
NH3放出热量为: 46.1kJ .
②若起始时向容器内放入1mol
N2和3mol
H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1
kJ,则Q1的数值为 18.44 ;若在同体积的容器中充入2mol
N2和6mol
H2,达平衡后放出的热量为Q2
kJ,则Q2 >
2Q1(填“>”、“<”或“=”)
【考点】有关反应热的计算.
【分析】(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量书写热化学方程式,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704KJ,标注物质聚集状态和对应焓变写出;
(2)依据反应的焓变△H=反应物键能总和﹣生成物键能总和计算;
(3)①根据反应2SO2(g)+O2(g)=2SO3(g)结合1mol
SO2(g)氧化为1mol
SO3的△H=﹣99kJ mol﹣1计算反应热;
②加入催化剂,可以使得活化能减小,反应速度加快;
(4)①依据图象分析,生成2mol氨气反应焓变=断裂化学键吸收能量﹣形成化学键放出能量计算得到1mol氨气放出热量;
②依据化学平衡计算生成氨气物质的量,结合热化学方程式计算Q1,若在同体积的容器中充入2mol
N2和6mol
H2,可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行计算分析达平衡后放出的热量为Q2
kJ.
【解答】解:(1)16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704KJ,标注物质聚集状态和对应焓变写出热化学方程式为:CH3OH(l)+O2(g)═CO2(g)+2H2O
(l)△H=﹣704KJ/mol;
故答案为:CH3OH(l)+O2(g)═CO2(g)+2H2O
(l)△H=﹣704KJ/mol;
(2)H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol
△H=反应物键能总和﹣生成物键能总和得到:﹣185kJ/mol=436KJ/mol+243KJ/mol﹣2E(H﹣Cl)
则E(H﹣Cl)=432kJ/mol;
故答案为:432kJ/mol;
(3)①因1mol
SO2(g)氧化为1mol
SO3的△H=﹣99kJ mol﹣1,所以2molSO2(g)氧化为2molSO3的△H=﹣198kJ mol﹣1,
则2SO2(g)+O2(g)=2SO3(g)△H=﹣198KJ mol﹣1,故答案为:﹣198;
②因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,加入催化剂,活化能减小,
故答案为:降低;
(4)①如图是N2和H2反应生成2mol
NH3过程中能量变化示意图,反应焓变△H=335KJ/mol﹣427.2KJ/mol=﹣92.2KJ/mol,所以生成1mol氨气放热46.1KJ;
故答案为:46.1
kJ;
②如图是N2和H2反应生成2mol
NH3过程中能量变化示意图,反应焓变△H=335KJ/mol﹣427.2KJ/mol=﹣92.2KJ/mol,
N2(g)+3H2(g)=2NH3(g)△H=﹣92.2KJ/mol
1
3
0
0.2
0.6
0.4
生成0.4mol氨气放热=×92,2KJ=18.44KJ;
若在同体积的容器中充入2mol
N2和6mol
H2,可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行达平衡后放出的热量Q2
大于2Q1;
故答案为:18.44,>.
19.在一定温度下将3mol
CO2和2mol
H2混合于2L的密闭容器中,发生如下反应:
CO2(g)+H2(g)═CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K= .
(2)已知在700℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2= 1.67 ,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K3= 0.77 .
(3)已知在1
000℃时,该反应的平衡常数K4为1.0,则该反应为 吸热 反应(填“吸热”或“放热”).
(4)能判断该反应达到化学平衡状态的依据是 C .
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a
mol
CO2的同时消耗a
mol
H2
D.混合气体的平均相对分子质量不变
(5)在1
000℃下,某时刻CO2的物质的量为2.0mol,则此时v(正) > v(逆)(填“>”、
“=”或“<”).该温度下反应达到平衡时,CO2的转化率为 40% .
【考点】化学平衡常数的含义;化学平衡状态的判断;化学平衡的计算.
【分析】(1)该反应的化学平衡常数表达式K=;
(2)反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2=;
反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K3=;
(3)升高温度,平衡向吸热反应方向移动;
(4)当该反应达到平衡状态时,同一物质的正逆反应速率相等,反应体系中各物质的含量不变;
(5)根据浓度商与平衡常数判断反应方向,根据平衡常数计算反应的二氧化碳的量,再结合转化率计算二氧化碳的转化率.
【解答】解:(1)该反应的化学平衡常数表达式K=,故答案为:;
(2)反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K2====1.67;
反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K3===0.77,
故答案为:1.67;0.77;
(3)在1
000℃时,该反应的平衡常数K4为1.0,升高温度平衡常数增大,平衡向正反应方向移动,说明正反应是吸热反应,故答案为:吸热;
(4)A.该反应前后气体的计量数之和不变,则无论是否达到平衡状态,容器中压强始终不变,则不能根据压强判断是否达到平衡状态,故错误;
B.c(CO2)=c(CO),该反应可能达到平衡状态,也可能没有达到平衡状态,与反应物浓度及转化率有关,所以不能判断是否达到平衡状态,故错误;
C.生成a
mol
CO2的同时消耗a
mol
H2,说明同一物质的正逆反应速率相等,该反应达到平衡状态,故正确;
D.混合气体的质量不变、物质的量不变,所以混合气体的平均相对分子质量始终不变,不能据此判断是否达到平衡状态,故错误;
故选C;
(5)CO2(g)+H2(g)═CO(g)+H2O(g)
起始1.5
1
0
0
反应0.5
0.5
0.5
0.5
平衡1
0.5
0.5
0.5
浓度商==0.5<1,则反应向正反应方向移动,所以v(正)>v(逆);
3mol
CO2和2mol
H2混合于2L的密闭容器中,则二氧化碳和氢气的起始浓度分别为1.5mol/L、1mol/L,在1
000℃下,某时刻CO2的物质的量为2.0mol,某时刻二氧化碳的浓度是1mol/L,
设该温度下达到平衡时,反应的二氧化碳的物质的量浓度为x
CO2(g)+H2(g)═CO(g)+H2O(g)
起始1.5
1
0
0
反应x
x
x
x
平衡1.5﹣x
1﹣x
x
x
,x=0.6
二氧化碳的转化率==40%,
故答案为:>;40%.
20.在一定温度下,将0.2mol的碘化氢充入1L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.08mol/L.
(1)求该反应的平衡常数.
(2)在上述温度下,该容器中若充入碘化氢0.4mol,求达到平衡时碘化氢的转化率和氢气的物质的量浓度.
【考点】化学平衡的计算.
【分析】达到平衡时,测得c(H2)=0.08mol/L,则
2HI(g) H2(g)+I2(g)
起始时各物质的浓度(mol L﹣1)
0.2
0
0
各物质的浓度变化量(mol L﹣1)
0.16 0.08
0.08
平衡时各物质的浓度(mol L﹣1)
0.04 0.08
0.08
(1)利用平衡的浓度计算K,K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)设转化的碘化氢为x,利用三段法得出各物质的平衡浓度,平衡常数与(1)相同,以此来计算.
【解答】解:达到平衡时,测得c(H2)=0.08mol/L,则
2HI(g) H2(g)+I2(g)
起始时各物质的浓度(mol L﹣1)
0.2
0
0
各物质的浓度变化量(mol L﹣1)
0.16 0.08
0.08
平衡时各物质的浓度(mol L﹣1)
0.04 0.08
0.08
(1)平衡时c(H2)=c(I2)=0.08mol/L,c(HI)=0.04mol/L,
则K==4,
答:该反应的平衡常数为4;
(2)在上述温度下,该容器中若充入碘化氢0.4mol,设HI转化了x
则
2HI(g) H2(g)+I2(g)
起始时各物质的浓度(mol L﹣1) 0.4
0 0
各物质的浓度变化量(mol L﹣1) x
0.5x
0.5x
平衡时各物质的浓度(mol L﹣1) 0.4﹣x
0.5x
0.5x
K==4,
解得:x=0.32
mol;
碘化氢转化率=×100%=80%
所以平衡时c(H2)==0.16mol/L;
答:平衡时碘化氢的转化率为80%,氢气的物质的量浓度为0.16mol/L.
2017年1月3日
同课章节目录
