选修1主题3课题1电池探秘 同步练习 (含答案)
文档属性
| 名称 | 选修1主题3课题1电池探秘 同步练习 (含答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 171.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-01-07 09:36:54 | ||
图片预览

文档简介
电池探秘
同步练习
考查点一 原电池的组成及其工作原理
1.有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;
③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
( )。
A.A>B>C>D
B.A>C>D>B
C.C>A>B>D
D.B>D>C>A
解析 金属与稀H2SO4溶液组成原电池,活泼金属为负极,失去电子发生氧化反应,较不活泼的金属为正极,H+在正极表面得到电子生成H2,电子运动方向由负极→正极,电流方向则由正极→负极。在题述原电池中,A—B原电池,A为负极;C—D原电池,C为负极;A—C原电池,A为负极;B—D原电池,D为负极。综上可知,金属活动性:A>C>D>B。
答案 B
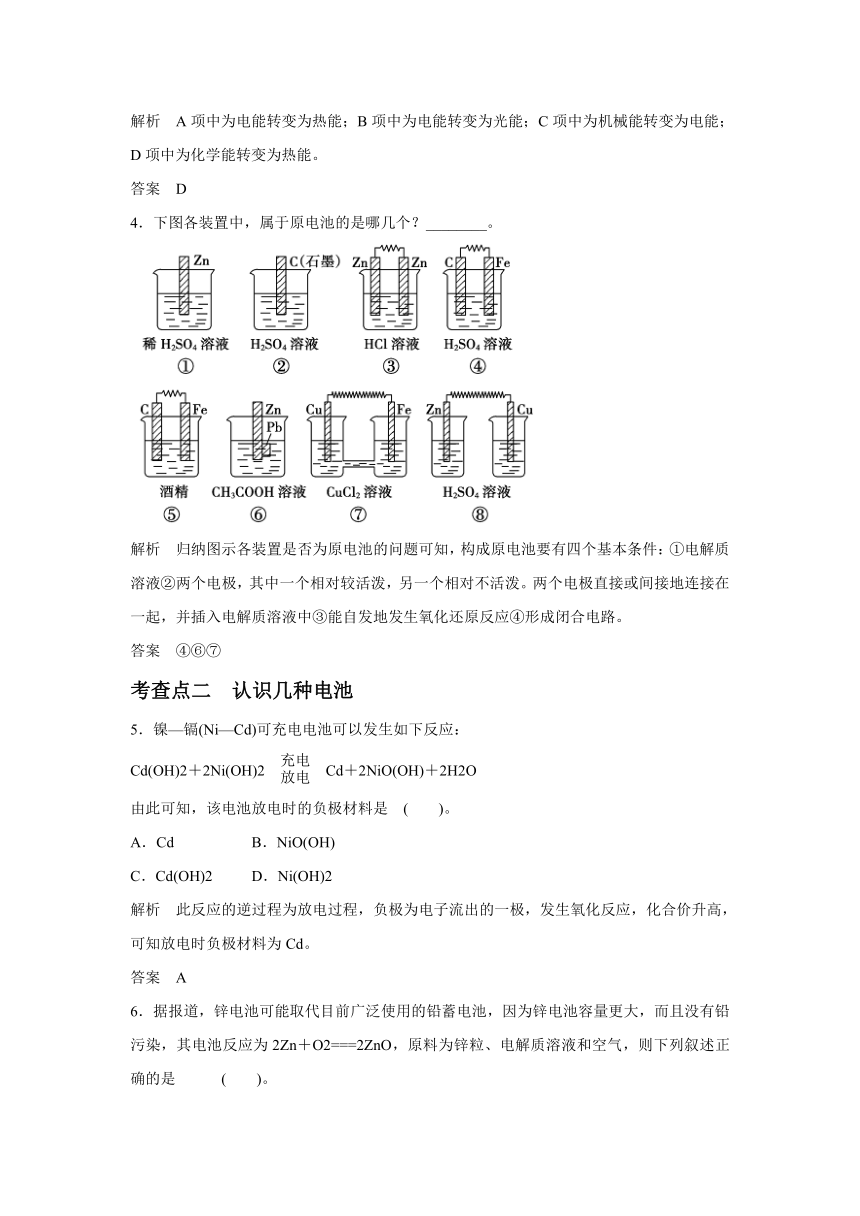
2.如图所示装置,能组成原电池并产生电流的是
( )。
INCLUDEPICTURE
"../../../A+3.TIF"
\
MERGEFORMAT
解析 选项A中两电池的电极是相同材料,不存在电势差;选项B能满足原电池的构成条件,能产生电流;选项C中酒精是非电解质,不导电,构不成闭合回路,故也不可能产生电流;选项D中两溶液分开,也不能构成闭合回路。
答案 B
3.人类生活需要能量。下列能量主要由化学变化产生的是
( )。
A.电熨斗通电发出的热量
B.电灯通电发出的光
C.水电站利用水力产生的电能
D.液化石油气燃烧放出的热量
解析 A项中为电能转变为热能;B项中为电能转变为光能;C项中为机械能转变为电能;D项中为化学能转变为热能。
答案 D
4.下图各装置中,属于原电池的是哪几个?________。
INCLUDEPICTURE
"../../../H48.tif"
\
MERGEFORMAT
解析 归纳图示各装置是否为原电池的问题可知,构成原电池要有四个基本条件:①电解质溶液②两个电极,其中一个相对较活泼,另一个相对不活泼。两个电极直接或间接地连接在一起,并插入电解质溶液中③能自发地发生氧化还原反应④形成闭合电路。
答案 ④⑥⑦
考查点二 认识几种电池
5.镍—镉(Ni—Cd)可充电电池可以发生如下反应:
Cd(OH)2+2Ni(OH)2Cd+2NiO(OH)+2H2O
由此可知,该电池放电时的负极材料是
( )。
A.Cd
B.NiO(OH)
C.Cd(OH)2
D.Ni(OH)2
解析 此反应的逆过程为放电过程,负极为电子流出的一极,发生氧化反应,化合价升高,可知放电时负极材料为Cd。
答案 A
6.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染,其电池反应为2Zn+O2===2ZnO,原料为锌粒、电解质溶液和空气,则下列叙述正确的是
( )。
A.锌为正极,空气进入负极反应
B.负极反应为Zn+2e--2e-===ZnO+H2O
C.正极发生氧化反应
D.电解质溶液肯定不是强酸
解析 2Zn+O2===2ZnO,Zn失电子,O2得电子,即Zn为原电池负极,O2在正极上反应,故B项正确;若电解质溶液为强酸,ZnO则不能存在,故D项也正确。
答案 BD
7.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入CH4的一极,其电极反应式是:CH4+10OH--8e-===CO+7H2O;通入O2的一极,其电极反应式是:2O2+4H2O+8e-===8OH-。下列叙述不正确的是
( )。
A.通入CH4的电极为负极
B.正极发生氧化反应
C.燃料电池工作时,溶液中的OH-向负极移动
D.该电池使用一段时间后应补充KOH
解析 在原电池中,负极上发生氧化反应,正极上发生还原反应,故B项错。
答案 B
8.有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池总反应方程式:8Li+3SOCl2===6LiCl+Li2SO3+2S,已知将亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3。则下列叙述正确的是
( )。
A.SOCl2在制备无水AlCl3的反应中只起干燥作用
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,SOCl2被还原为Li2SO3
D.电池工作过程中,消耗的锂与析出的S的质量之比为7∶8
解析 A,由信息将亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3知,SOCl2既能消耗水,生成的HCl又能抑制Al3+的水解;B,由电池反应知,金属锂作电池的负极,石墨作电池的正极;C,电池工作过程中,SOCl2被还原为S;D,电池工作过程中,消耗的锂与析出的S的质量之比为(8×7)∶(2×32)=7∶8。
答案 D
9.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是:
H2+NiO(OH)Ni(OH)2
根据此反应式判断,下列叙述正确的是
( )。
A.电池放电时,电池负极周围溶液的OH-浓度不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2是负极
解析 充电电池在放电时是一个电源(原电池),发生原电池反应,在这个反应方程式中从左到右是放电,根据发生氧化反应的是负极,发生还原反应的是正极,所以D项正确,B项错误;而H2作为电池的负极发生的反应是:H2-2e-===2H+,溶液中应该是H+浓度增大,OH-浓度减小,所以A项错误;充电反应是从右到左,所以氢元素被还原,C项正确。
答案 CD
考查点三 原电池正负极的判断及电极反应式的书写
10.关于如图所示装置的叙述,正确的是
( )。
A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
解析 从图中可以看出这是原电池,原电池的电极名称应说是正极、负极,故A项错;而原电池是活泼金属被消耗,B项错;负极(Zn)的电子经外线路流向正极(Cu),电流方向应与电子流向相反,故C项错。
答案 D
11.(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应:__________________________________;
银片上发生的电极反应:__________________________________。
(2)若该电池中两电极的总质量为60
g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47
g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA=6.02×1023
mol-1,电子电量为1.60×10-19C)
解析 (1)锌片、银片与稀硫酸构成原电池
锌片为负极,发生氧化反应:Zn-2e-===Zn2+
银片为正极,发生还原反应:2H++2e-===H2↑
(2)①锌片与银片减少的质量等于生成氢气所消耗的锌的质量,设产生的氢气体积为x。
Zn+2H+===Zn2++H2↑
65
g
22.4
L
60
g-47
g x
x=(60-47)g×22.4
L÷65
g=4.48
L
②反应消耗的锌为:13
g÷65
g·mol-1=0.20
mol
1
mol
Zn变为Zn2+时,转移2
mol
e-,则通过的电量为:
0.20
mol×2×6.02×1023mol-1×1.6×10-19C=3.85×104C
答案 (1)Zn-2e-===Zn2+ 2H++2e-===H2↑
(2)①4.48
L ②3.85×104C
12.(1)将Al片和Cu片用导线相连,插入稀H2SO4中组成原电池,写出电极名称及电极反应式:
Al片( )_________________________
_____________
_,
Cu片( )_____________________
__________________。
(2)若将Al片和Cu片用导线相连,插入浓HNO3中能否组成原电池?________(填“能”或“不能”,“若不能”,则不用回答下面的问题),若能组成原电池,写出电极名称及电极反应式:
Al片( )___________________________________________________,
Cu片( )___________________________________________________。
解析 (1)Al片和Cu片用导线相连,插入稀H2SO4中时,Al比Cu活泼,Al为负极,失电子被氧化为Al3+,Cu为正极,溶液中的H+得电子被还原为H2。(2)Al片和Cu片用导线相连,插入浓HNO3中时,由于铝钝化,不能溶解,Al为正极,Cu为负极,失电子被氧化为Cu2+。
答案 (1)负极 2Al-6e-===2Al3+
正极 6H++6e-===3H2↑
(2)能 正极 2NO+4H++2e-===2NO2↑+2H2O
负极 Cu-2e-===Cu2+
同步练习
考查点一 原电池的组成及其工作原理
1.有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;
③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
( )。
A.A>B>C>D
B.A>C>D>B
C.C>A>B>D
D.B>D>C>A
解析 金属与稀H2SO4溶液组成原电池,活泼金属为负极,失去电子发生氧化反应,较不活泼的金属为正极,H+在正极表面得到电子生成H2,电子运动方向由负极→正极,电流方向则由正极→负极。在题述原电池中,A—B原电池,A为负极;C—D原电池,C为负极;A—C原电池,A为负极;B—D原电池,D为负极。综上可知,金属活动性:A>C>D>B。
答案 B
2.如图所示装置,能组成原电池并产生电流的是
( )。
INCLUDEPICTURE
"../../../A+3.TIF"
\
MERGEFORMAT
解析 选项A中两电池的电极是相同材料,不存在电势差;选项B能满足原电池的构成条件,能产生电流;选项C中酒精是非电解质,不导电,构不成闭合回路,故也不可能产生电流;选项D中两溶液分开,也不能构成闭合回路。
答案 B
3.人类生活需要能量。下列能量主要由化学变化产生的是
( )。
A.电熨斗通电发出的热量
B.电灯通电发出的光
C.水电站利用水力产生的电能
D.液化石油气燃烧放出的热量
解析 A项中为电能转变为热能;B项中为电能转变为光能;C项中为机械能转变为电能;D项中为化学能转变为热能。
答案 D
4.下图各装置中,属于原电池的是哪几个?________。
INCLUDEPICTURE
"../../../H48.tif"
\
MERGEFORMAT
解析 归纳图示各装置是否为原电池的问题可知,构成原电池要有四个基本条件:①电解质溶液②两个电极,其中一个相对较活泼,另一个相对不活泼。两个电极直接或间接地连接在一起,并插入电解质溶液中③能自发地发生氧化还原反应④形成闭合电路。
答案 ④⑥⑦
考查点二 认识几种电池
5.镍—镉(Ni—Cd)可充电电池可以发生如下反应:
Cd(OH)2+2Ni(OH)2Cd+2NiO(OH)+2H2O
由此可知,该电池放电时的负极材料是
( )。
A.Cd
B.NiO(OH)
C.Cd(OH)2
D.Ni(OH)2
解析 此反应的逆过程为放电过程,负极为电子流出的一极,发生氧化反应,化合价升高,可知放电时负极材料为Cd。
答案 A
6.据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染,其电池反应为2Zn+O2===2ZnO,原料为锌粒、电解质溶液和空气,则下列叙述正确的是
( )。
A.锌为正极,空气进入负极反应
B.负极反应为Zn+2e--2e-===ZnO+H2O
C.正极发生氧化反应
D.电解质溶液肯定不是强酸
解析 2Zn+O2===2ZnO,Zn失电子,O2得电子,即Zn为原电池负极,O2在正极上反应,故B项正确;若电解质溶液为强酸,ZnO则不能存在,故D项也正确。
答案 BD
7.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入CH4的一极,其电极反应式是:CH4+10OH--8e-===CO+7H2O;通入O2的一极,其电极反应式是:2O2+4H2O+8e-===8OH-。下列叙述不正确的是
( )。
A.通入CH4的电极为负极
B.正极发生氧化反应
C.燃料电池工作时,溶液中的OH-向负极移动
D.该电池使用一段时间后应补充KOH
解析 在原电池中,负极上发生氧化反应,正极上发生还原反应,故B项错。
答案 B
8.有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂溶解在亚硫酰氯(SOCl2)中形成,电池总反应方程式:8Li+3SOCl2===6LiCl+Li2SO3+2S,已知将亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3。则下列叙述正确的是
( )。
A.SOCl2在制备无水AlCl3的反应中只起干燥作用
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,SOCl2被还原为Li2SO3
D.电池工作过程中,消耗的锂与析出的S的质量之比为7∶8
解析 A,由信息将亚硫酰氯和AlCl3·6H2O混合共热蒸干,可制得无水AlCl3知,SOCl2既能消耗水,生成的HCl又能抑制Al3+的水解;B,由电池反应知,金属锂作电池的负极,石墨作电池的正极;C,电池工作过程中,SOCl2被还原为S;D,电池工作过程中,消耗的锂与析出的S的质量之比为(8×7)∶(2×32)=7∶8。
答案 D
9.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是:
H2+NiO(OH)Ni(OH)2
根据此反应式判断,下列叙述正确的是
( )。
A.电池放电时,电池负极周围溶液的OH-浓度不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2是负极
解析 充电电池在放电时是一个电源(原电池),发生原电池反应,在这个反应方程式中从左到右是放电,根据发生氧化反应的是负极,发生还原反应的是正极,所以D项正确,B项错误;而H2作为电池的负极发生的反应是:H2-2e-===2H+,溶液中应该是H+浓度增大,OH-浓度减小,所以A项错误;充电反应是从右到左,所以氢元素被还原,C项正确。
答案 CD
考查点三 原电池正负极的判断及电极反应式的书写
10.关于如图所示装置的叙述,正确的是
( )。
A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
解析 从图中可以看出这是原电池,原电池的电极名称应说是正极、负极,故A项错;而原电池是活泼金属被消耗,B项错;负极(Zn)的电子经外线路流向正极(Cu),电流方向应与电子流向相反,故C项错。
答案 D
11.(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应:__________________________________;
银片上发生的电极反应:__________________________________。
(2)若该电池中两电极的总质量为60
g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47
g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA=6.02×1023
mol-1,电子电量为1.60×10-19C)
解析 (1)锌片、银片与稀硫酸构成原电池
锌片为负极,发生氧化反应:Zn-2e-===Zn2+
银片为正极,发生还原反应:2H++2e-===H2↑
(2)①锌片与银片减少的质量等于生成氢气所消耗的锌的质量,设产生的氢气体积为x。
Zn+2H+===Zn2++H2↑
65
g
22.4
L
60
g-47
g x
x=(60-47)g×22.4
L÷65
g=4.48
L
②反应消耗的锌为:13
g÷65
g·mol-1=0.20
mol
1
mol
Zn变为Zn2+时,转移2
mol
e-,则通过的电量为:
0.20
mol×2×6.02×1023mol-1×1.6×10-19C=3.85×104C
答案 (1)Zn-2e-===Zn2+ 2H++2e-===H2↑
(2)①4.48
L ②3.85×104C
12.(1)将Al片和Cu片用导线相连,插入稀H2SO4中组成原电池,写出电极名称及电极反应式:
Al片( )_________________________
_____________
_,
Cu片( )_____________________
__________________。
(2)若将Al片和Cu片用导线相连,插入浓HNO3中能否组成原电池?________(填“能”或“不能”,“若不能”,则不用回答下面的问题),若能组成原电池,写出电极名称及电极反应式:
Al片( )___________________________________________________,
Cu片( )___________________________________________________。
解析 (1)Al片和Cu片用导线相连,插入稀H2SO4中时,Al比Cu活泼,Al为负极,失电子被氧化为Al3+,Cu为正极,溶液中的H+得电子被还原为H2。(2)Al片和Cu片用导线相连,插入浓HNO3中时,由于铝钝化,不能溶解,Al为正极,Cu为负极,失电子被氧化为Cu2+。
答案 (1)负极 2Al-6e-===2Al3+
正极 6H++6e-===3H2↑
(2)能 正极 2NO+4H++2e-===2NO2↑+2H2O
负极 Cu-2e-===Cu2+
