3.2有机化合物结构的测定 学案 (2)
文档属性
| 名称 | 3.2有机化合物结构的测定 学案 (2) |
|
|
| 格式 | zip | ||
| 文件大小 | 504.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-01-07 00:00:00 | ||
图片预览


文档简介
3.2有机化合物结构的测定
学案
教学目的:
1.
掌握确定有机物元素组成和相对分子质量、实验式的方法。
2.
了解质谱仪测定有机化合物相对分子质量的方法和原理。
3.
了解不饱和度的概念,理解不饱和度在有机物结构确定中的作用。
4.
掌握常见官能团的确定方法。
5.
能通过计算和实验分析确定有机物的结构式或结构简式。
二.
重点、难点:
掌握确定有机物结构简式的步骤和方法
知识分析:
1.
测定有机化合物结构的方法是依据自身所具有的物理性质和化学性质来进行的。
2.
测定有机化合物结构的核心步骤是确定其分子式。
(一)有机化合物分子式的确定
1.
测定有机化合物的元素组成
2.
测定有机化合物的相对分子质量的方法
(1)依据气体的密度(标准状况):Mr=22.4×d
(2)依据气体的相对密度(D):Mr=DA
×MA
(3)依据理想气体状态方程:PV=nRT
Mr=mRT/(PV)
(4)气体的平均相对分子质量:=m总/n总
(5)Mr=
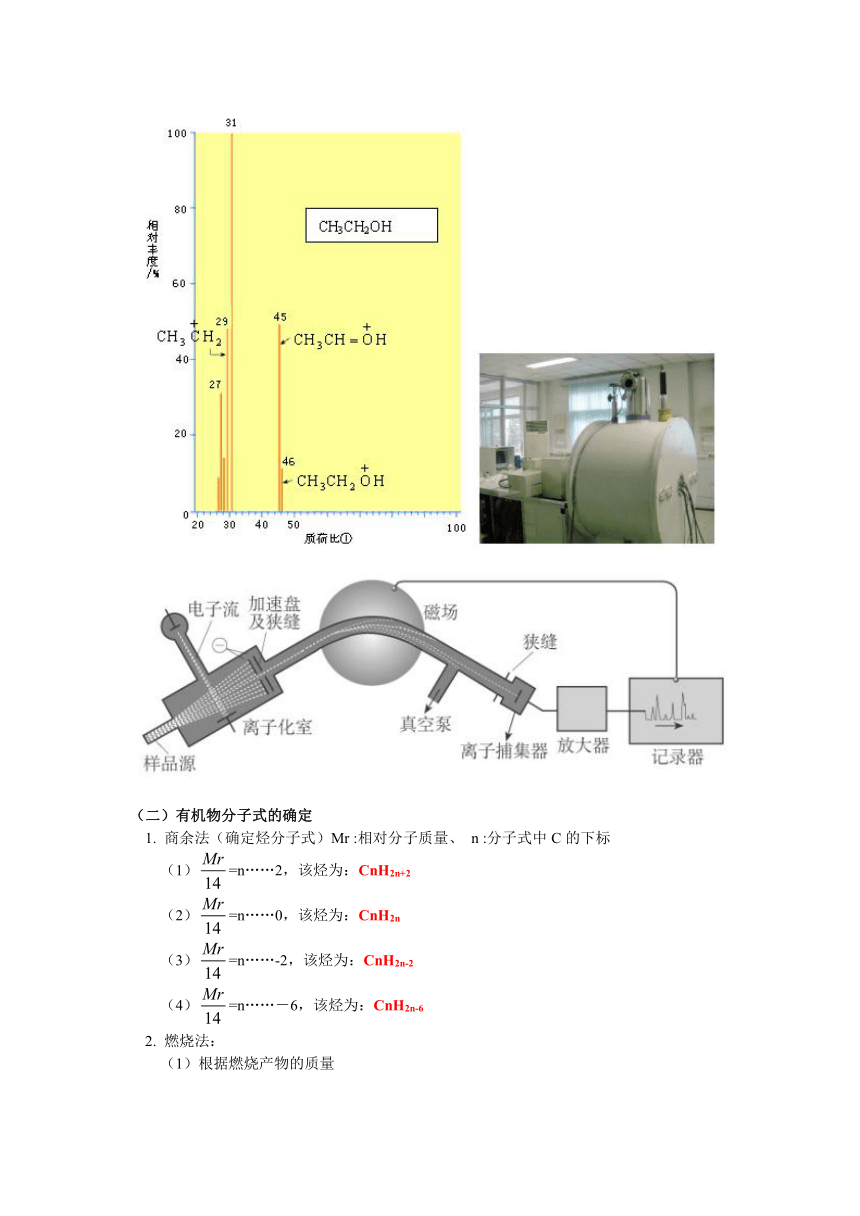
(6)质谱法
质荷比:有机物分子在高能电子流的轰击下形成的分子离子和碎片离子的相对分子质量与其所带电荷的比值。(横坐标上最大的分子离子即为该有机化合物的相对分子质量)
(二)有机物分子式的确定
1.
商余法(确定烃分子式)Mr
:相对分子质量、
n
:分子式中C的下标
(1)=n……2,该烃为:CnH2n+2
(2)=n……0,该烃为:CnH2n
(3)=n……-2,该烃为:CnH2n-2
(4)=n……-6,该烃为:CnH2n-6
2.
燃烧法:
(1)根据燃烧产物的质量
(2)根据燃烧方程式:
3.
最简式法:根据各元素的质量分数或燃烧法得到该有机物的最简式,结合其Mr进行求算
4.
求1mol有机物中C、H、O原子的物质的量,即可得分子式
思考:测定有机物的结构,关键步骤是判定有机物的不饱和度及其典型化学性质,进而确定有机物所含的官能团及其所处的位置。
(三)不饱和度的计算
(1)概念:烷烃分子的通式为CnH2n+2,分子中每减少2个碳氢键,同时必然会增加一个碳碳键,该碳碳键可能是重键(双键或叁键),也可能连接成环状,这些都称为增加了一个不饱和度,又叫缺氢指数,用字母表示。
化学键
不饱和度
化学键
不饱和度
一个碳碳双键
1
一个碳碳叁键
2
一个羰基
1
一个苯环
4
一个碳环
1
一个氰基
2
(2)计算公式:
I.
烃()
=n(C)+1-n(H)/2
II.
烃的衍生物()
=n(C)+1-n(H)/2
练习:
①
=
0
②
=
0
③
=
1
④
=
3
⑤
=
1
⑥
=
2
⑦
=
2
⑧
EMBED
Unknown=
1
⑨
=
2
⑩=
5
(3)利用不饱和度确定有机分子的官能团
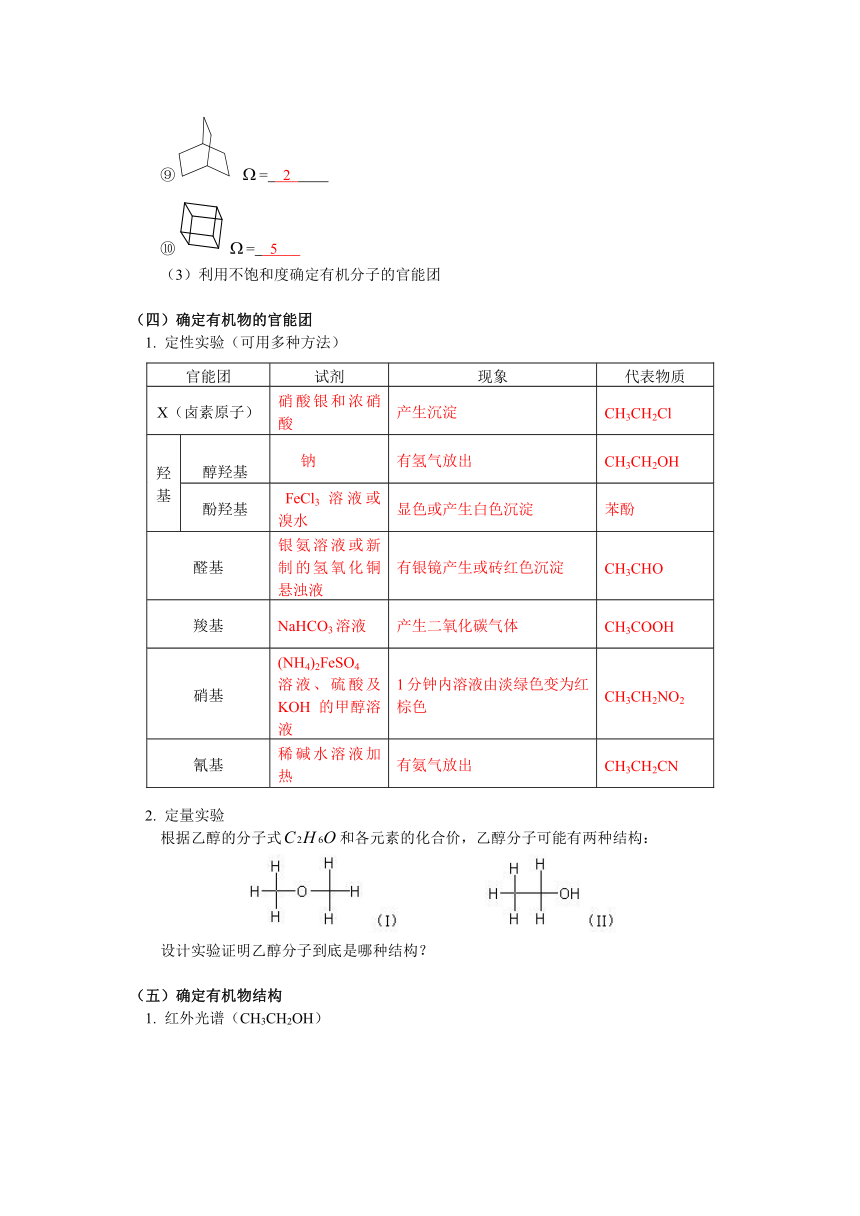
(四)确定有机物的官能团
1.
定性实验(可用多种方法)
官能团
试剂
现象
代表物质
X(卤素原子)
硝酸银和浓硝酸
产生沉淀
CH3CH2Cl
羟基
醇羟基
钠
有氢气放出
CH3CH2OH
酚羟基
FeCl3溶液或溴水
显色或产生白色沉淀
苯酚
醛基
银氨溶液或新制的氢氧化铜悬浊液
有银镜产生或砖红色沉淀
CH3CHO
羧基
NaHCO3溶液
产生二氧化碳气体
CH3COOH
硝基
(NH4)2FeSO4
溶液、硫酸及KOH的甲醇溶液
1分钟内溶液由淡绿色变为红棕色
CH3CH2NO2
氰基
稀碱水溶液加热
有氨气放出
CH3CH2CN
2.
定量实验
根据乙醇的分子式和各元素的化合价,乙醇分子可能有两种结构:
设计实验证明乙醇分子到底是哪种结构?
(五)确定有机物结构
1.
红外光谱(CH3CH2OH)
2.
核磁共振氢谱
下图是分子式为(C2H6O)的两种同分异构体中的两类1H的核磁共振氢谱
(左)CH3CH2OH
(右)CH3OCH3
练习:课本P126医用胶单体的结构确定。
【典型例题】
例1.
新兴的大脑营养学研究发现,大脑的生长发育与不饱和脂肪酸有密切的关系,从深海鱼油中提取的被称为“脑黄金”的DHA就是一种不饱和程度很高的脂肪酸,它的分子中含6个碳碳双键,学名二十六碳六烯酸,它的分子组成应是(
)
A.
C25H50COOH
B.
C25H40COOH
C.
C26H41COOH
D.
C26H47COOH
答案:B
解析:二十六碳六烯酸比二十六碳酸分子结构中多出六个碳碳双键,即多出6个不饱和度,应该减少12个氢原子,二十六碳酸符合通式CnH2nO2,是C26H52COOH,故二十六碳六烯酸为C25H40COOH。
点评:本题考查的是有机物名称和不饱和度的概念。
例2.
已知某有机物A的蒸汽是同状况下H2的23倍,2.3g
A完全燃烧生成CO20.1mol,H2O
2.7g。求A的分子式。
解法1:Mr(A)=23×2=46,2.3g
A的物质的量为0.05mol。
含n(C)=n(CO2)=0.1mol,n(H)=2n(H2O)=0.3mol。
即1molA中含C
2mol、H
6mol。
设A的分子式为C2H6Oz,12×2+1×6+16z=46,z=1。
A的分子式为C2H6O。
解法2:2.3g
A含n(C)=n(CO2)=0.1mol,m(C)=1.2g。
n(H)=2n(H2O)=0.3mol。
m(H)=0.3g,而2.3g
>
1.2g+0.3g;
故2.3g
A中m(O)=2.3g-1.2g-0.3g=0.8g,
n(O)=0.05mol
A的最简式为C2H6O,又Mr(A)=23×2=46
A的分子式为C2H6O。
解法3:设A的分子式为CxHyOz,Mr(A)=23×2=46
A的摩尔质量为46
g/mol。
46g
xmol
2.3g
0.1mol
2.7g
解得:x=2
y=6
12×2+1×6+16z=46,z=1。A的分子式为C2H6O。
点评:原子守恒是理解、分析、解决此类问题的出发点。
例3.
标准状况下某气态烃150mL的质量为0.5223g,经测定该烃含C
92.3%,H
7.7%,求其分子式。
解析:==,M=×22.4=78,该烃的相对分子质量为78。
N(C):N(H)=:=1:1
该烃的实验式为CH,设分子式为(CH)n,
13n=78,n=6,所以该烃的分子式为C6H6。
点评:实验式与分子式的关系是后者是前者的整数倍,由相对分子质量与实验式的式量关系得出分子式与实验式的关系。
例4.
由一种气态烷烃与一种气态烯烃组成的混合气,对氦气的相对密度是6,将1体积此混合气与4体积氧气混合,装入密闭容器中,用电火花点燃,使之充分燃烧。若反应前后均保持120℃,测得容器内压强比反应前增加了4%。求混合气体中烷烃与烯烃的分子式及各自的体积分数。
解析:(混)=6×4=24,Mr<24的烃只有CH4,设烯烃的分子式为CnH2n,体积为x。
CnH2n+1.5nO2n
CO2+nH2O(g)
V
1
1.5n
n
n
0.5n-1
x
5×4%
(0.5n-1)x=
5×4%
14nx+16(1-x)=24
n=
4
x=0.2
(CH4)=80%
(C4H8)=20%
点评:本题的难点在于燃烧后“压强增加4%”,利用阿伏加德罗定律的推论,可以将此条件转化成气体的体积(物质的量)增加4%。
【模拟试题】
一.
选择题
1.
燃烧0.2mol某有机物,得到0.4mol
CO2和0.6molH2O,由此可得出的结论是(
)
A.
该有机物含有2个C和6个H
B.
该有机物C、H原子个数比3:1
C.
该有机物含有2个CO2和3个H2O
D.
该有机物一个分子含有2个C和6个H,可能含有O
2.
已知甲醛、乙酸和丙酸的混合物中,含氧的质量分数为48%,则含碳的质量分数为(
)
A.
55.43%
B.
44.57%
C.
40%
D.
49%
3.
某烃分子中40个电子,它燃烧时生成等体积的CO2和H2O(g),该有机物的分子式(
)
A.
C4H8
B.
C4H10O
C.
C5H10
D.
C4H10
4.
某烯烃Mr=82,其中C、H原子个数比为3:5,则该烯烃分子中双键的数目是(
)
A.
5
B.
4
C.
3
D.
2
5.
取一定量的某有机物在空气中完全燃烧,生成CO2和H2O的物质的量比为2:3,则该有机物的分子式不可能是(
)
A.
CH4
B.
C2H6
C.
C2H6O
D.
C2H6O2
7.
某烃分子的不饱和度为4,分子内C原子数为8,该烃的分子式为
(
)
A.
C8H10
B.
C6H16
C.
C8H8
D.
C8H20
8.
某物质中可能含有甲酸、乙酸、甲醇和甲酸乙酯4种物质中的一种或几种,鉴定时有下列现象①可发生银镜反应②加入新制Cu(OH)2悬浊液不溶解③与含酚酞的NaOH溶液共热发现溶液中红色变浅逐渐变为无色。下列叙述正确的是(
)
A.
Y有甲酸和甲酸乙酯
B.
有乙酸和甲酸乙酯
C.
可能有甲醇,一定有甲酸乙酯
D.
几种物质都有
9.
天然维生素P存在于槐树花蕾中,它是一种营养增补剂,其结构如图所示,下列说法中不正确的是(
)
A.
天然维生素P的分子式为C27H30O16
B.
天然维生素P一定能发生水解反应
C.
天然维生素P一定能发生加成反应
D.
天然维生素P一定能发生取代反应
10.
有一种有机物的结构简式如下:
下列有关它的性质的叙述,正确的是(
)
①它有弱酸性,能与氢氧化钠反应
②它不能发生水解反应
③它能发生水解反应,水解后生成两种物质
④它能发生水解反应,水解后只生成一种物质
A.
只有①
B.
只有①②
C.
只有①③
D.
只有①④
二.
填空题
11.
分子式为CxHyO2的有机物1mol,完全燃烧产生的CO2和H2O(g)的体积相等,燃烧所消耗的氧气为44.8L(标准状况),y=_____________。
12.
某烃的相对分子质量为128,则该烃的分子式为
或
;
某一元烯醇的相对分子质量也为128,其分子式可能是
。
13.
取3.40g只含羟基,不含其他官能团的液态饱和多元醇,置于5.00L氧气中。点燃,醇完全燃烧。反应后气体体积减少0.56L,将气体通过CaO进行吸收,体积又减少了2.80L(所有气体体积均已换算成标准状况下的体积)。
(1)3.40g醇中C、H、O的物质的量分别为n(C)=_________,n(H)=__________,n(O)=___________;分子中C、H、O的原子个数比为_____________。
(2)根据以上比值能否确定该醇的分子式?
。
原因:_______________________________。
(3)若将该醇的任意一个羟基换成氯原子,只得到一种氯代物,试写出该饱和多元醇的结构简式:
。
三.
计算题
14.
某有机物由C、H、O三种元素组成,分子中有8个原子。1mol该有机物含有46mol质子。完全燃烧该有机物生成的CO2和H2O(g)的体积比为2:1(相同状况下测定)。取2.7g该有机物恰好与1mol/L的碳酸钠溶液30mL完全反应。求:
(1)有机物的分子式
(2)写出其结构简式
参考答案
http://21世纪教育网
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )
一.
1.
D
2.
B
3.
C
4.
D
5.
A
6.
A
7.
A
8.
C
9.
B
10.
D
二.
11.
4
12.
C9H20;C10H8;C8H16O
13.
(1)0.125mol;0.3mol;0.1mol;5:12:4
(2)能;上述碳、氢比值中氢原子已经使碳原子达到饱和,故实验式就是化学式。
(3)(CH2OH)4C
三.
14(1)C2H2O4
(2)
给生命加压
一艘货轮在空船返航途中,在浩淼的大海上,突然遭遇特大风暴。
货轮在暴风雨中不停地摇晃着、颠簸着,水手们惊惶失措,只有老船长镇静地指挥着:“打开所有货舱,立刻往里面灌水。”
水手们更加不安和不解:“往船里灌水不是自找死路吗?”
船长镇定地说:“大家见过根深干粗的树被暴风刮倒过吗?被刮倒的是没有根基的小树。”
水手们半信半疑地照着做了。虽然暴风巨浪依旧那么激烈,但随着货舱里的水位越来越高,货轮渐渐平稳了。
船长告诉那些松了一口气的水手:“一只空木桶,是很容易被风打翻的,如果装满水负重了,风是吹不倒的。船在负重的时候,是最安全的;空船时,才是最危险的时候。”
学案
教学目的:
1.
掌握确定有机物元素组成和相对分子质量、实验式的方法。
2.
了解质谱仪测定有机化合物相对分子质量的方法和原理。
3.
了解不饱和度的概念,理解不饱和度在有机物结构确定中的作用。
4.
掌握常见官能团的确定方法。
5.
能通过计算和实验分析确定有机物的结构式或结构简式。
二.
重点、难点:
掌握确定有机物结构简式的步骤和方法
知识分析:
1.
测定有机化合物结构的方法是依据自身所具有的物理性质和化学性质来进行的。
2.
测定有机化合物结构的核心步骤是确定其分子式。
(一)有机化合物分子式的确定
1.
测定有机化合物的元素组成
2.
测定有机化合物的相对分子质量的方法
(1)依据气体的密度(标准状况):Mr=22.4×d
(2)依据气体的相对密度(D):Mr=DA
×MA
(3)依据理想气体状态方程:PV=nRT
Mr=mRT/(PV)
(4)气体的平均相对分子质量:=m总/n总
(5)Mr=
(6)质谱法
质荷比:有机物分子在高能电子流的轰击下形成的分子离子和碎片离子的相对分子质量与其所带电荷的比值。(横坐标上最大的分子离子即为该有机化合物的相对分子质量)
(二)有机物分子式的确定
1.
商余法(确定烃分子式)Mr
:相对分子质量、
n
:分子式中C的下标
(1)=n……2,该烃为:CnH2n+2
(2)=n……0,该烃为:CnH2n
(3)=n……-2,该烃为:CnH2n-2
(4)=n……-6,该烃为:CnH2n-6
2.
燃烧法:
(1)根据燃烧产物的质量
(2)根据燃烧方程式:
3.
最简式法:根据各元素的质量分数或燃烧法得到该有机物的最简式,结合其Mr进行求算
4.
求1mol有机物中C、H、O原子的物质的量,即可得分子式
思考:测定有机物的结构,关键步骤是判定有机物的不饱和度及其典型化学性质,进而确定有机物所含的官能团及其所处的位置。
(三)不饱和度的计算
(1)概念:烷烃分子的通式为CnH2n+2,分子中每减少2个碳氢键,同时必然会增加一个碳碳键,该碳碳键可能是重键(双键或叁键),也可能连接成环状,这些都称为增加了一个不饱和度,又叫缺氢指数,用字母表示。
化学键
不饱和度
化学键
不饱和度
一个碳碳双键
1
一个碳碳叁键
2
一个羰基
1
一个苯环
4
一个碳环
1
一个氰基
2
(2)计算公式:
I.
烃()
=n(C)+1-n(H)/2
II.
烃的衍生物()
=n(C)+1-n(H)/2
练习:
①
=
0
②
=
0
③
=
1
④
=
3
⑤
=
1
⑥
=
2
⑦
=
2
⑧
EMBED
Unknown=
1
⑨
=
2
⑩=
5
(3)利用不饱和度确定有机分子的官能团
(四)确定有机物的官能团
1.
定性实验(可用多种方法)
官能团
试剂
现象
代表物质
X(卤素原子)
硝酸银和浓硝酸
产生沉淀
CH3CH2Cl
羟基
醇羟基
钠
有氢气放出
CH3CH2OH
酚羟基
FeCl3溶液或溴水
显色或产生白色沉淀
苯酚
醛基
银氨溶液或新制的氢氧化铜悬浊液
有银镜产生或砖红色沉淀
CH3CHO
羧基
NaHCO3溶液
产生二氧化碳气体
CH3COOH
硝基
(NH4)2FeSO4
溶液、硫酸及KOH的甲醇溶液
1分钟内溶液由淡绿色变为红棕色
CH3CH2NO2
氰基
稀碱水溶液加热
有氨气放出
CH3CH2CN
2.
定量实验
根据乙醇的分子式和各元素的化合价,乙醇分子可能有两种结构:
设计实验证明乙醇分子到底是哪种结构?
(五)确定有机物结构
1.
红外光谱(CH3CH2OH)
2.
核磁共振氢谱
下图是分子式为(C2H6O)的两种同分异构体中的两类1H的核磁共振氢谱
(左)CH3CH2OH
(右)CH3OCH3
练习:课本P126医用胶单体的结构确定。
【典型例题】
例1.
新兴的大脑营养学研究发现,大脑的生长发育与不饱和脂肪酸有密切的关系,从深海鱼油中提取的被称为“脑黄金”的DHA就是一种不饱和程度很高的脂肪酸,它的分子中含6个碳碳双键,学名二十六碳六烯酸,它的分子组成应是(
)
A.
C25H50COOH
B.
C25H40COOH
C.
C26H41COOH
D.
C26H47COOH
答案:B
解析:二十六碳六烯酸比二十六碳酸分子结构中多出六个碳碳双键,即多出6个不饱和度,应该减少12个氢原子,二十六碳酸符合通式CnH2nO2,是C26H52COOH,故二十六碳六烯酸为C25H40COOH。
点评:本题考查的是有机物名称和不饱和度的概念。
例2.
已知某有机物A的蒸汽是同状况下H2的23倍,2.3g
A完全燃烧生成CO20.1mol,H2O
2.7g。求A的分子式。
解法1:Mr(A)=23×2=46,2.3g
A的物质的量为0.05mol。
含n(C)=n(CO2)=0.1mol,n(H)=2n(H2O)=0.3mol。
即1molA中含C
2mol、H
6mol。
设A的分子式为C2H6Oz,12×2+1×6+16z=46,z=1。
A的分子式为C2H6O。
解法2:2.3g
A含n(C)=n(CO2)=0.1mol,m(C)=1.2g。
n(H)=2n(H2O)=0.3mol。
m(H)=0.3g,而2.3g
>
1.2g+0.3g;
故2.3g
A中m(O)=2.3g-1.2g-0.3g=0.8g,
n(O)=0.05mol
A的最简式为C2H6O,又Mr(A)=23×2=46
A的分子式为C2H6O。
解法3:设A的分子式为CxHyOz,Mr(A)=23×2=46
A的摩尔质量为46
g/mol。
46g
xmol
2.3g
0.1mol
2.7g
解得:x=2
y=6
12×2+1×6+16z=46,z=1。A的分子式为C2H6O。
点评:原子守恒是理解、分析、解决此类问题的出发点。
例3.
标准状况下某气态烃150mL的质量为0.5223g,经测定该烃含C
92.3%,H
7.7%,求其分子式。
解析:==,M=×22.4=78,该烃的相对分子质量为78。
N(C):N(H)=:=1:1
该烃的实验式为CH,设分子式为(CH)n,
13n=78,n=6,所以该烃的分子式为C6H6。
点评:实验式与分子式的关系是后者是前者的整数倍,由相对分子质量与实验式的式量关系得出分子式与实验式的关系。
例4.
由一种气态烷烃与一种气态烯烃组成的混合气,对氦气的相对密度是6,将1体积此混合气与4体积氧气混合,装入密闭容器中,用电火花点燃,使之充分燃烧。若反应前后均保持120℃,测得容器内压强比反应前增加了4%。求混合气体中烷烃与烯烃的分子式及各自的体积分数。
解析:(混)=6×4=24,Mr<24的烃只有CH4,设烯烃的分子式为CnH2n,体积为x。
CnH2n+1.5nO2n
CO2+nH2O(g)
V
1
1.5n
n
n
0.5n-1
x
5×4%
(0.5n-1)x=
5×4%
14nx+16(1-x)=24
n=
4
x=0.2
(CH4)=80%
(C4H8)=20%
点评:本题的难点在于燃烧后“压强增加4%”,利用阿伏加德罗定律的推论,可以将此条件转化成气体的体积(物质的量)增加4%。
【模拟试题】
一.
选择题
1.
燃烧0.2mol某有机物,得到0.4mol
CO2和0.6molH2O,由此可得出的结论是(
)
A.
该有机物含有2个C和6个H
B.
该有机物C、H原子个数比3:1
C.
该有机物含有2个CO2和3个H2O
D.
该有机物一个分子含有2个C和6个H,可能含有O
2.
已知甲醛、乙酸和丙酸的混合物中,含氧的质量分数为48%,则含碳的质量分数为(
)
A.
55.43%
B.
44.57%
C.
40%
D.
49%
3.
某烃分子中40个电子,它燃烧时生成等体积的CO2和H2O(g),该有机物的分子式(
)
A.
C4H8
B.
C4H10O
C.
C5H10
D.
C4H10
4.
某烯烃Mr=82,其中C、H原子个数比为3:5,则该烯烃分子中双键的数目是(
)
A.
5
B.
4
C.
3
D.
2
5.
取一定量的某有机物在空气中完全燃烧,生成CO2和H2O的物质的量比为2:3,则该有机物的分子式不可能是(
)
A.
CH4
B.
C2H6
C.
C2H6O
D.
C2H6O2
7.
某烃分子的不饱和度为4,分子内C原子数为8,该烃的分子式为
(
)
A.
C8H10
B.
C6H16
C.
C8H8
D.
C8H20
8.
某物质中可能含有甲酸、乙酸、甲醇和甲酸乙酯4种物质中的一种或几种,鉴定时有下列现象①可发生银镜反应②加入新制Cu(OH)2悬浊液不溶解③与含酚酞的NaOH溶液共热发现溶液中红色变浅逐渐变为无色。下列叙述正确的是(
)
A.
Y有甲酸和甲酸乙酯
B.
有乙酸和甲酸乙酯
C.
可能有甲醇,一定有甲酸乙酯
D.
几种物质都有
9.
天然维生素P存在于槐树花蕾中,它是一种营养增补剂,其结构如图所示,下列说法中不正确的是(
)
A.
天然维生素P的分子式为C27H30O16
B.
天然维生素P一定能发生水解反应
C.
天然维生素P一定能发生加成反应
D.
天然维生素P一定能发生取代反应
10.
有一种有机物的结构简式如下:
下列有关它的性质的叙述,正确的是(
)
①它有弱酸性,能与氢氧化钠反应
②它不能发生水解反应
③它能发生水解反应,水解后生成两种物质
④它能发生水解反应,水解后只生成一种物质
A.
只有①
B.
只有①②
C.
只有①③
D.
只有①④
二.
填空题
11.
分子式为CxHyO2的有机物1mol,完全燃烧产生的CO2和H2O(g)的体积相等,燃烧所消耗的氧气为44.8L(标准状况),y=_____________。
12.
某烃的相对分子质量为128,则该烃的分子式为
或
;
某一元烯醇的相对分子质量也为128,其分子式可能是
。
13.
取3.40g只含羟基,不含其他官能团的液态饱和多元醇,置于5.00L氧气中。点燃,醇完全燃烧。反应后气体体积减少0.56L,将气体通过CaO进行吸收,体积又减少了2.80L(所有气体体积均已换算成标准状况下的体积)。
(1)3.40g醇中C、H、O的物质的量分别为n(C)=_________,n(H)=__________,n(O)=___________;分子中C、H、O的原子个数比为_____________。
(2)根据以上比值能否确定该醇的分子式?
。
原因:_______________________________。
(3)若将该醇的任意一个羟基换成氯原子,只得到一种氯代物,试写出该饱和多元醇的结构简式:
。
三.
计算题
14.
某有机物由C、H、O三种元素组成,分子中有8个原子。1mol该有机物含有46mol质子。完全燃烧该有机物生成的CO2和H2O(g)的体积比为2:1(相同状况下测定)。取2.7g该有机物恰好与1mol/L的碳酸钠溶液30mL完全反应。求:
(1)有机物的分子式
(2)写出其结构简式
参考答案
http://21世纪教育网
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )
一.
1.
D
2.
B
3.
C
4.
D
5.
A
6.
A
7.
A
8.
C
9.
B
10.
D
二.
11.
4
12.
C9H20;C10H8;C8H16O
13.
(1)0.125mol;0.3mol;0.1mol;5:12:4
(2)能;上述碳、氢比值中氢原子已经使碳原子达到饱和,故实验式就是化学式。
(3)(CH2OH)4C
三.
14(1)C2H2O4
(2)
给生命加压
一艘货轮在空船返航途中,在浩淼的大海上,突然遭遇特大风暴。
货轮在暴风雨中不停地摇晃着、颠簸着,水手们惊惶失措,只有老船长镇静地指挥着:“打开所有货舱,立刻往里面灌水。”
水手们更加不安和不解:“往船里灌水不是自找死路吗?”
船长镇定地说:“大家见过根深干粗的树被暴风刮倒过吗?被刮倒的是没有根基的小树。”
水手们半信半疑地照着做了。虽然暴风巨浪依旧那么激烈,但随着货舱里的水位越来越高,货轮渐渐平稳了。
船长告诉那些松了一口气的水手:“一只空木桶,是很容易被风打翻的,如果装满水负重了,风是吹不倒的。船在负重的时候,是最安全的;空船时,才是最危险的时候。”
