人教版化学必修一4.1 无机非金属材料的主角--硅 公开课课件
文档属性
| 名称 | 人教版化学必修一4.1 无机非金属材料的主角--硅 公开课课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-01-07 00:00:00 | ||
图片预览










文档简介
课件30张PPT。 第四章
非金属及其化合物美丽的玻璃雕花艺术水
晶玛瑙瓷器(china)是中国最伟大的创造之一秦砖汉瓦秦始皇陵兵马俑硅太阳能电池硅芯片是各种计算机、微电子产品的核心第一节 无机非金属材料的主角
——硅
第一课时
存在状态:没有游离态,只有化合态,以硅酸、硅酸盐为
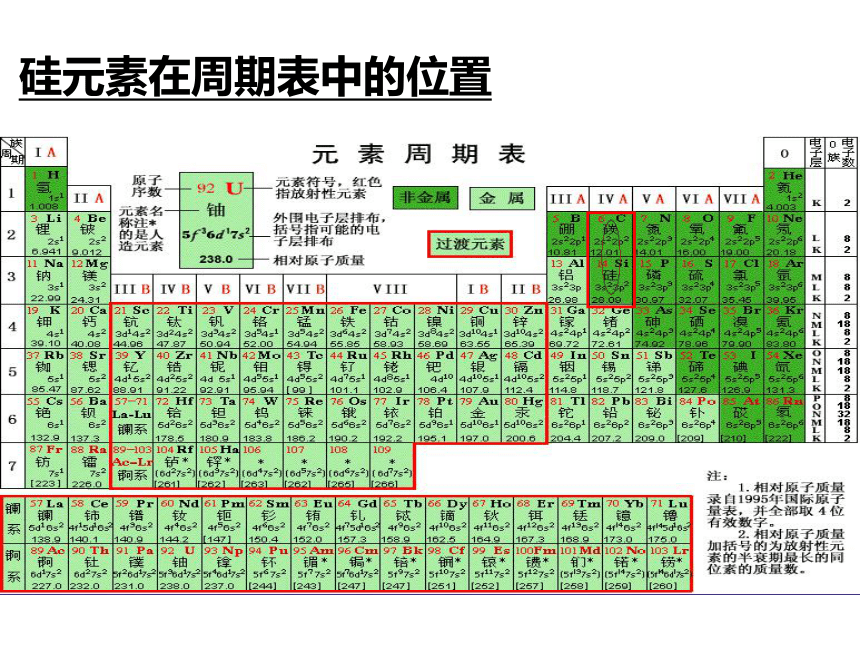
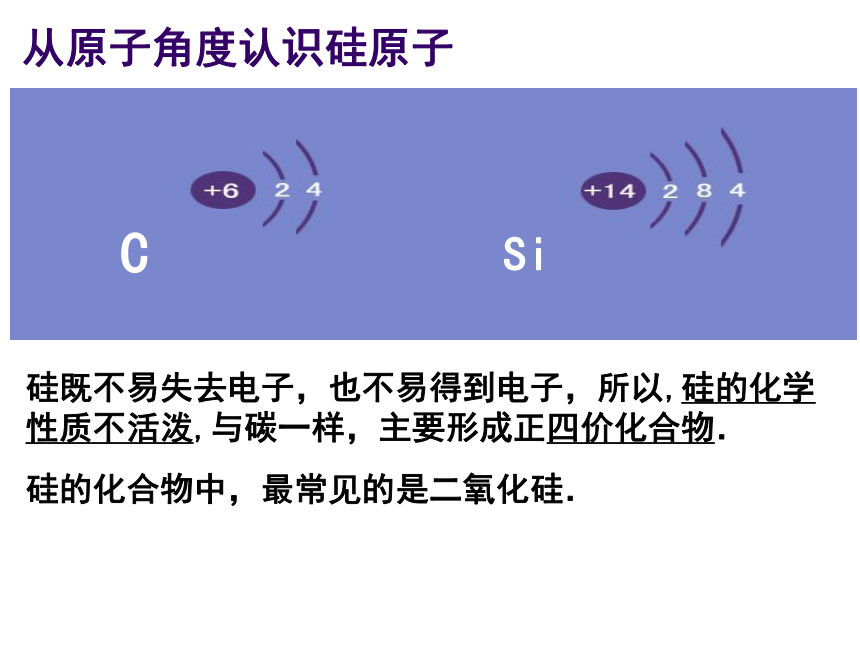
主一、硅元素存在硅元素分布:自然界中分布广泛,在地壳中居第二位,仅次于氧。是构成矿物和岩石的基本元素。硅是亲氧元素,其的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。要了解这些硅的化合物,必须知道硅的原子位置和结构硅元素在周期表中的位置从原子角度认识硅原子CSi硅既不易失去电子,也不易得到电子,所以,硅的化学性质不活泼,与碳一样,主要形成正四价化合物.硅的化合物中,最常见的是二氧化硅.1.SiO2的存在:二、二氧化硅结晶形:无定形:水晶、玛瑙石英硅藻土2、SiO2的物理性质坚硬固体,熔沸点高,不溶于水思考:CO2的物理性质怎样?气 态固态很小很大可溶于水难溶于水很 低很 高物理性质:(SiO2与CO2作比较)为什么SiO2和CO2的物理性质差异很大?思考与交流从结构去分析SiOSiO2具有空间网状结构,因此性质很稳定,它能发生什么反应呢?与CO2比较怎样? 3、结构 正四面体的空间网状结构,Si和O个数比1∶2,SiO2不是分子式。CO2+H2O=H2CO3CO2+2NaOH=Na2CO3+H2OCO2+CaO=CaCO3不反应 4、SiO2化学性质(与CO2比较)SiO2+2NaOH=Na2SiO3+H2O与唯一的酸—氢氟酸反应SiO2+4HF=SiF4↑+2H2O不反应可以刻蚀玻璃 已知玻璃中含有SiO2 1、实验室盛放NaOH溶液的试剂瓶为什么不用玻璃塞?改用什么塞子呢? 原因: 防止玻璃中的SiO2与NaOH溶液反应生成粘稠的Na2SiO3 ,使瓶塞和瓶口粘在一起 ,可改用胶塞。( SiO2+2NaOH=Na2SiO3+H2O ) 2、实验室中氢氟酸应如何保存?原因:玻璃中含有SiO2会与HF反应生成SiF4,不能用玻璃试剂瓶用塑料瓶盛装氢氟酸。思考与交流光学纤维胃镜5、二氧化硅的用途 ①石 英 制 品5、二氧化硅的用途②水晶石英、玛瑙③二氧化硅用来制光导纤维 光导纤维就是比头发丝还细的、能传导光信号的玻璃丝。光导纤维主要用于通讯、传感、测量等,光纤通讯的优点就是通信容量大,一对光纤上可同时传送3万门电话。 二氧化碳二氧化硅空 气 硅石、石英、水晶、玛瑙、沙子、硅藻土熔、沸点低, 微溶于水熔点高,硬度大,不溶于水CO2+H2O=H2CO3不反应CO2+2NaOH=Na2CO3+H2OSiO2+2NaOH=Na2SiO3+H2OCO2+CaO=CaCO3不反应课堂小结:SiO2与CO2比较 与NaOH反应与碱性氧化物反应思考: SiO2不能与水直接化合成H2SiO3。那怎样制备H2SiO3呢? 硅酸是一种怎样的物质呢?二、硅酸(H2SiO3)实验1:向饱和Na2SiO3溶液中,滴入酚酞,再滴入稀盐酸.滴入酚酞溶液呈红色,Na2SiO3呈碱性,硅酸难溶于水Na2SiO3+2HCl = H2SiO3(胶体)+2NaCl 1、制备:可溶性硅酸盐+稀盐酸 请观看视频 滴入盐酸有透明的硅酸凝胶产生 二、硅酸(H2SiO3) 1、制备:可溶性硅酸盐+稀盐酸Na2SiO3+2HCl=2NaCl+H2SiO3↓Na2SiO3 + H2O + CO2 ==Na2CO3 + H2SiO3↓ 酸性:H2CO3>H2SiO32、物理性质:白色,胶状,不溶于水。3、化学性质:②不稳定性
①弱酸性: H2SiO3+2NaOH=2H2O +Na2SiO34、用途:制硅胶--干燥剂和催化剂的载体(不能使石蕊变红)二、硅酸(H2SiO3)2、物理性质3、化学性质4、用途1、制备一、硅元素存在二、二氧化硅1、存在形式2、物理性质3、结构4、化学性质5、用途【课堂练习】
1 、要除去SiO2中混有的少量CaO杂质,最适宜的试剂是 ( )
A. 纯碱溶液 B. 盐酸 C. 硫酸 D. 苛性钠溶液
2、下列物质中,不能用玻璃瓶来盛装的是 ( )
A. 烧碱溶液 B. 浓硫酸
C. 氢氟酸 D. 碳酸钠溶液
3、下列各组物质有关性质关系的比较,正确的是( )
A. 稳定性:CO2> SiO2 B. 酸性: H2SiO3> H2CO3 C. 熔点:SiO2> CO2 (干冰) D. 硬度:SiO24、NaOH、KOH等碱性溶液可以贮存在下列哪种试剂瓶中 ( )
A.具有玻璃塞的细口瓶
B.具有玻璃塞的广口瓶
C.带滴管的滴瓶
D.具有橡胶塞的细口瓶
5、将过量的CO2分别通入①CaCl2溶液,②Na2SiO3溶液,③Ca(OH)2溶液,④ 饱和Na2CO3溶液。最终溶液中有白色沉淀析出的是 ( )
A. ①②③④ B. ②④ C. ①②③ D. ②③DB硅酸的酸性比盐酸弱,那么硅酸酸性与碳酸相比较如何呢?请你设计一个实验论证你的推断。将CO2通入Na2SiO3溶液中 方程式:
Na2SiO3+H2O+CO2==H2SiO3 (胶体) +Na2CO3你的结论:硅酸是一种很弱的酸,
酸性比碳酸还弱应用实践实验方案:作 业:课本P80~81, 3、5做在作业本上。看谁做得最好(课后小测)写出下列的化学方程式:
1、二氧化硅和氢氟酸反应
2、二氧化硅和氧化钙反应
3、二氧化硅和氢氧化钠溶液
4、实验室制取硅酸
5、二氧化碳通入氢氧化钠溶液SiO2+4HF==SiF4↑+2H2OSiO2+CaO=高温=CaSiO3
SiO2+2NaOH==Na2SiO3+H2O
Na2SiO3+2HCl=H2SiO3+2NaClCO2+2NaOH=Na2CO3+H2O
非金属及其化合物美丽的玻璃雕花艺术水
晶玛瑙瓷器(china)是中国最伟大的创造之一秦砖汉瓦秦始皇陵兵马俑硅太阳能电池硅芯片是各种计算机、微电子产品的核心第一节 无机非金属材料的主角
——硅
第一课时
存在状态:没有游离态,只有化合态,以硅酸、硅酸盐为
主一、硅元素存在硅元素分布:自然界中分布广泛,在地壳中居第二位,仅次于氧。是构成矿物和岩石的基本元素。硅是亲氧元素,其的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。要了解这些硅的化合物,必须知道硅的原子位置和结构硅元素在周期表中的位置从原子角度认识硅原子CSi硅既不易失去电子,也不易得到电子,所以,硅的化学性质不活泼,与碳一样,主要形成正四价化合物.硅的化合物中,最常见的是二氧化硅.1.SiO2的存在:二、二氧化硅结晶形:无定形:水晶、玛瑙石英硅藻土2、SiO2的物理性质坚硬固体,熔沸点高,不溶于水思考:CO2的物理性质怎样?气 态固态很小很大可溶于水难溶于水很 低很 高物理性质:(SiO2与CO2作比较)为什么SiO2和CO2的物理性质差异很大?思考与交流从结构去分析SiOSiO2具有空间网状结构,因此性质很稳定,它能发生什么反应呢?与CO2比较怎样? 3、结构 正四面体的空间网状结构,Si和O个数比1∶2,SiO2不是分子式。CO2+H2O=H2CO3CO2+2NaOH=Na2CO3+H2OCO2+CaO=CaCO3不反应 4、SiO2化学性质(与CO2比较)SiO2+2NaOH=Na2SiO3+H2O与唯一的酸—氢氟酸反应SiO2+4HF=SiF4↑+2H2O不反应可以刻蚀玻璃 已知玻璃中含有SiO2 1、实验室盛放NaOH溶液的试剂瓶为什么不用玻璃塞?改用什么塞子呢? 原因: 防止玻璃中的SiO2与NaOH溶液反应生成粘稠的Na2SiO3 ,使瓶塞和瓶口粘在一起 ,可改用胶塞。( SiO2+2NaOH=Na2SiO3+H2O ) 2、实验室中氢氟酸应如何保存?原因:玻璃中含有SiO2会与HF反应生成SiF4,不能用玻璃试剂瓶用塑料瓶盛装氢氟酸。思考与交流光学纤维胃镜5、二氧化硅的用途 ①石 英 制 品5、二氧化硅的用途②水晶石英、玛瑙③二氧化硅用来制光导纤维 光导纤维就是比头发丝还细的、能传导光信号的玻璃丝。光导纤维主要用于通讯、传感、测量等,光纤通讯的优点就是通信容量大,一对光纤上可同时传送3万门电话。 二氧化碳二氧化硅空 气 硅石、石英、水晶、玛瑙、沙子、硅藻土熔、沸点低, 微溶于水熔点高,硬度大,不溶于水CO2+H2O=H2CO3不反应CO2+2NaOH=Na2CO3+H2OSiO2+2NaOH=Na2SiO3+H2OCO2+CaO=CaCO3不反应课堂小结:SiO2与CO2比较 与NaOH反应与碱性氧化物反应思考: SiO2不能与水直接化合成H2SiO3。那怎样制备H2SiO3呢? 硅酸是一种怎样的物质呢?二、硅酸(H2SiO3)实验1:向饱和Na2SiO3溶液中,滴入酚酞,再滴入稀盐酸.滴入酚酞溶液呈红色,Na2SiO3呈碱性,硅酸难溶于水Na2SiO3+2HCl = H2SiO3(胶体)+2NaCl 1、制备:可溶性硅酸盐+稀盐酸 请观看视频 滴入盐酸有透明的硅酸凝胶产生 二、硅酸(H2SiO3) 1、制备:可溶性硅酸盐+稀盐酸Na2SiO3+2HCl=2NaCl+H2SiO3↓Na2SiO3 + H2O + CO2 ==Na2CO3 + H2SiO3↓ 酸性:H2CO3>H2SiO32、物理性质:白色,胶状,不溶于水。3、化学性质:②不稳定性
①弱酸性: H2SiO3+2NaOH=2H2O +Na2SiO34、用途:制硅胶--干燥剂和催化剂的载体(不能使石蕊变红)二、硅酸(H2SiO3)2、物理性质3、化学性质4、用途1、制备一、硅元素存在二、二氧化硅1、存在形式2、物理性质3、结构4、化学性质5、用途【课堂练习】
1 、要除去SiO2中混有的少量CaO杂质,最适宜的试剂是 ( )
A. 纯碱溶液 B. 盐酸 C. 硫酸 D. 苛性钠溶液
2、下列物质中,不能用玻璃瓶来盛装的是 ( )
A. 烧碱溶液 B. 浓硫酸
C. 氢氟酸 D. 碳酸钠溶液
3、下列各组物质有关性质关系的比较,正确的是( )
A. 稳定性:CO2> SiO2 B. 酸性: H2SiO3> H2CO3 C. 熔点:SiO2> CO2 (干冰) D. 硬度:SiO2
A.具有玻璃塞的细口瓶
B.具有玻璃塞的广口瓶
C.带滴管的滴瓶
D.具有橡胶塞的细口瓶
5、将过量的CO2分别通入①CaCl2溶液,②Na2SiO3溶液,③Ca(OH)2溶液,④ 饱和Na2CO3溶液。最终溶液中有白色沉淀析出的是 ( )
A. ①②③④ B. ②④ C. ①②③ D. ②③DB硅酸的酸性比盐酸弱,那么硅酸酸性与碳酸相比较如何呢?请你设计一个实验论证你的推断。将CO2通入Na2SiO3溶液中 方程式:
Na2SiO3+H2O+CO2==H2SiO3 (胶体) +Na2CO3你的结论:硅酸是一种很弱的酸,
酸性比碳酸还弱应用实践实验方案:作 业:课本P80~81, 3、5做在作业本上。看谁做得最好(课后小测)写出下列的化学方程式:
1、二氧化硅和氢氟酸反应
2、二氧化硅和氧化钙反应
3、二氧化硅和氢氧化钠溶液
4、实验室制取硅酸
5、二氧化碳通入氢氧化钠溶液SiO2+4HF==SiF4↑+2H2OSiO2+CaO=高温=CaSiO3
SiO2+2NaOH==Na2SiO3+H2O
Na2SiO3+2HCl=H2SiO3+2NaClCO2+2NaOH=Na2CO3+H2O
