2017届高三化学(通用版)二轮复习教案:专题2 突破点5 元素的“位—构—性”
文档属性
| 名称 | 2017届高三化学(通用版)二轮复习教案:专题2 突破点5 元素的“位—构—性” |  | |
| 格式 | zip | ||
| 文件大小 | 802.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-01-17 06:36:10 | ||
图片预览




文档简介
专题二 化学基本理论
建知识网络 明内在联系
突破点5 元素的“位—构—性”
提炼1 元素“位—构—性”的关系
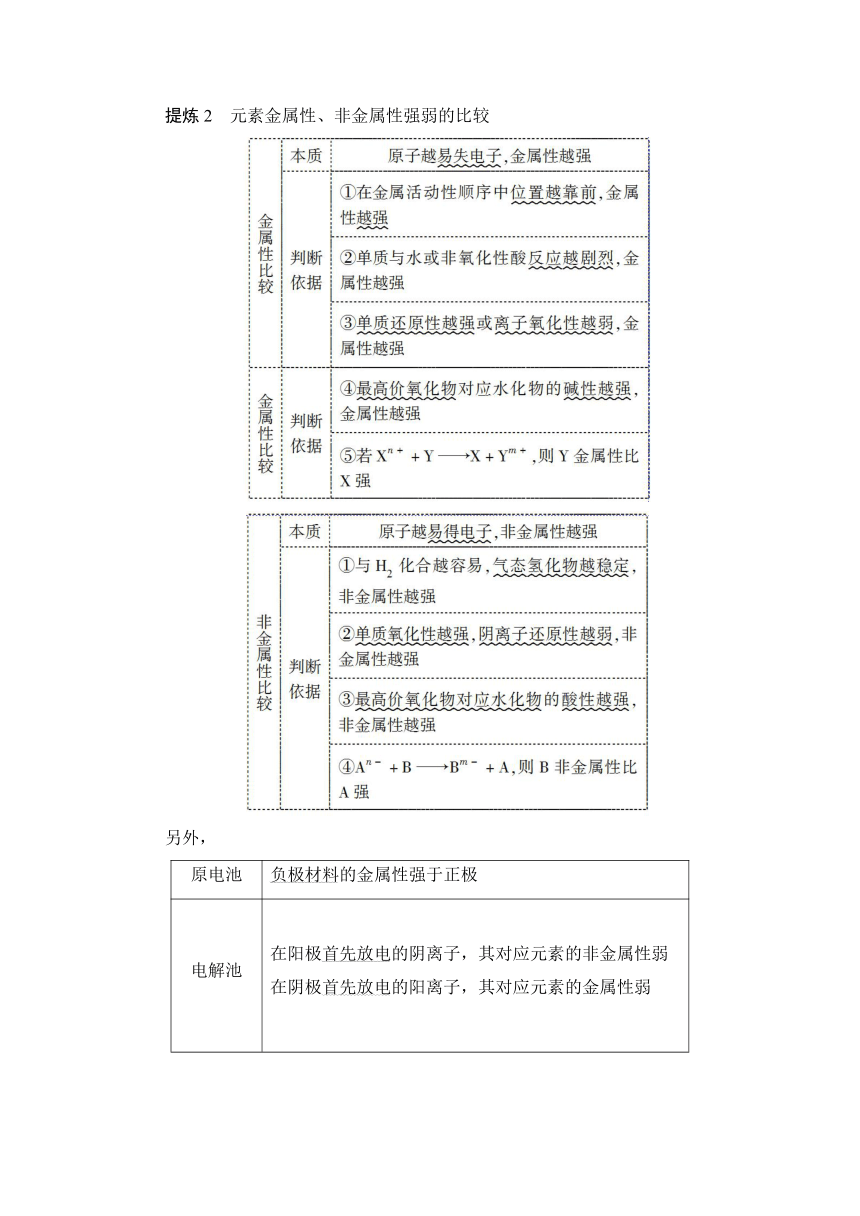
提炼2 元素金属性、非金属性强弱的比较
另外,
原电池
负极材料的金属性强于正极
电解池
在阳极首先放电的阴离子,其对应元素的非金属性弱在阴极首先放电的阳离子,其对应元素的金属性弱
回访1 (2016·全国甲卷)a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d与b同族。下列叙述错误的是( )
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d与a形成的化合物的溶液呈弱酸性
A [由题中所给的信息可知,a为H,b为O,c为Na,d为S。A项中,H与Na可以形成化合物NaH,H的化合价为-1;B项中,O与其他三种元素可以形成H2O、H2O2、Na2O、Na2O2、SO2、SO3等二元化合物;C项中,四种元素原子半径大小顺序为Na>S>O>H;D项中,H与S形成化合物H2S,其水溶液呈弱酸性。]
回访2 (2015·全国卷Ⅰ)W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:YD.X与Y不能存在于同一离子化合物中
B [W、X、Y、Z四种元素均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,故W是第一周期的H元素,X是第二周期的N元素,Y、Z是第三周期元素,因为四种元素的最外层电子数之和为18,故Y、Z最外层电子数之和为18-(1+5)=12,又因为第三周期主族元素最外层电子排布是1~7,故只有Y的最外层电子数是5,Z的最外层电子数是7才能满足条件,则Y是P元素,Z是Cl元素。
A.H2和N2都是分子晶体,对于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,沸点越高,故沸点:N2>H2,A不正确。
B.Cl元素的非金属性强于H元素,元素得电子能力越强,其对应阴离子越不容易失去电子,故对应阴离子的还原性:Cl-弱于H-,B正确。
C.P元素的非金属性弱于Cl元素的非金属性,元素非金属性越弱,其最高价氧化物对应水化物的酸性越弱,故酸性:H3PO4<HClO4,题目中未说明“最高价”,C不正确。
D.铵盐是离子化合物,N和P可能存在于同一离子化合物中,如(NH4)3PO4、(NH4)2HPO4、NH4H2PO4等,D不正确。]
回访3 (2015·全国卷Ⅱ)原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
B [由a的最外层电子数为1,a-的电子层结构与氦相同可知,a为H。b和c的次外层有8个电子,则b、c处于第三周期,又知b、c的最外层电子数分别为6、7,从而推知,b、c分别为S、Cl。由c-和d+的电子层结构相同可知,d为K。A项S、Cl处于第三周期,Cl的原子序数大于S,则Cl的非金属性强于S;由H2S中S元素显-2价、H元素显+1价可知,S的非金属性强于H,因此三种元素的非金属性次序为Cl>S>H。B项H和S、Cl可形成共价化合物H2S和HCl,而H与K则形成离子化合物KH。C项K和H、S、Cl均可形成离子化合物,分别为KH、K2S和KCl。D项H、S、Cl的最高化合价分别为+1、+6和+7,最低化合价分别为-1、-2和-1,因此三种元素各自最高和最低化合价的代数和分别为0、4、6。]
回访4 (2014·新课标全国卷Ⅰ)X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-
,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
D [短周期元素X、Z形成的最低价离子为X2-、Z-,Y+和Z-具有相同的电子层结构,则X、Y、Z三种元素分别处于第ⅥA、ⅠA、ⅦA族。又知X和Y处于同一周期,Y+和Z-具有相同的电子层结构,从而推知X、Y、Z分别为S、Na和F。
A.原子最外层电子数:F>S>Na。
B.Na单质为金属晶体,S、F2为分子晶体,S为固体,F2为气体,显然沸点Na>S>F2。
C.具有相同电子层结构的离子,元素的原子序数越大,原子半径越小,Na+、F-具有相同的电子层结构,则离子半径:F->Na+,S2-多一个电子层,所以S2-半径最大。
D.三种元素的原子序数关系为S>Na>F。]
热点题型1 文字叙述性元素推断
1.(2016·全国丙卷)四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:WB.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:WD.最高价氧化物的水化物的酸性:Y>Z
B [四种短周期主族元素的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X为Na元素;Z与X(Na)形成的离子化合物的水溶液呈中性,则Z为Cl元素;因W与X的简单离子电子层结构相同,且W与Y同族,则W可能为N(或O)元素、Y可能为P(或S)元素。A项,Na+与N3-(或O2-)电子层结构相同,核电荷数越大,离子半径越小,电子层数越多离子半径越大,故离子半径:Na+Y。D项,最高价氧化物对应的水化物中HClO4是最强的无机酸。]
2.(2016·太原模拟)X、Y、Z、W是原子序数依次增大的短周期元素,且原子最外层电子数之和为16。X与其他元素既不在同一周期,也不在同一主族。Y的阴离子与Z的阳离子具有相同的电子层结构,W原子得到一个电子后可形成与稀有气体原子相同的电子层结构。下列说法合理的是( )
A.简单离子半径:W>Z>Y
B.X与Y可形成既含极性键又含非极性键的化合物
C.Z与W形成的化合物一定是离子化合物
D.Y的氧化物对应水化物的酸性一定比W的弱
B [根据提供信息,可以推断X为H,Y为N(或O),Z为Al(或Mg),W为Cl。A项,W的离子有3个电子层,Z、Y的离子有2个电子层,而具有相同电子层结构的离子,核电荷数越大,离子半径越小,则简单离子半径:W>Y>Z;B项,H与N、O可形成N2H4、H2O2,均含极性键和非极性键;C项,Cl与Mg形成的MgCl2为离子化合物,但与Al形成的AlCl3为共价化合物;D项,Y的最高价氧化物对应水化物的酸性比W的弱。]
3.(2016·湖南东部六校联考)短周期元素X、Y、Z、W,它们的原子序数依次增大,X与Z同主族,并且原子序数之和为20,Y原子的质子数为Z原子的质子数的一半,W原子的最外层电子数比Y原子的最外层电子数多2个。下列叙述正确的是( )
A.Y的最高价氧化物对应的水化物可与其简单气态氢化物发生反应
B.原子半径:Z>W>Y>X
C.简单气态氢化物的稳定性:Z>W
D.X的简单气态氢化物与足量W的单质在光照条件下反应的生成物均为气体
A [在短周期元素中,C、Si的原子序数之和为6+14=20或设X的原子序数为a,则Z的原子序数为a+8,有a+(a+8)=20,解得a=6,即X为C,Z为Si。Y原子的质子数为7,Y为N。N原子最外层电子数为5,则W原子最外层电子数为7,W为Cl。HNO3+NH3===NH4NO3,A项正确;原子半径:r(Si)>r(Cl)>r(C)>r(N),B项错误;非金属性:Cl>Si,故稳定性:HCl>SiH4,C项错误;甲烷与氯气在光照下反应的产物有5种,一氯甲烷和氯化氢呈气态,二氯甲烷、三氯甲烷和四氯化碳都呈液态,D项错误。]
4.(2016·陕西西北九校模拟)X、Y、Z、W是四种短周期元素,且原子序数依次增大,元素X的周期序数等于其主族序数,且X为同主族元素中唯一的非金属元素,元素Y的一种单质是强力漂白剂,元素Z形成的简单离子是同周期元素形成的离子中半径最小的,含元素W的一种化合物是木材防火剂的原料。下列叙述错误的是( )
A.上述四种元素的原子半径大小:Z>W>Y>X
B.Z的氢氧化物和NaHCO3均可中和过多的胃酸和治疗胃溃疡
C.X与Y可形成既含极性共价键又含非极性共价键的共价化合物
D.W与Y形成的化合物既是某建筑材料的主要成分,也是工艺品(玛瑙等)的主要成分
B [元素X的周期序数等于其主族序数,且X为同主族元素中唯一的非金属元素,故X为H;Na2SiO3是木材防火剂的原料,且W的原子序数最大,故W为Si;Cl2和O3均是强力漂白剂,结合原子序数:YSi>O>H,即Z>W>Y>X,A项正确;Z的氢氧化物为Al(OH)3,Al(OH)3和NaHCO3均可中和过多的胃酸,但NaHCO3不能用于治疗胃溃疡,B项错误;H2O2为既含极性共价键又含非极性共价键的共价化合物,C项正确;SiO2既是砂石的主要成分,又是玛瑙、水晶的主要成分,D项正确。]
5.(2016·南昌重点中学二模)X、Y、Z、W四种短周期元素的原子序数依次增大,原子最外层电子数之和为13,X的原子半径比Y的小,X与W同主族,Z的族序数是其周期数的3倍。下列说法中正确的是( )
A.四种元素简单离子的半径XB.X与Y形成的离子化合物中既含离子键又含共价键
C.离子化合物W2Z2中阴阳离子数之比为1∶1
D.
只含X、Y、Z三种元素的化合物一定是共价化合物
B [由题知,Z是氧元素;若X是第二周期元素,则不能同时满足“原子序数依次增大”和“X的原子半径比Y的小”,故X是氢元素,则W是钠元素;结合最外层电子数之和为13知,Y是氮元素。简单离子的半径r(H+)6.(名师押题)元素W、R、X、Y的原子序数依次增大,Y的最高正价和最低负价代数和等于0,L层电子数是M层电子数的2倍;在常温常压下,W和R形成的两种氧化物可相互转化,但元素化合价没有变化;这4种元素的原子最外层电子数之和等于R的原子的核电荷数的2倍。下列说法正确的是( )
A.元素的非金属性:R>Y>W
B.R与其他三种元素均能形成共价化合物
C.简单氢化物的热稳定性:R>W>Y
D.原子半径:W>R>X>Y
C [依题意知,W为N,R为O,X为Na,Y为Si。A项,元素的非金属性:O>N>Si,错误。B项,Na2O、Na2O2是离子化合物,错误。D项,原子半径:Na>Si>N>O,错误。]
关于元素周期律、元素周期表的认识误区
1.误认为主族元素的最高正价一定等于族序数。但是F无正价。
2.误认为元素的非金属性越强,其氧化物对应水化物的酸性就越强。但是HClO、H2SO3是弱酸,忽略了关键词“最高价”。
3.误认为同周期相邻两主族元素原子序数之差等于1。忽视了ⅡA和ⅢA族相差11(第四、五周期)和25(第六、七周期)。
4.误认为失电子难的原子得电子的能力一定强。但是碳原子、稀有气体元素的原子失电子难,得电子也难。
5.误认为得失电子多的原子,得失电子的能力一定强。其实不然,不能把得失电子数的多少与得失电子的能力混淆。
6.误认为最高正价和最低负价绝对值相等的元素只有第ⅣA族的某些元素。忽视了第ⅠA族的H的最高正价为+1,最低负价为-1。
热点题型2 周期表片断型元素推断
1.(2015·广东高考改编)甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
A.丙与戊的原子序数相差18
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物可用于制造光导纤维
D [己的最高价氧化物对应水化物有强脱水性,则己为S;由元素在周期表中的相对位置可推断:丙为B、丁为Si、庚为F。因甲和丁在同一周期,且甲原子最外层与最内层具有相同电子数,则甲为Mg,乙为Ca。A.丙为B,原子序数为5,而戊位于P的下方,其原子序数比P的原子序数大18,即戊的原子序数为33,则丙与戊的原子序数相差28。B.同周期元素自左向右,元素的非金属性逐渐增强;同主族元素自上而下,元素的非金属性逐渐减弱,因此元素的非金属性:庚>己>戊,元素的非金属性越强,其气态氢化物的稳定性越强,故氢化物稳定性:庚>己>戊。C.常温下,甲(Mg)与水反应缓慢,加热时反应较快。D.丁(Si)的最高价氧化物为SiO2,可用于制造光导纤维,正确。]
2.(2016·沈阳质检)如图所示的四种短周期元素W、X、Y、Z,它们原子的最外层电子数之和为22。下列说法正确的是( )
A.X、Y、Z三种元素的简单氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.W、X、Z三种元素最高价氧化物对应的水化物的酸性依次增强
D.W、X、Y、Z四种元素最高正化合价依次升高
C [W、X、Y、Z为短周期元素,由元素在周期表中的位置可知,X、Y位于第二周期,W、Z位于第三周期,设W的最外层电子数为a,则X、Y、Z的最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si,X为N,Y为O,Z为Cl。X、Y、Z三种元素的简单氢化物分别为NH3、H2O、HCl,常温下H2O为液体,NH3、HCl为气体,故水的沸点最高,NH3分子间存在氢键,沸点比HCl的高,故沸点:H2O>NH3>HCl,A项错误;N、O和H形成的化合物NH4NO3中既有离子键又有共价键,B项错误;W、X、Z三种元素最高价氧化物对应的水化物分别为硅酸、硝酸、高氯酸,它们的酸性依次增强,C项正确;O没有最高正化合价,D项错误。]
3.(2016·福建毕业质检)短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示。下列说法中一定正确的是( )
A.最高正化合价:Z>X
B.X、Y、Z的单质中,Z的熔点最高
C.若X为非金属元素,则离子半径:Xn->Ym->Zm-
D.若X为金属元素,则X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强
C [一般情况下,元素的最高正化合价与其族序数相等,但O、F无最高正化合价,Z为O或F时不符合题意,A项错误;若X为Si,则三者的单质中,Si的熔点最高,B项错误;若X为非金属元素,则Xn-、Ym-具有相同电子层结构,核电荷数越小,离子半径越大,故离子半径:Xn->Ym-,而Ym-比Zm-多1个电子层,离子半径:Ym->Zm-,C项正确;X、Y、Z中X的金属性最强,故X的最高价氧化物对应水化物的碱性最强,D项错误。]
4.(2016·太原市重点中学4月模拟)R、X、Y、Z、A是短周期主族元素,它们在周期表中的相对位置如图所示。X原子最外层电子数等于其电子层数的3倍。下列推断正确的是( )
R
X
Y
Z
A
A.气态氢化物的热稳定性由强到弱的顺序为Z>R>X>Y
B.原子半径由小到大的顺序为ZC.最高价氧化物对应的水化物酸性由弱到强的顺序为ZD.
RY3、A2X、ZA5分子中每个原子最外层都达到8电子结构
C [由元素在周期表中的位置关系知,X位于第二周期,只有氧原子的最外层电子数等于其电子层数的3倍,则X为氧元素,由此推知R为氮元素,Y为氟元素,Z为磷元素,A为氯元素。A项,热稳定性:PH3r(Cl)>r(O)>r(F),错误;C项,最高价氧化物对应的水化物酸性:H3PO45.(2016·河北石家庄调研)已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )
X
Y
Z
W
A.若四种元素均为非金属元素,则W的最高价氧化物对应的水化物一定是强酸
B.若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
C.若四种元素均为金属元素,则Z的最高价氧化物对应的水化物一定为强碱
D.若四种元素中只有一种为金属,则Z与Y的最高价氧化物对应的水化物能反应
C [若四种元素均为非金属元素,则W可能是磷元素,H3PO4是中强酸,故A错误;若X为氮元素,HNO3为强酸,而氨气溶于水显碱性,故B错误;若四种元素均为金属元素,则Z是钠元素,氢氧化钠为强碱,故C正确;若四种元素中只有一种为金属,则Z是铝元素、Y是碳元素,氢氧化铝与碳酸不能反应,故D错误。]
6.(名师押题)三种短周期元素X、Y、Z的位置关系如图所示。X、Y的原子序数之和等于Z的原子序数,下列说法正确的是( )
A.Y位于第二周期ⅦA族
B.X的最高价氧化物对应水化物具有氧化性
C.Z的单质可用作太阳能电池的材料
D.X的原子只能形成共价单键
B [由题给条件可推出X、Y、Z分别是N、O和P。O位于第二周期ⅥA族,A项错误;磷不能用作太阳能电池的材料,C项错误;氮原子可形成共价单键、双键和三键,D项错误。]
解答元素推断与元素周期律题目的步骤
第一步:推断元素
(1)根据题目信息和原子结构推断元素在元素周期表中的位置及名称。
(2)根据元素及其化合物的性质判断出元素原子结构和在元素周期表中的位置。
第二步:联想“规律”
依据推出的元素在周期表中的位置,结合元素周期律对选项中元素的结构和元素性质的变化作出判断。
第三步:通盘“验证”
将判断的结果代入原题中进行检验,完全符合题设条件的才是正确选项。
建知识网络 明内在联系
突破点5 元素的“位—构—性”
提炼1 元素“位—构—性”的关系
提炼2 元素金属性、非金属性强弱的比较
另外,
原电池
负极材料的金属性强于正极
电解池
在阳极首先放电的阴离子,其对应元素的非金属性弱在阴极首先放电的阳离子,其对应元素的金属性弱
回访1 (2016·全国甲卷)a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d与b同族。下列叙述错误的是( )
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d与a形成的化合物的溶液呈弱酸性
A [由题中所给的信息可知,a为H,b为O,c为Na,d为S。A项中,H与Na可以形成化合物NaH,H的化合价为-1;B项中,O与其他三种元素可以形成H2O、H2O2、Na2O、Na2O2、SO2、SO3等二元化合物;C项中,四种元素原子半径大小顺序为Na>S>O>H;D项中,H与S形成化合物H2S,其水溶液呈弱酸性。]
回访2 (2015·全国卷Ⅰ)W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:Y
B [W、X、Y、Z四种元素均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,故W是第一周期的H元素,X是第二周期的N元素,Y、Z是第三周期元素,因为四种元素的最外层电子数之和为18,故Y、Z最外层电子数之和为18-(1+5)=12,又因为第三周期主族元素最外层电子排布是1~7,故只有Y的最外层电子数是5,Z的最外层电子数是7才能满足条件,则Y是P元素,Z是Cl元素。
A.H2和N2都是分子晶体,对于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,沸点越高,故沸点:N2>H2,A不正确。
B.Cl元素的非金属性强于H元素,元素得电子能力越强,其对应阴离子越不容易失去电子,故对应阴离子的还原性:Cl-弱于H-,B正确。
C.P元素的非金属性弱于Cl元素的非金属性,元素非金属性越弱,其最高价氧化物对应水化物的酸性越弱,故酸性:H3PO4<HClO4,题目中未说明“最高价”,C不正确。
D.铵盐是离子化合物,N和P可能存在于同一离子化合物中,如(NH4)3PO4、(NH4)2HPO4、NH4H2PO4等,D不正确。]
回访3 (2015·全国卷Ⅱ)原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
B [由a的最外层电子数为1,a-的电子层结构与氦相同可知,a为H。b和c的次外层有8个电子,则b、c处于第三周期,又知b、c的最外层电子数分别为6、7,从而推知,b、c分别为S、Cl。由c-和d+的电子层结构相同可知,d为K。A项S、Cl处于第三周期,Cl的原子序数大于S,则Cl的非金属性强于S;由H2S中S元素显-2价、H元素显+1价可知,S的非金属性强于H,因此三种元素的非金属性次序为Cl>S>H。B项H和S、Cl可形成共价化合物H2S和HCl,而H与K则形成离子化合物KH。C项K和H、S、Cl均可形成离子化合物,分别为KH、K2S和KCl。D项H、S、Cl的最高化合价分别为+1、+6和+7,最低化合价分别为-1、-2和-1,因此三种元素各自最高和最低化合价的代数和分别为0、4、6。]
回访4 (2014·新课标全国卷Ⅰ)X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-
,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
D [短周期元素X、Z形成的最低价离子为X2-、Z-,Y+和Z-具有相同的电子层结构,则X、Y、Z三种元素分别处于第ⅥA、ⅠA、ⅦA族。又知X和Y处于同一周期,Y+和Z-具有相同的电子层结构,从而推知X、Y、Z分别为S、Na和F。
A.原子最外层电子数:F>S>Na。
B.Na单质为金属晶体,S、F2为分子晶体,S为固体,F2为气体,显然沸点Na>S>F2。
C.具有相同电子层结构的离子,元素的原子序数越大,原子半径越小,Na+、F-具有相同的电子层结构,则离子半径:F->Na+,S2-多一个电子层,所以S2-半径最大。
D.三种元素的原子序数关系为S>Na>F。]
热点题型1 文字叙述性元素推断
1.(2016·全国丙卷)四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:W
C.气态氢化物的热稳定性:W
B [四种短周期主族元素的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X为Na元素;Z与X(Na)形成的离子化合物的水溶液呈中性,则Z为Cl元素;因W与X的简单离子电子层结构相同,且W与Y同族,则W可能为N(或O)元素、Y可能为P(或S)元素。A项,Na+与N3-(或O2-)电子层结构相同,核电荷数越大,离子半径越小,电子层数越多离子半径越大,故离子半径:Na+
2.(2016·太原模拟)X、Y、Z、W是原子序数依次增大的短周期元素,且原子最外层电子数之和为16。X与其他元素既不在同一周期,也不在同一主族。Y的阴离子与Z的阳离子具有相同的电子层结构,W原子得到一个电子后可形成与稀有气体原子相同的电子层结构。下列说法合理的是( )
A.简单离子半径:W>Z>Y
B.X与Y可形成既含极性键又含非极性键的化合物
C.Z与W形成的化合物一定是离子化合物
D.Y的氧化物对应水化物的酸性一定比W的弱
B [根据提供信息,可以推断X为H,Y为N(或O),Z为Al(或Mg),W为Cl。A项,W的离子有3个电子层,Z、Y的离子有2个电子层,而具有相同电子层结构的离子,核电荷数越大,离子半径越小,则简单离子半径:W>Y>Z;B项,H与N、O可形成N2H4、H2O2,均含极性键和非极性键;C项,Cl与Mg形成的MgCl2为离子化合物,但与Al形成的AlCl3为共价化合物;D项,Y的最高价氧化物对应水化物的酸性比W的弱。]
3.(2016·湖南东部六校联考)短周期元素X、Y、Z、W,它们的原子序数依次增大,X与Z同主族,并且原子序数之和为20,Y原子的质子数为Z原子的质子数的一半,W原子的最外层电子数比Y原子的最外层电子数多2个。下列叙述正确的是( )
A.Y的最高价氧化物对应的水化物可与其简单气态氢化物发生反应
B.原子半径:Z>W>Y>X
C.简单气态氢化物的稳定性:Z>W
D.X的简单气态氢化物与足量W的单质在光照条件下反应的生成物均为气体
A [在短周期元素中,C、Si的原子序数之和为6+14=20或设X的原子序数为a,则Z的原子序数为a+8,有a+(a+8)=20,解得a=6,即X为C,Z为Si。Y原子的质子数为7,Y为N。N原子最外层电子数为5,则W原子最外层电子数为7,W为Cl。HNO3+NH3===NH4NO3,A项正确;原子半径:r(Si)>r(Cl)>r(C)>r(N),B项错误;非金属性:Cl>Si,故稳定性:HCl>SiH4,C项错误;甲烷与氯气在光照下反应的产物有5种,一氯甲烷和氯化氢呈气态,二氯甲烷、三氯甲烷和四氯化碳都呈液态,D项错误。]
4.(2016·陕西西北九校模拟)X、Y、Z、W是四种短周期元素,且原子序数依次增大,元素X的周期序数等于其主族序数,且X为同主族元素中唯一的非金属元素,元素Y的一种单质是强力漂白剂,元素Z形成的简单离子是同周期元素形成的离子中半径最小的,含元素W的一种化合物是木材防火剂的原料。下列叙述错误的是( )
A.上述四种元素的原子半径大小:Z>W>Y>X
B.Z的氢氧化物和NaHCO3均可中和过多的胃酸和治疗胃溃疡
C.X与Y可形成既含极性共价键又含非极性共价键的共价化合物
D.W与Y形成的化合物既是某建筑材料的主要成分,也是工艺品(玛瑙等)的主要成分
B [元素X的周期序数等于其主族序数,且X为同主族元素中唯一的非金属元素,故X为H;Na2SiO3是木材防火剂的原料,且W的原子序数最大,故W为Si;Cl2和O3均是强力漂白剂,结合原子序数:Y
5.(2016·南昌重点中学二模)X、Y、Z、W四种短周期元素的原子序数依次增大,原子最外层电子数之和为13,X的原子半径比Y的小,X与W同主族,Z的族序数是其周期数的3倍。下列说法中正确的是( )
A.四种元素简单离子的半径X
C.离子化合物W2Z2中阴阳离子数之比为1∶1
D.
只含X、Y、Z三种元素的化合物一定是共价化合物
B [由题知,Z是氧元素;若X是第二周期元素,则不能同时满足“原子序数依次增大”和“X的原子半径比Y的小”,故X是氢元素,则W是钠元素;结合最外层电子数之和为13知,Y是氮元素。简单离子的半径r(H+)
A.元素的非金属性:R>Y>W
B.R与其他三种元素均能形成共价化合物
C.简单氢化物的热稳定性:R>W>Y
D.原子半径:W>R>X>Y
C [依题意知,W为N,R为O,X为Na,Y为Si。A项,元素的非金属性:O>N>Si,错误。B项,Na2O、Na2O2是离子化合物,错误。D项,原子半径:Na>Si>N>O,错误。]
关于元素周期律、元素周期表的认识误区
1.误认为主族元素的最高正价一定等于族序数。但是F无正价。
2.误认为元素的非金属性越强,其氧化物对应水化物的酸性就越强。但是HClO、H2SO3是弱酸,忽略了关键词“最高价”。
3.误认为同周期相邻两主族元素原子序数之差等于1。忽视了ⅡA和ⅢA族相差11(第四、五周期)和25(第六、七周期)。
4.误认为失电子难的原子得电子的能力一定强。但是碳原子、稀有气体元素的原子失电子难,得电子也难。
5.误认为得失电子多的原子,得失电子的能力一定强。其实不然,不能把得失电子数的多少与得失电子的能力混淆。
6.误认为最高正价和最低负价绝对值相等的元素只有第ⅣA族的某些元素。忽视了第ⅠA族的H的最高正价为+1,最低负价为-1。
热点题型2 周期表片断型元素推断
1.(2015·广东高考改编)甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
A.丙与戊的原子序数相差18
B.气态氢化物的稳定性:庚<己<戊
C.常温下,甲和乙的单质均能与水剧烈反应
D.丁的最高价氧化物可用于制造光导纤维
D [己的最高价氧化物对应水化物有强脱水性,则己为S;由元素在周期表中的相对位置可推断:丙为B、丁为Si、庚为F。因甲和丁在同一周期,且甲原子最外层与最内层具有相同电子数,则甲为Mg,乙为Ca。A.丙为B,原子序数为5,而戊位于P的下方,其原子序数比P的原子序数大18,即戊的原子序数为33,则丙与戊的原子序数相差28。B.同周期元素自左向右,元素的非金属性逐渐增强;同主族元素自上而下,元素的非金属性逐渐减弱,因此元素的非金属性:庚>己>戊,元素的非金属性越强,其气态氢化物的稳定性越强,故氢化物稳定性:庚>己>戊。C.常温下,甲(Mg)与水反应缓慢,加热时反应较快。D.丁(Si)的最高价氧化物为SiO2,可用于制造光导纤维,正确。]
2.(2016·沈阳质检)如图所示的四种短周期元素W、X、Y、Z,它们原子的最外层电子数之和为22。下列说法正确的是( )
A.X、Y、Z三种元素的简单氢化物的沸点依次升高
B.由X、Y和氢三种元素形成的化合物中只有共价键
C.W、X、Z三种元素最高价氧化物对应的水化物的酸性依次增强
D.W、X、Y、Z四种元素最高正化合价依次升高
C [W、X、Y、Z为短周期元素,由元素在周期表中的位置可知,X、Y位于第二周期,W、Z位于第三周期,设W的最外层电子数为a,则X、Y、Z的最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si,X为N,Y为O,Z为Cl。X、Y、Z三种元素的简单氢化物分别为NH3、H2O、HCl,常温下H2O为液体,NH3、HCl为气体,故水的沸点最高,NH3分子间存在氢键,沸点比HCl的高,故沸点:H2O>NH3>HCl,A项错误;N、O和H形成的化合物NH4NO3中既有离子键又有共价键,B项错误;W、X、Z三种元素最高价氧化物对应的水化物分别为硅酸、硝酸、高氯酸,它们的酸性依次增强,C项正确;O没有最高正化合价,D项错误。]
3.(2016·福建毕业质检)短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示。下列说法中一定正确的是( )
A.最高正化合价:Z>X
B.X、Y、Z的单质中,Z的熔点最高
C.若X为非金属元素,则离子半径:Xn->Ym->Zm-
D.若X为金属元素,则X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强
C [一般情况下,元素的最高正化合价与其族序数相等,但O、F无最高正化合价,Z为O或F时不符合题意,A项错误;若X为Si,则三者的单质中,Si的熔点最高,B项错误;若X为非金属元素,则Xn-、Ym-具有相同电子层结构,核电荷数越小,离子半径越大,故离子半径:Xn->Ym-,而Ym-比Zm-多1个电子层,离子半径:Ym->Zm-,C项正确;X、Y、Z中X的金属性最强,故X的最高价氧化物对应水化物的碱性最强,D项错误。]
4.(2016·太原市重点中学4月模拟)R、X、Y、Z、A是短周期主族元素,它们在周期表中的相对位置如图所示。X原子最外层电子数等于其电子层数的3倍。下列推断正确的是( )
R
X
Y
Z
A
A.气态氢化物的热稳定性由强到弱的顺序为Z>R>X>Y
B.原子半径由小到大的顺序为Z
RY3、A2X、ZA5分子中每个原子最外层都达到8电子结构
C [由元素在周期表中的位置关系知,X位于第二周期,只有氧原子的最外层电子数等于其电子层数的3倍,则X为氧元素,由此推知R为氮元素,Y为氟元素,Z为磷元素,A为氯元素。A项,热稳定性:PH3
X
Y
Z
W
A.若四种元素均为非金属元素,则W的最高价氧化物对应的水化物一定是强酸
B.若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
C.若四种元素均为金属元素,则Z的最高价氧化物对应的水化物一定为强碱
D.若四种元素中只有一种为金属,则Z与Y的最高价氧化物对应的水化物能反应
C [若四种元素均为非金属元素,则W可能是磷元素,H3PO4是中强酸,故A错误;若X为氮元素,HNO3为强酸,而氨气溶于水显碱性,故B错误;若四种元素均为金属元素,则Z是钠元素,氢氧化钠为强碱,故C正确;若四种元素中只有一种为金属,则Z是铝元素、Y是碳元素,氢氧化铝与碳酸不能反应,故D错误。]
6.(名师押题)三种短周期元素X、Y、Z的位置关系如图所示。X、Y的原子序数之和等于Z的原子序数,下列说法正确的是( )
A.Y位于第二周期ⅦA族
B.X的最高价氧化物对应水化物具有氧化性
C.Z的单质可用作太阳能电池的材料
D.X的原子只能形成共价单键
B [由题给条件可推出X、Y、Z分别是N、O和P。O位于第二周期ⅥA族,A项错误;磷不能用作太阳能电池的材料,C项错误;氮原子可形成共价单键、双键和三键,D项错误。]
解答元素推断与元素周期律题目的步骤
第一步:推断元素
(1)根据题目信息和原子结构推断元素在元素周期表中的位置及名称。
(2)根据元素及其化合物的性质判断出元素原子结构和在元素周期表中的位置。
第二步:联想“规律”
依据推出的元素在周期表中的位置,结合元素周期律对选项中元素的结构和元素性质的变化作出判断。
第三步:通盘“验证”
将判断的结果代入原题中进行检验,完全符合题设条件的才是正确选项。
同课章节目录
