2017届高三化学(通用版)二轮复习教案:专题2 突破点9 水溶液中的离子平衡
文档属性
| 名称 | 2017届高三化学(通用版)二轮复习教案:专题2 突破点9 水溶液中的离子平衡 |  | |
| 格式 | zip | ||
| 文件大小 | 698.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-01-17 06:37:29 | ||
图片预览



文档简介
突破点9 水溶液中的离子平衡
提炼1 电离平衡及应用
1.弱电解质只进行微弱电离,发生电离的弱电解质及产生的离子都是少量的,同时注意考虑水的电离
如0.1
mol/L的氨水中,由于存在电离平衡:NH3·H2O??NH+OH-、H2O??H++OH-,所以溶液中微粒浓度的关系为
c(NH3·H2O)>c(OH-)>c(NH)>c(H+)。
2.多元弱酸的电离分步进行,主要以第一步电离为主
如H2S溶液中,由于存在电离平衡:H2S??HS-+H+、HS-??S2-+H+、H2O??H++OH-,所以溶液中微粒浓度关系为c(H2S)>c(H+)>c(HS-)>c(S2-)。
3.电离平衡常见影响因素分析
(以CH3COOH??CH3COO-+H+为例)
改变条件
平衡移动方向
c(H+)
Ka
升高温度
正向移动
增大
增大
加水稀释
正向移动
减小
不变
加冰醋酸
正向移动
增大
不变
加浓盐酸
逆向移动
增大
不变
加入烧碱
正向移动
减小
不变
4.相同pH、相同体积的一元强酸与一元弱酸溶液的比较
5.溶液的酸碱性判断的最根本的标准是比较溶液中c(H+)和c(OH-)的相对大小,而pH=7或c(H+)=1×10-7
mol·L-1,仅仅是在室温下的特例,因此在使用pH判断溶液酸碱性时,要特别注意温度条件。
提炼2 水解平衡及应用
1.水解是微弱的
如浓度为0.1
mol/L、pH=5.5的(NH4)2SO4溶液中,由于c(H+)水=c(OH-)水,而水电离产生的一部分OH-与很少量的NH结合产生NH3·H2O,所以溶液中微粒浓度关系为c(NH)>c(SO)>c(H+)>c(NH3·H2O)>c(OH-)。
2.盐溶液的酸碱性
(1)正盐:谁弱谁水解,谁强显谁性。
强碱弱酸盐(如CH3COONa)―→弱酸根离子水解→结果:c(OH-)>c(H+)。
强酸弱碱盐(如NH4Cl)―→弱碱阳离子水解→结果:c(H+)>c(OH-)。
(2)酸式盐溶液
3.盐类水解的离子方程式
(1)多元弱酸盐的水解分步进行,以第一步为主,一般只写第一步水解的离子方程式,如Na2CO3水解的离子方程式:CO+H2O??HCO+OH-。
(2)多元弱碱阳离子的水解方程式一步写完,如FeCl3水解的离子方程式:Fe3++3H2O??Fe(OH)3+3H+。
(3)能完全水解的离子组,由于水解程度较大,书写时要用“===”“↑”“↓”等,如NaHCO3与AlCl3混合溶液反应的离子方程式:Al3++3HCO===Al(OH)3↓+3CO2↑。
如在Na2CO3溶液中存在着Na+、CO、H+、OH-、HCO,它们存在如下关系:c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-)。
(2)物料守恒规律
电解质溶液中,由于某些离子能水解或电离,粒子种类增多,但某些关键性的原子总是守恒的。
c(Na+)=2[c(CO)+c(HCO)+c(H2CO3)]
(3)质子守恒规律
电解质溶液中,电离、水解等过程中得到的质子(H+)数等于失去的质子(H+)数。
如Na2CO3溶液中质子守恒关系可以用图示分析如下:
由得失氢离子守恒可得:c(OH-)=c(H+)+c(HCO)+2c(H2CO3)。
提炼3 沉淀溶解平衡及应用1.沉淀溶解平衡常数——溶度积
(1)表达式:对于溶解平衡MmAn(s)??mMn+(aq)+nAm-(aq)
Ksp=[c(Mn+)]m·[c(Am-)]n。
(2)意义:溶度积(Ksp)反映了物质在水中的溶解能力。
(3)影响因素:溶度积常数只与难溶性电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关。
2.溶度积的应用
通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积(Qc)的相对大小,判断难溶电解质在给定条件下能否生成或溶解:
当Qc>Ksp时,溶液为过饱和溶液,沉淀析出。
当Qc=Ksp时,溶液为饱和溶液,处于平衡状态。
当Qc3.Ksp的应用注意事项
(1)用溶度积直接比较难溶电解质的溶解能力时,物质的类型(如AB型、A2B型、AB2型等)必须相同。
(2)对于同类型物质,Ksp数值越大,难溶电解质在水中的溶解能力越强;当一种离子和其他几种离子都可能产生沉淀时,Ksp越小,沉淀越容易生成。
(3)对于不同类型的物质,当Ksp相差不大时不能直接作为比较依据,如常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,不能判断前者溶解度大。
(4)沉淀的转化过程中一般是溶解度大的易转化为溶解度小的,但也可以使溶解度小的沉淀转化成溶解度大的沉淀,如用饱和Na2CO3溶液浸泡重晶石(BaSO4)可制备溶于酸的钡盐BaCO3。
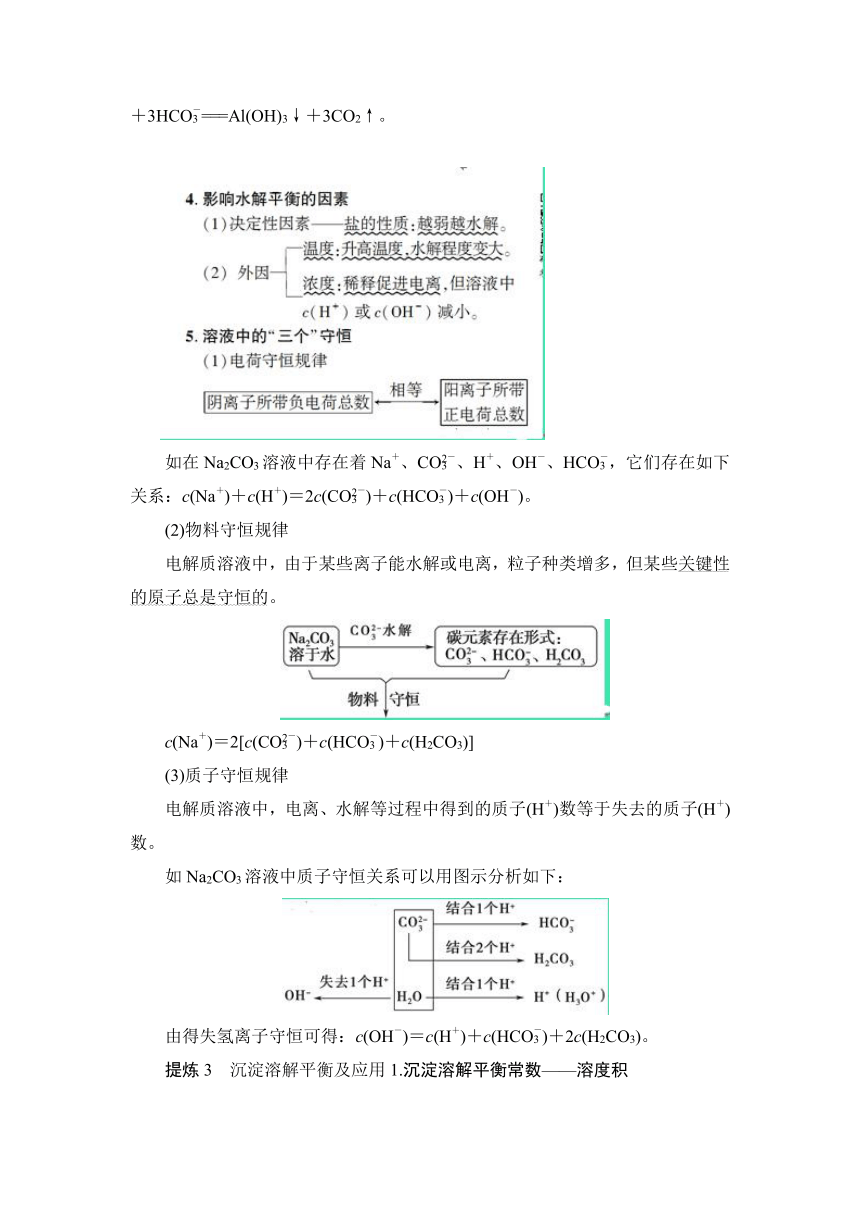
回访1 (2016·全国乙卷)298
K时,在20.0
mL
0.10
mol·L-1氨水中滴入0.10
mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10
mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0
mL
C.M点处的溶液中c(NH)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
D [A项用0.10
mol·L-1盐酸滴定20.0
mL
0.10
mol·L-1氨水,二者恰好完全反应时生成强酸弱碱盐NH4Cl,应选用甲基橙作指示剂。B项当V(HCl)=20.0
mL时,二者恰好完全反应生成NH4Cl,此时溶液呈酸性,而图中M点溶液的pH=7,故M点对应盐酸的体积小于20.0
mL。C项M点溶液呈中性,则有c(H+)=c(OH-);据电荷守恒可得c(H+)+c(NH)=c(OH-)+c(Cl-),则有c(NH)=c(Cl-),此时溶液中离子浓度关系为c(NH)=c(Cl-)>c(H+)=c(OH-)。D项NH3·H2O为弱电解质,部分发生电离,N点时V(HCl)=0,此时氨水的电离度为1.32%,则有c(OH-)=0.10
mol·L-1×1.32%=1.32×10-3
mol·L-1,c(H+)==
mol·L-1≈7.58×10-12
mol·L-1,故N点处的溶液中pH<12。]
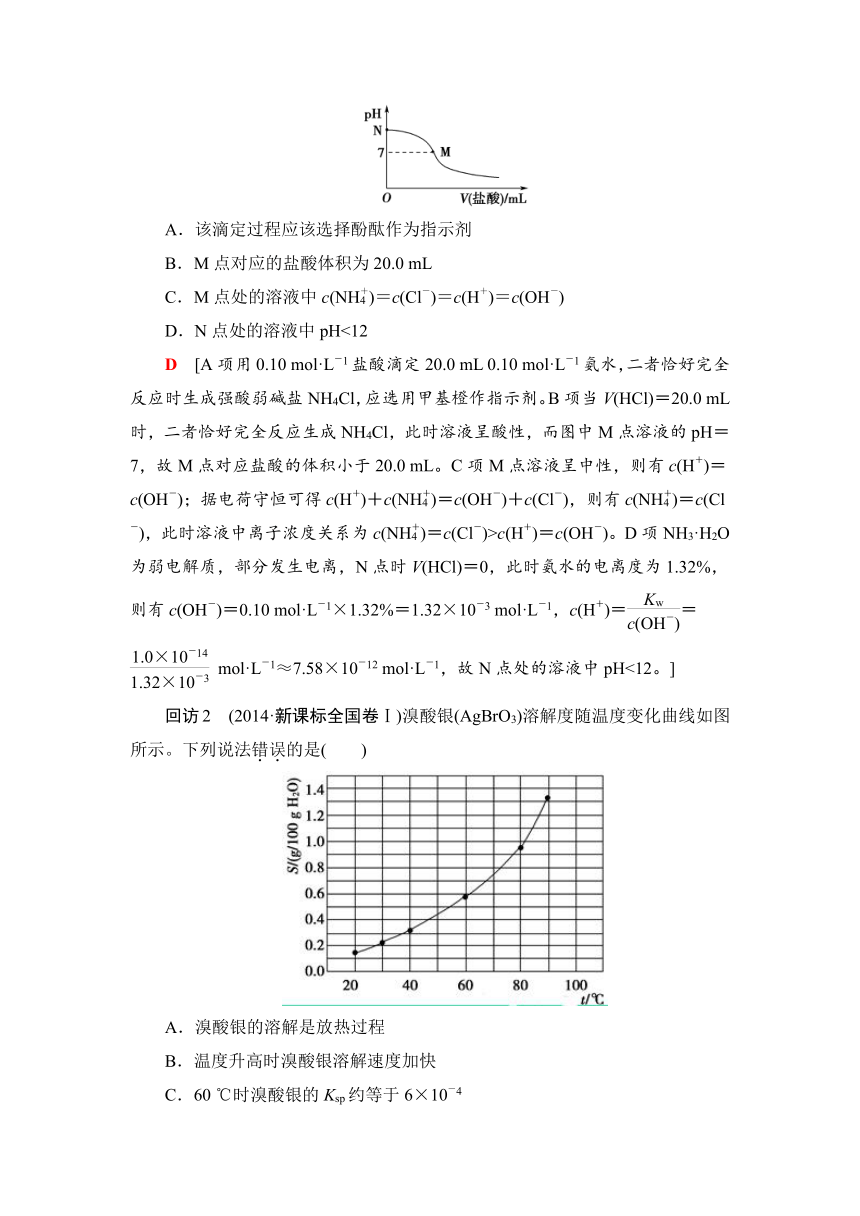
回访2 (2014·新课标全国卷Ⅰ)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示。下列说法错误的是( )
A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60
℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
A [A.由题图可知,随着温度升高,溴酸银的溶解度逐渐增大,因此AgBrO3的溶解是吸热过程。B.温度越高物质的溶解速率越快。C.由溶解度曲线可知,60
℃时AgBrO3的溶解度约为0.6
g,则其物质的量浓度约为0.025
mol·L-1,AgBrO3的Ksp=c(Ag+)·c(BrO)=0.025×0.025≈6×10-4。D.若KNO3中含有少量AgBrO3,可通过蒸发浓缩得到KNO3的饱和溶液,再冷却结晶获得KNO3晶体,而AgBrO3留在母液中。]
热点题型1 滴定曲线分析及应用
1.(2016·河北石家庄调研)用0.1
mol/L
NaOH溶液滴定10
mL
0.1
mol/L
H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法错误的是( )
A.A点溶液中加入少量水:增大
B.B点:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.C点:c(Na+)=c(HA-)+2c(A2-)
D.水电离出来的c(OH-):B>D
D [向H2A溶液中加入少量水,H2A、H+的浓度均减小,==,则增大,故A正确;10
mL
0.1
mol/L
NaOH溶液与10
mL
0.1
mol/L
H2A溶液反应恰好生成NaHA,此时溶液呈酸性,HA-的电离程度大于其水解程度,所以B点有c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B正确;根据电荷守恒,c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),C点溶液呈中性,所以c(Na+)=c(HA-)+2c(A2-),故C正确;D点H2A与氢氧化钠恰好反应生成Na2A,A2-水解促进水的电离,B点为NaHA溶液,HA-电离使溶液呈酸性,抑制水的电离,所以水电离出来的c(OH-):B2.常温下,向40.00
mL
0.1
mol·L-1
MOH溶液中滴加0.1
mol·L-1盐酸,混合溶液的pH与所加盐酸体积的关系如图所示。下列推断正确的是( )
A.MOH是强电解质
B.a点对应的溶液中:c(Cl-)>c(M+)>c(OH-)>c(H+)
C.b点对应的溶液中:c(Cl-)>c(M+)>c(H+)>c(OH-)
D.曲线上任意点所对应的溶液中都有c(H+)=c(OH-)+c(MOH)
C [A项,从图像中起点的pH和MOH溶液的浓度知,MOH是弱电解质,错误;B项,a点对应的溶液中:c(M+)>c(Cl-)>c(OH-)>c(H+),错误;C项,b点时,二者恰好完全中和生成MCl,MCl水解,溶液呈酸性,溶液中离子浓度关系为c(Cl-)>c(M+)>c(H+)>c(OH-),正确;D项,只有b点对应的溶液中,存在质子守恒式:c(H+)=c(OH-)+c(MOH),错误。]
3.25
℃时,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),所需S2-最低浓度的对数值lg
c(S2-)与lg
c(M2+)
的关系如图所示。下列说法正确的是( )
A.Ksp(CuS)约为1.0×10-20
B.向Cu2+浓度为10-5
mol·L-1的废水中加入ZnS粉末,会有CuS沉淀析出
C.向100
mL浓度均为10-5
mol·L-1的Cu2+、Mn2+、Fe2+、Zn2+的混合溶液中逐滴加入10-4
mol·L-1的Na2S溶液,Zn2+先沉淀
D.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
B [根据CuS对应的点(-25,-10)计算,c(S2-)=10-25
mol·L-1,c(Cu2+)=10-10
mol·L-1,故Ksp(CuS)=c(S2-)·c(Cu2+)=10-25×10-10=10-35,A项错误;图上的点越向右,说明c(S2-)越大,同理,图上的点越向上,说明c(M2+)越大,故Ksp(CuS)mol·L-1的废水中加入ZnS粉末,会有CuS沉淀析出,B项正确;CuS的Ksp最小,向同浓度的Cu2+、Mn2+、Fe2+、Zn2+的混合溶液中逐滴加入10-4
mol·L-1的Na2S溶液时,Cu2+先沉淀,C项错误;在Na2S溶液中,由物料守恒知2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),D项错误。]
4.(2016·天津高考)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1
mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
C [根据起点pH:HAHB>HD,根据酸性越强,酸的电离常数越大,则KHA>KHB>KHD,故A项正确;P点时根据横坐标中和百分数为50%知c(HB)∶c(NaB)=1∶1,根据纵坐标pH<7知酸的电离程度大于盐的水解程度,故B项正确;根据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)和pH=7知c(Na+)=c(A-),同理c(Na+)=c(B-)、c(Na+)=c(D-),根据中和原理知溶液显中性时需要的NaOH的量不同,故c(Na+)不相同,则c(A-)、c(B-)、c(D-)三者不相同,C项错误;当中和百分数都达到100%时,溶液为NaA、NaB、NaD的混合物,则c(OH-)=c(HA)+c(HB)+c(HD)+c(H+),即c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),D项正确。]
巧抓“四个点”突破滴定曲线问题
1.抓反应“一半”点,判断是什么溶质的等量混合。
2.抓“恰好”反应点,生成什么溶质,溶液呈什么性,是什么因素造成的。
3.抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足。
4.抓反应“过量”点,溶质是什么,判断谁多、谁少还是等量。
热点题型2 溶液中离子平衡的影响因素
1.(2016·安徽合肥质检)常温下,下列有关电解质溶液的叙述中错误的是( )
A.某H2SO4溶液中=1.0×10-8,由水电离出的c水(H+)=1×10-11
mol·L-1
B.将0.02
mol·L-1盐酸与0.02
mol·L-1
Ba(OH)2溶液等体积混合后,溶液pH约为12
C.将一定体积稀盐酸与稀氨水混合,当溶质为NH3·H2O和NH4Cl时,溶液的pH≥7
D.向0.1
mol·L-1
Na2CO3溶液中逐滴滴加0.1
mol·L-1稀盐酸,溶液中c(HCO)先增大后减小
C [A项,结合Kw进行计算,c(H+)=10-3
mol·L-1,则水电离的c水(H+)=c(OH-)=1×10-11
mol·L-1,正确;B项,等体积混合后c(OH-)=
mol·L-1=0.01
mol·L-1,正确;D项,Na2CO3溶液中滴加稀盐酸,发生反应依次为:CO+H+===HCO、HCO+H+===CO2↑+H2O,故c(HCO)先增大后减小,正确;C项,氨水和稀盐酸混合,当溶质为NH3·H2O和NH4Cl时,因两者相对量的不同,溶液的pH可能大于7、可能等于7也可能小于7,错误。]
2.(2016·河南八市质检)25
℃时,用蒸馏水稀释1
mol/L醋酸,下列各项始终保持增大趋势的是( )
A.
B.
C.
D.
c(H+)·c(CH3COO-)
A [稀释过程中,c(CH3COO-)和c(H+)减小,c(OH-)增大,故A项正确;加水稀释,CH3COOH对水的抑制效果减弱,故c(H+)减小幅度小于c(CH3COO-),减小;=,稀释过程中c(H+)减小,故C项错误;稀释过程中,c(CH3COO-)和c(H+)均减小,故c(CH3COO-)·c(H+)减小,故D项错误。]
3.(2015·广东高考)一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
C [A.c点溶液中c(OH-)>c(H+),溶液呈碱性,升温,溶液中c(OH-)不可能减小。B.由b点对应c(H+)与c(OH-)
可知,Kw=c(H+)·c(OH-)=1.0×10-7×1.0×10-7=1.0×10-14。C.FeCl3溶液水解显酸性,溶液中c(H+)增大,因一定温度下水的离子积是常数,故溶液中c(OH-)减小,因此加入FeCl3溶液可能引起由b向a的变化。D.c点溶液呈碱性,稀释时c(OH-)减小,同时c(H+)应增大,故稀释溶液时不可能引起由c向d的转化。]
4.(2016·湖北武汉调研)浓度均为0.1
mol/L、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg的变化关系如图所示。下列叙述正确的是( )
A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH-):aC.相同温度下,电离常数K(HX):a>b
D.当lg=3时,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则减小
B [根据题图分析,当lg=0时,HX溶液的pH>1,说明HX部分电离,为弱电解质,HY溶液的pH=1,说明其完全电离,为强电解质,A错误;酸或碱抑制水的电离,酸中的氢离子浓度越小,其抑制水电离的程度越小,根据题图分析,b点溶液中氢离子浓度小于a点,则水的电离程度a5.常温下,下列有关说法正确的是( )
A.将pH=2的盐酸和pH=5的稀硫酸等体积混合,混合液的pH=3.5
B.将pH=11的NaOH溶液和pH=13的Ba(OH)2溶液等体积混合,混合液的pH=12
C.将pH=2的H2X溶液稀释至原来的1
000倍,得到混合溶液的pH=5
D.将pH=1的盐酸和0.1
mol·L-1的Ba(OH)2溶液等体积混合,混合液的pH=12.7
D [常温下,水的离子积Kw=1×10-14。A项,混合液中c(H+)=≈5×10-3
mol·L-1,pH≈2.3,错误。B项,c(OH-)=≈0.05
mol·L-1,c(H+)==
mol·L-1=2×10-13
mol·L-1,pH≈12.7,错误。C项,若H2X为强酸,则稀释后溶液的pH=5;若H2X为弱酸,则稀释后溶液的pH<5,错误。D项,c(OH-)==0.05
mol·L-1,c(H+)==
mol·L-1=2×10-13
mol·L-1,pH≈12.7,正确。]
溶液pH计算的一般思维模型
热点题型3 离子浓度大小的比较
1.T
℃时,某浓度醋酸钠溶液的pH=10,下列说法一定正确的是( )
A.溶液中由水电离出的c(OH-)=1×10-10
mol·L-1
B.溶液中存在:c(H+)·c(OH-)=1×10-14
mol2·L-2
C.溶液中存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)>c(CH3COOH)
D.溶液中存在:c(CH3COOH)+c(CH3COO-)=c(Na+)
D [醋酸钠溶液中水的电离平衡受到促进,A项错误;只有在25
℃时,才有c(H+)·c(OH-)=1×10-14
mol2·L-2,B项错误;溶液中粒子浓度由大到小的顺序应为c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+),C项错误;根据物料守恒知,D项正确。]
2.下列溶液中粒子的物质的量浓度关系一定正确的是( )
A.常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)>c(H2A)
B.Na2CO3溶液:c(H+)-c(OH-)=c(HCO)+2c(CO)-c(Na+)
C.向NaOH溶液中滴入HCOOH溶液后溶液显碱性:
c(HCOO-)>c(OH-)>c(H+)
D.浓度均为0.1
mol·L-1的HF溶液与KF溶液等体积混合:c(F-)+c(HF)=0.2
mol·L-1
B [pH=9的NaHA溶液呈碱性,说明HA-的水解程度大于其电离程度,故c(H2A)>c(A2-),A项错误;B项等式可整理为c(H+)+c(Na+)=c(HCO)+2c(CO)+c(OH-),符合电荷守恒,B项正确;刚开始向NaOH溶液中滴入HCOOH溶液时,c(OH-)>c(HCOO-),C项错误;等体积混合后,c(F-)+c(HF)=0.1
mol·L-1,D项错误。]
3.常温下,用0.100
0
mol·L-1
NaOH溶液滴定20.00
mL
0.100
0
mol·L-1
CH3COOH溶液所得滴定曲线如图。下列说法不正确的是( )
A.点①所示溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+)
B.点②所示溶液中:c(Na+)=c(CH3COO-)
C.点③所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
D.滴定过程中可能出现:c(CH3COOH)>c(H+)>c(CH3COO-)>c(Na+)>c(OH-)
D [点①所示溶液的溶质为等物质的量的CH3COONa和CH3COOH,所以c(CH3COO-)+c(CH3COOH)=2c(Na+),A选项正确;点②所示溶液的pH=7,说明c(H+)=c(OH-),由电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(CH3COO-)=c(Na+),B选项正确;点③所示溶液表示氢氧化钠与醋酸恰好完全反应,溶质只有CH3COONa,根据物料守恒得:c(CH3COO-)+c(CH3COOH)=c(Na+),C选项正确;滴定过程中始终存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),D项中c(CH3COOH)>c(H+)>c(CH3COO-)>c(Na+)>c(OH-)表明c(H+)+c(Na+)>c(CH3COO-)+c(OH-),不符合电荷守恒,D选项错误。]
4.(2016·四川高考)向1
L含0.01
mol
NaAlO2和0.02
mol
NaOH的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01
molmol时发生的反应是2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO3。下列对应关系正确的是( )
选项
n(CO2)/mol
溶液中离子的物质的量浓度
A
0
c(Na+)>c(AlO)+c(OH-)
B
0.01
c(Na+)>c(AlO)>c(OH-)>c(CO)
C
0.015
c(Na+)>c(HCO)>c(CO)>c(OH-)
D
0.03
c(Na+)>c(HCO)>c(OH-)>c(H+)
D [A.当n(CO2)=0时,根据电荷守恒,c(H+)+c(Na+)=c(AlO)+c(OH-),所以c(Na+)mol时,溶液中溶质为NaAlO2和Na2CO3,因为碳酸酸性强于氢氧化铝,所以偏铝酸根离子水解程度比碳酸根离子强,溶液中离子浓度应为c(Na+)>c(CO)>c(AlO)>c(OH-),B项错误。C.当n(CO2)=0.015
mol时,溶液中溶质为Na2CO3,溶液中离子浓度应为c(Na+)>c(CO)>c(OH-)>c(HCO),C项错误。D.当n(CO2)=0.03
mol时,溶液中溶质为NaHCO3,溶液中离子浓度应为c(Na+)>c(HCO)>c(OH-)>c(H+),D项正确。]
5.(名师押题)pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用负对数值。如某溶液溶质的物质的量浓度为1×10-3
mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下列表达正确的是( )
A.中性溶液中,pC(H+)+pC(OH-)=14
B.pC(H+)=5的H2S溶液中,c(H+)=c(HS-)=1×10-5
mol·L-1
C.pC(OH-)=a的氨水,稀释10倍后,其pC(OH-)=b,则a=b-1
D.pC(OH-)=3的NaOH溶液,稀释100倍,其pC(OH-)=5
D [只有常温下才有pC(H+)+pC(OH-)=14,升高温度时二者之和不等于14,A错误;多元弱酸分步电离,H2S溶液中c(H+)>c(HS-),B错误;氨水是弱碱,稀释10n倍,pC(OH-)增大值小于n个单位,则a≠b-1,C错误;NaOH溶液稀释102倍,则pC(OH-)增大2个单位,D正确。]
6.(名师押题)25
℃时,在50
mL
0.1
mol·L-1的盐酸中逐滴加入0.2
mol·L-1的氨水,溶液pH随所加氨水的体积变化曲线如图。下列说法正确的是( )
A.在A、B之间任意一点都满足:c(Cl-)>c(NH)>c(H+)>c(OH-)
B.在B点:a>25,且c(Cl-)=c(NH)=c(H+)=c(OH-)
C.在C点:c(Cl-)>c(NH)>c(OH-)>c(H+)
D.在D点:c(OH-)+c(NH3·H2O)=c(Cl-)+c(H+)
D [选项A,由图像可知,起始时溶液中盐酸过量,溶液中c(H+)>c(NH),错误。选项B,B点溶液呈中性,则氨水略过量,a>25,但此时c(Cl-)=c(NH)>c(H+)=c(OH-),错误。选项C,在C点氨水过量,则:c(NH)>c(Cl-)>c(OH-)>c(H+),错误。选项D,由物料守恒:c(NH)+c(NH3·H2O)=2c(Cl-)和电荷守恒:c(NH)+c(H+)=c(OH-)+c(Cl-)即可得:c(OH-)+c(NH3·H2O)=c(Cl-)+c(H+),正确。]
分析溶液中微粒浓度关系的思维模型
提炼1 电离平衡及应用
1.弱电解质只进行微弱电离,发生电离的弱电解质及产生的离子都是少量的,同时注意考虑水的电离
如0.1
mol/L的氨水中,由于存在电离平衡:NH3·H2O??NH+OH-、H2O??H++OH-,所以溶液中微粒浓度的关系为
c(NH3·H2O)>c(OH-)>c(NH)>c(H+)。
2.多元弱酸的电离分步进行,主要以第一步电离为主
如H2S溶液中,由于存在电离平衡:H2S??HS-+H+、HS-??S2-+H+、H2O??H++OH-,所以溶液中微粒浓度关系为c(H2S)>c(H+)>c(HS-)>c(S2-)。
3.电离平衡常见影响因素分析
(以CH3COOH??CH3COO-+H+为例)
改变条件
平衡移动方向
c(H+)
Ka
升高温度
正向移动
增大
增大
加水稀释
正向移动
减小
不变
加冰醋酸
正向移动
增大
不变
加浓盐酸
逆向移动
增大
不变
加入烧碱
正向移动
减小
不变
4.相同pH、相同体积的一元强酸与一元弱酸溶液的比较
5.溶液的酸碱性判断的最根本的标准是比较溶液中c(H+)和c(OH-)的相对大小,而pH=7或c(H+)=1×10-7
mol·L-1,仅仅是在室温下的特例,因此在使用pH判断溶液酸碱性时,要特别注意温度条件。
提炼2 水解平衡及应用
1.水解是微弱的
如浓度为0.1
mol/L、pH=5.5的(NH4)2SO4溶液中,由于c(H+)水=c(OH-)水,而水电离产生的一部分OH-与很少量的NH结合产生NH3·H2O,所以溶液中微粒浓度关系为c(NH)>c(SO)>c(H+)>c(NH3·H2O)>c(OH-)。
2.盐溶液的酸碱性
(1)正盐:谁弱谁水解,谁强显谁性。
强碱弱酸盐(如CH3COONa)―→弱酸根离子水解→结果:c(OH-)>c(H+)。
强酸弱碱盐(如NH4Cl)―→弱碱阳离子水解→结果:c(H+)>c(OH-)。
(2)酸式盐溶液
3.盐类水解的离子方程式
(1)多元弱酸盐的水解分步进行,以第一步为主,一般只写第一步水解的离子方程式,如Na2CO3水解的离子方程式:CO+H2O??HCO+OH-。
(2)多元弱碱阳离子的水解方程式一步写完,如FeCl3水解的离子方程式:Fe3++3H2O??Fe(OH)3+3H+。
(3)能完全水解的离子组,由于水解程度较大,书写时要用“===”“↑”“↓”等,如NaHCO3与AlCl3混合溶液反应的离子方程式:Al3++3HCO===Al(OH)3↓+3CO2↑。
如在Na2CO3溶液中存在着Na+、CO、H+、OH-、HCO,它们存在如下关系:c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-)。
(2)物料守恒规律
电解质溶液中,由于某些离子能水解或电离,粒子种类增多,但某些关键性的原子总是守恒的。
c(Na+)=2[c(CO)+c(HCO)+c(H2CO3)]
(3)质子守恒规律
电解质溶液中,电离、水解等过程中得到的质子(H+)数等于失去的质子(H+)数。
如Na2CO3溶液中质子守恒关系可以用图示分析如下:
由得失氢离子守恒可得:c(OH-)=c(H+)+c(HCO)+2c(H2CO3)。
提炼3 沉淀溶解平衡及应用1.沉淀溶解平衡常数——溶度积
(1)表达式:对于溶解平衡MmAn(s)??mMn+(aq)+nAm-(aq)
Ksp=[c(Mn+)]m·[c(Am-)]n。
(2)意义:溶度积(Ksp)反映了物质在水中的溶解能力。
(3)影响因素:溶度积常数只与难溶性电解质的性质和温度有关,而与沉淀的量和溶液中离子的浓度无关。
2.溶度积的应用
通过比较溶度积与溶液中有关离子浓度幂的乘积——离子积(Qc)的相对大小,判断难溶电解质在给定条件下能否生成或溶解:
当Qc>Ksp时,溶液为过饱和溶液,沉淀析出。
当Qc=Ksp时,溶液为饱和溶液,处于平衡状态。
当Qc
(1)用溶度积直接比较难溶电解质的溶解能力时,物质的类型(如AB型、A2B型、AB2型等)必须相同。
(2)对于同类型物质,Ksp数值越大,难溶电解质在水中的溶解能力越强;当一种离子和其他几种离子都可能产生沉淀时,Ksp越小,沉淀越容易生成。
(3)对于不同类型的物质,当Ksp相差不大时不能直接作为比较依据,如常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,不能判断前者溶解度大。
(4)沉淀的转化过程中一般是溶解度大的易转化为溶解度小的,但也可以使溶解度小的沉淀转化成溶解度大的沉淀,如用饱和Na2CO3溶液浸泡重晶石(BaSO4)可制备溶于酸的钡盐BaCO3。
回访1 (2016·全国乙卷)298
K时,在20.0
mL
0.10
mol·L-1氨水中滴入0.10
mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10
mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0
mL
C.M点处的溶液中c(NH)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
D [A项用0.10
mol·L-1盐酸滴定20.0
mL
0.10
mol·L-1氨水,二者恰好完全反应时生成强酸弱碱盐NH4Cl,应选用甲基橙作指示剂。B项当V(HCl)=20.0
mL时,二者恰好完全反应生成NH4Cl,此时溶液呈酸性,而图中M点溶液的pH=7,故M点对应盐酸的体积小于20.0
mL。C项M点溶液呈中性,则有c(H+)=c(OH-);据电荷守恒可得c(H+)+c(NH)=c(OH-)+c(Cl-),则有c(NH)=c(Cl-),此时溶液中离子浓度关系为c(NH)=c(Cl-)>c(H+)=c(OH-)。D项NH3·H2O为弱电解质,部分发生电离,N点时V(HCl)=0,此时氨水的电离度为1.32%,则有c(OH-)=0.10
mol·L-1×1.32%=1.32×10-3
mol·L-1,c(H+)==
mol·L-1≈7.58×10-12
mol·L-1,故N点处的溶液中pH<12。]
回访2 (2014·新课标全国卷Ⅰ)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示。下列说法错误的是( )
A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60
℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
A [A.由题图可知,随着温度升高,溴酸银的溶解度逐渐增大,因此AgBrO3的溶解是吸热过程。B.温度越高物质的溶解速率越快。C.由溶解度曲线可知,60
℃时AgBrO3的溶解度约为0.6
g,则其物质的量浓度约为0.025
mol·L-1,AgBrO3的Ksp=c(Ag+)·c(BrO)=0.025×0.025≈6×10-4。D.若KNO3中含有少量AgBrO3,可通过蒸发浓缩得到KNO3的饱和溶液,再冷却结晶获得KNO3晶体,而AgBrO3留在母液中。]
热点题型1 滴定曲线分析及应用
1.(2016·河北石家庄调研)用0.1
mol/L
NaOH溶液滴定10
mL
0.1
mol/L
H2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法错误的是( )
A.A点溶液中加入少量水:增大
B.B点:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.C点:c(Na+)=c(HA-)+2c(A2-)
D.水电离出来的c(OH-):B>D
D [向H2A溶液中加入少量水,H2A、H+的浓度均减小,==,则增大,故A正确;10
mL
0.1
mol/L
NaOH溶液与10
mL
0.1
mol/L
H2A溶液反应恰好生成NaHA,此时溶液呈酸性,HA-的电离程度大于其水解程度,所以B点有c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B正确;根据电荷守恒,c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),C点溶液呈中性,所以c(Na+)=c(HA-)+2c(A2-),故C正确;D点H2A与氢氧化钠恰好反应生成Na2A,A2-水解促进水的电离,B点为NaHA溶液,HA-电离使溶液呈酸性,抑制水的电离,所以水电离出来的c(OH-):B
mL
0.1
mol·L-1
MOH溶液中滴加0.1
mol·L-1盐酸,混合溶液的pH与所加盐酸体积的关系如图所示。下列推断正确的是( )
A.MOH是强电解质
B.a点对应的溶液中:c(Cl-)>c(M+)>c(OH-)>c(H+)
C.b点对应的溶液中:c(Cl-)>c(M+)>c(H+)>c(OH-)
D.曲线上任意点所对应的溶液中都有c(H+)=c(OH-)+c(MOH)
C [A项,从图像中起点的pH和MOH溶液的浓度知,MOH是弱电解质,错误;B项,a点对应的溶液中:c(M+)>c(Cl-)>c(OH-)>c(H+),错误;C项,b点时,二者恰好完全中和生成MCl,MCl水解,溶液呈酸性,溶液中离子浓度关系为c(Cl-)>c(M+)>c(H+)>c(OH-),正确;D项,只有b点对应的溶液中,存在质子守恒式:c(H+)=c(OH-)+c(MOH),错误。]
3.25
℃时,用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),所需S2-最低浓度的对数值lg
c(S2-)与lg
c(M2+)
的关系如图所示。下列说法正确的是( )
A.Ksp(CuS)约为1.0×10-20
B.向Cu2+浓度为10-5
mol·L-1的废水中加入ZnS粉末,会有CuS沉淀析出
C.向100
mL浓度均为10-5
mol·L-1的Cu2+、Mn2+、Fe2+、Zn2+的混合溶液中逐滴加入10-4
mol·L-1的Na2S溶液,Zn2+先沉淀
D.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
B [根据CuS对应的点(-25,-10)计算,c(S2-)=10-25
mol·L-1,c(Cu2+)=10-10
mol·L-1,故Ksp(CuS)=c(S2-)·c(Cu2+)=10-25×10-10=10-35,A项错误;图上的点越向右,说明c(S2-)越大,同理,图上的点越向上,说明c(M2+)越大,故Ksp(CuS)
mol·L-1的Na2S溶液时,Cu2+先沉淀,C项错误;在Na2S溶液中,由物料守恒知2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),D项错误。]
4.(2016·天津高考)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1
mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
C [根据起点pH:HA
巧抓“四个点”突破滴定曲线问题
1.抓反应“一半”点,判断是什么溶质的等量混合。
2.抓“恰好”反应点,生成什么溶质,溶液呈什么性,是什么因素造成的。
3.抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足。
4.抓反应“过量”点,溶质是什么,判断谁多、谁少还是等量。
热点题型2 溶液中离子平衡的影响因素
1.(2016·安徽合肥质检)常温下,下列有关电解质溶液的叙述中错误的是( )
A.某H2SO4溶液中=1.0×10-8,由水电离出的c水(H+)=1×10-11
mol·L-1
B.将0.02
mol·L-1盐酸与0.02
mol·L-1
Ba(OH)2溶液等体积混合后,溶液pH约为12
C.将一定体积稀盐酸与稀氨水混合,当溶质为NH3·H2O和NH4Cl时,溶液的pH≥7
D.向0.1
mol·L-1
Na2CO3溶液中逐滴滴加0.1
mol·L-1稀盐酸,溶液中c(HCO)先增大后减小
C [A项,结合Kw进行计算,c(H+)=10-3
mol·L-1,则水电离的c水(H+)=c(OH-)=1×10-11
mol·L-1,正确;B项,等体积混合后c(OH-)=
mol·L-1=0.01
mol·L-1,正确;D项,Na2CO3溶液中滴加稀盐酸,发生反应依次为:CO+H+===HCO、HCO+H+===CO2↑+H2O,故c(HCO)先增大后减小,正确;C项,氨水和稀盐酸混合,当溶质为NH3·H2O和NH4Cl时,因两者相对量的不同,溶液的pH可能大于7、可能等于7也可能小于7,错误。]
2.(2016·河南八市质检)25
℃时,用蒸馏水稀释1
mol/L醋酸,下列各项始终保持增大趋势的是( )
A.
B.
C.
D.
c(H+)·c(CH3COO-)
A [稀释过程中,c(CH3COO-)和c(H+)减小,c(OH-)增大,故A项正确;加水稀释,CH3COOH对水的抑制效果减弱,故c(H+)减小幅度小于c(CH3COO-),减小;=,稀释过程中c(H+)减小,故C项错误;稀释过程中,c(CH3COO-)和c(H+)均减小,故c(CH3COO-)·c(H+)减小,故D项错误。]
3.(2015·广东高考)一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
C [A.c点溶液中c(OH-)>c(H+),溶液呈碱性,升温,溶液中c(OH-)不可能减小。B.由b点对应c(H+)与c(OH-)
可知,Kw=c(H+)·c(OH-)=1.0×10-7×1.0×10-7=1.0×10-14。C.FeCl3溶液水解显酸性,溶液中c(H+)增大,因一定温度下水的离子积是常数,故溶液中c(OH-)减小,因此加入FeCl3溶液可能引起由b向a的变化。D.c点溶液呈碱性,稀释时c(OH-)减小,同时c(H+)应增大,故稀释溶液时不可能引起由c向d的转化。]
4.(2016·湖北武汉调研)浓度均为0.1
mol/L、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg的变化关系如图所示。下列叙述正确的是( )
A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH-):a
D.当lg=3时,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则减小
B [根据题图分析,当lg=0时,HX溶液的pH>1,说明HX部分电离,为弱电解质,HY溶液的pH=1,说明其完全电离,为强电解质,A错误;酸或碱抑制水的电离,酸中的氢离子浓度越小,其抑制水电离的程度越小,根据题图分析,b点溶液中氢离子浓度小于a点,则水的电离程度a
A.将pH=2的盐酸和pH=5的稀硫酸等体积混合,混合液的pH=3.5
B.将pH=11的NaOH溶液和pH=13的Ba(OH)2溶液等体积混合,混合液的pH=12
C.将pH=2的H2X溶液稀释至原来的1
000倍,得到混合溶液的pH=5
D.将pH=1的盐酸和0.1
mol·L-1的Ba(OH)2溶液等体积混合,混合液的pH=12.7
D [常温下,水的离子积Kw=1×10-14。A项,混合液中c(H+)=≈5×10-3
mol·L-1,pH≈2.3,错误。B项,c(OH-)=≈0.05
mol·L-1,c(H+)==
mol·L-1=2×10-13
mol·L-1,pH≈12.7,错误。C项,若H2X为强酸,则稀释后溶液的pH=5;若H2X为弱酸,则稀释后溶液的pH<5,错误。D项,c(OH-)==0.05
mol·L-1,c(H+)==
mol·L-1=2×10-13
mol·L-1,pH≈12.7,正确。]
溶液pH计算的一般思维模型
热点题型3 离子浓度大小的比较
1.T
℃时,某浓度醋酸钠溶液的pH=10,下列说法一定正确的是( )
A.溶液中由水电离出的c(OH-)=1×10-10
mol·L-1
B.溶液中存在:c(H+)·c(OH-)=1×10-14
mol2·L-2
C.溶液中存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)>c(CH3COOH)
D.溶液中存在:c(CH3COOH)+c(CH3COO-)=c(Na+)
D [醋酸钠溶液中水的电离平衡受到促进,A项错误;只有在25
℃时,才有c(H+)·c(OH-)=1×10-14
mol2·L-2,B项错误;溶液中粒子浓度由大到小的顺序应为c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+),C项错误;根据物料守恒知,D项正确。]
2.下列溶液中粒子的物质的量浓度关系一定正确的是( )
A.常温下,pH=9的NaHA溶液:c(Na+)>c(HA-)>c(A2-)>c(H2A)
B.Na2CO3溶液:c(H+)-c(OH-)=c(HCO)+2c(CO)-c(Na+)
C.向NaOH溶液中滴入HCOOH溶液后溶液显碱性:
c(HCOO-)>c(OH-)>c(H+)
D.浓度均为0.1
mol·L-1的HF溶液与KF溶液等体积混合:c(F-)+c(HF)=0.2
mol·L-1
B [pH=9的NaHA溶液呈碱性,说明HA-的水解程度大于其电离程度,故c(H2A)>c(A2-),A项错误;B项等式可整理为c(H+)+c(Na+)=c(HCO)+2c(CO)+c(OH-),符合电荷守恒,B项正确;刚开始向NaOH溶液中滴入HCOOH溶液时,c(OH-)>c(HCOO-),C项错误;等体积混合后,c(F-)+c(HF)=0.1
mol·L-1,D项错误。]
3.常温下,用0.100
0
mol·L-1
NaOH溶液滴定20.00
mL
0.100
0
mol·L-1
CH3COOH溶液所得滴定曲线如图。下列说法不正确的是( )
A.点①所示溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+)
B.点②所示溶液中:c(Na+)=c(CH3COO-)
C.点③所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
D.滴定过程中可能出现:c(CH3COOH)>c(H+)>c(CH3COO-)>c(Na+)>c(OH-)
D [点①所示溶液的溶质为等物质的量的CH3COONa和CH3COOH,所以c(CH3COO-)+c(CH3COOH)=2c(Na+),A选项正确;点②所示溶液的pH=7,说明c(H+)=c(OH-),由电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则c(CH3COO-)=c(Na+),B选项正确;点③所示溶液表示氢氧化钠与醋酸恰好完全反应,溶质只有CH3COONa,根据物料守恒得:c(CH3COO-)+c(CH3COOH)=c(Na+),C选项正确;滴定过程中始终存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),D项中c(CH3COOH)>c(H+)>c(CH3COO-)>c(Na+)>c(OH-)表明c(H+)+c(Na+)>c(CH3COO-)+c(OH-),不符合电荷守恒,D选项错误。]
4.(2016·四川高考)向1
L含0.01
mol
NaAlO2和0.02
mol
NaOH的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01
mol
选项
n(CO2)/mol
溶液中离子的物质的量浓度
A
0
c(Na+)>c(AlO)+c(OH-)
B
0.01
c(Na+)>c(AlO)>c(OH-)>c(CO)
C
0.015
c(Na+)>c(HCO)>c(CO)>c(OH-)
D
0.03
c(Na+)>c(HCO)>c(OH-)>c(H+)
D [A.当n(CO2)=0时,根据电荷守恒,c(H+)+c(Na+)=c(AlO)+c(OH-),所以c(Na+)
mol时,溶液中溶质为Na2CO3,溶液中离子浓度应为c(Na+)>c(CO)>c(OH-)>c(HCO),C项错误。D.当n(CO2)=0.03
mol时,溶液中溶质为NaHCO3,溶液中离子浓度应为c(Na+)>c(HCO)>c(OH-)>c(H+),D项正确。]
5.(名师押题)pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用负对数值。如某溶液溶质的物质的量浓度为1×10-3
mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下列表达正确的是( )
A.中性溶液中,pC(H+)+pC(OH-)=14
B.pC(H+)=5的H2S溶液中,c(H+)=c(HS-)=1×10-5
mol·L-1
C.pC(OH-)=a的氨水,稀释10倍后,其pC(OH-)=b,则a=b-1
D.pC(OH-)=3的NaOH溶液,稀释100倍,其pC(OH-)=5
D [只有常温下才有pC(H+)+pC(OH-)=14,升高温度时二者之和不等于14,A错误;多元弱酸分步电离,H2S溶液中c(H+)>c(HS-),B错误;氨水是弱碱,稀释10n倍,pC(OH-)增大值小于n个单位,则a≠b-1,C错误;NaOH溶液稀释102倍,则pC(OH-)增大2个单位,D正确。]
6.(名师押题)25
℃时,在50
mL
0.1
mol·L-1的盐酸中逐滴加入0.2
mol·L-1的氨水,溶液pH随所加氨水的体积变化曲线如图。下列说法正确的是( )
A.在A、B之间任意一点都满足:c(Cl-)>c(NH)>c(H+)>c(OH-)
B.在B点:a>25,且c(Cl-)=c(NH)=c(H+)=c(OH-)
C.在C点:c(Cl-)>c(NH)>c(OH-)>c(H+)
D.在D点:c(OH-)+c(NH3·H2O)=c(Cl-)+c(H+)
D [选项A,由图像可知,起始时溶液中盐酸过量,溶液中c(H+)>c(NH),错误。选项B,B点溶液呈中性,则氨水略过量,a>25,但此时c(Cl-)=c(NH)>c(H+)=c(OH-),错误。选项C,在C点氨水过量,则:c(NH)>c(Cl-)>c(OH-)>c(H+),错误。选项D,由物料守恒:c(NH)+c(NH3·H2O)=2c(Cl-)和电荷守恒:c(NH)+c(H+)=c(OH-)+c(Cl-)即可得:c(OH-)+c(NH3·H2O)=c(Cl-)+c(H+),正确。]
分析溶液中微粒浓度关系的思维模型
同课章节目录
