2017届高三化学(通用版)二轮复习教案:专题4 突破点16 化学实验基础
文档属性
| 名称 | 2017届高三化学(通用版)二轮复习教案:专题4 突破点16 化学实验基础 | 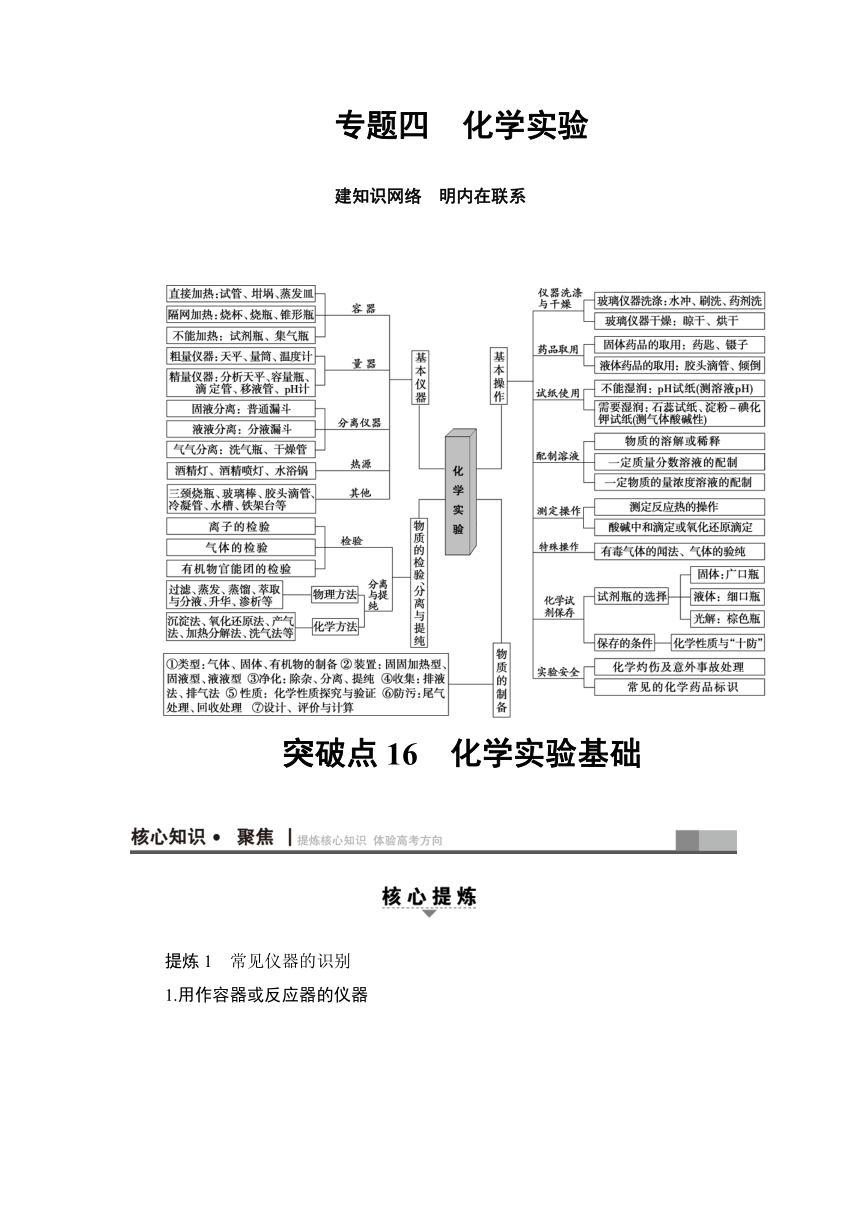 | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-01-17 06:34:18 | ||
图片预览



文档简介
专题四 化学实验
建知识网络 明内在联系
突破点16 化学实验基础
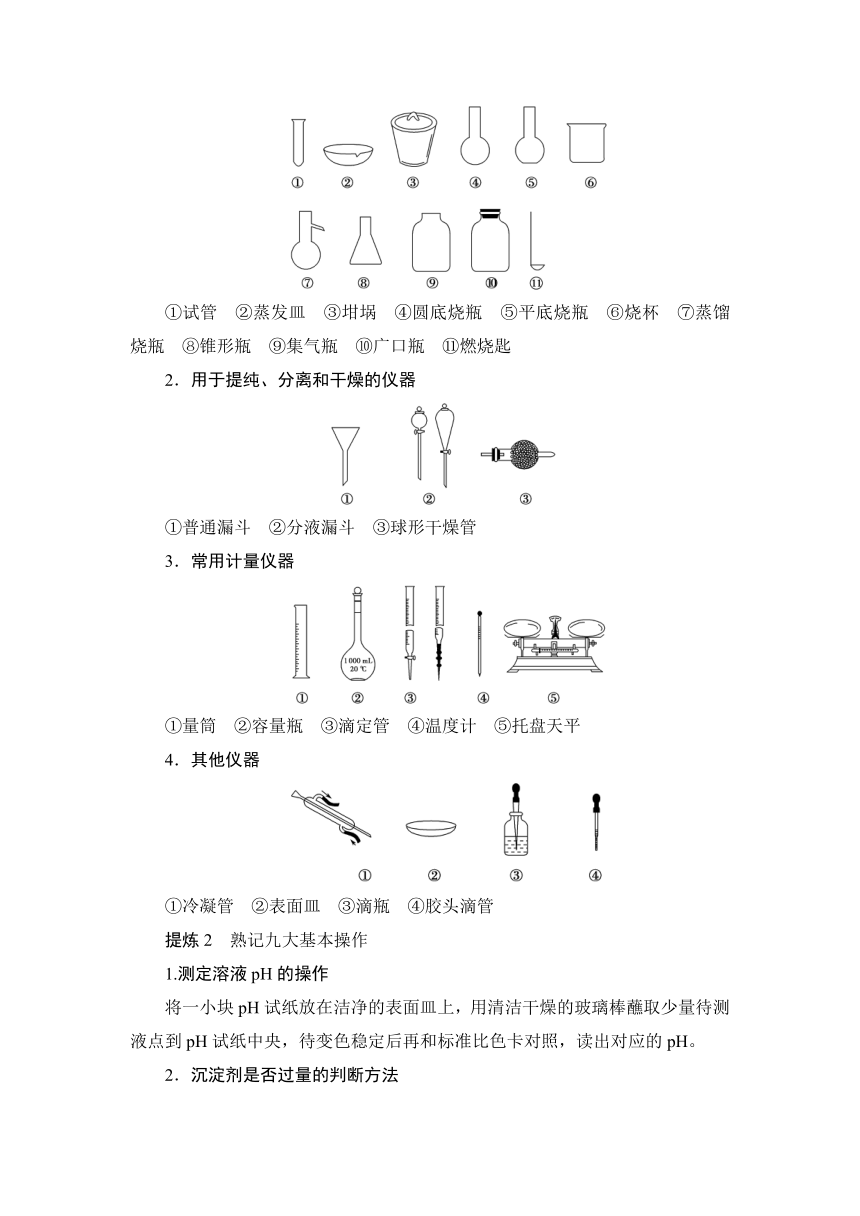
提炼1 常见仪器的识别
1.用作容器或反应器的仪器
①试管 ②蒸发皿 ③坩埚 ④圆底烧瓶 ⑤平底烧瓶 ⑥烧杯 ⑦蒸馏烧瓶 ⑧锥形瓶 ⑨集气瓶 ⑩广口瓶 燃烧匙
2.用于提纯、分离和干燥的仪器
①普通漏斗 ②分液漏斗 ③球形干燥管
3.常用计量仪器
①量筒 ②容量瓶 ③滴定管 ④温度计 ⑤托盘天平
4.其他仪器
①冷凝管 ②表面皿 ③滴瓶 ④胶头滴管
提炼2 熟记九大基本操作
1.测定溶液pH的操作
将一小块pH试纸放在洁净的表面皿上,用清洁干燥的玻璃棒蘸取少量待测液点到pH试纸中央,待变色稳定后再和标准比色卡对照,读出对应的pH。
2.沉淀剂是否过量的判断方法
(1)静置,向上层清液中继续滴加少量沉淀剂,若无沉淀产生,则证明沉淀剂已过量,否则沉淀剂不过量。
(2)静置,取上层清液适量于另一洁净试管中,向其中加入少量与沉淀剂作用产生沉淀的试剂,若产生沉淀,证明沉淀剂已过量,否则沉淀剂不过量。
3.洗涤沉淀操作
把蒸馏水沿着玻璃棒注入到过滤器中至浸没沉淀,静置,使蒸馏水滤出,重复2~3次即可。
4.判断沉淀是否洗净的操作
取最后一次洗涤液,滴加……(试剂),若没有……现象,证明沉淀已经洗净。
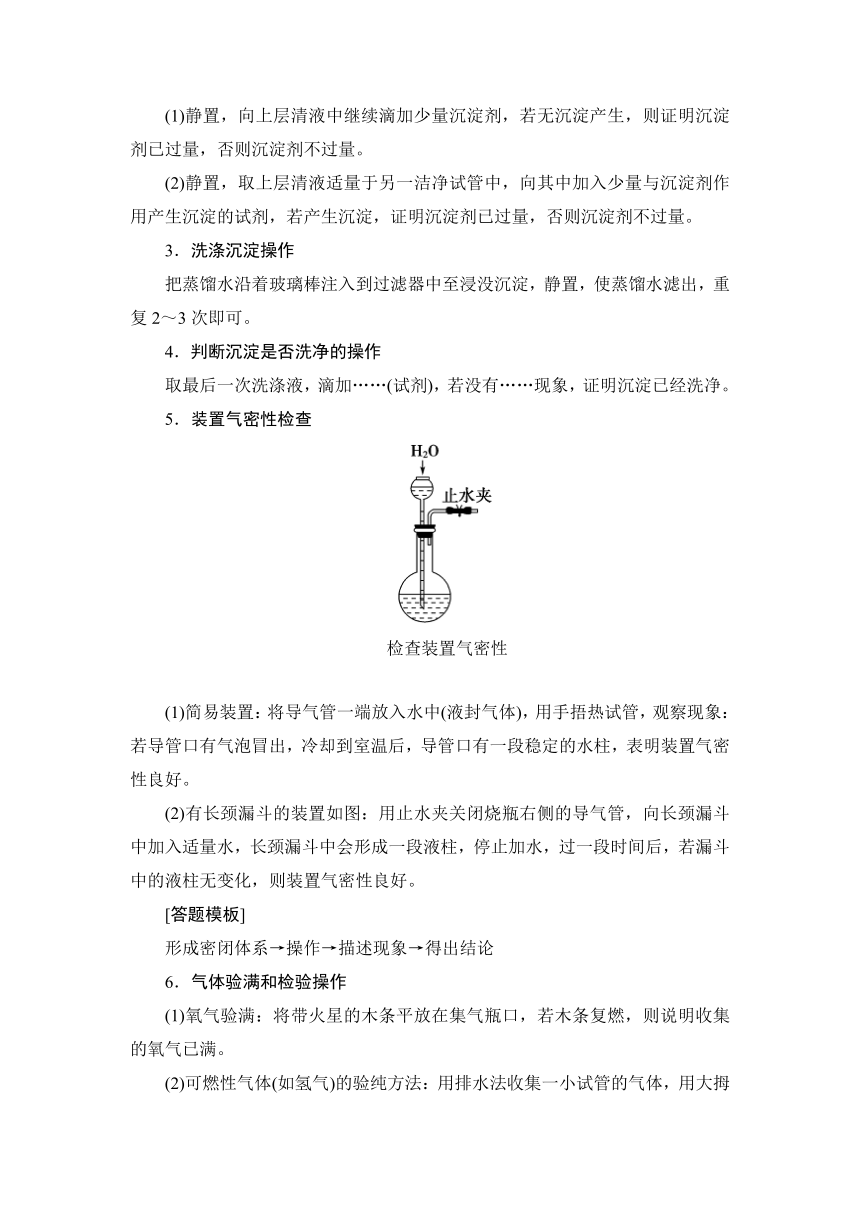
5.装置气密性检查
检查装置气密性
(1)简易装置:将导气管一端放入水中(液封气体),用手捂热试管,观察现象:若导管口有气泡冒出,冷却到室温后,导管口有一段稳定的水柱,表明装置气密性良好。
(2)有长颈漏斗的装置如图:用止水夹关闭烧瓶右侧的导气管,向长颈漏斗中加入适量水,长颈漏斗中会形成一段液柱,停止加水,过一段时间后,若漏斗中的液柱无变化,则装置气密性良好。
[答题模板]
形成密闭体系→操作→描述现象→得出结论
6.气体验满和检验操作
(1)氧气验满:将带火星的木条平放在集气瓶口,若木条复燃,则说明收集的氧气已满。
(2)可燃性气体(如氢气)的验纯方法:用排水法收集一小试管的气体,用大拇指摁住管口移近火焰,放开手指,若听到尖锐的爆鸣声,则气体不纯;若听到轻微的“噗”的一声,则气体纯净。
(3)二氧化碳验满:将燃着的木条平放在集气瓶口,若火焰熄灭,则气体已满。
(4)氨气验满:用湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝说明气体已满。
(5)氯气验满:用湿润的淀粉 碘化钾试纸放在集气瓶口,若试纸变蓝说明气体已满。
7.浓H2SO4稀释操作
将浓H2SO4沿烧杯壁缓缓注入水中,并用玻璃棒不断搅拌。
8.粗盐的提纯
(1)实验室提纯粗盐的实验操作依次为取样、溶解、沉淀、过滤、蒸发、冷却结晶、过滤、烘干。
(2)若过滤时发现滤液中有少量浑浊,从实验操作的角度分析,可能的原因是过滤时漏斗中液面高出滤纸边缘、玻璃棒靠在单层滤纸一边弄破滤纸。
9.从某物质稀溶液中结晶的实验操作
(1)溶解度受温度影响较小的:蒸发→结晶→过滤。
(2)溶解度受温度影响较大或带结晶水的:蒸发浓缩→冷却结晶→过滤。
提炼3 实验安全与事故处理
1.实验室常见事故处理方法
实验事故
处理方法
Na着火
用沙土覆盖灭火,不能用泡沫灭火器或干粉灭火器灭火
浓硫酸溅到皮肤上
用干净的布擦拭并用大量水冲洗,再涂稀碳酸氢钠溶液,严重者立即送往医院
浓碱液溅到皮肤上
先用大量清水冲洗,然后涂抹稀醋酸或硼酸
含汞的温度计被打破
大滴汞先收集于密闭容器中,然后用硫粉撒在汞散落的地方
2.危险化学品的处理方法
危险化学品
处理方法
NH3、Cl2、SO2等有毒尾气
用合适的试剂吸收且要防倒吸,不能随意排放
H2、CH4、CO等易燃尾气
点燃或收集,点燃前要先检验气体的纯度
Na、K
保存于煤油中,以防氧化或着火
液溴
需加水液封,另外还需要密封以防挥发
易挥发、易燃、易爆有机物
密封保存,以防挥发被引燃、引爆
强氧化剂与强还原剂
分开保存,以防倾倒时发生剧烈反应
回访1 判断正误(正确打“√”,错误打“×”)
(1)(2016·全国甲卷)分别将少量钠投入盛有水和乙醇的烧杯中,比较水和乙醇中氢的活泼性。( )
(2)(2016·全国乙卷)配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释。( )
(3)(2016·全国丙卷)配制稀硫酸时,先将浓硫酸加入烧杯中,后倒入蒸馏水。( )
[解析] (3)稀释浓硫酸时,一定要将浓硫酸沿烧杯内壁缓缓注入水中,并不断用玻璃棒搅拌。
[答案] (1)√ (2)√ (3)×
回访2 (2014·新课标全国卷Ⅰ)下列有关仪器使用方法或实验操作正确的是( )
A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B.酸式滴定管装标准溶液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
B [A.容量瓶是定量实验仪器,洗净后自然晾干,不能放进烘箱中烘干。
B.酸式滴定管用于准确量取溶液的体积,先用蒸馏水洗净后,再用待装溶液润洗2~3次,否则将导致待装溶液的浓度偏小,影响实验结果。
C.锥形瓶用蒸馏水洗涤后,直接加入待滴定溶液,若用待滴定溶液润洗,所含溶质的量增大,消耗标准溶液的体积增大,测得实验结果偏高。
D.配制溶液时,加水超过刻度线,应重新配制,若用滴管吸出多余部分,所得溶液的浓度将偏低。]
回访3 (2014·新课标全国卷Ⅰ)利用下图所示装置进行下列实验,能得出相应实验结论的是( )
B [分析①和②中物质发生的反应以及所产生的气体与③中物质的反应,根据相关现象得出实验结论。
A.Na2S与稀硫酸发生反应:Na2S+H2SO4===Na2SO4+H2S↑,H2S气体通过导管进入③,产生Ag2S黑色沉淀,可能是H2S与AgNO3反应的结果,不能得出Ksp(AgCl)>Ksp(Ag2S)。
B.浓硫酸使蔗糖发生脱水炭化,并与生成的碳发生氧化还原反应,生成CO2、SO2和H2O,混合气体通过导管进入③,其中SO2与溴水发生反应:SO2+Br2+2H2O===H2SO4+2HBr,该过程中浓硫酸体现脱水性和强氧化性。
C.稀盐酸与Na2SO3发生反应:Na2SO3+2HCl===2NaCl+SO2↑+H2O,SO2与Ba(NO3)2溶液发生氧化还原反应生成BaSO4沉淀,若③中为BaCl2等可溶性钡盐,则不能生成沉淀。
D.浓硝酸与Na2CO3发生反应:Na2CO3+2HNO3===2NaNO3+CO2↑+H2O,说明HNO3的酸性强于H2CO3,③中Na2SiO3溶液产生白色沉淀,但不能据此证明H2CO3的酸性强于H2SiO3,其原因是浓硝酸具有强挥发性,挥发出的HNO3气体与CO2一并进入Na2SiO3溶液,且均能与其发生反应而产生H2SiO3沉淀。]
热点题型1 基本仪器评价型
1.下列关于仪器的选择或使用正确的是( )
A.用量筒量取15.00
mL
NaOH溶液
B.用陶瓷坩埚高温煅烧CaCO3固体
C.洗净的试管、滴定管和容量瓶可以放进烘箱烘干
D.中和热测定实验中需要用到的玻璃仪器只有烧杯、温度计和环形玻璃搅拌棒三种
B [量筒无法量取15.00
mL
NaOH溶液,应选用量程为25.00
mL的碱式滴定管,A项错误;CaCO3固体分解需用耐高温的仪器,故陶瓷坩埚可以高温煅烧CaCO3固体,B项正确;试管洗净之后可烘干,而滴定管、容量瓶为精量仪器需晾干,不可烘干以防影响其精确度,C项错误;中和热测定实验中用到的玻璃仪器有大小烧杯、量筒、温度计、环形玻璃搅拌棒,D项错误。]
2.(2016·杭州第一次质量检测)为完成相应实验,实验器材(规格和数量不限)足够的一项是( )
相应实验
实验仪器和用品(夹持装置省略)
A
氯化钠溶液的蒸发结晶
烧杯、玻璃棒、酒精灯
B
用盐酸除去硫酸钡中的少量碳酸钡
烧杯、胶头滴管
C
配制0.5
mol·L-1的硫酸溶液
烧杯、玻璃棒、胶头滴管、容量瓶
D
用CCl4萃取溴水中的溴
分液漏斗、烧杯
D [A项,蒸发操作实验仪器还缺少蒸发皿,错误;B项,过滤装置中缺少漏斗、玻璃棒和滤纸,错误;C项,配制硫酸溶液,缺少量筒,错误;D项,做萃取实验,只用分液漏斗和烧杯,正确。]
3.下列制备和收集气体的实验装置合理的是( )
D [A.用NH4Cl与Ca(OH)2固体混合加热制取氨气,试管口要略向下倾斜,错误;B.用Cu与稀硝酸发生反应产生NO,NO容易与空气中的氧气发生反应,因此不能用排空气的方法收集,错误;C.Zn与稀硫酸发生反应产生氢气,由于氢气的密度比空气小,因此应该用向下排空气的方法收集,错误;D.H2O2在MnO2作催化剂时发生分解反应产生O2,由于O2微溶于水,因此可以用排水的方法收集,正确。]
4.(名师押题)下列对应仪器使用合理的是( )
A.甲:将FeSO4溶液滴加到NaOH溶液中,观察Fe(OH)2的颜色
B.乙:用托盘天平称量NaOH固体20.0
g,配制980
mL
0.5
mol/L
NaOH溶液
C.丙:加热NaHCO3固体,检验NaHCO3固体的热稳定性
D.丁:向蒸馏烧瓶中加入碎瓷片、乙醇、浓硫酸,加热至170
℃制乙烯
D [为防止滴入的液滴带入氧气,应将吸有NaOH溶液的长胶头滴管插入新制FeSO4溶液中,缓缓挤出NaOH溶液才能看到白色的Fe(OH)2沉淀,A项错误。NaOH易潮解,称量时应该放在小烧杯中或表面皿中,一般左盘放被称量的物质,右盘放砝码,B项错误。NaHCO3固体受热分解的产物中含水蒸气,冷凝之后液态水倒流会引起试管炸裂,故试管口应略向下倾斜,C项错误。检查装置气密性后,按顺序加入碎瓷片、乙醇、浓硫酸,加热至170
℃可制得乙烯,D项正确。]
1.化学实验中的几个数据
2.几种操作的“第一步”
(1)检查装置的气密性——制取气体、验证气体的性质等与气体有关的实验操作。
(2)检查是否漏水——滴定管、容量瓶、分液漏斗等的使用。
(3)调“0”点——天平等的使用。
(4)验纯——点燃可燃性气体。
(5)分别取少量溶液——未知溶液的鉴别。
(6)润湿——用红色石蕊试纸、蓝色石蕊试纸、碘化钾淀粉试纸检验或验证某些气体时。
热点题型2 实验目的判断型
1.(2016·济南调研)利用表中提供的仪器和药品,能达到相应实验目的的是( )
选项
仪器
药品
实验目的
A
烧杯、玻璃棒、胶头滴管
FeCl3溶液、NaOH溶液
制Fe(OH)3胶体
B
圆底烧瓶、导气管、烧杯、铁架台
干燥的二氧化碳气体、蒸馏水
模拟喷泉实验
C
酸式滴定管、锥形瓶、铁架台(带铁夹)
已知浓度的盐酸、待测NaOH溶液
测定NaOH溶液的物质的量浓度
D
酒精灯、玻璃棒、蒸发皿、三脚架
NaCl溶液
蒸发溶液得到晶体
D [A项错误,制备氢氧化铁胶体,应将饱和氯化铁溶液滴入沸水中,所以缺少了酒精灯、多了烧碱溶液;B项错误,二氧化碳仅仅能溶于水而非易溶于水,无法形成喷泉现象;C项错误,缺少碱式滴定管,没法准确量取一定体积的待测液且无指示剂;D项正确,仪器完备、操作精准。]
2.下列实验操作正确并能达到实验目的的是( )
A [ω(NaCl)=×100%=5%,将氯化钠加水搅拌均匀即可,A项正确。容量瓶不能用于溶解固体,B项错误。滴定读数时,视线应与凹液面最低点相切,俯视、仰视都会引起误差,C项错误。胶体粒子可以透过滤纸,故过滤无法除去氢氧化铁胶体中的小分子及离子,D项错误。]
3.(2016·南通调研)下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是( )
A.用图甲装置制取并收集二氧化硫
B.用图乙装置向反应后的混合物中加水稀释
C.用图丙装置过滤出稀释后混合物中的不溶物
D.用图丁装置将硫酸铜溶液蒸发浓缩后冷却结晶
D [A项,SO2的密度比空气大,收集时,应“长进短出”,且SO2会污染空气,应使用尾气吸收装置,错误;B项,反应后的溶液中含有浓H2SO4,将水加入混合物中稀释时,会引发暴沸,应将混合物加入水中,错误;C项,过滤时,应用玻璃棒引流,错误;D项,烧杯可以用于蒸发浓缩,无需用蒸发皿(用于蒸发结晶),正确。]
4.(名师押题)下列实验能达到实验目的的是( )
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
D [图1中的NaOH溶液与Cl2、HCl均发生反应,A项错误。在蒸发结晶时,溶质在较高温度下不发生变质的方能采用蒸发皿蒸发结晶,溶质在较高温度下发生变质的宜采用蒸发浓缩、冷却结晶;NH4Cl受热分解,蒸发的结果是NH4Cl分解为氨气与氯化氢气体,得不到NH4Cl晶体,B项错误。应用启普发生器制气时,固体反应物多为不溶于水的块状物,方能起到“随开随制,随关随停”的目的,Na2CO3易溶于盐酸,反应会持续进行,而且产生的CO2中含少量HCl气体,C项错误。图4所示装置利用密度差及溶解性差异,CCl4萃取碘水中的I2后在下层,水在上层,可达到萃取与分液的目的,D项正确。]
仪器的创新使用——洗气瓶的使用
图1 图2 图3
热点题型3 现象结论分析型
1.(2016·济南调研)根据下列实验操作和现象所得出的结论错误的是( )
选项
操作
现象
结论
A
向蔗糖中加入浓硫酸
蔗糖变成疏松多孔的海绵状碳
浓硫酸具有脱水性和强氧化性
B
向盛Na2SiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去
2
min后,试管里出现凝胶
非金属性:Cl>Si
C
向盛有铜片的容器中加入浓硝酸
产生大量红棕色气体,溶液变为蓝绿色
浓硝酸具有强氧化性和酸性
D
向等浓度的KCl、KI混合液中滴加AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
B [A项正确,蔗糖脱水变成炭黑和水,生成的炭黑接着和浓硫酸反应生成二氧化碳、二氧化硫等气体,使得糊状的炭黑鼓胀;B项错误,硅酸钠溶液和盐酸发生复分解反应,体现的是盐酸和硅酸强弱,根本不涉及两元素最高价氧化物对应水化物的酸性,因此不能比较两元素的非金属性;C项正确,Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,产物硝酸铜表明硝酸的酸性,产物二氧化氮表明硝酸的强氧化性;D项正确,对于AgCl、AgI两种类型相似的难溶电解质而言,谁的溶度积常数越小,谁就优先沉淀。]
2.(2016·潍坊高三统考)对实验Ⅰ~Ⅳ的实验现象预测错误的是( )
A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中溶液变血红色
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
B [苯的密度比水的密度小,振荡后静置,溶液分层,上层为I2的苯溶液,呈紫色,下层为水层,呈无色,A项正确;NH3通入AlCl3,溶液产生Al(OH)3沉淀,而Al(OH)3沉淀不溶于氨水,B项错误;Fe3+遇SCN-变血红色,C项正确;CaO吸收水,饱和CuSO4溶液中溶剂水减少,溶液中有晶体析出,D项正确。]
3.(2016·北京东城高三期末)为研究沉淀的生成及其转化,某小组进行如下实验。关于该实验的分析不正确的是( )
A.①浊液中存在平衡:AgSCN(s)??Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
D [溶液变红说明生成了Fe(SCN)3,产生黄色沉淀说明生成了AgI,由于加入的KI溶液的浓度相对KSCN大很多,KI过量,所以无法比较AgSCN和AgI的溶解度。]
4.(名师押题)下列根据实验操作与现象所得出的结论正确的是( )
选项
实验操作与现象
结论
A
向蛋白质溶液中滴加Pb(NO3)2溶液,产生白色沉淀,加水沉淀不消失
蛋白质发生了盐析
B
测定浓度均为0.1
mol·L-1
CH3COONa与HCOONa溶液的pH,CH3COONa溶液的pH较大
酸性:CH3COOH>HCOOH
C
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀
溶液X中一定含有SO
D
将少量FeS溶于盐酸,滴加新制氯水,先生成臭鸡蛋气味气体及浅绿色溶液,滴加新制氯水后浅绿色溶液变为棕黄色且有少量淡黄色沉淀生成
氧化性:Cl2>Fe3+,Cl2>S
D [A项,重金属离子Pb2+使蛋白质发生了变性,错误;B项,两种盐溶液水解均显碱性,盐溶液碱性强说明水解程度大,则对应酸的酸性弱,CH3COONa溶液的pH较大,则CH3COOH的酸性较弱,错误;C项,由于硝酸有强氧化性,当溶液中含SO时会被氧化为SO,也会与Ba2+形成沉淀,错误;D项,FeS与盐酸反应:FeS+2HCl===FeCl2+H2S↑,滴入氯水之后发生反应:Cl2+2Fe2+===2Fe3++2Cl-,H2S+Cl2===S↓+2HCl,由此可得氧化性:Cl2>Fe3+,Cl2>S。]
实验现象结论分析型试题常设陷阱
1.副反应或带出的杂质可能导致实验结论不准确。例如:蔗糖与浓硫酸反应时除产生SO2外还有CO2,将两种气体通入澄清石灰水均会产生白色沉淀;盐酸与碳酸盐反应产生CO2时盐酸会挥发,将两种气体通入硅酸钠溶液中均会产生白色沉淀。
2.实验现象掩盖事实导致的结论不准确。例如:铂丝蘸取溶液灼烧时,焰色呈黄色,误认为溶液中含Na元素、不含K元素。
3.实验操作错误导致的结论不准确。例如:向溶液中先滴加氯水、再滴加KSCN溶液,溶液变红色,误认为溶液中含Fe3+、不含Fe2+(此操作只能证明溶液中含Fe3+,不能证明是否含Fe2+);向溶液中先滴加氯水,然后滴加淀粉溶液变蓝色,误认为原溶液中含有碘单质。
4.原理应用错误导致所得结论不准确。例如:碳在高温下置换二氧化硅中的硅,误认为碳的还原性强于硅的(实质是利用平衡移动原理);二氧化硅与碳酸钠在高温下反应制备硅酸钠,误认为二氧化硅的酸性强于二氧化碳的酸性(实质是利用平衡移动原理)。
建知识网络 明内在联系
突破点16 化学实验基础
提炼1 常见仪器的识别
1.用作容器或反应器的仪器
①试管 ②蒸发皿 ③坩埚 ④圆底烧瓶 ⑤平底烧瓶 ⑥烧杯 ⑦蒸馏烧瓶 ⑧锥形瓶 ⑨集气瓶 ⑩广口瓶 燃烧匙
2.用于提纯、分离和干燥的仪器
①普通漏斗 ②分液漏斗 ③球形干燥管
3.常用计量仪器
①量筒 ②容量瓶 ③滴定管 ④温度计 ⑤托盘天平
4.其他仪器
①冷凝管 ②表面皿 ③滴瓶 ④胶头滴管
提炼2 熟记九大基本操作
1.测定溶液pH的操作
将一小块pH试纸放在洁净的表面皿上,用清洁干燥的玻璃棒蘸取少量待测液点到pH试纸中央,待变色稳定后再和标准比色卡对照,读出对应的pH。
2.沉淀剂是否过量的判断方法
(1)静置,向上层清液中继续滴加少量沉淀剂,若无沉淀产生,则证明沉淀剂已过量,否则沉淀剂不过量。
(2)静置,取上层清液适量于另一洁净试管中,向其中加入少量与沉淀剂作用产生沉淀的试剂,若产生沉淀,证明沉淀剂已过量,否则沉淀剂不过量。
3.洗涤沉淀操作
把蒸馏水沿着玻璃棒注入到过滤器中至浸没沉淀,静置,使蒸馏水滤出,重复2~3次即可。
4.判断沉淀是否洗净的操作
取最后一次洗涤液,滴加……(试剂),若没有……现象,证明沉淀已经洗净。
5.装置气密性检查
检查装置气密性
(1)简易装置:将导气管一端放入水中(液封气体),用手捂热试管,观察现象:若导管口有气泡冒出,冷却到室温后,导管口有一段稳定的水柱,表明装置气密性良好。
(2)有长颈漏斗的装置如图:用止水夹关闭烧瓶右侧的导气管,向长颈漏斗中加入适量水,长颈漏斗中会形成一段液柱,停止加水,过一段时间后,若漏斗中的液柱无变化,则装置气密性良好。
[答题模板]
形成密闭体系→操作→描述现象→得出结论
6.气体验满和检验操作
(1)氧气验满:将带火星的木条平放在集气瓶口,若木条复燃,则说明收集的氧气已满。
(2)可燃性气体(如氢气)的验纯方法:用排水法收集一小试管的气体,用大拇指摁住管口移近火焰,放开手指,若听到尖锐的爆鸣声,则气体不纯;若听到轻微的“噗”的一声,则气体纯净。
(3)二氧化碳验满:将燃着的木条平放在集气瓶口,若火焰熄灭,则气体已满。
(4)氨气验满:用湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝说明气体已满。
(5)氯气验满:用湿润的淀粉 碘化钾试纸放在集气瓶口,若试纸变蓝说明气体已满。
7.浓H2SO4稀释操作
将浓H2SO4沿烧杯壁缓缓注入水中,并用玻璃棒不断搅拌。
8.粗盐的提纯
(1)实验室提纯粗盐的实验操作依次为取样、溶解、沉淀、过滤、蒸发、冷却结晶、过滤、烘干。
(2)若过滤时发现滤液中有少量浑浊,从实验操作的角度分析,可能的原因是过滤时漏斗中液面高出滤纸边缘、玻璃棒靠在单层滤纸一边弄破滤纸。
9.从某物质稀溶液中结晶的实验操作
(1)溶解度受温度影响较小的:蒸发→结晶→过滤。
(2)溶解度受温度影响较大或带结晶水的:蒸发浓缩→冷却结晶→过滤。
提炼3 实验安全与事故处理
1.实验室常见事故处理方法
实验事故
处理方法
Na着火
用沙土覆盖灭火,不能用泡沫灭火器或干粉灭火器灭火
浓硫酸溅到皮肤上
用干净的布擦拭并用大量水冲洗,再涂稀碳酸氢钠溶液,严重者立即送往医院
浓碱液溅到皮肤上
先用大量清水冲洗,然后涂抹稀醋酸或硼酸
含汞的温度计被打破
大滴汞先收集于密闭容器中,然后用硫粉撒在汞散落的地方
2.危险化学品的处理方法
危险化学品
处理方法
NH3、Cl2、SO2等有毒尾气
用合适的试剂吸收且要防倒吸,不能随意排放
H2、CH4、CO等易燃尾气
点燃或收集,点燃前要先检验气体的纯度
Na、K
保存于煤油中,以防氧化或着火
液溴
需加水液封,另外还需要密封以防挥发
易挥发、易燃、易爆有机物
密封保存,以防挥发被引燃、引爆
强氧化剂与强还原剂
分开保存,以防倾倒时发生剧烈反应
回访1 判断正误(正确打“√”,错误打“×”)
(1)(2016·全国甲卷)分别将少量钠投入盛有水和乙醇的烧杯中,比较水和乙醇中氢的活泼性。( )
(2)(2016·全国乙卷)配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释。( )
(3)(2016·全国丙卷)配制稀硫酸时,先将浓硫酸加入烧杯中,后倒入蒸馏水。( )
[解析] (3)稀释浓硫酸时,一定要将浓硫酸沿烧杯内壁缓缓注入水中,并不断用玻璃棒搅拌。
[答案] (1)√ (2)√ (3)×
回访2 (2014·新课标全国卷Ⅰ)下列有关仪器使用方法或实验操作正确的是( )
A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B.酸式滴定管装标准溶液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
B [A.容量瓶是定量实验仪器,洗净后自然晾干,不能放进烘箱中烘干。
B.酸式滴定管用于准确量取溶液的体积,先用蒸馏水洗净后,再用待装溶液润洗2~3次,否则将导致待装溶液的浓度偏小,影响实验结果。
C.锥形瓶用蒸馏水洗涤后,直接加入待滴定溶液,若用待滴定溶液润洗,所含溶质的量增大,消耗标准溶液的体积增大,测得实验结果偏高。
D.配制溶液时,加水超过刻度线,应重新配制,若用滴管吸出多余部分,所得溶液的浓度将偏低。]
回访3 (2014·新课标全国卷Ⅰ)利用下图所示装置进行下列实验,能得出相应实验结论的是( )
B [分析①和②中物质发生的反应以及所产生的气体与③中物质的反应,根据相关现象得出实验结论。
A.Na2S与稀硫酸发生反应:Na2S+H2SO4===Na2SO4+H2S↑,H2S气体通过导管进入③,产生Ag2S黑色沉淀,可能是H2S与AgNO3反应的结果,不能得出Ksp(AgCl)>Ksp(Ag2S)。
B.浓硫酸使蔗糖发生脱水炭化,并与生成的碳发生氧化还原反应,生成CO2、SO2和H2O,混合气体通过导管进入③,其中SO2与溴水发生反应:SO2+Br2+2H2O===H2SO4+2HBr,该过程中浓硫酸体现脱水性和强氧化性。
C.稀盐酸与Na2SO3发生反应:Na2SO3+2HCl===2NaCl+SO2↑+H2O,SO2与Ba(NO3)2溶液发生氧化还原反应生成BaSO4沉淀,若③中为BaCl2等可溶性钡盐,则不能生成沉淀。
D.浓硝酸与Na2CO3发生反应:Na2CO3+2HNO3===2NaNO3+CO2↑+H2O,说明HNO3的酸性强于H2CO3,③中Na2SiO3溶液产生白色沉淀,但不能据此证明H2CO3的酸性强于H2SiO3,其原因是浓硝酸具有强挥发性,挥发出的HNO3气体与CO2一并进入Na2SiO3溶液,且均能与其发生反应而产生H2SiO3沉淀。]
热点题型1 基本仪器评价型
1.下列关于仪器的选择或使用正确的是( )
A.用量筒量取15.00
mL
NaOH溶液
B.用陶瓷坩埚高温煅烧CaCO3固体
C.洗净的试管、滴定管和容量瓶可以放进烘箱烘干
D.中和热测定实验中需要用到的玻璃仪器只有烧杯、温度计和环形玻璃搅拌棒三种
B [量筒无法量取15.00
mL
NaOH溶液,应选用量程为25.00
mL的碱式滴定管,A项错误;CaCO3固体分解需用耐高温的仪器,故陶瓷坩埚可以高温煅烧CaCO3固体,B项正确;试管洗净之后可烘干,而滴定管、容量瓶为精量仪器需晾干,不可烘干以防影响其精确度,C项错误;中和热测定实验中用到的玻璃仪器有大小烧杯、量筒、温度计、环形玻璃搅拌棒,D项错误。]
2.(2016·杭州第一次质量检测)为完成相应实验,实验器材(规格和数量不限)足够的一项是( )
相应实验
实验仪器和用品(夹持装置省略)
A
氯化钠溶液的蒸发结晶
烧杯、玻璃棒、酒精灯
B
用盐酸除去硫酸钡中的少量碳酸钡
烧杯、胶头滴管
C
配制0.5
mol·L-1的硫酸溶液
烧杯、玻璃棒、胶头滴管、容量瓶
D
用CCl4萃取溴水中的溴
分液漏斗、烧杯
D [A项,蒸发操作实验仪器还缺少蒸发皿,错误;B项,过滤装置中缺少漏斗、玻璃棒和滤纸,错误;C项,配制硫酸溶液,缺少量筒,错误;D项,做萃取实验,只用分液漏斗和烧杯,正确。]
3.下列制备和收集气体的实验装置合理的是( )
D [A.用NH4Cl与Ca(OH)2固体混合加热制取氨气,试管口要略向下倾斜,错误;B.用Cu与稀硝酸发生反应产生NO,NO容易与空气中的氧气发生反应,因此不能用排空气的方法收集,错误;C.Zn与稀硫酸发生反应产生氢气,由于氢气的密度比空气小,因此应该用向下排空气的方法收集,错误;D.H2O2在MnO2作催化剂时发生分解反应产生O2,由于O2微溶于水,因此可以用排水的方法收集,正确。]
4.(名师押题)下列对应仪器使用合理的是( )
A.甲:将FeSO4溶液滴加到NaOH溶液中,观察Fe(OH)2的颜色
B.乙:用托盘天平称量NaOH固体20.0
g,配制980
mL
0.5
mol/L
NaOH溶液
C.丙:加热NaHCO3固体,检验NaHCO3固体的热稳定性
D.丁:向蒸馏烧瓶中加入碎瓷片、乙醇、浓硫酸,加热至170
℃制乙烯
D [为防止滴入的液滴带入氧气,应将吸有NaOH溶液的长胶头滴管插入新制FeSO4溶液中,缓缓挤出NaOH溶液才能看到白色的Fe(OH)2沉淀,A项错误。NaOH易潮解,称量时应该放在小烧杯中或表面皿中,一般左盘放被称量的物质,右盘放砝码,B项错误。NaHCO3固体受热分解的产物中含水蒸气,冷凝之后液态水倒流会引起试管炸裂,故试管口应略向下倾斜,C项错误。检查装置气密性后,按顺序加入碎瓷片、乙醇、浓硫酸,加热至170
℃可制得乙烯,D项正确。]
1.化学实验中的几个数据
2.几种操作的“第一步”
(1)检查装置的气密性——制取气体、验证气体的性质等与气体有关的实验操作。
(2)检查是否漏水——滴定管、容量瓶、分液漏斗等的使用。
(3)调“0”点——天平等的使用。
(4)验纯——点燃可燃性气体。
(5)分别取少量溶液——未知溶液的鉴别。
(6)润湿——用红色石蕊试纸、蓝色石蕊试纸、碘化钾淀粉试纸检验或验证某些气体时。
热点题型2 实验目的判断型
1.(2016·济南调研)利用表中提供的仪器和药品,能达到相应实验目的的是( )
选项
仪器
药品
实验目的
A
烧杯、玻璃棒、胶头滴管
FeCl3溶液、NaOH溶液
制Fe(OH)3胶体
B
圆底烧瓶、导气管、烧杯、铁架台
干燥的二氧化碳气体、蒸馏水
模拟喷泉实验
C
酸式滴定管、锥形瓶、铁架台(带铁夹)
已知浓度的盐酸、待测NaOH溶液
测定NaOH溶液的物质的量浓度
D
酒精灯、玻璃棒、蒸发皿、三脚架
NaCl溶液
蒸发溶液得到晶体
D [A项错误,制备氢氧化铁胶体,应将饱和氯化铁溶液滴入沸水中,所以缺少了酒精灯、多了烧碱溶液;B项错误,二氧化碳仅仅能溶于水而非易溶于水,无法形成喷泉现象;C项错误,缺少碱式滴定管,没法准确量取一定体积的待测液且无指示剂;D项正确,仪器完备、操作精准。]
2.下列实验操作正确并能达到实验目的的是( )
A [ω(NaCl)=×100%=5%,将氯化钠加水搅拌均匀即可,A项正确。容量瓶不能用于溶解固体,B项错误。滴定读数时,视线应与凹液面最低点相切,俯视、仰视都会引起误差,C项错误。胶体粒子可以透过滤纸,故过滤无法除去氢氧化铁胶体中的小分子及离子,D项错误。]
3.(2016·南通调研)下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是( )
A.用图甲装置制取并收集二氧化硫
B.用图乙装置向反应后的混合物中加水稀释
C.用图丙装置过滤出稀释后混合物中的不溶物
D.用图丁装置将硫酸铜溶液蒸发浓缩后冷却结晶
D [A项,SO2的密度比空气大,收集时,应“长进短出”,且SO2会污染空气,应使用尾气吸收装置,错误;B项,反应后的溶液中含有浓H2SO4,将水加入混合物中稀释时,会引发暴沸,应将混合物加入水中,错误;C项,过滤时,应用玻璃棒引流,错误;D项,烧杯可以用于蒸发浓缩,无需用蒸发皿(用于蒸发结晶),正确。]
4.(名师押题)下列实验能达到实验目的的是( )
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
D [图1中的NaOH溶液与Cl2、HCl均发生反应,A项错误。在蒸发结晶时,溶质在较高温度下不发生变质的方能采用蒸发皿蒸发结晶,溶质在较高温度下发生变质的宜采用蒸发浓缩、冷却结晶;NH4Cl受热分解,蒸发的结果是NH4Cl分解为氨气与氯化氢气体,得不到NH4Cl晶体,B项错误。应用启普发生器制气时,固体反应物多为不溶于水的块状物,方能起到“随开随制,随关随停”的目的,Na2CO3易溶于盐酸,反应会持续进行,而且产生的CO2中含少量HCl气体,C项错误。图4所示装置利用密度差及溶解性差异,CCl4萃取碘水中的I2后在下层,水在上层,可达到萃取与分液的目的,D项正确。]
仪器的创新使用——洗气瓶的使用
图1 图2 图3
热点题型3 现象结论分析型
1.(2016·济南调研)根据下列实验操作和现象所得出的结论错误的是( )
选项
操作
现象
结论
A
向蔗糖中加入浓硫酸
蔗糖变成疏松多孔的海绵状碳
浓硫酸具有脱水性和强氧化性
B
向盛Na2SiO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去
2
min后,试管里出现凝胶
非金属性:Cl>Si
C
向盛有铜片的容器中加入浓硝酸
产生大量红棕色气体,溶液变为蓝绿色
浓硝酸具有强氧化性和酸性
D
向等浓度的KCl、KI混合液中滴加AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
B [A项正确,蔗糖脱水变成炭黑和水,生成的炭黑接着和浓硫酸反应生成二氧化碳、二氧化硫等气体,使得糊状的炭黑鼓胀;B项错误,硅酸钠溶液和盐酸发生复分解反应,体现的是盐酸和硅酸强弱,根本不涉及两元素最高价氧化物对应水化物的酸性,因此不能比较两元素的非金属性;C项正确,Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,产物硝酸铜表明硝酸的酸性,产物二氧化氮表明硝酸的强氧化性;D项正确,对于AgCl、AgI两种类型相似的难溶电解质而言,谁的溶度积常数越小,谁就优先沉淀。]
2.(2016·潍坊高三统考)对实验Ⅰ~Ⅳ的实验现象预测错误的是( )
A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中溶液变血红色
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
B [苯的密度比水的密度小,振荡后静置,溶液分层,上层为I2的苯溶液,呈紫色,下层为水层,呈无色,A项正确;NH3通入AlCl3,溶液产生Al(OH)3沉淀,而Al(OH)3沉淀不溶于氨水,B项错误;Fe3+遇SCN-变血红色,C项正确;CaO吸收水,饱和CuSO4溶液中溶剂水减少,溶液中有晶体析出,D项正确。]
3.(2016·北京东城高三期末)为研究沉淀的生成及其转化,某小组进行如下实验。关于该实验的分析不正确的是( )
A.①浊液中存在平衡:AgSCN(s)??Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
D [溶液变红说明生成了Fe(SCN)3,产生黄色沉淀说明生成了AgI,由于加入的KI溶液的浓度相对KSCN大很多,KI过量,所以无法比较AgSCN和AgI的溶解度。]
4.(名师押题)下列根据实验操作与现象所得出的结论正确的是( )
选项
实验操作与现象
结论
A
向蛋白质溶液中滴加Pb(NO3)2溶液,产生白色沉淀,加水沉淀不消失
蛋白质发生了盐析
B
测定浓度均为0.1
mol·L-1
CH3COONa与HCOONa溶液的pH,CH3COONa溶液的pH较大
酸性:CH3COOH>HCOOH
C
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀
溶液X中一定含有SO
D
将少量FeS溶于盐酸,滴加新制氯水,先生成臭鸡蛋气味气体及浅绿色溶液,滴加新制氯水后浅绿色溶液变为棕黄色且有少量淡黄色沉淀生成
氧化性:Cl2>Fe3+,Cl2>S
D [A项,重金属离子Pb2+使蛋白质发生了变性,错误;B项,两种盐溶液水解均显碱性,盐溶液碱性强说明水解程度大,则对应酸的酸性弱,CH3COONa溶液的pH较大,则CH3COOH的酸性较弱,错误;C项,由于硝酸有强氧化性,当溶液中含SO时会被氧化为SO,也会与Ba2+形成沉淀,错误;D项,FeS与盐酸反应:FeS+2HCl===FeCl2+H2S↑,滴入氯水之后发生反应:Cl2+2Fe2+===2Fe3++2Cl-,H2S+Cl2===S↓+2HCl,由此可得氧化性:Cl2>Fe3+,Cl2>S。]
实验现象结论分析型试题常设陷阱
1.副反应或带出的杂质可能导致实验结论不准确。例如:蔗糖与浓硫酸反应时除产生SO2外还有CO2,将两种气体通入澄清石灰水均会产生白色沉淀;盐酸与碳酸盐反应产生CO2时盐酸会挥发,将两种气体通入硅酸钠溶液中均会产生白色沉淀。
2.实验现象掩盖事实导致的结论不准确。例如:铂丝蘸取溶液灼烧时,焰色呈黄色,误认为溶液中含Na元素、不含K元素。
3.实验操作错误导致的结论不准确。例如:向溶液中先滴加氯水、再滴加KSCN溶液,溶液变红色,误认为溶液中含Fe3+、不含Fe2+(此操作只能证明溶液中含Fe3+,不能证明是否含Fe2+);向溶液中先滴加氯水,然后滴加淀粉溶液变蓝色,误认为原溶液中含有碘单质。
4.原理应用错误导致所得结论不准确。例如:碳在高温下置换二氧化硅中的硅,误认为碳的还原性强于硅的(实质是利用平衡移动原理);二氧化硅与碳酸钠在高温下反应制备硅酸钠,误认为二氧化硅的酸性强于二氧化碳的酸性(实质是利用平衡移动原理)。
同课章节目录
