人教版化学必修1第四章非金属及其化合物复习(23张ppt) (共23张PPT)
文档属性
| 名称 | 人教版化学必修1第四章非金属及其化合物复习(23张ppt) (共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 849.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-02-02 18:55:58 | ||
图片预览





文档简介
课件23张PPT。第四章 非金属及其化合物期末复习一、硅 (Si)及其化合物一)二氧化硅(SiO2)—酸性氧化物1、存在:广泛存在于自然界中,也叫硅石,
代表物石英晶体——水晶2、物理性质:难溶于水,熔沸点高3、化学性质:稳定,不活泼(1)与HF反应:SiO2+4HF=SiF4↑+2H2O
SiO2+CaO===CaSiO3(2)与碱性氧化物反应高温SiO2+2NaOH=Na2SiO3+H2OSiO2+Ca(OH)2=CaSiO3+H2O(3)与碱反应:二)硅酸(H2SiO3)1、制取:可溶性的硅酸盐与酸的反应Na2SiO3+2HCl=2NaCl+H2SiO3↓2、性质:① 白色胶状,难溶② 弱酸性(酸性 H2SiO3 < H2CO3)③ 脱水形成“硅胶”Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(用作干燥剂)三)、硅1、物理性质:硅有晶体硅和无定形硅两种。晶体硅是灰黑色、有金属光泽、熔点、沸点都很高,硬度大的固体。导电性介于导体和绝缘体之间。2、化学性质----不活泼(1)与O2、 F2反应
Si + O2 == SiO2 Si + 2F2 == SiF4
(2)与氢氟酸反应:Si + 4HF = SiF4 ↑+ 2H2↑
(3)与强碱反应
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑高温二、富集在海水中的元素——氯 氯的原子结构和性质:结构:性质: Cl得e-Cl-易得到一个电子,显-1价,强氧化性
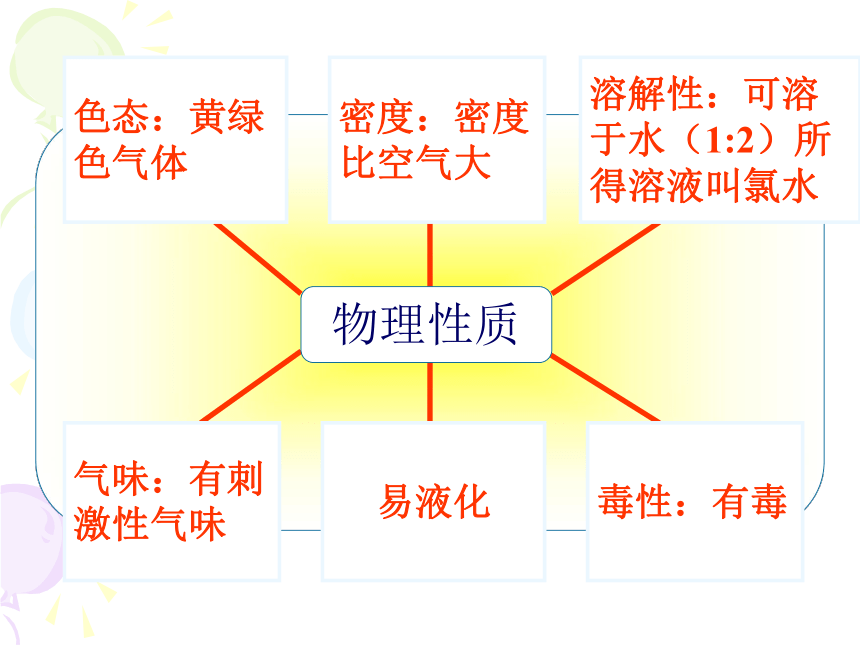
可以失去电子显正价+1、+5、+7物理性质色态:黄绿色气体溶解性:可溶于水(1:2)所得溶液叫氯水密度:密度比空气大气味:有刺激性气味
易液化
毒性:有毒
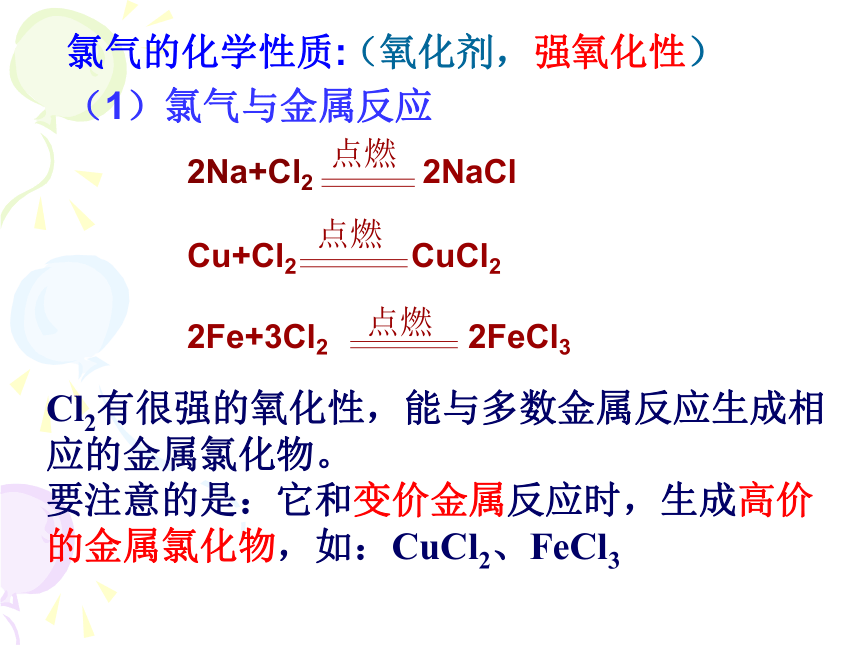
氯气的化学性质:(氧化剂,强氧化性)(1)氯气与金属反应Cl2有很强的氧化性,能与多数金属反应生成相应的金属氯化物。
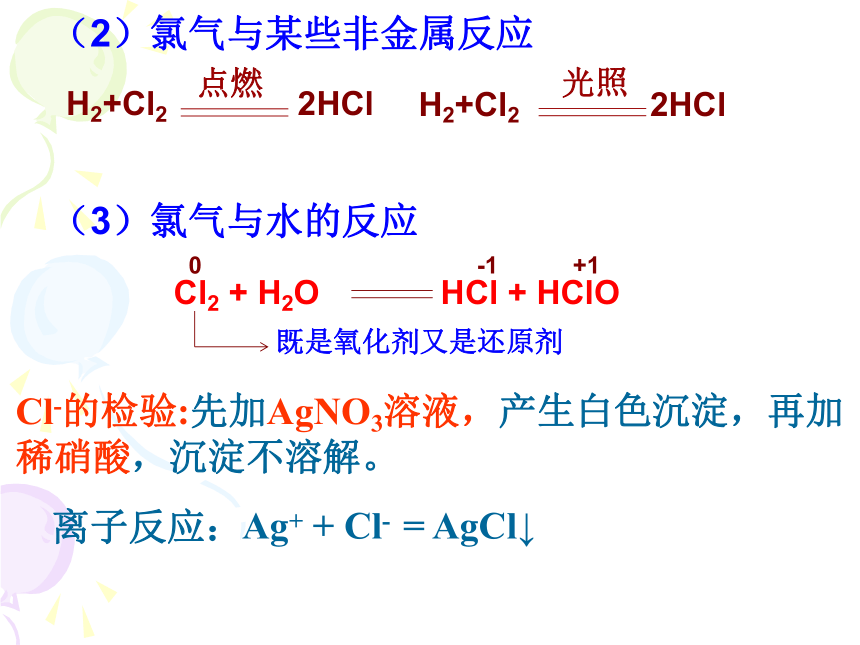
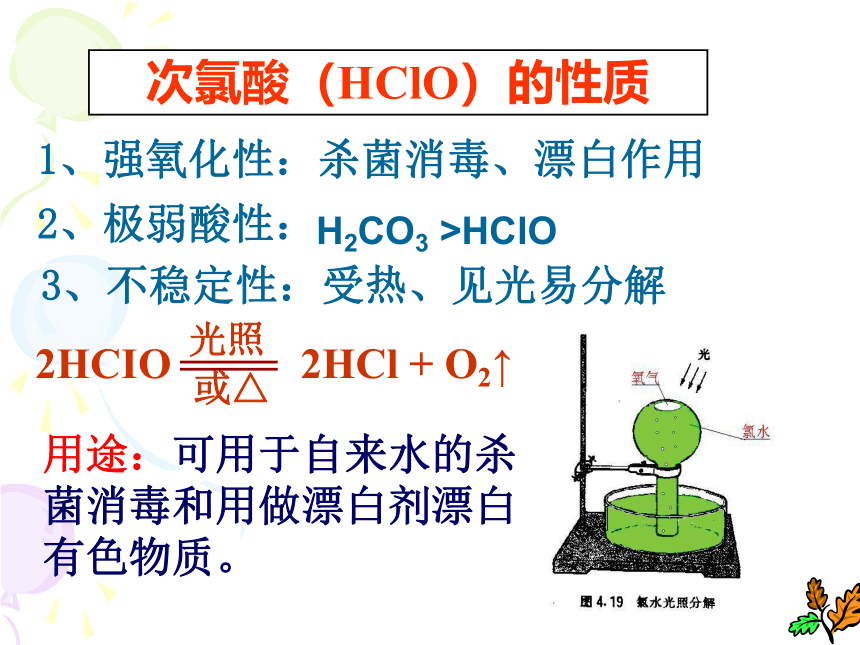
要注意的是:它和变价金属反应时,生成高价的金属氯化物,如:CuCl2、FeCl3 (2)氯气与某些非金属反应(3)氯气与水的反应Cl-的检验:先加AgNO3溶液,产生白色沉淀,再加稀硝酸,沉淀不溶解。离子反应:Ag+ + Cl- = AgCl↓次氯酸(HClO)的性质1、强氧化性:杀菌消毒、漂白作用2、极弱酸性:3、不稳定性:受热、见光易分解用途:可用于自来水的杀菌消毒和用做漂白剂漂白有色物质。H2CO3 >HClO(4)氯气与碱溶液的反应Cl2 + 2OH- === Cl- + ClO- + H2O Cl2+2NaOH====NaCl+NaClO+H2O
2Cl2+2Ca(OH)2=====CaCl2+Ca(ClO)2+2H2O漂白粉的制取、成分、原理:2Ca(OH)2 + 2Cl2 === CaCl2 + Ca(ClO)2 + 2H2O漂白粉的成分: 漂白粉的有效成分: CaCl2 和 Ca(ClO)2的混合物Ca(ClO)2 Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO漂白原理:(反应原理:强酸制取弱酸)比较:气态液态液态Cl2分子 纯净物纯净物混合物Cl2分子 无无有H2O、 Cl2、HClOCl-、 H+、 ClO-混合物液态H2O、 Cl-、 H+无三、硫和氮的氧化物一)硫的氧化物1、二氧化硫:1)物理性质:无色、有刺激性气味的有毒的气体,密度比空气大,易液化 。2)化学性质:(1)跟水反应:(2)与碱反应生成盐和水SO2 + 2 NaOH = Na2SO3 + H2OSO2 + Ca(OH)2 = CaSO3↓ + H2O(3)既有氧化性,又有还原性 SO2 + 2 H2S = 3 S ↓ + 2 H2O (4)漂白性:暂时性漂白,可逆 用途:它可以用来漂白纸浆、毛、丝、草编制品等。SO2+4S SO30+62、SO3 ——无色固体,酸性氧化物化学性质:(1) 与H2O的反应 (硫酸)(2)与碱反应生成盐和水 SO3 + 2 NaOH = Na2SO4 + H2OSO3 + H2O = H2SO4SO3 + Ca(OH)2 = CaSO4 + H2O(3)与碱性氧化物反应生成盐 SO3 + CaO = CaSO4 1、在放电或高温下:
N2 + O2 ====2 NO (无色)
2、在常温下:
2 NO + O2 = 2 NO2 (红棕色)
*比较NO和NO2的性质:
NO:无色无味、不溶于水(不与水反应)、不稳定(易氧化)
NO2:红棕色有刺激性气味、易溶于水、稳定、有毒性
3、 NO2 易溶于水:
3 NO2 + H2O =2HNO3 + NO
放电二)NO2和NO或高温一)氨(NH3)四、氨 硫酸 硝酸1、物理性质:无色有刺激性气味的气体,比空气轻、极易溶于水(1:700) ,易液化。2、化学性质:(1)氨与水反应NH3 + H2ONH3 · H2ONH4+ + OH-NH3.H2O不稳定,受热分解为氨和水:NH3 · H2O == NH3 ↑ + H2O加热(2)氨与酸反应——生成铵盐现象:产生大量的白烟NH3 + HCl == NH4ClNH3的实验室制法反应原理:铵盐的性质铵盐受热易分解:△NH4NO3 + NaOH == NH3↑ + NaNO3 + H2ONH4+的检验:铵盐 OH-△有刺激性气味的气体产生,湿润的红色石蕊试纸变蓝(1)H2SO4=2H++SO42-
HCl = H++Cl-
HNO3 = H++NO3-
(2)稀硫酸和盐酸属于有弱氧化性,其氧化性实际上是H+的氧化性,与金属反应时H+被还原为H2;而浓硫酸和硝酸属于有强氧化性,与金属反应时是+6价的S和+5价的N被还原为SO2和NO或NO2等,无H2产生。酸酸的通性实质就是H+的性质。 二)硫酸1、物理性质:浓硫酸无色、无味、粘稠的油状液体,密度大,沸点高,难挥发,与水任意比互溶。2、化学性质:
1)稀硫酸具有酸的通性
A、使石蕊溶液变红
B、和碱反应
C、和碱性氧化物反应
D、和盐反应
E、和金属反应 3、浓硫酸的特性:
①吸水性:可作干燥剂(不可干燥氨气)
②脱水性
③强氧化性浓硫酸的强氧化性:① 加热时浓硫酸能与大多数金属(除Au、 Pt)反应,但不生成氢气。钝化:常温下,浓硫酸或浓硝酸能使Al、Fe等金属表面生成致密的氧化物保护膜,阻止内部金属继续反应。此现象称 “钝化”② 与某些非金属反应三)硝酸纯HNO3是 色、易 ,有
气味的液体,能与水任意比互溶. 物理性质: 挥发刺激性无化学性质:强氧化性:稀硝酸和浓硝酸都有强氧化性硝酸能与大部分金属(除金和铂)反应:四)王水:硝酸虽具有强氧化性,但不能氧化金、铂。但王水能金、铂溶解。王水是浓HNO3和浓HCl按1:3的体积比混合成的氧化性更强的溶液.
代表物石英晶体——水晶2、物理性质:难溶于水,熔沸点高3、化学性质:稳定,不活泼(1)与HF反应:SiO2+4HF=SiF4↑+2H2O
SiO2+CaO===CaSiO3(2)与碱性氧化物反应高温SiO2+2NaOH=Na2SiO3+H2OSiO2+Ca(OH)2=CaSiO3+H2O(3)与碱反应:二)硅酸(H2SiO3)1、制取:可溶性的硅酸盐与酸的反应Na2SiO3+2HCl=2NaCl+H2SiO3↓2、性质:① 白色胶状,难溶② 弱酸性(酸性 H2SiO3 < H2CO3)③ 脱水形成“硅胶”Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(用作干燥剂)三)、硅1、物理性质:硅有晶体硅和无定形硅两种。晶体硅是灰黑色、有金属光泽、熔点、沸点都很高,硬度大的固体。导电性介于导体和绝缘体之间。2、化学性质----不活泼(1)与O2、 F2反应
Si + O2 == SiO2 Si + 2F2 == SiF4
(2)与氢氟酸反应:Si + 4HF = SiF4 ↑+ 2H2↑
(3)与强碱反应
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑高温二、富集在海水中的元素——氯 氯的原子结构和性质:结构:性质: Cl得e-Cl-易得到一个电子,显-1价,强氧化性
可以失去电子显正价+1、+5、+7物理性质色态:黄绿色气体溶解性:可溶于水(1:2)所得溶液叫氯水密度:密度比空气大气味:有刺激性气味
易液化
毒性:有毒
氯气的化学性质:(氧化剂,强氧化性)(1)氯气与金属反应Cl2有很强的氧化性,能与多数金属反应生成相应的金属氯化物。
要注意的是:它和变价金属反应时,生成高价的金属氯化物,如:CuCl2、FeCl3 (2)氯气与某些非金属反应(3)氯气与水的反应Cl-的检验:先加AgNO3溶液,产生白色沉淀,再加稀硝酸,沉淀不溶解。离子反应:Ag+ + Cl- = AgCl↓次氯酸(HClO)的性质1、强氧化性:杀菌消毒、漂白作用2、极弱酸性:3、不稳定性:受热、见光易分解用途:可用于自来水的杀菌消毒和用做漂白剂漂白有色物质。H2CO3 >HClO(4)氯气与碱溶液的反应Cl2 + 2OH- === Cl- + ClO- + H2O Cl2+2NaOH====NaCl+NaClO+H2O
2Cl2+2Ca(OH)2=====CaCl2+Ca(ClO)2+2H2O漂白粉的制取、成分、原理:2Ca(OH)2 + 2Cl2 === CaCl2 + Ca(ClO)2 + 2H2O漂白粉的成分: 漂白粉的有效成分: CaCl2 和 Ca(ClO)2的混合物Ca(ClO)2 Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO漂白原理:(反应原理:强酸制取弱酸)比较:气态液态液态Cl2分子 纯净物纯净物混合物Cl2分子 无无有H2O、 Cl2、HClOCl-、 H+、 ClO-混合物液态H2O、 Cl-、 H+无三、硫和氮的氧化物一)硫的氧化物1、二氧化硫:1)物理性质:无色、有刺激性气味的有毒的气体,密度比空气大,易液化 。2)化学性质:(1)跟水反应:(2)与碱反应生成盐和水SO2 + 2 NaOH = Na2SO3 + H2OSO2 + Ca(OH)2 = CaSO3↓ + H2O(3)既有氧化性,又有还原性 SO2 + 2 H2S = 3 S ↓ + 2 H2O (4)漂白性:暂时性漂白,可逆 用途:它可以用来漂白纸浆、毛、丝、草编制品等。SO2+4S SO30+62、SO3 ——无色固体,酸性氧化物化学性质:(1) 与H2O的反应 (硫酸)(2)与碱反应生成盐和水 SO3 + 2 NaOH = Na2SO4 + H2OSO3 + H2O = H2SO4SO3 + Ca(OH)2 = CaSO4 + H2O(3)与碱性氧化物反应生成盐 SO3 + CaO = CaSO4 1、在放电或高温下:
N2 + O2 ====2 NO (无色)
2、在常温下:
2 NO + O2 = 2 NO2 (红棕色)
*比较NO和NO2的性质:
NO:无色无味、不溶于水(不与水反应)、不稳定(易氧化)
NO2:红棕色有刺激性气味、易溶于水、稳定、有毒性
3、 NO2 易溶于水:
3 NO2 + H2O =2HNO3 + NO
放电二)NO2和NO或高温一)氨(NH3)四、氨 硫酸 硝酸1、物理性质:无色有刺激性气味的气体,比空气轻、极易溶于水(1:700) ,易液化。2、化学性质:(1)氨与水反应NH3 + H2ONH3 · H2ONH4+ + OH-NH3.H2O不稳定,受热分解为氨和水:NH3 · H2O == NH3 ↑ + H2O加热(2)氨与酸反应——生成铵盐现象:产生大量的白烟NH3 + HCl == NH4ClNH3的实验室制法反应原理:铵盐的性质铵盐受热易分解:△NH4NO3 + NaOH == NH3↑ + NaNO3 + H2ONH4+的检验:铵盐 OH-△有刺激性气味的气体产生,湿润的红色石蕊试纸变蓝(1)H2SO4=2H++SO42-
HCl = H++Cl-
HNO3 = H++NO3-
(2)稀硫酸和盐酸属于有弱氧化性,其氧化性实际上是H+的氧化性,与金属反应时H+被还原为H2;而浓硫酸和硝酸属于有强氧化性,与金属反应时是+6价的S和+5价的N被还原为SO2和NO或NO2等,无H2产生。酸酸的通性实质就是H+的性质。 二)硫酸1、物理性质:浓硫酸无色、无味、粘稠的油状液体,密度大,沸点高,难挥发,与水任意比互溶。2、化学性质:
1)稀硫酸具有酸的通性
A、使石蕊溶液变红
B、和碱反应
C、和碱性氧化物反应
D、和盐反应
E、和金属反应 3、浓硫酸的特性:
①吸水性:可作干燥剂(不可干燥氨气)
②脱水性
③强氧化性浓硫酸的强氧化性:① 加热时浓硫酸能与大多数金属(除Au、 Pt)反应,但不生成氢气。钝化:常温下,浓硫酸或浓硝酸能使Al、Fe等金属表面生成致密的氧化物保护膜,阻止内部金属继续反应。此现象称 “钝化”② 与某些非金属反应三)硝酸纯HNO3是 色、易 ,有
气味的液体,能与水任意比互溶. 物理性质: 挥发刺激性无化学性质:强氧化性:稀硝酸和浓硝酸都有强氧化性硝酸能与大部分金属(除金和铂)反应:四)王水:硝酸虽具有强氧化性,但不能氧化金、铂。但王水能金、铂溶解。王水是浓HNO3和浓HCl按1:3的体积比混合成的氧化性更强的溶液.
