2017春高二化学鲁科版选修二检测:2.3 纯碱制造技术的发展
文档属性
| 名称 | 2017春高二化学鲁科版选修二检测:2.3 纯碱制造技术的发展 | 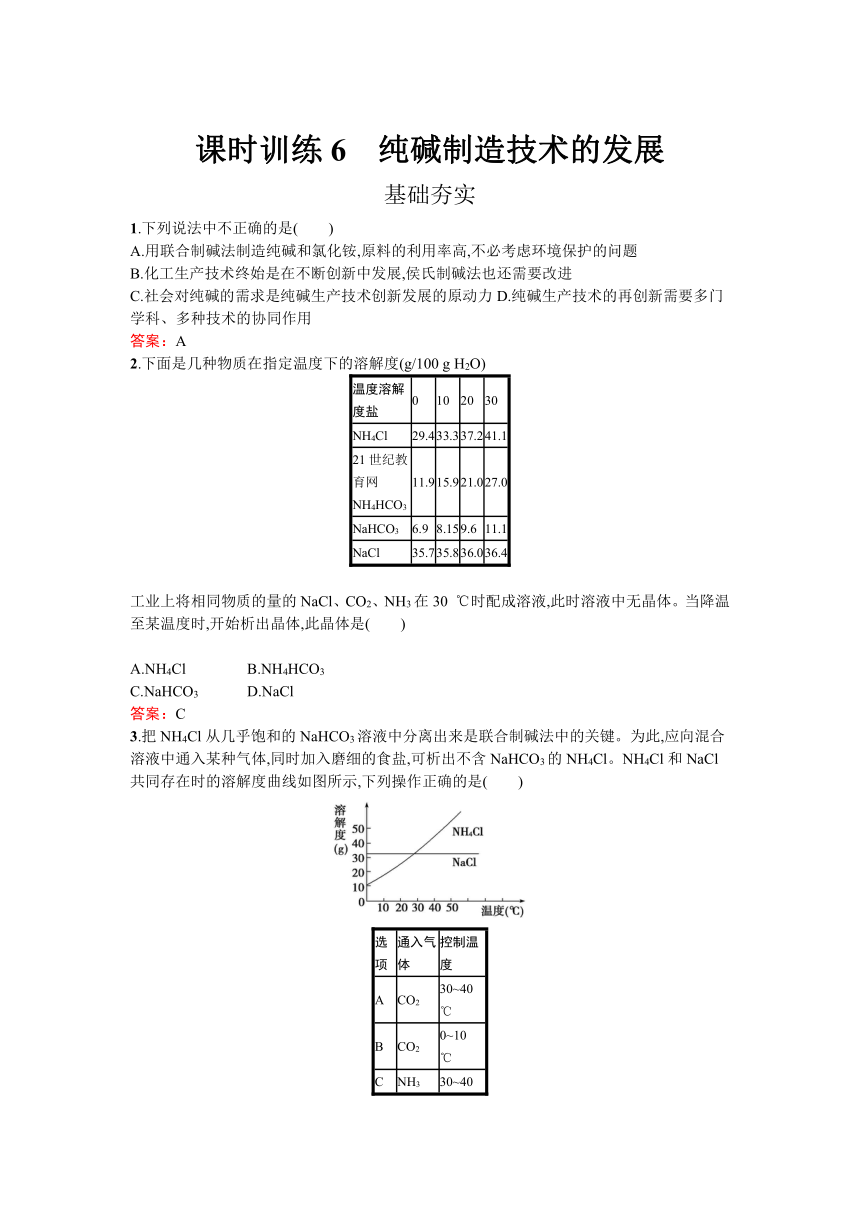 | |
| 格式 | zip | ||
| 文件大小 | 268.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-02-14 14:31:11 | ||
图片预览


文档简介
课时训练6 纯碱制造技术的发展
基础夯实
1.下列说法中不正确的是( )
A.用联合制碱法制造纯碱和氯化铵,原料的利用率高,不必考虑环境保护的问题
B.化工生产技术终始是在不断创新中发展,侯氏制碱法也还需要改进
C.社会对纯碱的需求是纯碱生产技术创新发展的原动力D.纯碱生产技术的再创新需要多门学科、多种技术的协同作用
答案:A
2.下面是几种物质在指定温度下的溶解度(g/100
g
H2O)
温度溶解度盐
0
10
20
30
NH4Cl
29.4
33.3
37.2
41.1
21世纪教育网NH4HCO3
11.9
15.9
21.0
27.0
NaHCO3
6.9
8.15
9.6
11.1
NaCl
35.7
35.8
36.0
36.4
工业上将相同物质的量的NaCl、CO2、NH3在30
℃时配成溶液,此时溶液中无晶体。当降温至某温度时,开始析出晶体,此晶体是( )
A.NH4Cl
B.NH4HCO3
C.NaHCO3
D.NaCl
答案:C
3.把NH4Cl从几乎饱和的NaHCO3溶液中分离出来是联合制碱法中的关键。为此,应向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不含NaHCO3的NH4Cl。NH4Cl和NaCl共同存在时的溶解度曲线如图所示,下列操作正确的是( )
选项
通入气体
控制温度
A
CO2
30~40
℃
B
CO2
0~10
℃
C
NH3
30~40
℃
D
NH3
0~10
℃
解析:析出NH4Cl应选择NH4Cl的溶解度很小的范围,即0~10
℃,同时通入NH3以增大溶液中N的浓度,利于NH4Cl的析出。
答案:D
4.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。
下列操作正确的是( )
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
解析:CO2在水中的溶解度不大,而NH3极易溶于水,所以先通NH3,剩余NH3用稀硫酸吸收。
答案:C
5.某制碱法的生产流程如下:
氨水溶液A
B该法生产过程中可循环的物质是( )
A.NH3和CO2
B.Ca(OH)2
C.NH4Cl
D.NaCl
答案:A6.我国化工专家侯德榜大胆改革国外氨碱法生产工艺发明了联合制碱法,联合制碱法所得最终的化工产品的组合正确的是( )
①NaHCO3 ②Na2CO3 ③CaCl2 ④NH4HCO3
⑤NH4Cl
A.①②
B.②③
C.②⑤
D.②④
解析:联合制碱法利用反应:NaCl+NH3+H2O+CO2NaHCO3↓+NH4Cl,先过滤出NaHCO3,煅烧得Na2CO3,再向滤液中加入氨气和食盐粉并降温得NH4Cl,故最终产品为②和⑤。
答案:C
7.侯氏制碱法的步骤如下:
饱和食盐水饱和氨化食盐水
悬浊液
试回答下列问题:
(1)若上述的悬浊液是NaHCO3和NH4Cl的混合液,则Ⅰ和Ⅱ的总反应式为 。
(2)由这一反应可知NaCl比NaHCO3的溶解度 。
(3)操作Ⅰ、Ⅱ不能颠倒的原因是
。
(4)Ⅲ的操作叫 。
(5)Ⅳ的操作叫 。
解析:(1)根据反应物和生成物可写出总反应式。(2)由制备步骤可知,第Ⅱ步得到的悬浊液含有NaHCO3固体,说明NaCl的溶解度比NaHCO3的溶解度大。
答案:(1)NaCl+NH3+CO2+H2ONaHCO3↓+NH4Cl
(2)大
(3)由于CO2在水中的溶解度较小,后通NH3不可能产生大量HC,故不可能析出NaHCO3晶体
(4)过滤 (5)煅烧
能力提升
8.工业制纯碱时,第一步通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶。它的反应原理可以用下面的方程式表示:NH3+CO2+H2ONH4HCO3,NH4HCO3+NaCl(饱和)NaHCO3↓+NH4Cl
以上反应的总结果是放热反应。下面设计了一个实验,用最简单的实验装置模拟这一实验过程,获得碳酸氢钠结晶。可供选择的实验用品有:稀盐酸、稀硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。实验装置示意图(包括反应时容器中的物质)如下,图中玻璃容器从左至右分别用A、B、C、D、E符号标明。
(1)请写出在图上A、B、C、D、E各玻璃容器中盛放物质的化学式或名称。
A ,B ,C ,D ,
E 。
(2)利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶
答案:(1)CaCO3 蒸馏水(或水) 冰水(或冷水) 饱和氯化钠的浓氨水溶液 稀硫酸
(2)取少量产品放在试管中,在酒精灯上加热至不再有气体放出时,停止加热。试管中如有白色剩余物质,则得到的产品不是NH4HCO3。试管冷却后,向其中加入适量盐酸,反应激烈,冒大量气泡,最后剩余物全部溶解,说明得到的结晶是NaHCO3。如加入盐酸后,晶体全部溶解,但无气泡产生,则得到的结晶可能是食盐。
9.我国化学家侯德榜改革国外的纯碱生产工艺,探索出了一种生产纯碱的方法,其生产流程可简要表示如下:
(1)上述生产纯碱的方法称 ,副产品的一种用途为 。
(2)沉淀池中发生反应的化学方程式是
。
(3)写出上述流程中X物质的分子式为 。
(4)使原料氯化钠的利用率从75%提高到95%以上,主要是设计了 (填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
a.增大N的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出NH4Cl的纯度
解析:将NH3和CO2两种气体通入NaCl溶液后,发生化学反应:NH3+CO2+H2O+NaClNaHCO3↓+NH4Cl,NaHCO3溶解度较小,结晶析出;NH4Cl溶解度较大,留在母液中;溶液里还有未反应的NaCl和未结晶的NaHCO3。从母液中提取NH4Cl后,含有NaCl和NaHCO3的溶液循环到沉淀池中再次利用,这样就大大提高了氯化钠的利用率。NaHCO3在煅烧炉中发生化学反应2NaHCO3Na2CO3+CO2↑+H2O↑。生成的CO2循环到沉淀池中再次利用。含NH4Cl、NaHCO3、NaCl的母液中通入NH3后,发生反应NH3+H2ONH3·H2ON+OH-,这样有利于NH4Cl的析出和NaHCO3转化为Na2CO3。
答案:(1)侯氏制碱法(或联合制碱法) 用做农作物的化肥(其他合理的答案亦可)
(2)NH3+CO2+H2O+NaClNaHCO3↓+NH4Cl
(3)CO2
(4)Ⅰ 过滤
(5)硝酸酸化的硝酸银溶液
(6)ac
基础夯实
1.下列说法中不正确的是( )
A.用联合制碱法制造纯碱和氯化铵,原料的利用率高,不必考虑环境保护的问题
B.化工生产技术终始是在不断创新中发展,侯氏制碱法也还需要改进
C.社会对纯碱的需求是纯碱生产技术创新发展的原动力D.纯碱生产技术的再创新需要多门学科、多种技术的协同作用
答案:A
2.下面是几种物质在指定温度下的溶解度(g/100
g
H2O)
温度溶解度盐
0
10
20
30
NH4Cl
29.4
33.3
37.2
41.1
21世纪教育网NH4HCO3
11.9
15.9
21.0
27.0
NaHCO3
6.9
8.15
9.6
11.1
NaCl
35.7
35.8
36.0
36.4
工业上将相同物质的量的NaCl、CO2、NH3在30
℃时配成溶液,此时溶液中无晶体。当降温至某温度时,开始析出晶体,此晶体是( )
A.NH4Cl
B.NH4HCO3
C.NaHCO3
D.NaCl
答案:C
3.把NH4Cl从几乎饱和的NaHCO3溶液中分离出来是联合制碱法中的关键。为此,应向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不含NaHCO3的NH4Cl。NH4Cl和NaCl共同存在时的溶解度曲线如图所示,下列操作正确的是( )
选项
通入气体
控制温度
A
CO2
30~40
℃
B
CO2
0~10
℃
C
NH3
30~40
℃
D
NH3
0~10
℃
解析:析出NH4Cl应选择NH4Cl的溶解度很小的范围,即0~10
℃,同时通入NH3以增大溶液中N的浓度,利于NH4Cl的析出。
答案:D
4.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。
下列操作正确的是( )
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3,然后a通入CO2,c中放碱石灰C.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
解析:CO2在水中的溶解度不大,而NH3极易溶于水,所以先通NH3,剩余NH3用稀硫酸吸收。
答案:C
5.某制碱法的生产流程如下:
氨水溶液A
B该法生产过程中可循环的物质是( )
A.NH3和CO2
B.Ca(OH)2
C.NH4Cl
D.NaCl
答案:A6.我国化工专家侯德榜大胆改革国外氨碱法生产工艺发明了联合制碱法,联合制碱法所得最终的化工产品的组合正确的是( )
①NaHCO3 ②Na2CO3 ③CaCl2 ④NH4HCO3
⑤NH4Cl
A.①②
B.②③
C.②⑤
D.②④
解析:联合制碱法利用反应:NaCl+NH3+H2O+CO2NaHCO3↓+NH4Cl,先过滤出NaHCO3,煅烧得Na2CO3,再向滤液中加入氨气和食盐粉并降温得NH4Cl,故最终产品为②和⑤。
答案:C
7.侯氏制碱法的步骤如下:
饱和食盐水饱和氨化食盐水
悬浊液
试回答下列问题:
(1)若上述的悬浊液是NaHCO3和NH4Cl的混合液,则Ⅰ和Ⅱ的总反应式为 。
(2)由这一反应可知NaCl比NaHCO3的溶解度 。
(3)操作Ⅰ、Ⅱ不能颠倒的原因是
。
(4)Ⅲ的操作叫 。
(5)Ⅳ的操作叫 。
解析:(1)根据反应物和生成物可写出总反应式。(2)由制备步骤可知,第Ⅱ步得到的悬浊液含有NaHCO3固体,说明NaCl的溶解度比NaHCO3的溶解度大。
答案:(1)NaCl+NH3+CO2+H2ONaHCO3↓+NH4Cl
(2)大
(3)由于CO2在水中的溶解度较小,后通NH3不可能产生大量HC,故不可能析出NaHCO3晶体
(4)过滤 (5)煅烧
能力提升
8.工业制纯碱时,第一步通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶。它的反应原理可以用下面的方程式表示:NH3+CO2+H2ONH4HCO3,NH4HCO3+NaCl(饱和)NaHCO3↓+NH4Cl
以上反应的总结果是放热反应。下面设计了一个实验,用最简单的实验装置模拟这一实验过程,获得碳酸氢钠结晶。可供选择的实验用品有:稀盐酸、稀硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。实验装置示意图(包括反应时容器中的物质)如下,图中玻璃容器从左至右分别用A、B、C、D、E符号标明。
(1)请写出在图上A、B、C、D、E各玻璃容器中盛放物质的化学式或名称。
A ,B ,C ,D ,
E 。
(2)利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶
答案:(1)CaCO3 蒸馏水(或水) 冰水(或冷水) 饱和氯化钠的浓氨水溶液 稀硫酸
(2)取少量产品放在试管中,在酒精灯上加热至不再有气体放出时,停止加热。试管中如有白色剩余物质,则得到的产品不是NH4HCO3。试管冷却后,向其中加入适量盐酸,反应激烈,冒大量气泡,最后剩余物全部溶解,说明得到的结晶是NaHCO3。如加入盐酸后,晶体全部溶解,但无气泡产生,则得到的结晶可能是食盐。
9.我国化学家侯德榜改革国外的纯碱生产工艺,探索出了一种生产纯碱的方法,其生产流程可简要表示如下:
(1)上述生产纯碱的方法称 ,副产品的一种用途为 。
(2)沉淀池中发生反应的化学方程式是
。
(3)写出上述流程中X物质的分子式为 。
(4)使原料氯化钠的利用率从75%提高到95%以上,主要是设计了 (填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
a.增大N的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出NH4Cl的纯度
解析:将NH3和CO2两种气体通入NaCl溶液后,发生化学反应:NH3+CO2+H2O+NaClNaHCO3↓+NH4Cl,NaHCO3溶解度较小,结晶析出;NH4Cl溶解度较大,留在母液中;溶液里还有未反应的NaCl和未结晶的NaHCO3。从母液中提取NH4Cl后,含有NaCl和NaHCO3的溶液循环到沉淀池中再次利用,这样就大大提高了氯化钠的利用率。NaHCO3在煅烧炉中发生化学反应2NaHCO3Na2CO3+CO2↑+H2O↑。生成的CO2循环到沉淀池中再次利用。含NH4Cl、NaHCO3、NaCl的母液中通入NH3后,发生反应NH3+H2ONH3·H2ON+OH-,这样有利于NH4Cl的析出和NaHCO3转化为Na2CO3。
答案:(1)侯氏制碱法(或联合制碱法) 用做农作物的化肥(其他合理的答案亦可)
(2)NH3+CO2+H2O+NaClNaHCO3↓+NH4Cl
(3)CO2
(4)Ⅰ 过滤
(5)硝酸酸化的硝酸银溶液
(6)ac
同课章节目录
