2017春高二化学鲁科版选修二检测:1.2 氨的工业合成
文档属性
| 名称 | 2017春高二化学鲁科版选修二检测:1.2 氨的工业合成 |  | |
| 格式 | zip | ||
| 文件大小 | 362.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-02-14 21:17:26 | ||
图片预览


文档简介
课时训练2 氨的工业合成
基础夯实
1.将空气中的氮气转化成氮的化合物的过程称为固氮。下列过程中能实现人工固氮的是( )
A.雷雨放电时在大气中生成氮的氧化物
B.电解饱和食盐水
C.与豆科植物共生的根瘤菌吸收空气中的氮生成某些含氮化合物
D.工业合成氨
解析:A、C均是自然固氮,只有D是人工固氮。
答案:D
2.用焦炭、空气、水为原料制备NH3的有关反应的化学方程式如下:
①C+H2OCO+H2②CO+H2OCO2+H2
③N2+3H22NH3
参加反应的焦炭与氨气之间的物质的量之比约为
( )
A.3∶4
B.3∶2
C.2∶3
D.1∶2
解析:此题应采用关系式来求解。由反应①②可得C~2H2,由③可得,3H2~2NH3,故:3C~6H2~4NH3,n(C)∶n(NH3)=3∶4。
答案:A
3.1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是( )
A.①②③
B.②④⑤
C.①③⑤
D.②③④
答案:B
4.有关合成氨工业的说法中,正确的是( )
A.从合成塔出来的混合气体中,NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2在实际生产中是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500
℃左右,目的是使化学平衡向正反应方向移动
D.合成氨采用的压强是2×107~5×107
Pa,因为该压强下铁触媒的活性最大
答案:B
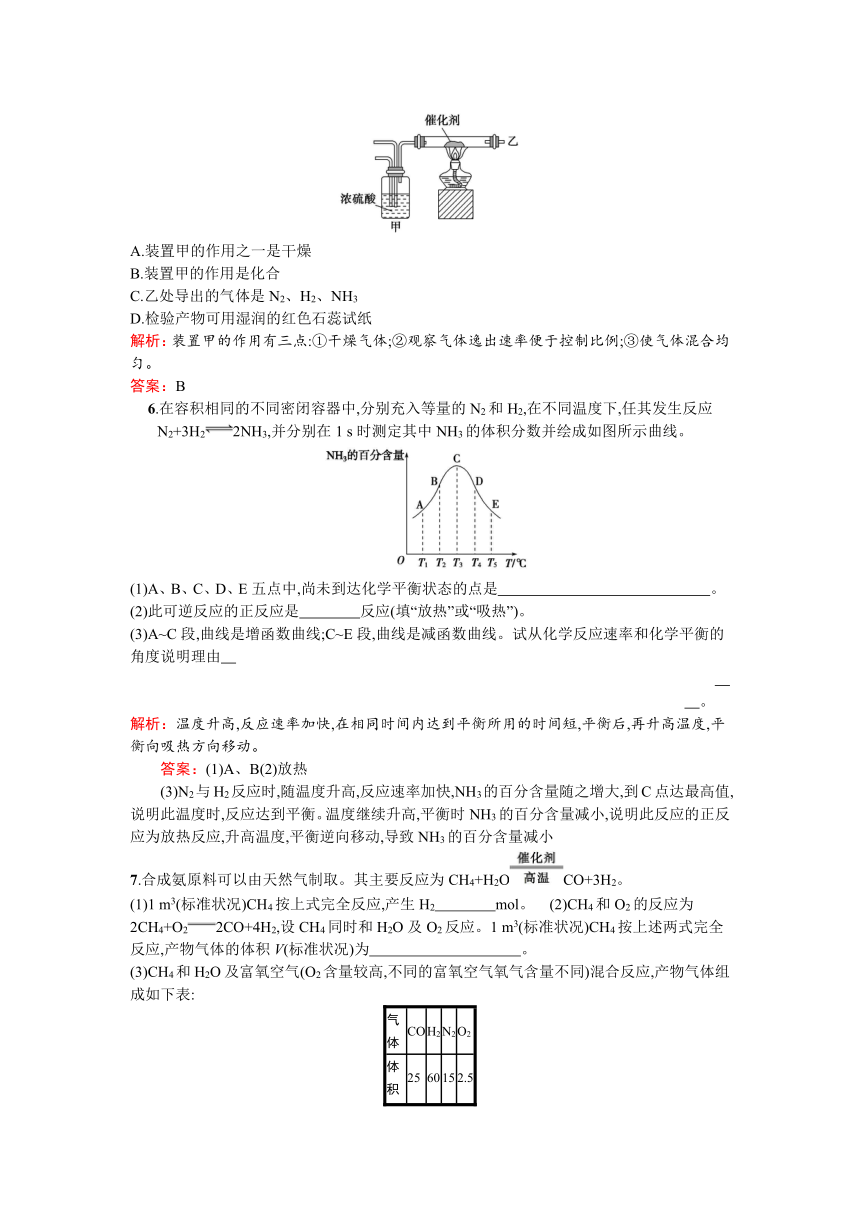
5.实验室合成氨装置如图所示,则以下说法中错误的是
( )
A.装置甲的作用之一是干燥
B.装置甲的作用是化合
C.乙处导出的气体是N2、H2、NH3
D.检验产物可用湿润的红色石蕊试纸
解析:装置甲的作用有三点:①干燥气体;②观察气体逸出速率便于控制比例;③使气体混合均匀。
答案:B
6.在容积相同的不同密闭容器中,分别充入等量的N2和H2,在不同温度下,任其发生反应N2+3H22NH3,并分别在1
s时测定其中NH3的体积分数并绘成如图所示曲线。
(1)A、B、C、D、E五点中,尚未到达化学平衡状态的点是 。
(2)此可逆反应的正反应是 反应(填“放热”或“吸热”)。
(3)A~C段,曲线是增函数曲线;C~E段,曲线是减函数曲线。试从化学反应速率和化学平衡的角度说明理由
。
解析:温度升高,反应速率加快,在相同时间内达到平衡所用的时间短,平衡后,再升高温度,平衡向吸热方向移动。
答案:(1)A、B(2)放热
(3)N2与H2反应时,随温度升高,反应速率加快,NH3的百分含量随之增大,到C点达最高值,说明此温度时,反应达到平衡。温度继续升高,平衡时NH3的百分含量减小,说明此反应的正反应为放热反应,升高温度,平衡逆向移动,导致NH3的百分含量减小
7.合成氨原料可以由天然气制取。其主要反应为CH4+H2OCO+3H2。
(1)1
m3(标准状况)CH4按上式完全反应,产生H2 mol。 (2)CH4和O2的反应为2CH4+O22CO+4H2,设CH4同时和H2O及O2反应。1
m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为 。
(3)CH4和H2O及富氧空气(O2含量较高,不同的富氧空气氧气含量不同)混合反应,产物气体组成如下表:
气体
CO
H2
N2
O2
体积/L
25
60
15
2.5
计算该富氧空气中O2和N2体积比V(O2)∶V(N2)。
解析:(1)由方程式知:每摩尔CH4完全转化为3
mol
H2,故有n(H2)=×3≈133.9
mol。
(2)由CH4+H2OCO+3H2知,1
mol
CH4完全按上式反应可生成4
mol气体,如按2CH4+O22CO+4H2知,每1
mol
CH4完全反应可产生3
mol气体。按阿伏加德罗定律的推论知:1
m3
CH4与H2O及O2按上述两式完全反应,产生气体的体积V应符合3
m3m3。
(3)设CH4与H2O反应产生CO的体积为y升,CH4与O2反应产生CO的体积为x升:
则有所以
由2CH4+O22CO+4H2得
该反应消耗氧气体积为:
L=7.5
L,故空气中V(O2)∶V(N2)=。答案:(1)133.9 (2)3
m3m3 (3)
能力提升
8.工业合成氨是在一定条件下进行的可逆反应:N2+3H22NH3。
其部分工艺流程如下:
请回答下列问题:
(1)第②步除需要催化剂这个条件外,还需要的条件是 。 (2)第①步操作中的原料气的“净化”目的是 ,第③步操作中的目的是 。
(3)工业合成氨反应后可以通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法的原理类似于下列哪种方法 (填字母)。
a.过滤
b.蒸馏
c.分液
d.萃取
你作出这个判断的理由是
。
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟生成。该反应的化学方程式为
。
解析:(2)原料气中往往含有使催化剂中毒的物质,所以在进行原料气的反应前,需要除掉其中的杂质;工业合成氨反应后的混合气体中既有氨气,也有未反应的氢气、氮气,所以为了提高原料气的利用率,将未反应的原料气进行重新利用,这样可以提高经济效益。(3)降低温度,氨变为液态,从而进行分离,所以跟工业上利用的蒸馏类似,都是通过改变温度,使物质的状态发生变化而分离。(4)2NH3+3Cl2N2+6HCl,生成的HCl又与NH3反应生成NH4Cl小颗粒——白烟产生。
答案:(1)高温、高压(或500
℃左右、20~50
MPa)
(2)防止催化剂“中毒” 提高原料利用率(或提高经济效益等)
(3)b 通过温度的改变而改变物质的状态,达到分离的目的
(4)8NH3+3Cl26NH4Cl+N2
9.
图甲
合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。
(1)X的化学式为 。
(2)图中条件选定的主要原因是 (填字母编号)。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(3)改变反应条件,会使平衡发生移动。如图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是 ,当横坐标为温度时,变化趋势正确的是 (填字母编号)。
图乙
解析:(1)原料气N2和H2经一定条件下反应,最后生成液态NH3(X)从设备中分离出来,同时尾气中含有的Y(N2和H2)进行循环利用。(2)温度选择在500
℃并不是从化学平衡的影响分析的,而是因为催化剂在此温度时活性大,而且还可以适当提高化学反应速率。压强选择20~50
MPa是从化学平衡理论分析的,压强越大,平衡向生成NH3的方向移动,但不能过大,因为压强过大,对设备、材料的要求高,投资大,这样就不经济。(3)考查压强、温度对化学平衡的影响。
答案:(1)NH3 (2)BC (3)c a
10.已知如下图所示“合成氨”的演示实验(夹持仪器均已省略)。在Y形管的一侧用Zn粒和稀硫酸反应制取H2,另一侧用NaNO2固体和饱和NH4Cl溶液反应制取N2。N2和H2混合通过还原铁粉来合成NH3,再将产生的气体通入酚酞溶液中,若酚酞溶液变红,即说明产生了氨气。某课外活动小组通过查阅资料和多次实验,得到了如下信息:
信息一:NaNO2固体和饱和NH4Cl溶液混合加热的过程中发生了如下反应:
①NaNO2+NH4ClNH4NO2+NaCl;
②NH4NO2NH3+HNO2;
③2HNO2N2O3+H2O;
④2NH3+N2O32N2+3H2O。
信息二:不同体积比的N2、H2混合气体在相同实验条件下合成氨,使酚酞溶液变红所需要的时间如下:
N2和H2的体积比
5∶1
3∶1
1∶1
1∶3
1∶5
酚酞溶液变红所需时间/min
8~9
7~8
6~7
3~4
9~10
据此回答下列问题:
(1)Y形管左侧管中发生反应的离子方程式为
。
(2)石棉绒的作用是 。
(3)课外小组的同学们认为,该实验中即使酚酞溶液变红也不能说明N2和H2反应合成了NH3,得出此结论的理由是 。
请你另设计一个简单的实验验证你的理由
。
欲解决这一问题,可以选用下图的 装置连接在原装置中的 和 之间。
(4)在上述实验过程中,为尽快观察到酚酞溶液变红的实验现象,应该控制N2和H2的体积比为 比较适宜。但该装置还难以实现此目的,原因是
。
(5)实验过程中通入试管C中的气体的成分有 。
答案:(1)Zn+2H+Zn2++H2↑
(2)增大混合气体与催化剂还原铁粉的接触面积,使反应进行得更充分
(3)从分步反应可知,产生N2的过程中,有可能直接产生氨气 将NaNO2固体和饱和NH4Cl溶液混合加热产生的气体直接通入酚酞溶液,若酚酞溶液变红,则说明理由成立,否则不成立 ③ A B
(4)1∶3 无法控制通入B中的N2和H2的体积比
(5)NH3、N2、H2
11.某化学学习小组决定在实验室模拟工业生产原理制备少量氨气,设计了如下实验:
①连接好装置并检查实验装置的气密性后,制备少量氢气并检验氢气纯度;
②用氢气将空气中的氧气消耗掉,得到氢气与氮气的混合气体;
③用铁触媒催化使氢气与氮气反应生成氨气;
④检验氨气的生成。
(1)检验氢气纯度的目的是 。
(2)上述各装置的接口正确的连接顺序为 。
(3)操作②时,弹簧夹a、b、c的开、关情况为 ,如何判断氧气已经完全被消耗掉
。
(4)在步骤③中,先加热铁触媒,后通混合气体的原因是 ,反应管D中发生反应的化学方程式是
。
(5)若有氨气生成,现象为 。
(6)该装置 (填“有”或“无”)缺点,若有,改进措施为
。
解析:(1)点燃易燃气体时,若气体中混有空气(氧气),点燃会发生爆炸,故点燃之前一定要检验纯度;(2)根据实验步骤的先后,可确定各装置的接口顺序为①⑤④②③⑥;(3)用氢气将空气中的氧气消耗掉时,应该关闭弹簧夹b、c,打开a;点燃氢气,当火焰熄灭时,则氧气被消耗掉;(4)由于铁触媒有一定的活性温度要求,故先加热铁触媒,再通混合气体;(5)若产生氨气,溶于水显碱性,会使E中溶液变红;(6)为防止催化剂中毒,应该在反应前把氢气与氮气的混合气体干燥,另外氨气是一种污染性气体,不能直接排入大气中,应该设有尾气处理装置。
答案:(1)防止因氢气不纯而发生爆炸
(2)①⑤④②③⑥
(3)关闭弹簧夹b、c,打开a 氢气在C瓶内燃烧,火焰熄灭时,证明氧气完全被消耗掉
(4)铁触媒在较高温度时活性增大,加快合成氨的反应速率 N2+3H22NH3
(5)E中溶液变红
(6)有 氢气与氮气的混合气体应该先通过干燥装置,再通入反应装置;⑦后连接一个吸收氨气的装置
基础夯实
1.将空气中的氮气转化成氮的化合物的过程称为固氮。下列过程中能实现人工固氮的是( )
A.雷雨放电时在大气中生成氮的氧化物
B.电解饱和食盐水
C.与豆科植物共生的根瘤菌吸收空气中的氮生成某些含氮化合物
D.工业合成氨
解析:A、C均是自然固氮,只有D是人工固氮。
答案:D
2.用焦炭、空气、水为原料制备NH3的有关反应的化学方程式如下:
①C+H2OCO+H2②CO+H2OCO2+H2
③N2+3H22NH3
参加反应的焦炭与氨气之间的物质的量之比约为
( )
A.3∶4
B.3∶2
C.2∶3
D.1∶2
解析:此题应采用关系式来求解。由反应①②可得C~2H2,由③可得,3H2~2NH3,故:3C~6H2~4NH3,n(C)∶n(NH3)=3∶4。
答案:A
3.1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是( )
A.①②③
B.②④⑤
C.①③⑤
D.②③④
答案:B
4.有关合成氨工业的说法中,正确的是( )
A.从合成塔出来的混合气体中,NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2在实际生产中是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500
℃左右,目的是使化学平衡向正反应方向移动
D.合成氨采用的压强是2×107~5×107
Pa,因为该压强下铁触媒的活性最大
答案:B
5.实验室合成氨装置如图所示,则以下说法中错误的是
( )
A.装置甲的作用之一是干燥
B.装置甲的作用是化合
C.乙处导出的气体是N2、H2、NH3
D.检验产物可用湿润的红色石蕊试纸
解析:装置甲的作用有三点:①干燥气体;②观察气体逸出速率便于控制比例;③使气体混合均匀。
答案:B
6.在容积相同的不同密闭容器中,分别充入等量的N2和H2,在不同温度下,任其发生反应N2+3H22NH3,并分别在1
s时测定其中NH3的体积分数并绘成如图所示曲线。
(1)A、B、C、D、E五点中,尚未到达化学平衡状态的点是 。
(2)此可逆反应的正反应是 反应(填“放热”或“吸热”)。
(3)A~C段,曲线是增函数曲线;C~E段,曲线是减函数曲线。试从化学反应速率和化学平衡的角度说明理由
。
解析:温度升高,反应速率加快,在相同时间内达到平衡所用的时间短,平衡后,再升高温度,平衡向吸热方向移动。
答案:(1)A、B(2)放热
(3)N2与H2反应时,随温度升高,反应速率加快,NH3的百分含量随之增大,到C点达最高值,说明此温度时,反应达到平衡。温度继续升高,平衡时NH3的百分含量减小,说明此反应的正反应为放热反应,升高温度,平衡逆向移动,导致NH3的百分含量减小
7.合成氨原料可以由天然气制取。其主要反应为CH4+H2OCO+3H2。
(1)1
m3(标准状况)CH4按上式完全反应,产生H2 mol。 (2)CH4和O2的反应为2CH4+O22CO+4H2,设CH4同时和H2O及O2反应。1
m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为 。
(3)CH4和H2O及富氧空气(O2含量较高,不同的富氧空气氧气含量不同)混合反应,产物气体组成如下表:
气体
CO
H2
N2
O2
体积/L
25
60
15
2.5
计算该富氧空气中O2和N2体积比V(O2)∶V(N2)。
解析:(1)由方程式知:每摩尔CH4完全转化为3
mol
H2,故有n(H2)=×3≈133.9
mol。
(2)由CH4+H2OCO+3H2知,1
mol
CH4完全按上式反应可生成4
mol气体,如按2CH4+O22CO+4H2知,每1
mol
CH4完全反应可产生3
mol气体。按阿伏加德罗定律的推论知:1
m3
CH4与H2O及O2按上述两式完全反应,产生气体的体积V应符合3
m3
(3)设CH4与H2O反应产生CO的体积为y升,CH4与O2反应产生CO的体积为x升:
则有所以
由2CH4+O22CO+4H2得
该反应消耗氧气体积为:
L=7.5
L,故空气中V(O2)∶V(N2)=。答案:(1)133.9 (2)3
m3
能力提升
8.工业合成氨是在一定条件下进行的可逆反应:N2+3H22NH3。
其部分工艺流程如下:
请回答下列问题:
(1)第②步除需要催化剂这个条件外,还需要的条件是 。 (2)第①步操作中的原料气的“净化”目的是 ,第③步操作中的目的是 。
(3)工业合成氨反应后可以通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法的原理类似于下列哪种方法 (填字母)。
a.过滤
b.蒸馏
c.分液
d.萃取
你作出这个判断的理由是
。
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟生成。该反应的化学方程式为
。
解析:(2)原料气中往往含有使催化剂中毒的物质,所以在进行原料气的反应前,需要除掉其中的杂质;工业合成氨反应后的混合气体中既有氨气,也有未反应的氢气、氮气,所以为了提高原料气的利用率,将未反应的原料气进行重新利用,这样可以提高经济效益。(3)降低温度,氨变为液态,从而进行分离,所以跟工业上利用的蒸馏类似,都是通过改变温度,使物质的状态发生变化而分离。(4)2NH3+3Cl2N2+6HCl,生成的HCl又与NH3反应生成NH4Cl小颗粒——白烟产生。
答案:(1)高温、高压(或500
℃左右、20~50
MPa)
(2)防止催化剂“中毒” 提高原料利用率(或提高经济效益等)
(3)b 通过温度的改变而改变物质的状态,达到分离的目的
(4)8NH3+3Cl26NH4Cl+N2
9.
图甲
合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。
(1)X的化学式为 。
(2)图中条件选定的主要原因是 (填字母编号)。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(3)改变反应条件,会使平衡发生移动。如图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是 ,当横坐标为温度时,变化趋势正确的是 (填字母编号)。
图乙
解析:(1)原料气N2和H2经一定条件下反应,最后生成液态NH3(X)从设备中分离出来,同时尾气中含有的Y(N2和H2)进行循环利用。(2)温度选择在500
℃并不是从化学平衡的影响分析的,而是因为催化剂在此温度时活性大,而且还可以适当提高化学反应速率。压强选择20~50
MPa是从化学平衡理论分析的,压强越大,平衡向生成NH3的方向移动,但不能过大,因为压强过大,对设备、材料的要求高,投资大,这样就不经济。(3)考查压强、温度对化学平衡的影响。
答案:(1)NH3 (2)BC (3)c a
10.已知如下图所示“合成氨”的演示实验(夹持仪器均已省略)。在Y形管的一侧用Zn粒和稀硫酸反应制取H2,另一侧用NaNO2固体和饱和NH4Cl溶液反应制取N2。N2和H2混合通过还原铁粉来合成NH3,再将产生的气体通入酚酞溶液中,若酚酞溶液变红,即说明产生了氨气。某课外活动小组通过查阅资料和多次实验,得到了如下信息:
信息一:NaNO2固体和饱和NH4Cl溶液混合加热的过程中发生了如下反应:
①NaNO2+NH4ClNH4NO2+NaCl;
②NH4NO2NH3+HNO2;
③2HNO2N2O3+H2O;
④2NH3+N2O32N2+3H2O。
信息二:不同体积比的N2、H2混合气体在相同实验条件下合成氨,使酚酞溶液变红所需要的时间如下:
N2和H2的体积比
5∶1
3∶1
1∶1
1∶3
1∶5
酚酞溶液变红所需时间/min
8~9
7~8
6~7
3~4
9~10
据此回答下列问题:
(1)Y形管左侧管中发生反应的离子方程式为
。
(2)石棉绒的作用是 。
(3)课外小组的同学们认为,该实验中即使酚酞溶液变红也不能说明N2和H2反应合成了NH3,得出此结论的理由是 。
请你另设计一个简单的实验验证你的理由
。
欲解决这一问题,可以选用下图的 装置连接在原装置中的 和 之间。
(4)在上述实验过程中,为尽快观察到酚酞溶液变红的实验现象,应该控制N2和H2的体积比为 比较适宜。但该装置还难以实现此目的,原因是
。
(5)实验过程中通入试管C中的气体的成分有 。
答案:(1)Zn+2H+Zn2++H2↑
(2)增大混合气体与催化剂还原铁粉的接触面积,使反应进行得更充分
(3)从分步反应可知,产生N2的过程中,有可能直接产生氨气 将NaNO2固体和饱和NH4Cl溶液混合加热产生的气体直接通入酚酞溶液,若酚酞溶液变红,则说明理由成立,否则不成立 ③ A B
(4)1∶3 无法控制通入B中的N2和H2的体积比
(5)NH3、N2、H2
11.某化学学习小组决定在实验室模拟工业生产原理制备少量氨气,设计了如下实验:
①连接好装置并检查实验装置的气密性后,制备少量氢气并检验氢气纯度;
②用氢气将空气中的氧气消耗掉,得到氢气与氮气的混合气体;
③用铁触媒催化使氢气与氮气反应生成氨气;
④检验氨气的生成。
(1)检验氢气纯度的目的是 。
(2)上述各装置的接口正确的连接顺序为 。
(3)操作②时,弹簧夹a、b、c的开、关情况为 ,如何判断氧气已经完全被消耗掉
。
(4)在步骤③中,先加热铁触媒,后通混合气体的原因是 ,反应管D中发生反应的化学方程式是
。
(5)若有氨气生成,现象为 。
(6)该装置 (填“有”或“无”)缺点,若有,改进措施为
。
解析:(1)点燃易燃气体时,若气体中混有空气(氧气),点燃会发生爆炸,故点燃之前一定要检验纯度;(2)根据实验步骤的先后,可确定各装置的接口顺序为①⑤④②③⑥;(3)用氢气将空气中的氧气消耗掉时,应该关闭弹簧夹b、c,打开a;点燃氢气,当火焰熄灭时,则氧气被消耗掉;(4)由于铁触媒有一定的活性温度要求,故先加热铁触媒,再通混合气体;(5)若产生氨气,溶于水显碱性,会使E中溶液变红;(6)为防止催化剂中毒,应该在反应前把氢气与氮气的混合气体干燥,另外氨气是一种污染性气体,不能直接排入大气中,应该设有尾气处理装置。
答案:(1)防止因氢气不纯而发生爆炸
(2)①⑤④②③⑥
(3)关闭弹簧夹b、c,打开a 氢气在C瓶内燃烧,火焰熄灭时,证明氧气完全被消耗掉
(4)铁触媒在较高温度时活性增大,加快合成氨的反应速率 N2+3H22NH3
(5)E中溶液变红
(6)有 氢气与氮气的混合气体应该先通过干燥装置,再通入反应装置;⑦后连接一个吸收氨气的装置
同课章节目录
