课题3 溶液的浓度同步练习(带解析)
图片预览



文档简介
课题3 溶液的浓度(带解析)
一、选择题
1、实验室里用氯化钾固体配制一定溶质质量分数的氯化钾溶液时,下列仪器中,不必用到的是( )
A.托盘天平 B.烧怀 C.量筒 D.漏斗
2、在配制一定质量分数的溶液时,下列哪一操作使结果变大( )
A.称量的药品溶解时不慎洒落 B.量取液体时,仰视读数
C.配好的溶液转移时,不洒落 D.量取液体时,俯视读数
3、现将100克10%的食盐溶液,若将其溶质质量分数增大一倍,可采用的方法是( )
A.蒸发一半溶剂 B.蒸发10克溶剂
C.加入12.5克氯化钠??? D.加入10克氯化钠
4、某同学欲配制50克质量分数为7.0%的食盐溶液,在称量食盐时,将砝码放在了左盘(1克以下用游码),其他各步操作均正确,那么他实际上所配制的食盐水的质量分数是( )
A.5.1% B.5.4% C.4.8% D.5.0%
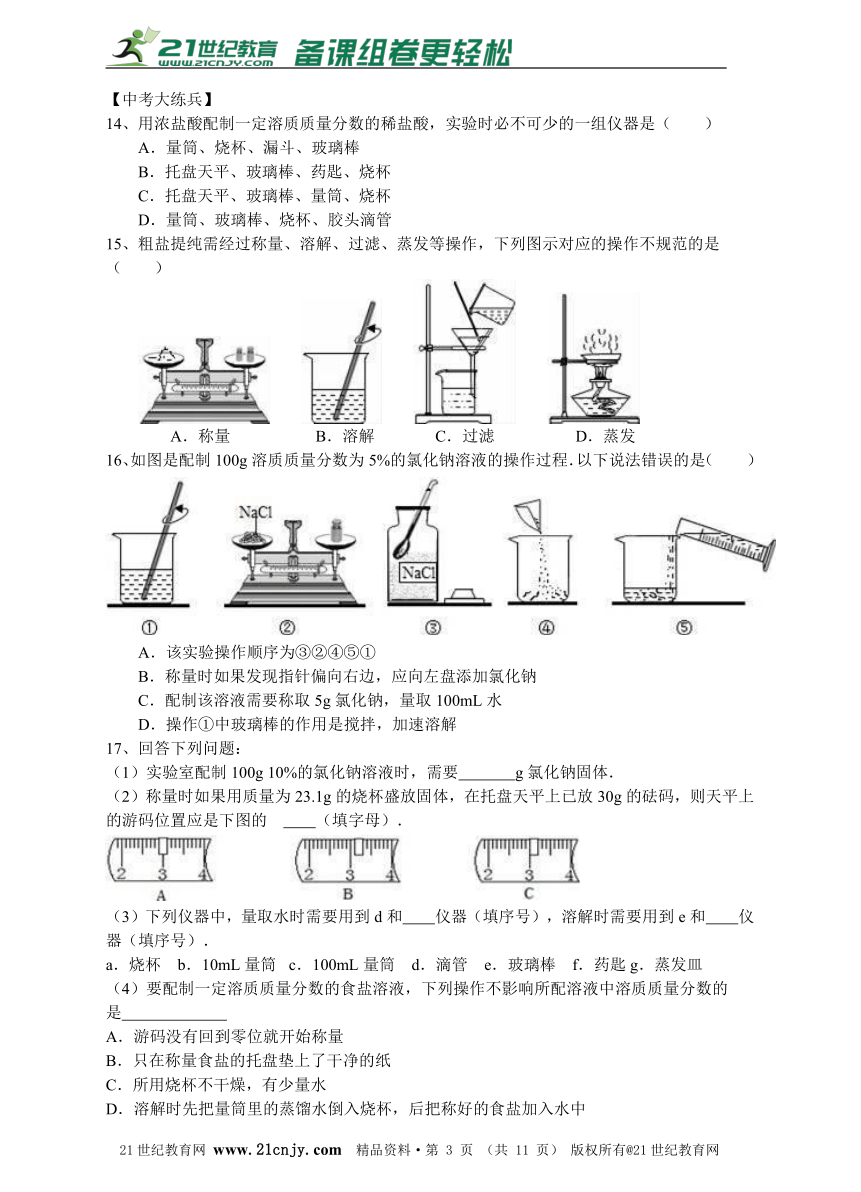
5、农业生产中通常用10%~20%的食盐水来选种,现有配好的15%的食盐水200kg,其中含水为( )
A.30 kg??? B.170 kg?? C.140 kg?? D.200 kg
6、在一定温度下,某固态溶质(不含结晶水)的水溶液甲,经历如下变化:溶液甲蒸发5g水无晶体析出得到溶液乙,溶液乙蒸发5g水析出2g晶体得到溶液丙.下列结论正确的是( )
A.溶液甲可能是饱和溶液
B.溶液乙和溶液丙中的溶质质量分数可能相等
C.溶液乙一定是饱和溶液
D.溶液丙若再蒸发5g水,析出的晶体一定小于2g
7、实验室配制50g溶质质量分数为15%的氯化钠溶液.下列说法中错误的是( )
A.实验的步骤为计算、称取、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
8、在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是( )
①用量筒量取水时俯视读数
②配制溶液的烧杯用少量蒸馏水润洗
③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数
④盛装溶液的试剂瓶用蒸馏水润洗
⑤氯化钠晶体不纯.
A.①②③④⑤?? B.只有①②④⑤ C.只有①②③?? D.只有②③④⑤
二、填空题
9、无土栽培是一种在营养液中培育植物的农业高新技术,有良好的发展前景.某课外实验小组要配制150g溶质质量分数为1.4%的硝酸钾溶液用于配制营养液.
(1)需硝酸钾 g,需水 mL(水的密度是1.0g/cm3)
(2)配制此硝酸钾溶液的步骤为 、 和 ;配制过程中用到的仪器有 、药匙和胶头滴管.
(3)若在量取水时俯视凹液面最低处,其它操作正确,则所得溶液的溶质质量分数为 1.4%(填>或<或=).
10、配制100g 5%的氯化钠溶液,主要步骤是:计算、称量、量取、溶解、装瓶贴标签.
(1)溶解过程中用到的仪器有 .
(2)实际配制的溶液中溶质的质量分数小于5%,其原因可能有 .
A.氯化钠固体不纯????????????????????? B.固体倒入烧杯时洒落
C.配制时烧杯不干燥??????????????????? D.装瓶时有液体溅出.
11、某同学配制100g质量分数为8.5%的氯化钠时有如下操作,按要求回答问题:
【计算】需要氯化钠固体的质量为 g;水的体积为 mL(水的密度:1g/cm3);
【称量】用托盘天平称量出所需的氯化钠固体后倒入烧杯中,称量时砝码应放在天平的 盘(填“左”或“右”).
12、生产、生活中常需配制溶液.
(1)配制一瓶如图所示溶液需氯化钠 g.
(2)配制一定质量分数的氯化钠溶液时,下列哪些操作会导致溶液的质量分数偏小?请说明偏小的原因.①用量筒量取水时仰视读数;②往烧杯中加水时有水溅出;③称量含不溶性杂质的氯化钠来配制溶液;④将配制好的溶液往试剂瓶中转移时有少量溅出.
三、实验探究题
13、小华同学配制50g溶质质量分数为5%的NaCl溶液,操作流程如图:
(1)小华同学应称取氯化钠的质量是 ;
(2)若用20%的氯化钠溶液配制,需要20%的氯化钠溶液 g;蒸馏水 g(请在答案纸上写出过程)
(3)在用托盘天平称取食盐的过程中,发现指针已偏向分度盘右侧,他接下来的操作是 ;
(4)如果所配得的溶液溶质的质量分数比5%小,你认为可能的原因有 .
A 量取水时俯视读数
B 所用氯化钠中含有杂质
C 称量时左托盘放砝码,右托盘放氯化钠(1g以下用游码)
D 用来配制溶液的烧杯刚用少量蒸馏水润洗过
E 转移的过程中有少量液体溅出.
【中考大练兵】
14、用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是( )
A.量筒、烧杯、漏斗、玻璃棒
B.托盘天平、玻璃棒、药匙、烧杯
C.托盘天平、玻璃棒、量筒、烧杯
D.量筒、玻璃棒、烧杯、胶头滴管
15、粗盐提纯需经过称量、溶解、过滤、蒸发等操作,下列图示对应的操作不规范的是( )??????????? 21·cn·jy·com
A.称量??????????????? B.溶解???????????????C.过滤?????????????? D.蒸发??
16、如图是配制100g溶质质量分数为5%的氯化钠溶液的操作过程.以下说法错误的是( )
A.该实验操作顺序为③②④⑤①
B.称量时如果发现指针偏向右边,应向左盘添加氯化钠
C.配制该溶液需要称取5g氯化钠,量取100mL水
D.操作①中玻璃棒的作用是搅拌,加速溶解
17、回答下列问题:
(1)实验室配制100g 10%的氯化钠溶液时,需要 g氯化钠固体.
(2)称量时如果用质量为23.1g的烧杯盛放固体,在托盘天平上已放30g的砝码,则天平上的游码位置应是下图的 (填字母).21*cnjy*com
(3)下列仪器中,量取水时需要用到d和 仪器(填序号),溶解时需要用到e和 仪器(填序号).
a.烧杯?? b.10mL量筒? c.100mL量筒?? d.滴管?? e.玻璃棒?? f.药匙g.蒸发皿
(4)要配制一定溶质质量分数的食盐溶液,下列操作不影响所配溶液中溶质质量分数的
是
A.游码没有回到零位就开始称量
B.只在称量食盐的托盘垫上了干净的纸
C.所用烧杯不干燥,有少量水
D.溶解时先把量筒里的蒸馏水倒入烧杯,后把称好的食盐加入水中
(5)用固体氢氧化钠配制50g20%的氢氧化钠溶液时,应该用①计算 ②称、量③ ④转移贴标签等操作步骤.2-1-c-n-j-y
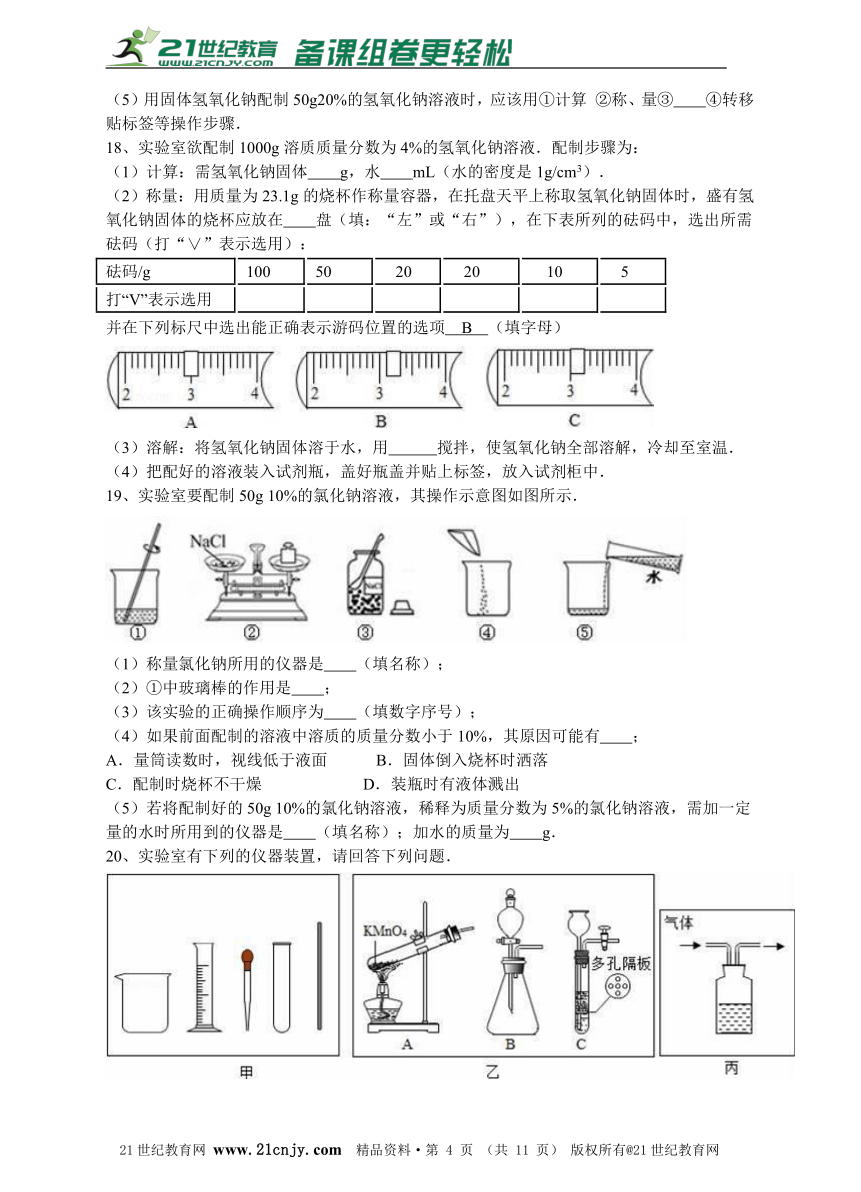
18、实验室欲配制1000g溶质质量分数为4%的氢氧化钠溶液.配制步骤为:
(1)计算:需氢氧化钠固体 g,水 mL(水的密度是1g/cm3).
(2)称量:用质量为23.1g的烧杯作称量容器,在托盘天平上称取氢氧化钠固体时,盛有氢氧化钠固体的烧杯应放在 盘(填:“左”或“右”),在下表所列的砝码中,选出所需砝码(打“∨”表示选用):21教育名师原创作品
砝码/g
100
50
? 20
? 20
?? 10
? 5
打“V”表示选用
并在下列标尺中选出能正确表示游码位置的选项 B (填字母)
(3)溶解:将氢氧化钠固体溶于水,用 搅拌,使氢氧化钠全部溶解,冷却至室温.
(4)把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中.
19、实验室要配制50g 10%的氯化钠溶液,其操作示意图如图所示.
(1)称量氯化钠所用的仪器是 (填名称);
(2)①中玻璃棒的作用是 ;
(3)该实验的正确操作顺序为 (填数字序号);
(4)如果前面配制的溶液中溶质的质量分数小于10%,其原因可能有 ;
A.量筒读数时,视线低于液面?????????? B.固体倒入烧杯时洒落
C.配制时烧杯不干燥??????????????????????? D.装瓶时有液体溅出
(5)若将配制好的50g 10%的氯化钠溶液,稀释为质量分数为5%的氯化钠溶液,需加一定量的水时所用到的仪器是 (填名称);加水的质量为 g.21世纪教育网版权所有
20、实验室有下列的仪器装置,请回答下列问题.
(1)配制50g质量分数5%的氯化钠溶液,不需要甲图中的仪器是 (填名称),还缺少的仪器是 ;在量取水时,若仰视量筒凹液面的最低处,其他操作规范,则配制的溶液的质量分数 (选填“大于”、“等于”或“小于”)5%.www-2-1-cnjy-com
(2)乙图A用于实验室制取氧气,请指出中的一处错误 ;若用乙图B来制取氧气,则反应的化学方程式是 .【版权所有:21教育】
(3)实验室用可图B或C来制取CO2,C装置相对于B操作上的优点是 ;用排空气法收集CO2,检验CO2集满的操作是 .
(4)如图丙是用排水法收集氧气的实验装置,请把图丙补充完整.
(5)实验室用锌粒与稀硫酸反应制取氢气,发生装置如乙图图C所示.打开止水夹,若发现稀硫酸未能与有孔塑料板上锌粒接触,但此时已无稀硫酸可加,为不影响生成的气体量,则下列物质中,最适宜从长颈漏斗中添加的是 (填字母).
A.水????? B.碳酸钠溶液???? C.硫酸钠溶液???? D.澄清石灰水.
21、将氢氧化钠和硫酸钠的混合物13.8g放入88.2g水中使其完全溶解,再加入98g溶质质量分数为10%的硫酸溶液,恰好完全反应.试计算:
(1)98g10%的硫酸溶液中溶质的质量;
(2)原混合物中氢氧化钠的质量;
(3)反应后所得溶液中溶质的质量分数.
参考答案及解析
1、D
【解答】使用固体氯化钾配制一定溶质质量分数的氯化钾溶液的配制步骤“计算﹣称量﹣溶解”,称量时需要使用托盘天平称取固体氯化钾的质量、需要使用量筒量取液体水的体积;溶解时需要使用烧杯作为溶解容器;21教育网
而漏斗是过滤时的主要仪器,在配制溶液时不需要.
2、D
【解答】A、称量的药品溶解时不慎洒落,会造成实际所取的溶质的质量偏小,则使溶质质【解答】解:配制50克质量分数为7.0%的食盐溶液,需要食盐的质量为50g×7.0%=3.5g;由左盘的质量=右盘的质量+游码的质量可知:砝码质量=药品质量+游码的质量,所以药品质量=砝码质量﹣游码质量,即药品质量=3.0g﹣0.5g=2.5g.21cnjy.com
其他各步操作均正确,那么他实际上所配制的食盐水的质量分数是100%≈5.1%.
5、B
【解答】由15%的食盐水200kg,溶质为食盐、溶剂为水,
则食盐的质量为200kg×15%=30kg,
则水的质量为200kg﹣30kg=170kg,
6、B
【解答】A、由于溶液甲蒸发掉5g水后,没有晶体析出,说明溶液甲是不饱和溶液,故A错误;
B、由于溶液乙蒸发掉5g水后,析出了2g晶体,则溶液丙一定是饱和溶液,如果乙溶液也是饱和的,则溶液乙和溶液丙中的溶质质量分数相等,故B正确;2·1·c·n·j·y
C、由于溶液乙中不存在未溶解的溶质,因此乙溶液可能是饱和溶液也可能是不饱和溶液,故C错误;
D、由于乙溶液可能是不饱和溶液,而丙是饱和溶液,因此溶液丙若再蒸发5g水,析出的晶体可能大于2g,而乙溶液也是饱和,则丙是饱和溶液,因此溶液丙若再蒸发5g水,析出的晶体等于2g,故D不正确;
7、C
【解答】A、实验室配制50g溶质质量分数为15%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、转移,故选项说法正确.
B、溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率,故选项说法正确.
C、把配制好的氯化钠溶液倒入刚用蒸馏水洗过的试剂瓶中,相当于对配制的溶液进行了稀(2)计算、称量,溶解;托盘天平、烧杯、玻璃棒、量筒;www.21-cn-jy.com
(3)>.
【解答】(1)配制150 g溶质质量分数为1.4%的硝酸钾溶液需硝酸钾的质量=150g×1.4%=2.1g,需水的质量=15g﹣2.1g=147.9g,即147.9mL;
(2)配制此硝酸钾溶液的步骤为计算、称量和溶解;配制过程中用到的仪器有托盘天平、烧杯、玻璃棒、量筒、药匙和胶头滴管.
(3)若在量取水时俯视凹液面最低处,其它操作正确俯视,所取液体体积会小于147.9mL,溶剂量偏小而使所得溶液的溶质质量分数大于1.4%.
10、(1)烧杯、玻璃棒;(2)ABC.
【解答】(1)溶解是需要用到烧杯和玻璃棒;
(2)A.氯化钠固体不纯,造成溶质少了,将导致溶质质量分数偏小;
B.固体倒入烧杯时洒落,造成溶质少了,将导致溶质质量分数偏小;
C.配制时烧杯不干燥,造成溶剂质量偏大,将导致溶质质量分数偏小;
D.装瓶时有液体溅出,溶质质量分数无影响;
11、8.5; 91.5;
【解答】【计算】溶质质量=溶液质量×溶质的质量分数=100g×8.5%=8.5g,溶剂质量=溶液质量﹣溶质质量,则所需蒸馏水的质量=100g﹣8.5g=91.5g;
12、(1)0.9;
(2)①和③;操作①使溶剂的质量偏大;操作③使溶质的质量偏小.
【解答】解:(1)溶质质量=溶液质量×溶质的质量分数,配制一瓶如图所示溶液需氯化钠的质量为1.0g/cm3×100cm3×0.9%=0.9g.
(2)①用量筒量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小.
②往烧杯中加水时有水溅出,会造成实际量取的水的体积偏小,则使溶质质量分数偏大.
③称量含不溶性杂质的氯化钠来配制溶液,会造成实际所取的溶质的质量偏小,则使溶质质15、D???????????????????????? 【来源:21cnj*y.co*m】
【解答】A、托盘天平的使用要遵循“左物右码”的原则,故A正确;??????????
B、溶解操作中,为加快食盐的溶解速率,可使用玻璃棒进行搅拌,故B正确;??????????
C、过滤液体时,要注意“一贴、二低、三靠”的原则,故C正确;????????
D、蒸发时,应用玻璃棒不断搅拌,以防液体受热不均匀,造成液体飞溅;图中没有用玻璃棒搅拌,故D错误.?????? ???????????????????
16、C
【解答】A、配制100g溶质质量分数为5%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解;该实验操作顺序为③②④⑤①,故选项说法正确.
B、称量氯化钠时,步骤应该是:先调好砝码和游码,再向左盘增减药品至天平平衡,然后向左边托盘添加氯化钠;称量时如果发现指针偏向右边,说明食盐的质量小于砝码的质量,故应进行的操作是继续向左盘添加氯化钠,直至天平平衡,故选项说法正确.
C、溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=100g﹣5g=95g(合95mL),故选项说法错误.
D、操作①是溶解操作,玻璃棒的作用是搅拌,加速溶解,故选项说法正确.
17、(1)10;
(2)B;
(3)②c;a;
(4)D;
(5)溶解.
【解答】(1)溶质质量=溶液质量×溶质的质量分数,实验室配制100g10%的氯化钠溶液,需氯化钠的质量=100g×10%=10g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=100g﹣10g=90g(合90mL).
(2)称量时如果用质量为23.1g的烧杯盛放固体,称量的氯化钠的质量为10g,即称量的总质量为33.1g,在托盘天平上已放30g的砝码,游码的质量应为3.1g,则天平上的游码位置应(5)选用固体氢氧化钠溶解在一定水中而配制溶液的方法,需要溶质氢氧化钠的质量=50g×20%=10g,需溶剂水的质量=50g﹣10g=40g(合40mL),然后称量出固体氢氧化钠,用量筒量取水40mL,溶解即可,所以用固体氢氧化钠配制50g 20%的氢氧化钠溶液的步骤包括:计算、天平称量、量筒量取、溶解.
18、(1)40,960.
(2)左,50,10.B
(3)玻璃棒
【解答】(1)需要固体氢氧化钠的质量为:1000克×4%═40克,水的质量:1000克﹣40克=960克,由于水的密度为1g/cm3所以体积为960mL,故答案为:40,960.
(2)称量时左物右码,由于烧杯加药品的质量为40g+23.1g=63.1g.所以砝码选择50克,10克,然后用游码,游码在标尺的位置应该是游码的左端对准刻度,所以应选B,故答案为:左,50,10.B【来源:21·世纪·教育·网】
表格如下:
砝码/g
100
50
? 20
? 20
?? 10
? 5
打“V”表示选用
V
?V
(3)溶解时通常要用玻璃棒以加速溶解速度,故答案为:玻璃棒.
19、(1)托盘天平;
(2)搅拌加速食盐的溶解;
(3)③②④⑤①;
(3)能使反应随时停止随时开始(或能随关随停); 把燃着的木条靠近集气瓶口,如果熄灭,证明已收集满;【出处:21教育名师】
(4)如图:
(5)AC.
【解答】(1)配制一定质量分数的溶液,需要的仪器有烧杯、量筒、托盘天平、玻璃棒、胶头滴管,故不需要的仪器是试管,需要增加的仪器是托盘天平,若仰视量筒凹液面的最低处,则量取的水多,故配制的溶液的质量分数偏小;21·世纪*教育网
(2)实验室制取氧气时,如果加热固体则试管口应略向下倾斜,防止有水产生,倒流炸裂试管;如果用过氧化氢制氧气,则是固液反应不需加热,所以用B装置制取,化学方程式2H2O22H2O+O2↑;21*cnjy*com
(3)实验室制取CO2的装置可以用B或C,C装置相对于B操作上的优点是能使反应随时停止随时开始(或能随关随停);检验CO2集满的操作是把燃着的木条靠近集气瓶口,如果熄灭,证明已收集满;
(4)用排水法收集氧气,利用洗气瓶应短进长出,所以补全装置如图;
(5)根据稀硫酸的性质,稀硫酸能和碱反应,能和盐反应,因为碳酸钠溶液和澄清石灰水都(3)所得溶液溶质质量分数=×100%=10%
答:(1)硫酸溶液中溶质质量为9.8g;
(2)原混合物中氢氧化钠的质量8g;
(3)反应后所得溶液中溶质质量分数为10%.
一、选择题
1、实验室里用氯化钾固体配制一定溶质质量分数的氯化钾溶液时,下列仪器中,不必用到的是( )
A.托盘天平 B.烧怀 C.量筒 D.漏斗
2、在配制一定质量分数的溶液时,下列哪一操作使结果变大( )
A.称量的药品溶解时不慎洒落 B.量取液体时,仰视读数
C.配好的溶液转移时,不洒落 D.量取液体时,俯视读数
3、现将100克10%的食盐溶液,若将其溶质质量分数增大一倍,可采用的方法是( )
A.蒸发一半溶剂 B.蒸发10克溶剂
C.加入12.5克氯化钠??? D.加入10克氯化钠
4、某同学欲配制50克质量分数为7.0%的食盐溶液,在称量食盐时,将砝码放在了左盘(1克以下用游码),其他各步操作均正确,那么他实际上所配制的食盐水的质量分数是( )
A.5.1% B.5.4% C.4.8% D.5.0%
5、农业生产中通常用10%~20%的食盐水来选种,现有配好的15%的食盐水200kg,其中含水为( )
A.30 kg??? B.170 kg?? C.140 kg?? D.200 kg
6、在一定温度下,某固态溶质(不含结晶水)的水溶液甲,经历如下变化:溶液甲蒸发5g水无晶体析出得到溶液乙,溶液乙蒸发5g水析出2g晶体得到溶液丙.下列结论正确的是( )
A.溶液甲可能是饱和溶液
B.溶液乙和溶液丙中的溶质质量分数可能相等
C.溶液乙一定是饱和溶液
D.溶液丙若再蒸发5g水,析出的晶体一定小于2g
7、实验室配制50g溶质质量分数为15%的氯化钠溶液.下列说法中错误的是( )
A.实验的步骤为计算、称取、量取、溶解、转移
B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率
C.把配制好的氯化钠溶液倒入刚用蒸馏水洗过的试剂瓶中,并贴上标签
D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水
8、在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是( )
①用量筒量取水时俯视读数
②配制溶液的烧杯用少量蒸馏水润洗
③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数
④盛装溶液的试剂瓶用蒸馏水润洗
⑤氯化钠晶体不纯.
A.①②③④⑤?? B.只有①②④⑤ C.只有①②③?? D.只有②③④⑤
二、填空题
9、无土栽培是一种在营养液中培育植物的农业高新技术,有良好的发展前景.某课外实验小组要配制150g溶质质量分数为1.4%的硝酸钾溶液用于配制营养液.
(1)需硝酸钾 g,需水 mL(水的密度是1.0g/cm3)
(2)配制此硝酸钾溶液的步骤为 、 和 ;配制过程中用到的仪器有 、药匙和胶头滴管.
(3)若在量取水时俯视凹液面最低处,其它操作正确,则所得溶液的溶质质量分数为 1.4%(填>或<或=).
10、配制100g 5%的氯化钠溶液,主要步骤是:计算、称量、量取、溶解、装瓶贴标签.
(1)溶解过程中用到的仪器有 .
(2)实际配制的溶液中溶质的质量分数小于5%,其原因可能有 .
A.氯化钠固体不纯????????????????????? B.固体倒入烧杯时洒落
C.配制时烧杯不干燥??????????????????? D.装瓶时有液体溅出.
11、某同学配制100g质量分数为8.5%的氯化钠时有如下操作,按要求回答问题:
【计算】需要氯化钠固体的质量为 g;水的体积为 mL(水的密度:1g/cm3);
【称量】用托盘天平称量出所需的氯化钠固体后倒入烧杯中,称量时砝码应放在天平的 盘(填“左”或“右”).
12、生产、生活中常需配制溶液.
(1)配制一瓶如图所示溶液需氯化钠 g.
(2)配制一定质量分数的氯化钠溶液时,下列哪些操作会导致溶液的质量分数偏小?请说明偏小的原因.①用量筒量取水时仰视读数;②往烧杯中加水时有水溅出;③称量含不溶性杂质的氯化钠来配制溶液;④将配制好的溶液往试剂瓶中转移时有少量溅出.
三、实验探究题
13、小华同学配制50g溶质质量分数为5%的NaCl溶液,操作流程如图:
(1)小华同学应称取氯化钠的质量是 ;
(2)若用20%的氯化钠溶液配制,需要20%的氯化钠溶液 g;蒸馏水 g(请在答案纸上写出过程)
(3)在用托盘天平称取食盐的过程中,发现指针已偏向分度盘右侧,他接下来的操作是 ;
(4)如果所配得的溶液溶质的质量分数比5%小,你认为可能的原因有 .
A 量取水时俯视读数
B 所用氯化钠中含有杂质
C 称量时左托盘放砝码,右托盘放氯化钠(1g以下用游码)
D 用来配制溶液的烧杯刚用少量蒸馏水润洗过
E 转移的过程中有少量液体溅出.
【中考大练兵】
14、用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是( )
A.量筒、烧杯、漏斗、玻璃棒
B.托盘天平、玻璃棒、药匙、烧杯
C.托盘天平、玻璃棒、量筒、烧杯
D.量筒、玻璃棒、烧杯、胶头滴管
15、粗盐提纯需经过称量、溶解、过滤、蒸发等操作,下列图示对应的操作不规范的是( )??????????? 21·cn·jy·com
A.称量??????????????? B.溶解???????????????C.过滤?????????????? D.蒸发??
16、如图是配制100g溶质质量分数为5%的氯化钠溶液的操作过程.以下说法错误的是( )
A.该实验操作顺序为③②④⑤①
B.称量时如果发现指针偏向右边,应向左盘添加氯化钠
C.配制该溶液需要称取5g氯化钠,量取100mL水
D.操作①中玻璃棒的作用是搅拌,加速溶解
17、回答下列问题:
(1)实验室配制100g 10%的氯化钠溶液时,需要 g氯化钠固体.
(2)称量时如果用质量为23.1g的烧杯盛放固体,在托盘天平上已放30g的砝码,则天平上的游码位置应是下图的 (填字母).21*cnjy*com
(3)下列仪器中,量取水时需要用到d和 仪器(填序号),溶解时需要用到e和 仪器(填序号).
a.烧杯?? b.10mL量筒? c.100mL量筒?? d.滴管?? e.玻璃棒?? f.药匙g.蒸发皿
(4)要配制一定溶质质量分数的食盐溶液,下列操作不影响所配溶液中溶质质量分数的
是
A.游码没有回到零位就开始称量
B.只在称量食盐的托盘垫上了干净的纸
C.所用烧杯不干燥,有少量水
D.溶解时先把量筒里的蒸馏水倒入烧杯,后把称好的食盐加入水中
(5)用固体氢氧化钠配制50g20%的氢氧化钠溶液时,应该用①计算 ②称、量③ ④转移贴标签等操作步骤.2-1-c-n-j-y
18、实验室欲配制1000g溶质质量分数为4%的氢氧化钠溶液.配制步骤为:
(1)计算:需氢氧化钠固体 g,水 mL(水的密度是1g/cm3).
(2)称量:用质量为23.1g的烧杯作称量容器,在托盘天平上称取氢氧化钠固体时,盛有氢氧化钠固体的烧杯应放在 盘(填:“左”或“右”),在下表所列的砝码中,选出所需砝码(打“∨”表示选用):21教育名师原创作品
砝码/g
100
50
? 20
? 20
?? 10
? 5
打“V”表示选用
并在下列标尺中选出能正确表示游码位置的选项 B (填字母)
(3)溶解:将氢氧化钠固体溶于水,用 搅拌,使氢氧化钠全部溶解,冷却至室温.
(4)把配好的溶液装入试剂瓶,盖好瓶盖并贴上标签,放入试剂柜中.
19、实验室要配制50g 10%的氯化钠溶液,其操作示意图如图所示.
(1)称量氯化钠所用的仪器是 (填名称);
(2)①中玻璃棒的作用是 ;
(3)该实验的正确操作顺序为 (填数字序号);
(4)如果前面配制的溶液中溶质的质量分数小于10%,其原因可能有 ;
A.量筒读数时,视线低于液面?????????? B.固体倒入烧杯时洒落
C.配制时烧杯不干燥??????????????????????? D.装瓶时有液体溅出
(5)若将配制好的50g 10%的氯化钠溶液,稀释为质量分数为5%的氯化钠溶液,需加一定量的水时所用到的仪器是 (填名称);加水的质量为 g.21世纪教育网版权所有
20、实验室有下列的仪器装置,请回答下列问题.
(1)配制50g质量分数5%的氯化钠溶液,不需要甲图中的仪器是 (填名称),还缺少的仪器是 ;在量取水时,若仰视量筒凹液面的最低处,其他操作规范,则配制的溶液的质量分数 (选填“大于”、“等于”或“小于”)5%.www-2-1-cnjy-com
(2)乙图A用于实验室制取氧气,请指出中的一处错误 ;若用乙图B来制取氧气,则反应的化学方程式是 .【版权所有:21教育】
(3)实验室用可图B或C来制取CO2,C装置相对于B操作上的优点是 ;用排空气法收集CO2,检验CO2集满的操作是 .
(4)如图丙是用排水法收集氧气的实验装置,请把图丙补充完整.
(5)实验室用锌粒与稀硫酸反应制取氢气,发生装置如乙图图C所示.打开止水夹,若发现稀硫酸未能与有孔塑料板上锌粒接触,但此时已无稀硫酸可加,为不影响生成的气体量,则下列物质中,最适宜从长颈漏斗中添加的是 (填字母).
A.水????? B.碳酸钠溶液???? C.硫酸钠溶液???? D.澄清石灰水.
21、将氢氧化钠和硫酸钠的混合物13.8g放入88.2g水中使其完全溶解,再加入98g溶质质量分数为10%的硫酸溶液,恰好完全反应.试计算:
(1)98g10%的硫酸溶液中溶质的质量;
(2)原混合物中氢氧化钠的质量;
(3)反应后所得溶液中溶质的质量分数.
参考答案及解析
1、D
【解答】使用固体氯化钾配制一定溶质质量分数的氯化钾溶液的配制步骤“计算﹣称量﹣溶解”,称量时需要使用托盘天平称取固体氯化钾的质量、需要使用量筒量取液体水的体积;溶解时需要使用烧杯作为溶解容器;21教育网
而漏斗是过滤时的主要仪器,在配制溶液时不需要.
2、D
【解答】A、称量的药品溶解时不慎洒落,会造成实际所取的溶质的质量偏小,则使溶质质【解答】解:配制50克质量分数为7.0%的食盐溶液,需要食盐的质量为50g×7.0%=3.5g;由左盘的质量=右盘的质量+游码的质量可知:砝码质量=药品质量+游码的质量,所以药品质量=砝码质量﹣游码质量,即药品质量=3.0g﹣0.5g=2.5g.21cnjy.com
其他各步操作均正确,那么他实际上所配制的食盐水的质量分数是100%≈5.1%.
5、B
【解答】由15%的食盐水200kg,溶质为食盐、溶剂为水,
则食盐的质量为200kg×15%=30kg,
则水的质量为200kg﹣30kg=170kg,
6、B
【解答】A、由于溶液甲蒸发掉5g水后,没有晶体析出,说明溶液甲是不饱和溶液,故A错误;
B、由于溶液乙蒸发掉5g水后,析出了2g晶体,则溶液丙一定是饱和溶液,如果乙溶液也是饱和的,则溶液乙和溶液丙中的溶质质量分数相等,故B正确;2·1·c·n·j·y
C、由于溶液乙中不存在未溶解的溶质,因此乙溶液可能是饱和溶液也可能是不饱和溶液,故C错误;
D、由于乙溶液可能是不饱和溶液,而丙是饱和溶液,因此溶液丙若再蒸发5g水,析出的晶体可能大于2g,而乙溶液也是饱和,则丙是饱和溶液,因此溶液丙若再蒸发5g水,析出的晶体等于2g,故D不正确;
7、C
【解答】A、实验室配制50g溶质质量分数为15%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、转移,故选项说法正确.
B、溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率,故选项说法正确.
C、把配制好的氯化钠溶液倒入刚用蒸馏水洗过的试剂瓶中,相当于对配制的溶液进行了稀(2)计算、称量,溶解;托盘天平、烧杯、玻璃棒、量筒;www.21-cn-jy.com
(3)>.
【解答】(1)配制150 g溶质质量分数为1.4%的硝酸钾溶液需硝酸钾的质量=150g×1.4%=2.1g,需水的质量=15g﹣2.1g=147.9g,即147.9mL;
(2)配制此硝酸钾溶液的步骤为计算、称量和溶解;配制过程中用到的仪器有托盘天平、烧杯、玻璃棒、量筒、药匙和胶头滴管.
(3)若在量取水时俯视凹液面最低处,其它操作正确俯视,所取液体体积会小于147.9mL,溶剂量偏小而使所得溶液的溶质质量分数大于1.4%.
10、(1)烧杯、玻璃棒;(2)ABC.
【解答】(1)溶解是需要用到烧杯和玻璃棒;
(2)A.氯化钠固体不纯,造成溶质少了,将导致溶质质量分数偏小;
B.固体倒入烧杯时洒落,造成溶质少了,将导致溶质质量分数偏小;
C.配制时烧杯不干燥,造成溶剂质量偏大,将导致溶质质量分数偏小;
D.装瓶时有液体溅出,溶质质量分数无影响;
11、8.5; 91.5;
【解答】【计算】溶质质量=溶液质量×溶质的质量分数=100g×8.5%=8.5g,溶剂质量=溶液质量﹣溶质质量,则所需蒸馏水的质量=100g﹣8.5g=91.5g;
12、(1)0.9;
(2)①和③;操作①使溶剂的质量偏大;操作③使溶质的质量偏小.
【解答】解:(1)溶质质量=溶液质量×溶质的质量分数,配制一瓶如图所示溶液需氯化钠的质量为1.0g/cm3×100cm3×0.9%=0.9g.
(2)①用量筒量取水时仰视读数,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小.
②往烧杯中加水时有水溅出,会造成实际量取的水的体积偏小,则使溶质质量分数偏大.
③称量含不溶性杂质的氯化钠来配制溶液,会造成实际所取的溶质的质量偏小,则使溶质质15、D???????????????????????? 【来源:21cnj*y.co*m】
【解答】A、托盘天平的使用要遵循“左物右码”的原则,故A正确;??????????
B、溶解操作中,为加快食盐的溶解速率,可使用玻璃棒进行搅拌,故B正确;??????????
C、过滤液体时,要注意“一贴、二低、三靠”的原则,故C正确;????????
D、蒸发时,应用玻璃棒不断搅拌,以防液体受热不均匀,造成液体飞溅;图中没有用玻璃棒搅拌,故D错误.?????? ???????????????????
16、C
【解答】A、配制100g溶质质量分数为5%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解;该实验操作顺序为③②④⑤①,故选项说法正确.
B、称量氯化钠时,步骤应该是:先调好砝码和游码,再向左盘增减药品至天平平衡,然后向左边托盘添加氯化钠;称量时如果发现指针偏向右边,说明食盐的质量小于砝码的质量,故应进行的操作是继续向左盘添加氯化钠,直至天平平衡,故选项说法正确.
C、溶质质量=溶液质量×溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g×5%=5g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=100g﹣5g=95g(合95mL),故选项说法错误.
D、操作①是溶解操作,玻璃棒的作用是搅拌,加速溶解,故选项说法正确.
17、(1)10;
(2)B;
(3)②c;a;
(4)D;
(5)溶解.
【解答】(1)溶质质量=溶液质量×溶质的质量分数,实验室配制100g10%的氯化钠溶液,需氯化钠的质量=100g×10%=10g;溶剂质量=溶液质量﹣溶质质量,则所需水的质量=100g﹣10g=90g(合90mL).
(2)称量时如果用质量为23.1g的烧杯盛放固体,称量的氯化钠的质量为10g,即称量的总质量为33.1g,在托盘天平上已放30g的砝码,游码的质量应为3.1g,则天平上的游码位置应(5)选用固体氢氧化钠溶解在一定水中而配制溶液的方法,需要溶质氢氧化钠的质量=50g×20%=10g,需溶剂水的质量=50g﹣10g=40g(合40mL),然后称量出固体氢氧化钠,用量筒量取水40mL,溶解即可,所以用固体氢氧化钠配制50g 20%的氢氧化钠溶液的步骤包括:计算、天平称量、量筒量取、溶解.
18、(1)40,960.
(2)左,50,10.B
(3)玻璃棒
【解答】(1)需要固体氢氧化钠的质量为:1000克×4%═40克,水的质量:1000克﹣40克=960克,由于水的密度为1g/cm3所以体积为960mL,故答案为:40,960.
(2)称量时左物右码,由于烧杯加药品的质量为40g+23.1g=63.1g.所以砝码选择50克,10克,然后用游码,游码在标尺的位置应该是游码的左端对准刻度,所以应选B,故答案为:左,50,10.B【来源:21·世纪·教育·网】
表格如下:
砝码/g
100
50
? 20
? 20
?? 10
? 5
打“V”表示选用
V
?V
(3)溶解时通常要用玻璃棒以加速溶解速度,故答案为:玻璃棒.
19、(1)托盘天平;
(2)搅拌加速食盐的溶解;
(3)③②④⑤①;
(3)能使反应随时停止随时开始(或能随关随停); 把燃着的木条靠近集气瓶口,如果熄灭,证明已收集满;【出处:21教育名师】
(4)如图:
(5)AC.
【解答】(1)配制一定质量分数的溶液,需要的仪器有烧杯、量筒、托盘天平、玻璃棒、胶头滴管,故不需要的仪器是试管,需要增加的仪器是托盘天平,若仰视量筒凹液面的最低处,则量取的水多,故配制的溶液的质量分数偏小;21·世纪*教育网
(2)实验室制取氧气时,如果加热固体则试管口应略向下倾斜,防止有水产生,倒流炸裂试管;如果用过氧化氢制氧气,则是固液反应不需加热,所以用B装置制取,化学方程式2H2O22H2O+O2↑;21*cnjy*com
(3)实验室制取CO2的装置可以用B或C,C装置相对于B操作上的优点是能使反应随时停止随时开始(或能随关随停);检验CO2集满的操作是把燃着的木条靠近集气瓶口,如果熄灭,证明已收集满;
(4)用排水法收集氧气,利用洗气瓶应短进长出,所以补全装置如图;
(5)根据稀硫酸的性质,稀硫酸能和碱反应,能和盐反应,因为碳酸钠溶液和澄清石灰水都(3)所得溶液溶质质量分数=×100%=10%
答:(1)硫酸溶液中溶质质量为9.8g;
(2)原混合物中氢氧化钠的质量8g;
(3)反应后所得溶液中溶质质量分数为10%.
同课章节目录
