配置溶液 教案
图片预览

文档简介
1.4配置溶液
教案
一.用容量瓶配制溶液所用仪器:
1、烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、分析天平、药匙(固体溶质使用)、移液管(液体溶质使用)
2、容量瓶
2.1、.构造:
磨口、细颈、梨形平底
2.2、特点:
①
容量瓶上注明温度和容积。②
容量瓶颈部有刻度线。
2.3、使用范围:专门用来配制一定体积、一定物质的量浓度的溶液。
2.4、注意事项:①
使用前先检漏。
②
不可装热或冷的液体。③
不能用来溶解固体物质或存放液体或进行化学反应。
3、使用容量瓶六忌:一忌用容量瓶进行溶解(体积不准确),二忌直接往容量瓶倒液(会洒到外面);三忌加水超过刻度线(浓度偏低);四忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高);五忌不洗涤玻璃棒和烧杯(浓度偏低);六忌标准溶液存放于容量瓶(容量瓶是量器,不是容器)。
二.用容量瓶配制溶液的步骤:
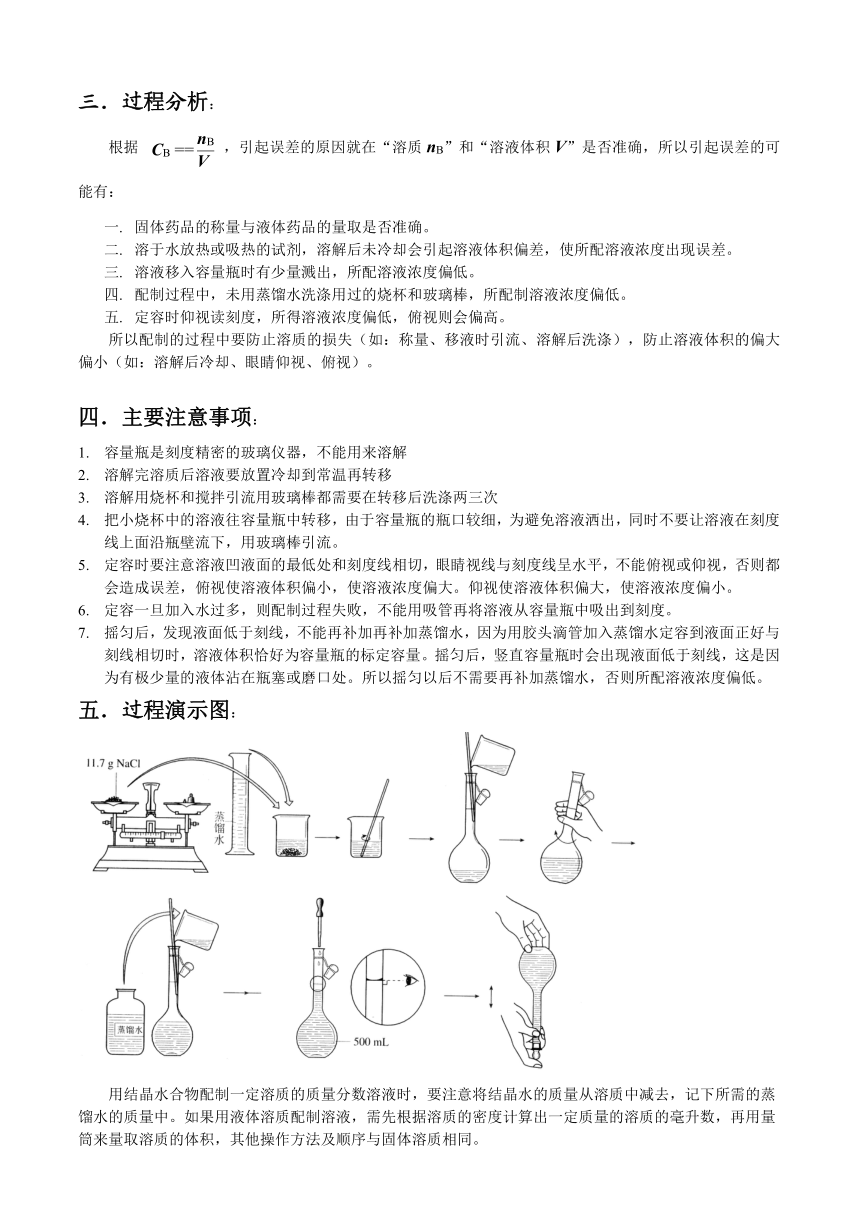
全过程有计算,称量,溶解,冷却,转移,洗涤,定容,摇匀/装瓶八个步骤
八字方针:计,量,溶,冷,转,洗,定,摇
以0.1mol/LNaCO3溶液500ml为例说明溶液的配制过程
1.计算:NaCO3物质的量=0.1mol/L×0.5L=0.05mol,由NaCO3摩尔质量106g/mol,
则NaCO3质量=0.05mol×106g/mol=5.3g
2.称量:用分析天平称量5.300g,注意托盘天平、分析天平的使用。
3.溶解:在烧杯中用100ml蒸馏水使之完全溶解,并用玻璃棒搅拌(注意:应冷却,不可在容量瓶中溶解)
4.转移,洗涤:把溶解好的溶液移入500ml容量瓶,,由于容量瓶瓶口较细,为避免溶液洒出,同时不要让溶液在刻度线上面沿瓶壁流下,用玻璃棒引流。为保证溶质尽可能全部转移到容量瓶中,应该用蒸馏水洗涤烧杯和玻璃棒二、三次,并将每次洗涤后的溶液都注入到容量瓶中。轻轻振荡容量瓶,使溶液充分混合。(用玻璃棒引流)
5.定容:加水到接近刻度2-3厘米时,改用胶头滴管加蒸馏水到刻度,这个操作叫定容。。定容时要注意溶液凹液面的最低处和刻度线相切,眼睛视线与刻度线呈水平,不能俯视或仰视,否则都会造成误差
6.摇匀:定容后的溶液浓度不均匀,要把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次,使溶液混合均匀。这个操作叫做摇匀。
7.贴上标签:把定容后的Na2CO3溶液摇匀。把配制好的溶液倒入试剂瓶中,盖上瓶塞,贴上标签。
问题:在配制溶液的过程中哪些操作可能引起溶液浓度的误差?
三.过程分析:
根据
,引起误差的原因就在“溶质nB”和“溶液体积V”是否准确,所以引起误差的可能有:
固体药品的称量与液体药品的量取是否准确。
溶于水放热或吸热的试剂,溶解后未冷却会引起溶液体积偏差,使所配溶液浓度出现误差。
溶液移入容量瓶时有少量溅出,所配溶液浓度偏低。
配制过程中,未用蒸馏水洗涤用过的烧杯和玻璃棒,所配制溶液浓度偏低。
定容时仰视读刻度,所得溶液浓度偏低,俯视则会偏高。
所以配制的过程中要防止溶质的损失(如:称量、移液时引流、溶解后洗涤),防止溶液体积的偏大偏小(如:溶解后冷却、眼睛仰视、俯视)。
四.主要注意事项:
容量瓶是刻度精密的玻璃仪器,不能用来溶解
溶解完溶质后溶液要放置冷却到常温再转移
溶解用烧杯和搅拌引流用玻璃棒都需要在转移后洗涤两三次
把小烧杯中的溶液往容量瓶中转移,由于容量瓶的瓶口较细,为避免溶液洒出,同时不要让溶液在刻度线上面沿瓶壁流下,用玻璃棒引流。
定容时要注意溶液凹液面的最低处和刻度线相切,眼睛视线与刻度线呈水平,不能俯视或仰视,否则都会造成误差,俯视使溶液体积偏小,使溶液浓度偏大。仰视使溶液体积偏大,使溶液浓度偏小。
定容一旦加入水过多,则配制过程失败,不能用吸管再将溶液从容量瓶中吸出到刻度。
摇匀后,发现液面低于刻线,不能再补加再补加蒸馏水,因为用胶头滴管加入蒸馏水定容到液面正好与刻线相切时,溶液体积恰好为容量瓶的标定容量。摇匀后,竖直容量瓶时会出现液面低于刻线,这是因为有极少量的液体沾在瓶塞或磨口处。所以摇匀以后不需要再补加蒸馏水,否则所配溶液浓度偏低。
五.过程演示图:
用结晶水合物配制一定溶质的质量分数溶液时,要注意将结晶水的质量从溶质中减去,记下所需的蒸馏水的质量中。如果用液体溶质配制溶液,需先根据溶质的密度计算出一定质量的溶质的毫升数,再用量筒来量取溶质的体积,其他操作方法及顺序与固体溶质相同。
1.在容量瓶上无需有标记的是
A.标线
B.温度
C.浓度
D.容量
2.某实验需要0.2
mol
NaOH固体,用托盘天平称取固体时,天平读数(游码及砝码)将
A.等于8.0g
B.等于8.00g
C.大于8.0g
D.等于0.2g
3.0.5L
1mol/L的FeCl3溶液与0.2L
1
mol/L的KCl溶液中,Cl-浓度比为
A.15∶2
B.1∶1
C.3∶1
D.1∶3
4.相对分子质量为M的某物质在室温下的溶解度为S
g,此时测得饱和溶液的密度为ρg·cm-3,则该饱和溶液的物质的量浓度是
A.
B.
C.
D.
5.将标准状况下的a
L
HCl(气)溶于1000g水中,得到的盐酸密度为b
g/cm3,则该盐酸的物质的量浓度是
A.
B.
C.
D.
6.NA为阿伏加德罗常数,下列关于0.2mol/L
K2SO4溶液的正确说法是
A.500mL溶液中所含K+、SO42-总数为0.3NA
B.500mL溶液中含有0.1NA个K+离子
C.1L溶液中K+离子浓度是0.2mol/L
D.2L溶液中SO42-离子浓度是0.4mol/L
7.取100mL
0.3mol/L和300mL
0.25mol/L的硫酸注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是
A.0.21mol/L
B.0.42mol/L
C.0.56mol/L
D.0.26mol/L
8.某Al2(SO4)3溶液V
mL中含a
g
Al3+,取出V/4
mL溶液稀释成4V
mL后,SO42-的物质的量浓度为
A.125/54V
mol·L-1
B.125a/36V
mol·L-1
C.125a/18V
mol·L-1
D.125a/V
mol·L-1
9.将2.4mol某金属投入1.8L
2mol/L的某酸溶液中,恰好完全反应,并产生7.2g氢气,则该金属和酸分别是
A.二价金属,二元酸
B.二价金属,三元酸
C.三价金属,二元酸
D.一价金属,一元酸
10.配制一定体积、一定物质的量浓度的溶液,实验结果产生偏低影响的是
A.容量瓶中原有少量蒸馏水
B.溶解所用的烧杯未洗涤
C.定容时仰视观察液面
D.定容时俯视观察液面
11.有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为
A.0.1mol/L
B.0.15mol/L
C.0.2mol/L
D.0.25mol/L
12.在100g浓度为18mol/L、密度为ρ的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入水的体积
A.小于100mL
B.等于100mL
C.大于100mL
D.等于
13.用密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止。已知所生成的溶液的质量等于原BaCl2溶液的质量,则H2SO4溶液的浓度为
A.21.9%
B.42.1%
C.13.5mol/L
D.5.67mol/L
14.质量为8.02g的铁片,放进1.0L
0.90mol/L的CuSO4溶液中,过一段时间取出洗净、干燥、称量,质量为8.66g。若认为溶液的体积没有变化,则Cu2+的浓度变为
A.0.89mol/L
B.0.82mol/L
C.0.78mol/L
D.0.6mol/L
15.将4gNaOH溶解在10mL水中,稀至1L后取出10mL,其物质的量浓度是
A.
1mol/L
B.
0.1mol/L
C.
0.01mol/L
D.
10mol/L
16.用硫酸铜晶体配制500mL0.1mol/L的硫酸铜溶液,需要硫酸铜晶体的质量为
A.
25g
B.
12.5g
C.
6.25g
D.
37.5g
17.实验室常用98%(ρ=1.84g/mL)的浓H2SO4配制1:4的稀H2SO4,此稀H2SO4的密度为1.23g/mL,其物质的量浓度为
A.
4.6mol/L
B.
5.7mol/L
C.
3.88mol/L
D.
18.4mol/L
18.由Na2SO4和NaNO3组成的混合物88g溶于水配制成1L溶液,此溶液中Na+的浓度为1.2mol/L,则原混合物中NaNO3的质量为
A.
17g
B.
34g
C.
25.5g
D.
51g
CB
==
nB
 ̄
V
教案
一.用容量瓶配制溶液所用仪器:
1、烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、分析天平、药匙(固体溶质使用)、移液管(液体溶质使用)
2、容量瓶
2.1、.构造:
磨口、细颈、梨形平底
2.2、特点:
①
容量瓶上注明温度和容积。②
容量瓶颈部有刻度线。
2.3、使用范围:专门用来配制一定体积、一定物质的量浓度的溶液。
2.4、注意事项:①
使用前先检漏。
②
不可装热或冷的液体。③
不能用来溶解固体物质或存放液体或进行化学反应。
3、使用容量瓶六忌:一忌用容量瓶进行溶解(体积不准确),二忌直接往容量瓶倒液(会洒到外面);三忌加水超过刻度线(浓度偏低);四忌读数仰视或俯视(仰视浓度偏低,俯视浓度偏高);五忌不洗涤玻璃棒和烧杯(浓度偏低);六忌标准溶液存放于容量瓶(容量瓶是量器,不是容器)。
二.用容量瓶配制溶液的步骤:
全过程有计算,称量,溶解,冷却,转移,洗涤,定容,摇匀/装瓶八个步骤
八字方针:计,量,溶,冷,转,洗,定,摇
以0.1mol/LNaCO3溶液500ml为例说明溶液的配制过程
1.计算:NaCO3物质的量=0.1mol/L×0.5L=0.05mol,由NaCO3摩尔质量106g/mol,
则NaCO3质量=0.05mol×106g/mol=5.3g
2.称量:用分析天平称量5.300g,注意托盘天平、分析天平的使用。
3.溶解:在烧杯中用100ml蒸馏水使之完全溶解,并用玻璃棒搅拌(注意:应冷却,不可在容量瓶中溶解)
4.转移,洗涤:把溶解好的溶液移入500ml容量瓶,,由于容量瓶瓶口较细,为避免溶液洒出,同时不要让溶液在刻度线上面沿瓶壁流下,用玻璃棒引流。为保证溶质尽可能全部转移到容量瓶中,应该用蒸馏水洗涤烧杯和玻璃棒二、三次,并将每次洗涤后的溶液都注入到容量瓶中。轻轻振荡容量瓶,使溶液充分混合。(用玻璃棒引流)
5.定容:加水到接近刻度2-3厘米时,改用胶头滴管加蒸馏水到刻度,这个操作叫定容。。定容时要注意溶液凹液面的最低处和刻度线相切,眼睛视线与刻度线呈水平,不能俯视或仰视,否则都会造成误差
6.摇匀:定容后的溶液浓度不均匀,要把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次,使溶液混合均匀。这个操作叫做摇匀。
7.贴上标签:把定容后的Na2CO3溶液摇匀。把配制好的溶液倒入试剂瓶中,盖上瓶塞,贴上标签。
问题:在配制溶液的过程中哪些操作可能引起溶液浓度的误差?
三.过程分析:
根据
,引起误差的原因就在“溶质nB”和“溶液体积V”是否准确,所以引起误差的可能有:
固体药品的称量与液体药品的量取是否准确。
溶于水放热或吸热的试剂,溶解后未冷却会引起溶液体积偏差,使所配溶液浓度出现误差。
溶液移入容量瓶时有少量溅出,所配溶液浓度偏低。
配制过程中,未用蒸馏水洗涤用过的烧杯和玻璃棒,所配制溶液浓度偏低。
定容时仰视读刻度,所得溶液浓度偏低,俯视则会偏高。
所以配制的过程中要防止溶质的损失(如:称量、移液时引流、溶解后洗涤),防止溶液体积的偏大偏小(如:溶解后冷却、眼睛仰视、俯视)。
四.主要注意事项:
容量瓶是刻度精密的玻璃仪器,不能用来溶解
溶解完溶质后溶液要放置冷却到常温再转移
溶解用烧杯和搅拌引流用玻璃棒都需要在转移后洗涤两三次
把小烧杯中的溶液往容量瓶中转移,由于容量瓶的瓶口较细,为避免溶液洒出,同时不要让溶液在刻度线上面沿瓶壁流下,用玻璃棒引流。
定容时要注意溶液凹液面的最低处和刻度线相切,眼睛视线与刻度线呈水平,不能俯视或仰视,否则都会造成误差,俯视使溶液体积偏小,使溶液浓度偏大。仰视使溶液体积偏大,使溶液浓度偏小。
定容一旦加入水过多,则配制过程失败,不能用吸管再将溶液从容量瓶中吸出到刻度。
摇匀后,发现液面低于刻线,不能再补加再补加蒸馏水,因为用胶头滴管加入蒸馏水定容到液面正好与刻线相切时,溶液体积恰好为容量瓶的标定容量。摇匀后,竖直容量瓶时会出现液面低于刻线,这是因为有极少量的液体沾在瓶塞或磨口处。所以摇匀以后不需要再补加蒸馏水,否则所配溶液浓度偏低。
五.过程演示图:
用结晶水合物配制一定溶质的质量分数溶液时,要注意将结晶水的质量从溶质中减去,记下所需的蒸馏水的质量中。如果用液体溶质配制溶液,需先根据溶质的密度计算出一定质量的溶质的毫升数,再用量筒来量取溶质的体积,其他操作方法及顺序与固体溶质相同。
1.在容量瓶上无需有标记的是
A.标线
B.温度
C.浓度
D.容量
2.某实验需要0.2
mol
NaOH固体,用托盘天平称取固体时,天平读数(游码及砝码)将
A.等于8.0g
B.等于8.00g
C.大于8.0g
D.等于0.2g
3.0.5L
1mol/L的FeCl3溶液与0.2L
1
mol/L的KCl溶液中,Cl-浓度比为
A.15∶2
B.1∶1
C.3∶1
D.1∶3
4.相对分子质量为M的某物质在室温下的溶解度为S
g,此时测得饱和溶液的密度为ρg·cm-3,则该饱和溶液的物质的量浓度是
A.
B.
C.
D.
5.将标准状况下的a
L
HCl(气)溶于1000g水中,得到的盐酸密度为b
g/cm3,则该盐酸的物质的量浓度是
A.
B.
C.
D.
6.NA为阿伏加德罗常数,下列关于0.2mol/L
K2SO4溶液的正确说法是
A.500mL溶液中所含K+、SO42-总数为0.3NA
B.500mL溶液中含有0.1NA个K+离子
C.1L溶液中K+离子浓度是0.2mol/L
D.2L溶液中SO42-离子浓度是0.4mol/L
7.取100mL
0.3mol/L和300mL
0.25mol/L的硫酸注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是
A.0.21mol/L
B.0.42mol/L
C.0.56mol/L
D.0.26mol/L
8.某Al2(SO4)3溶液V
mL中含a
g
Al3+,取出V/4
mL溶液稀释成4V
mL后,SO42-的物质的量浓度为
A.125/54V
mol·L-1
B.125a/36V
mol·L-1
C.125a/18V
mol·L-1
D.125a/V
mol·L-1
9.将2.4mol某金属投入1.8L
2mol/L的某酸溶液中,恰好完全反应,并产生7.2g氢气,则该金属和酸分别是
A.二价金属,二元酸
B.二价金属,三元酸
C.三价金属,二元酸
D.一价金属,一元酸
10.配制一定体积、一定物质的量浓度的溶液,实验结果产生偏低影响的是
A.容量瓶中原有少量蒸馏水
B.溶解所用的烧杯未洗涤
C.定容时仰视观察液面
D.定容时俯视观察液面
11.有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为
A.0.1mol/L
B.0.15mol/L
C.0.2mol/L
D.0.25mol/L
12.在100g浓度为18mol/L、密度为ρ的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入水的体积
A.小于100mL
B.等于100mL
C.大于100mL
D.等于
13.用密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止。已知所生成的溶液的质量等于原BaCl2溶液的质量,则H2SO4溶液的浓度为
A.21.9%
B.42.1%
C.13.5mol/L
D.5.67mol/L
14.质量为8.02g的铁片,放进1.0L
0.90mol/L的CuSO4溶液中,过一段时间取出洗净、干燥、称量,质量为8.66g。若认为溶液的体积没有变化,则Cu2+的浓度变为
A.0.89mol/L
B.0.82mol/L
C.0.78mol/L
D.0.6mol/L
15.将4gNaOH溶解在10mL水中,稀至1L后取出10mL,其物质的量浓度是
A.
1mol/L
B.
0.1mol/L
C.
0.01mol/L
D.
10mol/L
16.用硫酸铜晶体配制500mL0.1mol/L的硫酸铜溶液,需要硫酸铜晶体的质量为
A.
25g
B.
12.5g
C.
6.25g
D.
37.5g
17.实验室常用98%(ρ=1.84g/mL)的浓H2SO4配制1:4的稀H2SO4,此稀H2SO4的密度为1.23g/mL,其物质的量浓度为
A.
4.6mol/L
B.
5.7mol/L
C.
3.88mol/L
D.
18.4mol/L
18.由Na2SO4和NaNO3组成的混合物88g溶于水配制成1L溶液,此溶液中Na+的浓度为1.2mol/L,则原混合物中NaNO3的质量为
A.
17g
B.
34g
C.
25.5g
D.
51g
CB
==
nB
 ̄
V
同课章节目录
- 第1章 水
- 1 地球上的水
- 2 水的三态变化
- 3 水是常用的溶剂
- 4 配制溶液
- 5 水的组成
- 6 水资源的利用和保护
- 第2章 空气
- 1 空气的存在
- 2 空气的成分
- 3 氧气
- 4 二氧化碳
- 5 保护大气圈
- 第3章 阳光
- 1 太阳辐射能
- 2 阳光的传播
- 3 阳光的组成
- 第4章 土壤
- 1 土壤的组成和性状
- 2 土壤与植物
- 3 人类活动与土壤
- 第5章 生态系统
- 1 种群和群落
- 2 生态系统
- 3 生物圈
- 第6章 动物和人的生殖与发育
- 1 动物的生殖与发育
- 2 人的生殖与发育
- 第7章 植物和微生物的生殖与发育
- 1 绿色开花植物的有性生殖和发育
- 2 种子的萌发和幼苗形成
- 3 植物的无性生殖
- 4 细菌和真菌的繁殖
