化学反应中的能【课件】
图片预览





文档简介
课件16张PPT。化学反应中的热量变化2Na+2H2O=2NaOH+H2↑ 1 2将塑料袋中两种白色药品
混合,轻轻揉搓,注意不要将塑
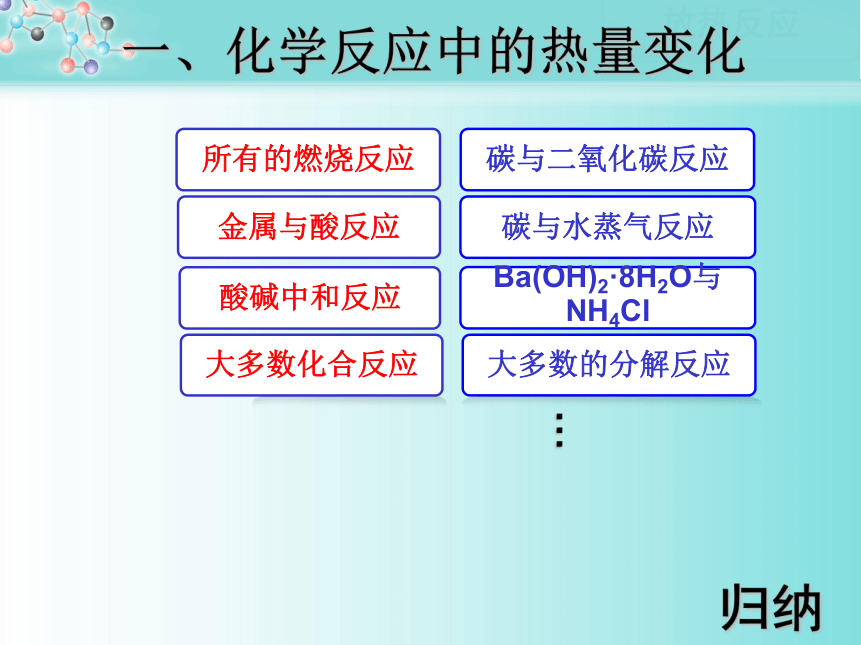
料袋揉破,体会现象。打开信封,将黑色药品露置在空气中,轻轻揉搓,一段时间后摸一摸感觉温度的变化。化学反应中的能量变化,通常表现为 的变化热量酸碱中和反应金属与酸反应所有的燃烧反应Ba(OH)2·8H2O与NH4Cl碳与水蒸气反应碳与二氧化碳反应…归纳一、化学反应中的热量变化阅读课本P36-37归纳总结化学反应
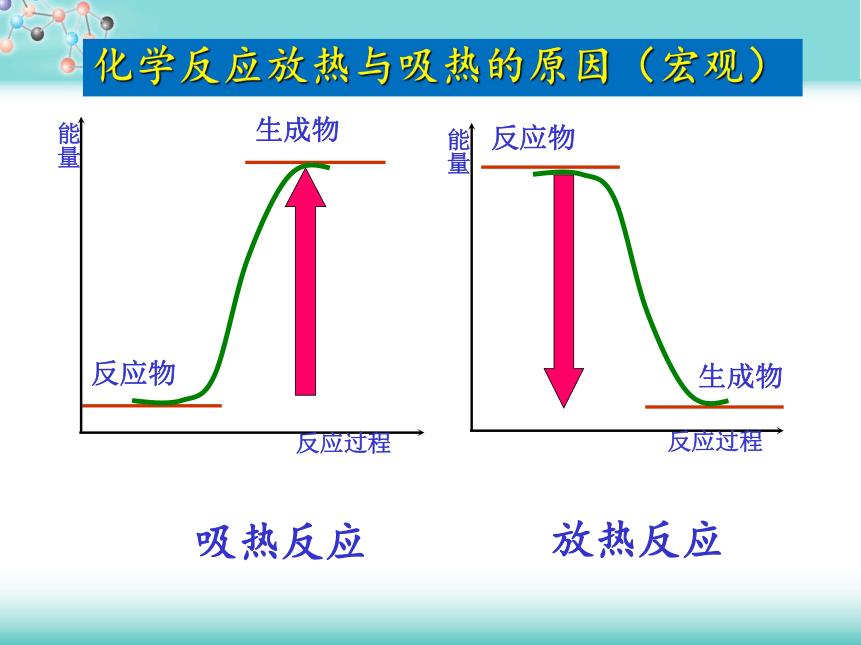
能量变化宏观:反应物与生成物总能量相对大小微观:化学键断裂与形成二、化学反应中能量变化的原因放热反应吸热反应化学反应放热与吸热的原因(宏观)能量反应物能量生成物能量反应物能量生成物能量能量化学反应放热与吸热的原因放热反应:吸热反应:反应物生成物旧化学键断裂,吸收能量E1新化学键形成,放出能量E2E1>E2吸热E1 需要碱金属的用量与放出热量关系的表达式 三.热化学方程式【观察与思考】化学方程式与热化学方程式有什么不同?C + O2==CO2 CaCO3(s)=CaO(s) + CO2(g) △H= 178.5kJ/mol化学方程式 C(s)+ O2(g)=CO2(g) △H= - 393.6kJ/mol CaCO3==CaO + CO2↑ 热化学方程式 高温 点燃 能量变化物质变化 标明物质的聚集状态,用g、l、s分别代表气态、液态 、固态 用△H 标明反应放出或吸收的热量,放热△H为“-”, 吸热△H为“+” ,单位为kJ/mol C(s)+ O2(g)=CO2(g) △H= - 393.6kJ/mol 2、热化学方程式表示的意义 1mol 固体碳与1mol 氧气完全反应生成1mol二氧化碳气体,放出393.6kJ的热量①2SO2 + O2 = 2SO3 △H = -196 . 6kJ ? mol-1课堂练习1:判断下列热化学反应方程式书写是否正确?×××C(s)+ O2(g)=CO2(g) △H= 393.6kJ/mol 科研人员利用碱金属实现肿瘤高温消融治疗的新方法。碱金属热疗法的基本原理在于利用了组织内自身的水环境,通过注射微量碱金属如钠、钾或其合金来产生放热化学反应,达到极为高效的热消融目的。已知:
2Na(s)+2H2O(l)=2NaOH(aq)+H2(g) △H = –567kJ/mol
在某次试验中经过医疗测定需要56.7KJ的热量,才能达到消融的效果,请计算需要钠的质量,要想得到注射时的体积还需要什么数据?课堂练习2:总结收获本节内容总结Thank you !
混合,轻轻揉搓,注意不要将塑
料袋揉破,体会现象。打开信封,将黑色药品露置在空气中,轻轻揉搓,一段时间后摸一摸感觉温度的变化。化学反应中的能量变化,通常表现为 的变化热量酸碱中和反应金属与酸反应所有的燃烧反应Ba(OH)2·8H2O与NH4Cl碳与水蒸气反应碳与二氧化碳反应…归纳一、化学反应中的热量变化阅读课本P36-37归纳总结化学反应
能量变化宏观:反应物与生成物总能量相对大小微观:化学键断裂与形成二、化学反应中能量变化的原因放热反应吸热反应化学反应放热与吸热的原因(宏观)能量反应物能量生成物能量反应物能量生成物能量能量化学反应放热与吸热的原因放热反应:吸热反应:反应物生成物旧化学键断裂,吸收能量E1新化学键形成,放出能量E2E1>E2吸热E1
2Na(s)+2H2O(l)=2NaOH(aq)+H2(g) △H = –567kJ/mol
在某次试验中经过医疗测定需要56.7KJ的热量,才能达到消融的效果,请计算需要钠的质量,要想得到注射时的体积还需要什么数据?课堂练习2:总结收获本节内容总结Thank you !
