化学反应中的能量变化【课件】
图片预览







文档简介
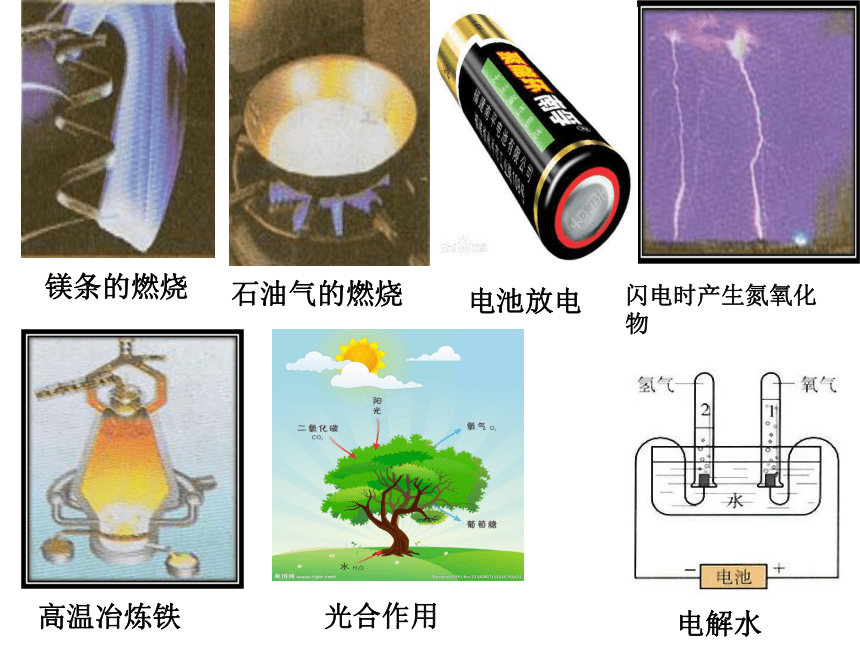
课件23张PPT。学起于思,思源于疑。 --------陈献章(明代学者)镁条的燃烧闪电时产生氮氧化物石油气的燃烧高温冶炼铁电池放电光合作用电解水专题2
第二单元 化学反应中的热量分组实验实验1:向一支试管中放入用砂纸打磨光亮的镁
条,加入1mL2mol/L的盐酸,用手触
摸试管外壁,有什么感觉?实验2:在完好的塑料袋中依次加入2药匙氢氧
化钡晶体、1药匙氯化铵,排出空气,扎
紧袋口,揉搓使之充分混合,用手触摸塑
料袋,有什么感觉?从热量变化角度看化学反应试管外壁
发热镁与盐酸反应有热量放出塑料袋外壁很凉氢氧化钡晶体与氯化铵晶体反应需要吸收热量吸热反应:吸收热量的化学反应。一、放热反应与吸热反应放热反应:放出热量的化学反应。判断下列反应是放热反应还是吸热反应:
(1)镁条的燃烧;
(2)高温下木炭与二氧化碳分生成一氧化碳;
(3)氧化钙与水反应。
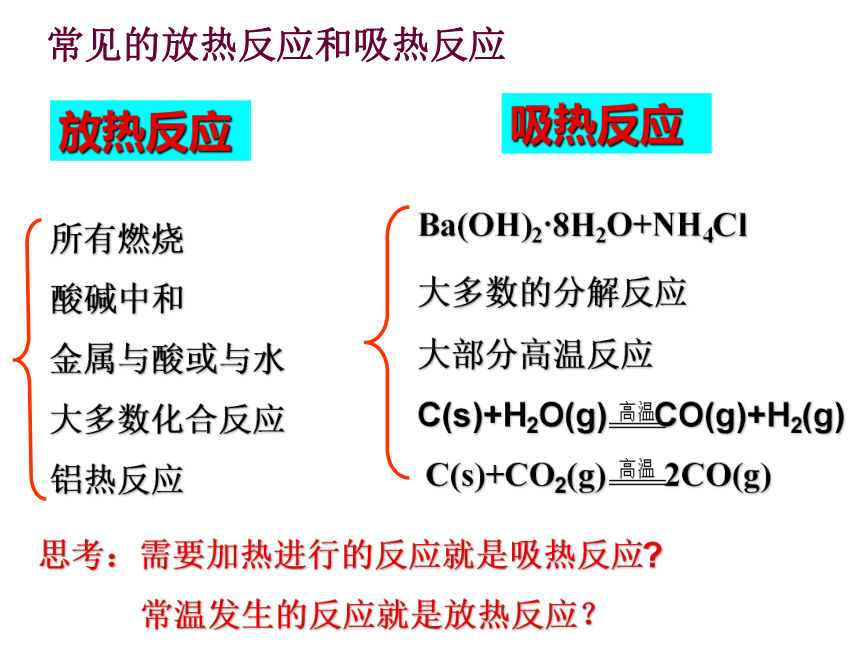
(4)盐酸和氢氧化钠溶液反应放热反应吸热反应放热反应放热反应问题解决常见的放热反应和吸热反应放热反应吸热反应思考:需要加热进行的反应就是吸热反应?
常温发生的反应就是放热反应?交流与讨论化学反应中为什么会有能量的变化?宏观:反应物和生成物所具有的能量不同.从宏观角度分析 练习:下列说法中错误的是( )
A、化学反应过程中的能量变化,遵循能量守恒定律
B、化学反应中能量变化,除了热量外,还可以是光
能、电能等。
C、需要加热才能进行的化学反应一定是吸热反应
D、反应物的总能量高于生成物的总能量时,发生放
热反应。C
微观 化学反应的实质:旧键的断裂、新键的形成若断键吸收能量>成键放出能量 , 反应;
若断键吸收能量<成键放出能量, 反应。吸热放热判断: 中热量变化?化学键角度(微观)反应热(1)定义:在化学反应中放出或吸收的热量
(2)符号:
(3)单位:△H kJ ?mol-1 二、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方程式 点燃 观察以下热化学反应方程式,你发现了什么?2H2(g) + O2(g)==2H2O(g) △H=-483.6 kJ/mol
2H2(g) + O2(g)== 2H2O(l) △H=-571.6 kJ/mol结论:同种物质聚集状态不同,能量不同2H2(g) + O2(g)== 2H2O(l) △H=-571.6 kJ/mol
H2(g) +1/2O2(g)== H2O(l) △H=-285.8 kJ/mol结论:△H 的值与化学计量数成正比化学计量数只表示物质的量,可用分数2.热化学方程式的书写步骤(1)写出正确的化学方程式(2)标明各物质的聚集状态(3)注明反应热 △H
“—”表示放热,“+”表示吸热,单位:kJ/mol。①2SO2 + O2 = 2SO3 △H = -196 . 6kJ ? mol-1课堂练习:③ C(s) + O2(g) = CO2 (g) △H = + 393 .6kJ ? mol-1判断下列热化学反应方程式书写是否正确?×××例1. 已知每1 mol 碳完全燃烧生成二氧化碳时将放出393.6kJ热量,写出该反应的热化学方程式。 C(s)+O2(g)=CO2(g);△H=-393.6kJ/mol例2. 已知每1 mol 甲烷完全燃烧生成二氧化碳和液态水时将放出889.6kJ热量,写出该反应的热化学方程式。CH4(g) +2O2(g) = CO2(g) + 2H2O(l);△H =-889.6kJ/mol 练一练:写出下列反应的热化学方程式1. 1mol碳酸钙完全分解生成1mol CaO和1mol CO2气体,吸收178.5kJ热量。2. 6g碳在氧气中完全燃烧,生成CO2气体,放出196.8kJ热量。3. 已知2H2(g) +O2(g) = 2H2O(l) △H =-571.6 kJ/mol,
则反应H2(g) +1/2 O2(g) = H2O(l) △H =?
2H2O(l) = 2H2(g) +O2(g) △H =?B5、
C金刚石(S)+O2(g) = CO2(g) △H=- 395.5 KJ ?mol-1 (1)
C石墨(S) + O2(g) = CO2(g) △H=- 393.4 KJ ?mol-1 (2)
写出石墨转化为金刚石方程式,并判断哪一种物质更稳
定。 石墨能量更低,更稳定。 C石墨(S) = C金刚石(S) △H=+2.1 KJ ?mol-1 通过这节课你学到了什么?1.能量转化的方式,特别是化学能与 热能的相互转化。
2.学会判定放热反应和吸热反应,学会热化学方程式的书写。
3.明确化学键的断裂和形成是化学反应中能量变化的主要原因。
条,加入1mL2mol/L的盐酸,用手触
摸试管外壁,有什么感觉?实验2:在完好的塑料袋中依次加入2药匙氢氧
化钡晶体、1药匙氯化铵,排出空气,扎
紧袋口,揉搓使之充分混合,用手触摸塑
料袋,有什么感觉?从热量变化角度看化学反应试管外壁
发热镁与盐酸反应有热量放出塑料袋外壁很凉氢氧化钡晶体与氯化铵晶体反应需要吸收热量吸热反应:吸收热量的化学反应。一、放热反应与吸热反应放热反应:放出热量的化学反应。判断下列反应是放热反应还是吸热反应:
(1)镁条的燃烧;
(2)高温下木炭与二氧化碳分生成一氧化碳;
(3)氧化钙与水反应。
(4)盐酸和氢氧化钠溶液反应放热反应吸热反应放热反应放热反应问题解决常见的放热反应和吸热反应放热反应吸热反应思考:需要加热进行的反应就是吸热反应?
常温发生的反应就是放热反应?交流与讨论化学反应中为什么会有能量的变化?宏观:反应物和生成物所具有的能量不同.从宏观角度分析 练习:下列说法中错误的是( )
A、化学反应过程中的能量变化,遵循能量守恒定律
B、化学反应中能量变化,除了热量外,还可以是光
能、电能等。
C、需要加热才能进行的化学反应一定是吸热反应
D、反应物的总能量高于生成物的总能量时,发生放
热反应。C
微观 化学反应的实质:旧键的断裂、新键的形成若断键吸收能量>成键放出能量 , 反应;
若断键吸收能量<成键放出能量, 反应。吸热放热判断: 中热量变化?化学键角度(微观)反应热(1)定义:在化学反应中放出或吸收的热量
(2)符号:
(3)单位:△H kJ ?mol-1 二、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方程式 点燃 观察以下热化学反应方程式,你发现了什么?2H2(g) + O2(g)==2H2O(g) △H=-483.6 kJ/mol
2H2(g) + O2(g)== 2H2O(l) △H=-571.6 kJ/mol结论:同种物质聚集状态不同,能量不同2H2(g) + O2(g)== 2H2O(l) △H=-571.6 kJ/mol
H2(g) +1/2O2(g)== H2O(l) △H=-285.8 kJ/mol结论:△H 的值与化学计量数成正比化学计量数只表示物质的量,可用分数2.热化学方程式的书写步骤(1)写出正确的化学方程式(2)标明各物质的聚集状态(3)注明反应热 △H
“—”表示放热,“+”表示吸热,单位:kJ/mol。①2SO2 + O2 = 2SO3 △H = -196 . 6kJ ? mol-1课堂练习:③ C(s) + O2(g) = CO2 (g) △H = + 393 .6kJ ? mol-1判断下列热化学反应方程式书写是否正确?×××例1. 已知每1 mol 碳完全燃烧生成二氧化碳时将放出393.6kJ热量,写出该反应的热化学方程式。 C(s)+O2(g)=CO2(g);△H=-393.6kJ/mol例2. 已知每1 mol 甲烷完全燃烧生成二氧化碳和液态水时将放出889.6kJ热量,写出该反应的热化学方程式。CH4(g) +2O2(g) = CO2(g) + 2H2O(l);△H =-889.6kJ/mol 练一练:写出下列反应的热化学方程式1. 1mol碳酸钙完全分解生成1mol CaO和1mol CO2气体,吸收178.5kJ热量。2. 6g碳在氧气中完全燃烧,生成CO2气体,放出196.8kJ热量。3. 已知2H2(g) +O2(g) = 2H2O(l) △H =-571.6 kJ/mol,
则反应H2(g) +1/2 O2(g) = H2O(l) △H =?
2H2O(l) = 2H2(g) +O2(g) △H =?B5、
C金刚石(S)+O2(g) = CO2(g) △H=- 395.5 KJ ?mol-1 (1)
C石墨(S) + O2(g) = CO2(g) △H=- 393.4 KJ ?mol-1 (2)
写出石墨转化为金刚石方程式,并判断哪一种物质更稳
定。 石墨能量更低,更稳定。 C石墨(S) = C金刚石(S) △H=+2.1 KJ ?mol-1 通过这节课你学到了什么?1.能量转化的方式,特别是化学能与 热能的相互转化。
2.学会判定放热反应和吸热反应,学会热化学方程式的书写。
3.明确化学键的断裂和形成是化学反应中能量变化的主要原因。
