广东省普宁市第二中学2016-2017学年高一下学期第一次月考化学试题 Word版含答案
文档属性
| 名称 | 广东省普宁市第二中学2016-2017学年高一下学期第一次月考化学试题 Word版含答案 |  | |
| 格式 | zip | ||
| 文件大小 | 284.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-02-22 08:22:43 | ||
图片预览


文档简介
普宁市第二中学2016-2017学年度高一级下学期第一次月考
化学试题
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名和考生号填写在答题卷上。
2.用2B铅笔将选择题答案在答题卷对应位置涂黑;答案不能答在试卷上。
3.非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卷各题目指定区域内的相应位置上;不准使用铅笔或涂改液。不按以上要求作答的答案无效。
4.考生必须保持答题卷的整洁。
可能用到的相对原子质量:
一、选择题(本题包括10小题,每小题只有一个选项符合题意,共30分。)
1.
下列关于胶体的叙述不正确的是
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.
胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
D.用平行光照射溶液和胶体时,产生的现象相同
2.
设表示阿伏加德罗常数的值,下列叙述正确的是
A.所含质子数为
B.1摩尔氦气所含的原子数为
C.在标准状况下水所含分子数为
D.与足量盐酸反应转移的电子数为
3.
下列各组离子方程式可用表示的是
A.硫酸溶液中和氢氧化钠溶液
B.硫酸溶液中和氢氧化钡溶液
C.盐酸溶解氧化铜
D.盐酸溶解氢氧化镁
4.
需要有适当的氧化剂才能实现的反应是
A.
B.
C.
D.
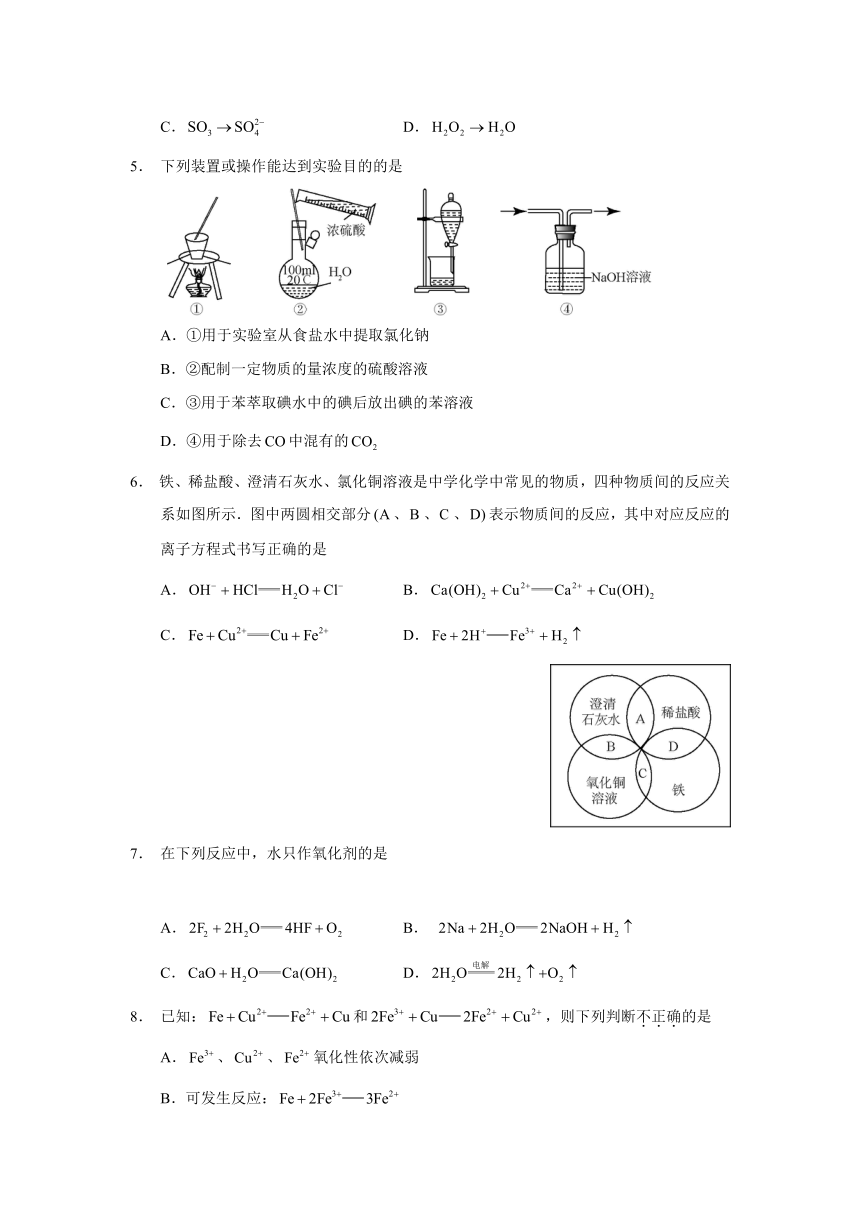
5.
下列装置或操作能达到实验目的的是
A.①用于实验室从食盐水中提取氯化钠
B.②配制一定物质的量浓度的硫酸溶液
C.③用于苯萃取碘水中的碘后放出碘的苯溶液
D.④用于除去中混有的
6.
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分、、、表示物质间的反应,其中对应反应的离子方程式书写正确的是
A.
B.
C.
D.
7.
在下列反应中,水只作氧化剂的是
A.
B.
C.
D.
8.
已知:和,则下列判断不正确的是
A.、、氧化性依次减弱
B.可发生反应:
C.、、还原性依次减弱
D.将铁、铜混合粉末放入溶液中,铁粉先溶解
9.
用下列方法均可制得氧气:
①
②
③
④
若要制得相同质量的氧气,反应中电子转移数目之比为
A.
B.
C.
D.
10.饮用水中的对人类健康会产生危害,为了降低饮用水中的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将还原为,反应的转化为:
(未配平)
下列有关该反应说法不正确的是
A.表现碱性
B.是氧化产物,是还原产物
C.每生成转移
D.氧化剂与还原剂物质的量之比为
二、选择题(本题包括5小题.每小题有一个或两个选项符合题意,共20分)
11.下列离子方程式正确的是
A.向溶液中加入粉:
B.向溶液中通入:
C.饱和溶液滴入沸水中制胶体:
D.溶液与溶液混合:
12.在强酸性溶液中,能大量共存的离子组是
A.、、、
B.、、、
C.、、、
D.、、、
13.下列反应过程中溶液的导电性有显著变化的是
A.向溶液中滴加盐酸至完全中和
B.向溶液中滴加盐酸至完全中和
C.向溶液中滴加硫酸至完全中和
D.向溶液中滴加至沉淀完全
14.某化工厂按如下步骤进行生产:①以煤为燃料煅烧碳酸钙;②用饱和溶液吸收步骤①中产生的(转化为小苏打);③使步骤①中产生的跟水反应生成消石灰;④消石灰跟溶液反应,所得产品之一循环利用.下列说法不正确的是
A.生产过程中没有涉及到氧化还原反应
B.生产过程中没有涉及到置换反应
C.该厂生产的主要原料为煤、纯碱
D.该厂生产的最终产品是小苏打及烧碱
15.在和的混合溶液中加入,恰好使溶液中的离子完全沉淀;如加入足量强碱交加热可得到,则原溶液中的浓度为
A.
B.
C.
D.
三、填空题(本题包括5个小题,共52分)
16.(10分)实验室要配制100
mL
2
mol/L
NaCl溶液,请回答下列问题:
(1)
配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和___________。
(2)
用托盘天平称取氯化钠固体,其质量为__________
g。
(3)
下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)
如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度_______(填“偏高”或“偏低”或“无影响”,下同);若定容时俯视容量瓶刻度线,会造成所配溶液的物质的量浓度_________。
17.(6分)下列物质:①CO2
②盐酸
③烧碱固体
④酒精
⑤铁
⑥硫酸
⑦CaCO3
⑧BaSO4
⑨食盐水⑩Fe(OH)3(用编号回答)请按下列分类标准回答问题。
(1)
属于非电解质的是
;属于混合物的是_____
___。
(2)
既不是电解质也不是非电解质的是
;能导电的是____
____。
(3)
属于难溶性盐的是____
____;属于碱的是___
_____。
18.(10分)完成下列填空。
(1)
0.
5L
1mol/L的CaCl2
溶液,
Cl-的物质的量浓度为___________mol/L。
(2)
标况下,33.6L的NH3溶解于水配成1L溶液,则溶液的物质的量浓度为_____mol/L。
(3)
在Fe2O3+2AlAl2O3+2Fe中,氧化剂是__________;还原产物是_________。
(4)
标出上述方程式电子转移的方向与数目(用双线桥法)
。
19.(14分)已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。请回答下列问题。
(1)
写出下列物质的化学式:D
;Q
_
。
(2)
A和水反应的化学方程式
。
(3)
若要确定E溶液中是否含有W物质,所选试剂为________
。
a.
氯水和KSCN溶液
b.
KSCN溶液
c.
浓氨水
d.
酸性高锰酸钾溶液
(4)
B与E混和得到H并在潮湿空气中变成M的过程中,可观察到的现象_____________________。
(5)
B和R反应生成N的离子方程式
_
;
W溶液与单质T反应的离子方程式
。
20.(12分)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:
MnO2
+
4HCl(浓)
MnCl2
+
Cl2↑+
2H2O
(1)
该反应中被氧化的元素是
,氧化剂是
,还原剂和氧化剂的物质的量之比是
,在此反应中,浓盐酸表现出的性质是
。
(2)取一定量的浓盐酸使其与二氧化锰反应,产生的氯气在标准状况下的体积33.6
L,则参加反应的HCl的物质的量为
,反应中转移电子数为
。
化学参考答案
1
2
3
4
5
6
7
8
9
10
C
C
A
A
D
C
B
C
B
A
11
12
13
14
15
A
BC
C
AC
C
16.(10分,每空2分)
(1)
100
mL容量瓶
(2)
11.7
(3)
①③⑤②④
(4)
偏低;
偏高
17.(6分,每空1分)
(1)
①④;
②⑨
(2)
②⑤⑨
;②⑤⑨
(3)
⑦⑧;③⑩
18.(10分,每空2分)
(1)
2
(2)
1.5
(3)
Fe2O3
;Fe
(4)
略
19.(14分,每空2分)
(1)
Fe3O4
Al2O3
(2)
2Na2O2+2H2O=4NaOH+O2↑
(3)
b
(4)
生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
(5)
2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe+2Fe3+=
3Fe2+
20.(12分,每空2分)
(1)
Cl
;MnO2
;2:1
;还原性和酸性
(2)
6
mol;3NA或1.806×1024
化学试题
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名和考生号填写在答题卷上。
2.用2B铅笔将选择题答案在答题卷对应位置涂黑;答案不能答在试卷上。
3.非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卷各题目指定区域内的相应位置上;不准使用铅笔或涂改液。不按以上要求作答的答案无效。
4.考生必须保持答题卷的整洁。
可能用到的相对原子质量:
一、选择题(本题包括10小题,每小题只有一个选项符合题意,共30分。)
1.
下列关于胶体的叙述不正确的是
A.胶体区别于其他分散系的本质特征是分散质的微粒直径在之间
B.光线透过胶体时,胶体中可发生丁达尔效应
C.
胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
D.用平行光照射溶液和胶体时,产生的现象相同
2.
设表示阿伏加德罗常数的值,下列叙述正确的是
A.所含质子数为
B.1摩尔氦气所含的原子数为
C.在标准状况下水所含分子数为
D.与足量盐酸反应转移的电子数为
3.
下列各组离子方程式可用表示的是
A.硫酸溶液中和氢氧化钠溶液
B.硫酸溶液中和氢氧化钡溶液
C.盐酸溶解氧化铜
D.盐酸溶解氢氧化镁
4.
需要有适当的氧化剂才能实现的反应是
A.
B.
C.
D.
5.
下列装置或操作能达到实验目的的是
A.①用于实验室从食盐水中提取氯化钠
B.②配制一定物质的量浓度的硫酸溶液
C.③用于苯萃取碘水中的碘后放出碘的苯溶液
D.④用于除去中混有的
6.
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,四种物质间的反应关系如图所示.图中两圆相交部分、、、表示物质间的反应,其中对应反应的离子方程式书写正确的是
A.
B.
C.
D.
7.
在下列反应中,水只作氧化剂的是
A.
B.
C.
D.
8.
已知:和,则下列判断不正确的是
A.、、氧化性依次减弱
B.可发生反应:
C.、、还原性依次减弱
D.将铁、铜混合粉末放入溶液中,铁粉先溶解
9.
用下列方法均可制得氧气:
①
②
③
④
若要制得相同质量的氧气,反应中电子转移数目之比为
A.
B.
C.
D.
10.饮用水中的对人类健康会产生危害,为了降低饮用水中的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将还原为,反应的转化为:
(未配平)
下列有关该反应说法不正确的是
A.表现碱性
B.是氧化产物,是还原产物
C.每生成转移
D.氧化剂与还原剂物质的量之比为
二、选择题(本题包括5小题.每小题有一个或两个选项符合题意,共20分)
11.下列离子方程式正确的是
A.向溶液中加入粉:
B.向溶液中通入:
C.饱和溶液滴入沸水中制胶体:
D.溶液与溶液混合:
12.在强酸性溶液中,能大量共存的离子组是
A.、、、
B.、、、
C.、、、
D.、、、
13.下列反应过程中溶液的导电性有显著变化的是
A.向溶液中滴加盐酸至完全中和
B.向溶液中滴加盐酸至完全中和
C.向溶液中滴加硫酸至完全中和
D.向溶液中滴加至沉淀完全
14.某化工厂按如下步骤进行生产:①以煤为燃料煅烧碳酸钙;②用饱和溶液吸收步骤①中产生的(转化为小苏打);③使步骤①中产生的跟水反应生成消石灰;④消石灰跟溶液反应,所得产品之一循环利用.下列说法不正确的是
A.生产过程中没有涉及到氧化还原反应
B.生产过程中没有涉及到置换反应
C.该厂生产的主要原料为煤、纯碱
D.该厂生产的最终产品是小苏打及烧碱
15.在和的混合溶液中加入,恰好使溶液中的离子完全沉淀;如加入足量强碱交加热可得到,则原溶液中的浓度为
A.
B.
C.
D.
三、填空题(本题包括5个小题,共52分)
16.(10分)实验室要配制100
mL
2
mol/L
NaCl溶液,请回答下列问题:
(1)
配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和___________。
(2)
用托盘天平称取氯化钠固体,其质量为__________
g。
(3)
下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)
如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度_______(填“偏高”或“偏低”或“无影响”,下同);若定容时俯视容量瓶刻度线,会造成所配溶液的物质的量浓度_________。
17.(6分)下列物质:①CO2
②盐酸
③烧碱固体
④酒精
⑤铁
⑥硫酸
⑦CaCO3
⑧BaSO4
⑨食盐水⑩Fe(OH)3(用编号回答)请按下列分类标准回答问题。
(1)
属于非电解质的是
;属于混合物的是_____
___。
(2)
既不是电解质也不是非电解质的是
;能导电的是____
____。
(3)
属于难溶性盐的是____
____;属于碱的是___
_____。
18.(10分)完成下列填空。
(1)
0.
5L
1mol/L的CaCl2
溶液,
Cl-的物质的量浓度为___________mol/L。
(2)
标况下,33.6L的NH3溶解于水配成1L溶液,则溶液的物质的量浓度为_____mol/L。
(3)
在Fe2O3+2AlAl2O3+2Fe中,氧化剂是__________;还原产物是_________。
(4)
标出上述方程式电子转移的方向与数目(用双线桥法)
。
19.(14分)已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。请回答下列问题。
(1)
写出下列物质的化学式:D
;Q
_
。
(2)
A和水反应的化学方程式
。
(3)
若要确定E溶液中是否含有W物质,所选试剂为________
。
a.
氯水和KSCN溶液
b.
KSCN溶液
c.
浓氨水
d.
酸性高锰酸钾溶液
(4)
B与E混和得到H并在潮湿空气中变成M的过程中,可观察到的现象_____________________。
(5)
B和R反应生成N的离子方程式
_
;
W溶液与单质T反应的离子方程式
。
20.(12分)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:
MnO2
+
4HCl(浓)
MnCl2
+
Cl2↑+
2H2O
(1)
该反应中被氧化的元素是
,氧化剂是
,还原剂和氧化剂的物质的量之比是
,在此反应中,浓盐酸表现出的性质是
。
(2)取一定量的浓盐酸使其与二氧化锰反应,产生的氯气在标准状况下的体积33.6
L,则参加反应的HCl的物质的量为
,反应中转移电子数为
。
化学参考答案
1
2
3
4
5
6
7
8
9
10
C
C
A
A
D
C
B
C
B
A
11
12
13
14
15
A
BC
C
AC
C
16.(10分,每空2分)
(1)
100
mL容量瓶
(2)
11.7
(3)
①③⑤②④
(4)
偏低;
偏高
17.(6分,每空1分)
(1)
①④;
②⑨
(2)
②⑤⑨
;②⑤⑨
(3)
⑦⑧;③⑩
18.(10分,每空2分)
(1)
2
(2)
1.5
(3)
Fe2O3
;Fe
(4)
略
19.(14分,每空2分)
(1)
Fe3O4
Al2O3
(2)
2Na2O2+2H2O=4NaOH+O2↑
(3)
b
(4)
生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
(5)
2Al+2OH-+2H2O=2AlO2-+3H2↑
Fe+2Fe3+=
3Fe2+
20.(12分,每空2分)
(1)
Cl
;MnO2
;2:1
;还原性和酸性
(2)
6
mol;3NA或1.806×1024
同课章节目录
