课题1 常见的酸和碱 同步练习(带解析)
文档属性
| 名称 | 课题1 常见的酸和碱 同步练习(带解析) |  | |
| 格式 | zip | ||
| 文件大小 | 520.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-02-24 09:21:47 | ||
图片预览


文档简介
课题1 常见的酸和碱 同步练习(带解析)
一、选择题
1、下列是人体中几种体液的正常pH,碱性最强的是( )
A.血浆(7.35~7.45)?? B.胰液(7.5~8.0)
C.胃液(0.9~1.5) D.唾液(6.6~7.1)
2、科学家研究发现,人体大脑皮层体液最理想的pH介于7.35~7.45之间.人体大脑皮层体液的酸碱度( )
A.偏酸性?? B.偏碱性?? C.呈中性?? D.难以判断
3、以下生产、生活中的做法不符合环保理念的是( )
A.开发使用新能源
B.工业用水重复使用
C.秸秆回收利用,不露天焚烧
D.电脑、电视长期处于待机状态
4、下列做法或说法中不正确的是( )
A.用熟石灰降低土壤碱性,改良土壤结构
B.用煮沸或蒸馏的方法能降低水的硬度
C.将煤球制成“蜂窝煤”是为了增大与空气的接触面积,使其燃烧更充分
D.使用可降解塑料代替传统塑料,有利于减轻“白色污染”
5、类推是学习中常用的思维方法,现有以下类推结果,其中错误的是( )
①碱的水溶液通常呈碱性,所以碱性溶液一定是碱的溶液
②氧化物都含有氧元素,所以含氧元素的化合物不一定是氧化物
③酸碱发生中和反应生成盐和水,所以生成水的反应一定是中和反应
④燃烧一般都伴随发光、发热现象,所以有发光、发热现象的变化就是燃烧
⑤单质是由同种元素组成的,则由同种元素组成的纯净物一定是单质.
A.①②③④ B.①②③④⑤?? C.②③④⑤ D.①③④
6、分析推理是化学学习中常用的思维方法.下列分析推理正确的是( )
A.酸和碱发生中和反应生成盐和水;生成盐和水的反应都是中和反应
B.酸雨的pH小于7,所以pH小于7的雨水一定是酸雨
C.碱溶液能使无色酚酞试液变红,所以能使无色酚酞试液变红的溶液一定是碱溶液
D.水和双氧水组成相同但化学性质不同,是由于它们的分子构成不同
7、下列实验现象描述正确的是( )
A.熟石灰中加入一定量的水:白色固体变成白色浆液,放出大量的热
B.加热通入足量二氧化碳后的石蕊溶液:溶液由紫色变为红色
C.硫在空气中燃烧:发出蓝紫色火焰,产生有刺激性气味的气体,放热
D.铁钉放在硫酸铜溶液中:银白色固体表面有紫红色固体析出,溶液由蓝色变为浅绿色
二、填空题
8、将生锈的铁钉投入到过量的稀盐酸中,刚开始观察到的现象是 ,其反应的化学方程式是 ;过一段时间后,又可以观察到的现象是 ,铁钉发生反应的化学方程式是 .【来源:21cnj*y.co*m】
9、小华家有一张铁床,因长期受潮已锈迹斑斑.他从上面取一枚生锈的铁螺丝放入一定量的稀硫酸中,观察到铁锈(主要成分是Fe2O3)逐渐消失,此反应的化学方程式是 .小华同学结合学过的化学知识,提出了一些防止铁床进一步锈蚀的建议,请写出一条小华同学的合理建议 .【出处:21教育名师】
10、结合NaOH、Ca(OH)2,的相关知识,回答下列问题.
(1)可用来改良酸性土壤的固体是 ;
(2)从微观角度看,它们的溶液具有相似化学性质的原因是 ;
(3)区分两种溶液可选用的试剂是 .
11、为了探究氢氧化钙的化学性质,同学们进行了以下实验:
A.向氢氧化钙溶液中通入二氧化碳;
B.向氢氧化钙溶液中滴加2滴酚酞溶液后,振荡,再加入过量的稀盐酸;
C.向氢氧化钙溶液中加入一定量的碳酸钠溶液,振荡.
(1)实验B的目的是 ;
(2)实验C中发生反应的化学方程式为 ;
(3)将上述3个实验后的废液倒入同一个洁净的烧杯里,静止后发现烧杯底部有白色沉淀,上层清液呈无色,则上层清液中一定含有的溶质包括酚酞和 .
三、实验探究题
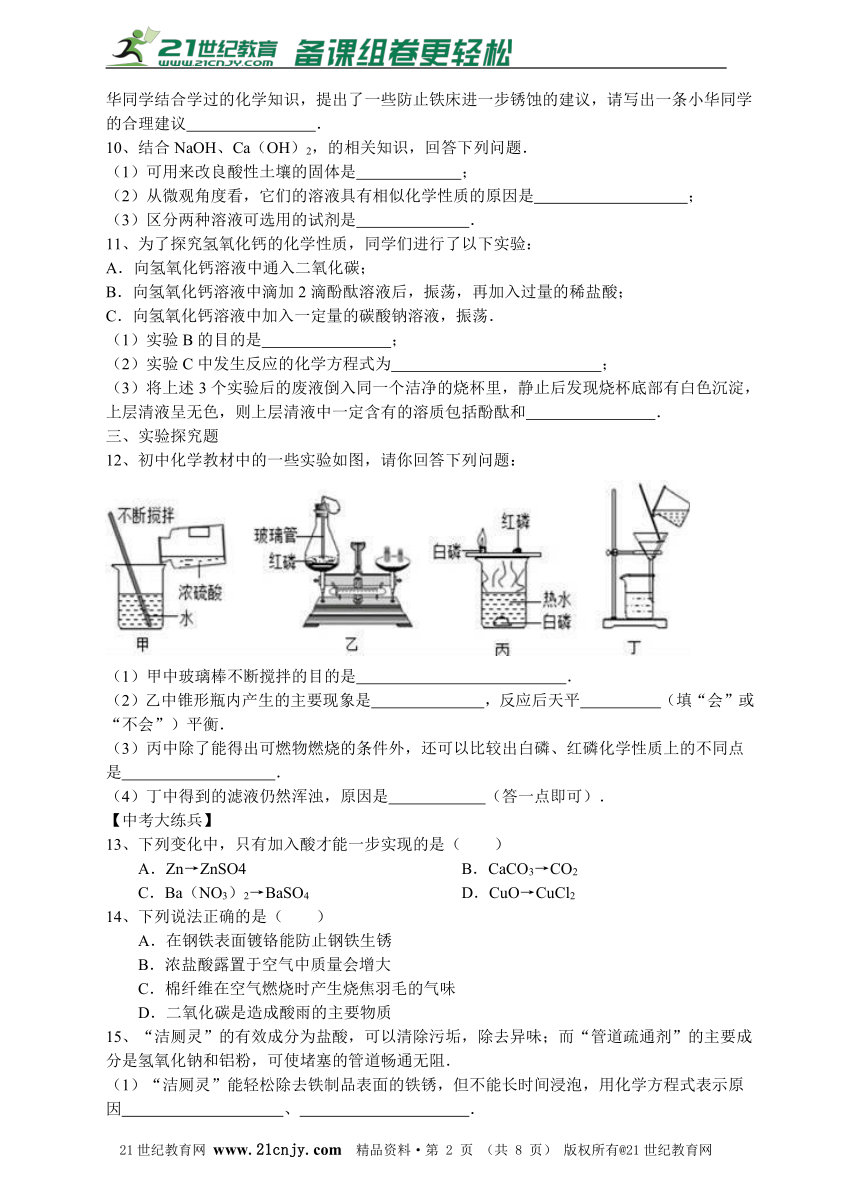
12、初中化学教材中的一些实验如图,请你回答下列问题:
(1)甲中玻璃棒不断搅拌的目的是 .
(2)乙中锥形瓶内产生的主要现象是 ,反应后天平 (填“会”或“不会”)平衡.2·1·c·n·j·y
(3)丙中除了能得出可燃物燃烧的条件外,还可以比较出白磷、红磷化学性质上的不同点是 .【版权所有:21教育】
(4)丁中得到的滤液仍然浑浊,原因是 (答一点即可).
【中考大练兵】
13、下列变化中,只有加入酸才能一步实现的是( )
A.Zn→ZnSO4??? B.CaCO3→CO2???
C.Ba(NO3)2→BaSO4 D.CuO→CuCl2
14、下列说法正确的是( )
A.在钢铁表面镀铬能防止钢铁生锈
B.浓盐酸露置于空气中质量会增大
C.棉纤维在空气燃烧时产生烧焦羽毛的气味
D.二氧化碳是造成酸雨的主要物质
15、“洁厕灵”的有效成分为盐酸,可以清除污垢,除去异味;而“管道疏通剂”的主要成分是氢氧化钠和铝粉,可使堵塞的管道畅通无阻.21世纪教育网版权所有
(1)“洁厕灵”能轻松除去铁制品表面的铁锈,但不能长时间浸泡,用化学方程式表示原因 、 .21教育网
(2)“漂白精”的有效成分为次氯酸钠(NaClO),可以快速漂除衣物污渍,若与“洁厕灵”混用,易产生一种有毒气体,反应的化学方程式为:NaClO+2HCl═NaCl+Cl2↑+X,则X的化学式为 .www.21-cn-jy.com
(3)管道疏通剂疏通管道的原理是:铝与氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为 .21*cnjy*com
(4)管道疏通剂不能与“洁厕灵”混合使用,用化学方程式表示原因 .
16、化学是在分子、原子层面上认识和创造物质的一门科学.请用化学观点讨论下面的问题:(第(1)问用化学用语表示)
(1)酸溶液具有相似的化学性质,是因为不同的酸溶液中都含有相同的 .
(2)过氧化氢是一种常用的杀菌消毒剂,其原因是过氧化氢分子中含有一种叫做“过氧基”(下列物质①中虚线框标出的部分)的结构.据此推测下列②﹣④的物质中,可用作杀菌消毒剂的是 (填序号).
①? ②H﹣O﹣H?? ③O=C=O ④
(3)若分别用○和●代表两种不同元素的原子.这两种元素分别组成的单质在点燃条件下发生反应,反应前后的微观模拟图如下图所示,若用A代表○、B代表●,请用A、B表示该反应的化学方程式: .
17、如图所示是Ca(OH)2的部分性质实验,回答有关问题.
(1)A中的实验现象是 ;
(2)C中发生反应的化学方程式为 ;
(3)将这三个实验后的所有物质倒入同一洁净的烧杯中,静置,观察到上层溶液为无色,底部有白色沉淀.取少量上层溶液与足量稀盐酸混合,无明显现象.综合分析可知:上层溶液中一定含有的溶质是酚酞和 ,可能含有的溶质是 .
18、氢氧化钠是一种重要的化工原料,广泛地应用于肥皂、石油、造纸、纺织、等行业.
(1)氢氧化钠的俗名是 (只写一种).氢氧化钠与硫酸反应的化学方程式为 .
(2)氢氧化钠固体曝露在空气中时容易吸收水分而潮解,还易与空气中的 发生 反应而变质,其反应的化学方程式为 .
(3)实验室有一瓶久置的固体,标签上写着“氢氧化钠”.为了检验里面是否还存在NaOH,小帆、小玉同学分别取少量该固体样品进行以下实验:
小帆同学做了如下实验:
实验步骤
实验现象
实验结论
取少量样品于试管中,加蒸馏水溶解得无色溶液,滴入2滴无色酚酞试液
无色酚酞试液变红
样品中含有氢氧化钠
小玉认为小帆的实验方案不严密,不能证实无色溶液中一定含有氢氧化钠,理由是:
小玉设计了另一个实验:请你完成表格里所缺内容.
实验步骤
实验现象
实验结论
①取少量样品于试管中,加入足量的CaCl2溶液
②过滤,向滤液中滴加几滴
有白色沉淀生成
样品中确实含有氢氧化钠
小玉加入足量的CaCl2溶液的实验目的是 .
参考答案及解析
1、B
【解答】A、血浆的pH为7.35~7.45,大于7,显碱性.
B、胰液的pH为7.5~8.0,大于7,显碱性.
5、D
【解答】①碱性溶液不一定是碱溶液.例如,碳酸钠的水溶液显碱性,它是盐.
②氧化物是含有两种元素且其中一种是氧元素的化合物,含有氧元素的化合物不一定是两种元素,例如碳酸中含有氧元素,但它不是氧化物.21·cn·jy·com
③生成盐和水的反应不一定是中和反应.例如,石灰水和二氧化碳反应生成碳酸钙(盐)和水,但不是中和反应;【来源:21·世纪·教育·网】
④有发光、放热现象的变化不一定是燃烧,例如电灯通电时发光、放热,但是不属于燃烧.
⑤单质是由一种元素组成的纯净物,单质一定由同种元素组成.但由同种元素组成的物质不一定是单质.例如,氧气和臭氧组成的物质,是由氧元素组成的物质,属于混合物,不属于单质.所以上述说法正确.21·世纪*教育网
所以类推结果错误的为①③④.
6、D
【解答】A、中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如CO2+2NaOH═Na2CO3+H2O,故选项推理错误.www-2-1-cnjy-com
B、酸雨的pH小于7,所以pH小于7的雨水不一定是酸雨,正常雨水的pH也小于7,故选项推理错误.
C、碱溶液能使无色酚酞试液变红,但能使无色酚酞试液变红的溶液不一定是碱溶液,也可能是碳酸钠等盐溶液,故选项说法错误.21cnjy.com
D、水和双氧水组成相同但化学性质不同,是因为它们的分子构成不同,不同种的分子化学性质不同,故选项推理正确.21*cnjy*com
7、D
【解答】A、生石灰与水反应生成氢氧化钙,生石灰中加入一定量的水,白色固体变成白色浆液,该反应放出大量的热,不是熟石灰,故选项说法错误.21教育名师原创作品
B、加热通入足量二氧化碳后的石蕊溶液,碳酸不稳定,加热后分解生成水和二氧化碳,溶液由红色变为紫色,故选项说法错误.
C、硫在空气中燃烧,产生淡蓝色火焰,产生有刺激性气味的气体,放热,故选项说法错误.
D、铁钉与硫酸铜溶液反应生成硫酸亚铁溶液和铜,银白色固体表面有红色物质析出,溶液由蓝色变为浅绿色,故选项说法正确.
(3)二氧化碳与氢氧化钙混合产生白色沉淀,与氢氧化钠溶液混合不反应,可以鉴别,区分两种溶液可选用的试剂是二氧化碳.
11、(1)证明氢氧化钙能与盐酸反应;
(2)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(3)氯化钠
【解答】(1)向氢氧化钙溶液中滴加2滴酚酞溶液后,振荡,溶液呈红色,再加入过量的稀盐酸,红色逐渐变为无色,说明氢氧化钙能与盐酸反应,因此实验B的目的是证明氢氧化钙能与盐酸反应,故填:证明氢氧化钙能与盐酸反应;
(2)氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(3)将上述3个实验后的废液倒入同一个洁净的烧杯里,静止后发现烧杯底部有白色沉淀,说明盐酸全部反应,上层清液呈无色,说明没有显碱性的氢氧化钙、碳酸钠和氢氧化钠,则上层清液中一定含有的溶质包括酚酞和生成的氯化钠,故填:氯化钠.
12、(1)使热量及时地扩散;
(2)产生大量的白烟,放出大量的热;会;
(3)红磷的着火点比白磷的高;
(4)滤纸破损(或滤液高于滤纸边缘或盛接滤液的烧杯不干净等).
【解答】(1)稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散.
(2)红磷在空气中燃烧,产生大量的白烟,放出大量的热;由于实验是在密闭装置内进行,反应后天平会平衡.
(3)铜片上的白磷、红磷均为可燃物,均能与氧气接触,白磷燃烧、红磷不燃烧,说明了红磷的着火点比白磷的高.
(4)过滤后发现滤液仍然浑浊,可能原因是滤纸破损(会使得液体中的不溶物进入下面的烧杯,从而使得滤液浑浊)、液面高于滤纸边缘(会使部分液体未经过滤纸的过滤直接流下,(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)NaOH+HCl=NaCl+H2O,2Al+6HCl=2AlCl3+3H2↑
【解答】(1)“洁厕灵”的有效成分为盐酸,铁锈的主要成分是氧化铁(Fe2O3),将铁制品放入“洁厕灵”中,先是表面的铁锈的主要成分氧化铁与盐酸反应生成氯化铁与水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;当铁锈完全反应后,铁与稀盐酸发生反应,生成氯化亚铁与氢气,反应的化学方程式为:Fe+2HCl═FeCl2+H2↑.
(2)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式NaClO+2HCl═NaCl+Cl2↑+X,反应前钠、氯、氧、氢原子个数分别为1、3、1、2,反应后的生成物中钠、氯、氧、氢原子个数分别为1、3、0、0,根据反应前后原子种类、数目不变,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O.
(3)铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)“洁厕灵”中含有稀盐酸,能和氢氧化钠反应生成氯化钠和水,能和铝反应生成氯化铝和氢气,反应的化学方程式为:NaOH+HCl=NaCl+H2O,2Al+6HCl=2AlCl3+3H2↑.
16、(1)H+;
(2)④;
(3)A2+B2=2BA
【解答】(1)酸的共性是因为酸会在溶液中都电离出相同的阳离子氢离子.碱的共性是因为碱会在溶液中都电离出相同的阴离子氢氧根离子.酸与碱发生中和反应会生成水,是因为氢离子与氢氧根离子结合会成为水;
(2)由图示信息可知氧氧单键相连才具有杀菌消毒剂,所以第④各物质中含有这一键.
(1)物质A的分子由两个相同的A原子构成,物质A为单质,其化学式可表示为A2;物质B的分子也是由两个相同的B原子所构成,物质B为单质,其化学式可表示为B2;生成的两个分子构成相同,是同一种物质的两个分子,生成物的分子是由一个A原子和一个B原子构
实验步骤
实验现象
实验结论
①取少量样品于试管中,加入足量的CaCl2溶液
②过滤,向滤液中滴加几滴 硫酸铜溶液
有白色沉淀生成
有蓝色沉淀生成
样品中确实含有氢氧化钠
除尽溶液中的碳酸钠.
【解答】(1)氢氧化钠的俗名是火碱、烧碱、苛性钠;氢氧化钠与硫酸反应的反应物是氢氧化钠和硫酸,生成物是硫酸钠和水,用观察法配平,所以方程式是:2NaOH+H2SO4=Na2SO4+2H2O;2-1-c-n-j-y
(2)由于氢氧化钠易吸收空气中水而潮解,易与二氧化碳反应生成碳酸钠和水而变质;反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O;
(3)因为碳酸钠显碱性,也能使无色的酚酞试液变红色,故无色酚酞试液变红,不能证明有氢氧化钠的存在;
因为溶液中有碳酸钠,所以应首先除去碳酸钠,故可加入足量的CaCl2溶液,氯化钙与碳酸钠反应从而除去了碳酸钠,然后把沉淀过滤去,向滤液中滴加几滴硫酸铜溶液,生成了蓝色沉淀,故能证明有氢氧化钠存在;
小玉加入足量的CaCl2溶液的实验目的是除尽溶液中的碳酸钠.
一、选择题
1、下列是人体中几种体液的正常pH,碱性最强的是( )
A.血浆(7.35~7.45)?? B.胰液(7.5~8.0)
C.胃液(0.9~1.5) D.唾液(6.6~7.1)
2、科学家研究发现,人体大脑皮层体液最理想的pH介于7.35~7.45之间.人体大脑皮层体液的酸碱度( )
A.偏酸性?? B.偏碱性?? C.呈中性?? D.难以判断
3、以下生产、生活中的做法不符合环保理念的是( )
A.开发使用新能源
B.工业用水重复使用
C.秸秆回收利用,不露天焚烧
D.电脑、电视长期处于待机状态
4、下列做法或说法中不正确的是( )
A.用熟石灰降低土壤碱性,改良土壤结构
B.用煮沸或蒸馏的方法能降低水的硬度
C.将煤球制成“蜂窝煤”是为了增大与空气的接触面积,使其燃烧更充分
D.使用可降解塑料代替传统塑料,有利于减轻“白色污染”
5、类推是学习中常用的思维方法,现有以下类推结果,其中错误的是( )
①碱的水溶液通常呈碱性,所以碱性溶液一定是碱的溶液
②氧化物都含有氧元素,所以含氧元素的化合物不一定是氧化物
③酸碱发生中和反应生成盐和水,所以生成水的反应一定是中和反应
④燃烧一般都伴随发光、发热现象,所以有发光、发热现象的变化就是燃烧
⑤单质是由同种元素组成的,则由同种元素组成的纯净物一定是单质.
A.①②③④ B.①②③④⑤?? C.②③④⑤ D.①③④
6、分析推理是化学学习中常用的思维方法.下列分析推理正确的是( )
A.酸和碱发生中和反应生成盐和水;生成盐和水的反应都是中和反应
B.酸雨的pH小于7,所以pH小于7的雨水一定是酸雨
C.碱溶液能使无色酚酞试液变红,所以能使无色酚酞试液变红的溶液一定是碱溶液
D.水和双氧水组成相同但化学性质不同,是由于它们的分子构成不同
7、下列实验现象描述正确的是( )
A.熟石灰中加入一定量的水:白色固体变成白色浆液,放出大量的热
B.加热通入足量二氧化碳后的石蕊溶液:溶液由紫色变为红色
C.硫在空气中燃烧:发出蓝紫色火焰,产生有刺激性气味的气体,放热
D.铁钉放在硫酸铜溶液中:银白色固体表面有紫红色固体析出,溶液由蓝色变为浅绿色
二、填空题
8、将生锈的铁钉投入到过量的稀盐酸中,刚开始观察到的现象是 ,其反应的化学方程式是 ;过一段时间后,又可以观察到的现象是 ,铁钉发生反应的化学方程式是 .【来源:21cnj*y.co*m】
9、小华家有一张铁床,因长期受潮已锈迹斑斑.他从上面取一枚生锈的铁螺丝放入一定量的稀硫酸中,观察到铁锈(主要成分是Fe2O3)逐渐消失,此反应的化学方程式是 .小华同学结合学过的化学知识,提出了一些防止铁床进一步锈蚀的建议,请写出一条小华同学的合理建议 .【出处:21教育名师】
10、结合NaOH、Ca(OH)2,的相关知识,回答下列问题.
(1)可用来改良酸性土壤的固体是 ;
(2)从微观角度看,它们的溶液具有相似化学性质的原因是 ;
(3)区分两种溶液可选用的试剂是 .
11、为了探究氢氧化钙的化学性质,同学们进行了以下实验:
A.向氢氧化钙溶液中通入二氧化碳;
B.向氢氧化钙溶液中滴加2滴酚酞溶液后,振荡,再加入过量的稀盐酸;
C.向氢氧化钙溶液中加入一定量的碳酸钠溶液,振荡.
(1)实验B的目的是 ;
(2)实验C中发生反应的化学方程式为 ;
(3)将上述3个实验后的废液倒入同一个洁净的烧杯里,静止后发现烧杯底部有白色沉淀,上层清液呈无色,则上层清液中一定含有的溶质包括酚酞和 .
三、实验探究题
12、初中化学教材中的一些实验如图,请你回答下列问题:
(1)甲中玻璃棒不断搅拌的目的是 .
(2)乙中锥形瓶内产生的主要现象是 ,反应后天平 (填“会”或“不会”)平衡.2·1·c·n·j·y
(3)丙中除了能得出可燃物燃烧的条件外,还可以比较出白磷、红磷化学性质上的不同点是 .【版权所有:21教育】
(4)丁中得到的滤液仍然浑浊,原因是 (答一点即可).
【中考大练兵】
13、下列变化中,只有加入酸才能一步实现的是( )
A.Zn→ZnSO4??? B.CaCO3→CO2???
C.Ba(NO3)2→BaSO4 D.CuO→CuCl2
14、下列说法正确的是( )
A.在钢铁表面镀铬能防止钢铁生锈
B.浓盐酸露置于空气中质量会增大
C.棉纤维在空气燃烧时产生烧焦羽毛的气味
D.二氧化碳是造成酸雨的主要物质
15、“洁厕灵”的有效成分为盐酸,可以清除污垢,除去异味;而“管道疏通剂”的主要成分是氢氧化钠和铝粉,可使堵塞的管道畅通无阻.21世纪教育网版权所有
(1)“洁厕灵”能轻松除去铁制品表面的铁锈,但不能长时间浸泡,用化学方程式表示原因 、 .21教育网
(2)“漂白精”的有效成分为次氯酸钠(NaClO),可以快速漂除衣物污渍,若与“洁厕灵”混用,易产生一种有毒气体,反应的化学方程式为:NaClO+2HCl═NaCl+Cl2↑+X,则X的化学式为 .www.21-cn-jy.com
(3)管道疏通剂疏通管道的原理是:铝与氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为 .21*cnjy*com
(4)管道疏通剂不能与“洁厕灵”混合使用,用化学方程式表示原因 .
16、化学是在分子、原子层面上认识和创造物质的一门科学.请用化学观点讨论下面的问题:(第(1)问用化学用语表示)
(1)酸溶液具有相似的化学性质,是因为不同的酸溶液中都含有相同的 .
(2)过氧化氢是一种常用的杀菌消毒剂,其原因是过氧化氢分子中含有一种叫做“过氧基”(下列物质①中虚线框标出的部分)的结构.据此推测下列②﹣④的物质中,可用作杀菌消毒剂的是 (填序号).
①? ②H﹣O﹣H?? ③O=C=O ④
(3)若分别用○和●代表两种不同元素的原子.这两种元素分别组成的单质在点燃条件下发生反应,反应前后的微观模拟图如下图所示,若用A代表○、B代表●,请用A、B表示该反应的化学方程式: .
17、如图所示是Ca(OH)2的部分性质实验,回答有关问题.
(1)A中的实验现象是 ;
(2)C中发生反应的化学方程式为 ;
(3)将这三个实验后的所有物质倒入同一洁净的烧杯中,静置,观察到上层溶液为无色,底部有白色沉淀.取少量上层溶液与足量稀盐酸混合,无明显现象.综合分析可知:上层溶液中一定含有的溶质是酚酞和 ,可能含有的溶质是 .
18、氢氧化钠是一种重要的化工原料,广泛地应用于肥皂、石油、造纸、纺织、等行业.
(1)氢氧化钠的俗名是 (只写一种).氢氧化钠与硫酸反应的化学方程式为 .
(2)氢氧化钠固体曝露在空气中时容易吸收水分而潮解,还易与空气中的 发生 反应而变质,其反应的化学方程式为 .
(3)实验室有一瓶久置的固体,标签上写着“氢氧化钠”.为了检验里面是否还存在NaOH,小帆、小玉同学分别取少量该固体样品进行以下实验:
小帆同学做了如下实验:
实验步骤
实验现象
实验结论
取少量样品于试管中,加蒸馏水溶解得无色溶液,滴入2滴无色酚酞试液
无色酚酞试液变红
样品中含有氢氧化钠
小玉认为小帆的实验方案不严密,不能证实无色溶液中一定含有氢氧化钠,理由是:
小玉设计了另一个实验:请你完成表格里所缺内容.
实验步骤
实验现象
实验结论
①取少量样品于试管中,加入足量的CaCl2溶液
②过滤,向滤液中滴加几滴
有白色沉淀生成
样品中确实含有氢氧化钠
小玉加入足量的CaCl2溶液的实验目的是 .
参考答案及解析
1、B
【解答】A、血浆的pH为7.35~7.45,大于7,显碱性.
B、胰液的pH为7.5~8.0,大于7,显碱性.
5、D
【解答】①碱性溶液不一定是碱溶液.例如,碳酸钠的水溶液显碱性,它是盐.
②氧化物是含有两种元素且其中一种是氧元素的化合物,含有氧元素的化合物不一定是两种元素,例如碳酸中含有氧元素,但它不是氧化物.21·cn·jy·com
③生成盐和水的反应不一定是中和反应.例如,石灰水和二氧化碳反应生成碳酸钙(盐)和水,但不是中和反应;【来源:21·世纪·教育·网】
④有发光、放热现象的变化不一定是燃烧,例如电灯通电时发光、放热,但是不属于燃烧.
⑤单质是由一种元素组成的纯净物,单质一定由同种元素组成.但由同种元素组成的物质不一定是单质.例如,氧气和臭氧组成的物质,是由氧元素组成的物质,属于混合物,不属于单质.所以上述说法正确.21·世纪*教育网
所以类推结果错误的为①③④.
6、D
【解答】A、中和反应生成盐和水,但生成盐和水的反应不一定是中和反应,如CO2+2NaOH═Na2CO3+H2O,故选项推理错误.www-2-1-cnjy-com
B、酸雨的pH小于7,所以pH小于7的雨水不一定是酸雨,正常雨水的pH也小于7,故选项推理错误.
C、碱溶液能使无色酚酞试液变红,但能使无色酚酞试液变红的溶液不一定是碱溶液,也可能是碳酸钠等盐溶液,故选项说法错误.21cnjy.com
D、水和双氧水组成相同但化学性质不同,是因为它们的分子构成不同,不同种的分子化学性质不同,故选项推理正确.21*cnjy*com
7、D
【解答】A、生石灰与水反应生成氢氧化钙,生石灰中加入一定量的水,白色固体变成白色浆液,该反应放出大量的热,不是熟石灰,故选项说法错误.21教育名师原创作品
B、加热通入足量二氧化碳后的石蕊溶液,碳酸不稳定,加热后分解生成水和二氧化碳,溶液由红色变为紫色,故选项说法错误.
C、硫在空气中燃烧,产生淡蓝色火焰,产生有刺激性气味的气体,放热,故选项说法错误.
D、铁钉与硫酸铜溶液反应生成硫酸亚铁溶液和铜,银白色固体表面有红色物质析出,溶液由蓝色变为浅绿色,故选项说法正确.
(3)二氧化碳与氢氧化钙混合产生白色沉淀,与氢氧化钠溶液混合不反应,可以鉴别,区分两种溶液可选用的试剂是二氧化碳.
11、(1)证明氢氧化钙能与盐酸反应;
(2)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(3)氯化钠
【解答】(1)向氢氧化钙溶液中滴加2滴酚酞溶液后,振荡,溶液呈红色,再加入过量的稀盐酸,红色逐渐变为无色,说明氢氧化钙能与盐酸反应,因此实验B的目的是证明氢氧化钙能与盐酸反应,故填:证明氢氧化钙能与盐酸反应;
(2)氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(3)将上述3个实验后的废液倒入同一个洁净的烧杯里,静止后发现烧杯底部有白色沉淀,说明盐酸全部反应,上层清液呈无色,说明没有显碱性的氢氧化钙、碳酸钠和氢氧化钠,则上层清液中一定含有的溶质包括酚酞和生成的氯化钠,故填:氯化钠.
12、(1)使热量及时地扩散;
(2)产生大量的白烟,放出大量的热;会;
(3)红磷的着火点比白磷的高;
(4)滤纸破损(或滤液高于滤纸边缘或盛接滤液的烧杯不干净等).
【解答】(1)稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散.
(2)红磷在空气中燃烧,产生大量的白烟,放出大量的热;由于实验是在密闭装置内进行,反应后天平会平衡.
(3)铜片上的白磷、红磷均为可燃物,均能与氧气接触,白磷燃烧、红磷不燃烧,说明了红磷的着火点比白磷的高.
(4)过滤后发现滤液仍然浑浊,可能原因是滤纸破损(会使得液体中的不溶物进入下面的烧杯,从而使得滤液浑浊)、液面高于滤纸边缘(会使部分液体未经过滤纸的过滤直接流下,(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)NaOH+HCl=NaCl+H2O,2Al+6HCl=2AlCl3+3H2↑
【解答】(1)“洁厕灵”的有效成分为盐酸,铁锈的主要成分是氧化铁(Fe2O3),将铁制品放入“洁厕灵”中,先是表面的铁锈的主要成分氧化铁与盐酸反应生成氯化铁与水,反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;当铁锈完全反应后,铁与稀盐酸发生反应,生成氯化亚铁与氢气,反应的化学方程式为:Fe+2HCl═FeCl2+H2↑.
(2)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式NaClO+2HCl═NaCl+Cl2↑+X,反应前钠、氯、氧、氢原子个数分别为1、3、1、2,反应后的生成物中钠、氯、氧、氢原子个数分别为1、3、0、0,根据反应前后原子种类、数目不变,则每个X分子由2个氢原子和1个氧原子构成,则物质X的化学式为H2O.
(3)铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)“洁厕灵”中含有稀盐酸,能和氢氧化钠反应生成氯化钠和水,能和铝反应生成氯化铝和氢气,反应的化学方程式为:NaOH+HCl=NaCl+H2O,2Al+6HCl=2AlCl3+3H2↑.
16、(1)H+;
(2)④;
(3)A2+B2=2BA
【解答】(1)酸的共性是因为酸会在溶液中都电离出相同的阳离子氢离子.碱的共性是因为碱会在溶液中都电离出相同的阴离子氢氧根离子.酸与碱发生中和反应会生成水,是因为氢离子与氢氧根离子结合会成为水;
(2)由图示信息可知氧氧单键相连才具有杀菌消毒剂,所以第④各物质中含有这一键.
(1)物质A的分子由两个相同的A原子构成,物质A为单质,其化学式可表示为A2;物质B的分子也是由两个相同的B原子所构成,物质B为单质,其化学式可表示为B2;生成的两个分子构成相同,是同一种物质的两个分子,生成物的分子是由一个A原子和一个B原子构
实验步骤
实验现象
实验结论
①取少量样品于试管中,加入足量的CaCl2溶液
②过滤,向滤液中滴加几滴 硫酸铜溶液
有白色沉淀生成
有蓝色沉淀生成
样品中确实含有氢氧化钠
除尽溶液中的碳酸钠.
【解答】(1)氢氧化钠的俗名是火碱、烧碱、苛性钠;氢氧化钠与硫酸反应的反应物是氢氧化钠和硫酸,生成物是硫酸钠和水,用观察法配平,所以方程式是:2NaOH+H2SO4=Na2SO4+2H2O;2-1-c-n-j-y
(2)由于氢氧化钠易吸收空气中水而潮解,易与二氧化碳反应生成碳酸钠和水而变质;反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O;
(3)因为碳酸钠显碱性,也能使无色的酚酞试液变红色,故无色酚酞试液变红,不能证明有氢氧化钠的存在;
因为溶液中有碳酸钠,所以应首先除去碳酸钠,故可加入足量的CaCl2溶液,氯化钙与碳酸钠反应从而除去了碳酸钠,然后把沉淀过滤去,向滤液中滴加几滴硫酸铜溶液,生成了蓝色沉淀,故能证明有氢氧化钠存在;
小玉加入足量的CaCl2溶液的实验目的是除尽溶液中的碳酸钠.
同课章节目录
