化学中常用的物理量——物质的量【课件】第一课时
文档属性
| 名称 | 化学中常用的物理量——物质的量【课件】第一课时 |

|
|
| 格式 | zip | ||
| 文件大小 | 134.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-02-23 11:17:40 | ||
图片预览




文档简介
课件19张PPT。第三节 化学中常用的物理量---物质的量
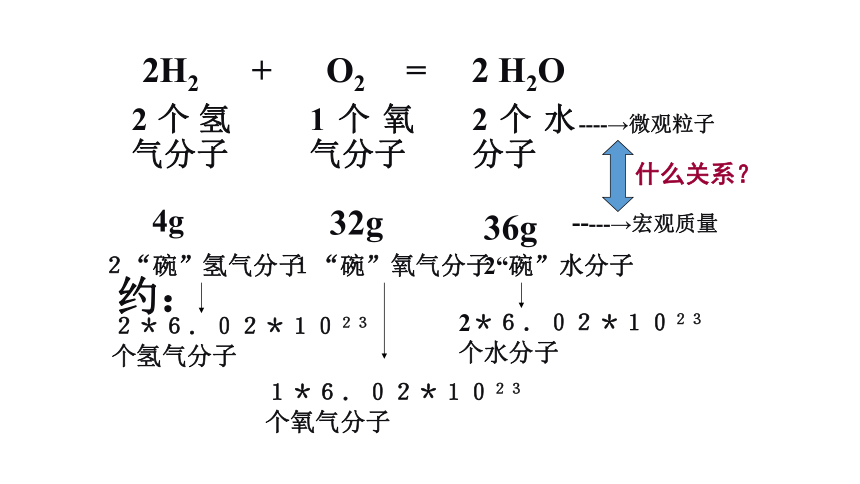
第一课时2H2 + O2 = 2 H2O 2个氢气分子 1个氧气分子 2个水分子 ----→微观粒子 4g32g36g-----→宏观质量
什么关系?2*6.02*1023
个氢气分子 1*6.02*1023
个氧气分子
2*6.02*1023
个水分子
约:2“碗”氢气分子 1“碗”氧气分子2“碗”水分子
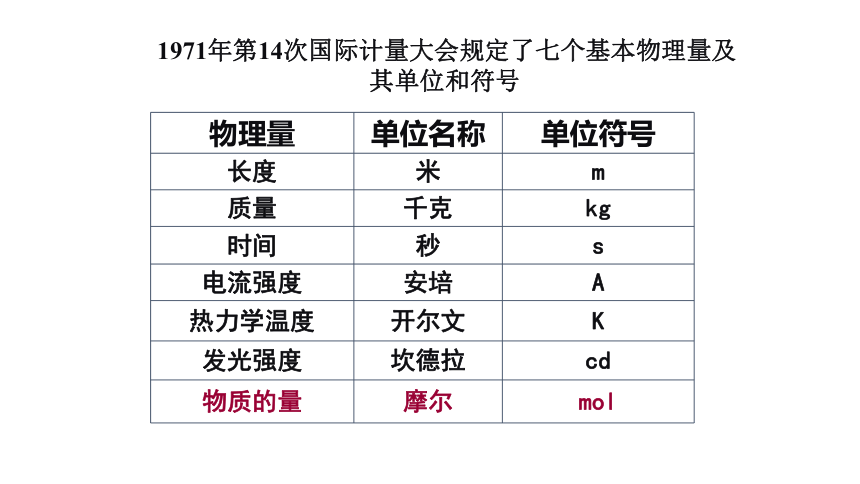
1971年第14次国际计量大会规定了七个基本物理量及其单位和符号一、物质的量(n)
1.定义:物质的量是以0.012kg12C所含的碳原子数为标准来衡量其他微粒数目多少的物理量。
符号为n3.表示含有一定数目粒子的集体
符号用n表示4.物质的量是一个物理量,专用名词,不能增减2.单位: 摩尔 (符号:mol)
练习:
判断下列说法是否正确:
A.1摩尔氧 B.1摩尔O C.2摩尔大米
D.3摩尔H2O E.0.5molNa+
思考:1mol微粒到底有多少?
国际上规定,1mol任何微粒所含微粒数与12g12C所含的碳原子数相等
二、阿伏加德罗常数(NA)1、定义:用12g12C所含的碳原子数叫
阿伏加德罗常数。用NA表示2、阿伏加德罗常数数值是:
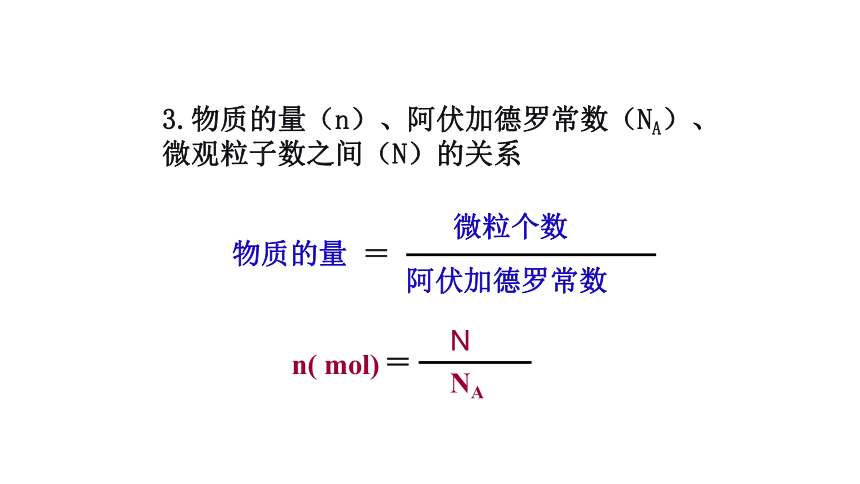
6.02×1023mol-1 3.物质的量(n)、阿伏加德罗常数(NA)、微观粒子数之间(N)的关系
物质的量 =N
注:
1.1mol粒子含有粒子数约为6.02×1023个
2.粒子──可以是分子、原子、离子,
电子、中子、质子等基本的粒子,也可
以是特定粒子的组合,但是一定要说明确。
6.02×10233 mol H2SO4 中有( )个H2SO4 ,可以电离出( )mol H+
4 mol O2含有( )mol O原子,( )mol质子
1.204×1024个 Na+中约含有( )molNa+
N个C的物质的量是( )mol
填空3NA68642N/NAO2的物质的量 阿伏加德罗常数 粒子数
1mol × 6.02×1023 mol-1 = 6.02×1023
2mol × 6.02×1023 mol-1 = 1.204×1024
n ×NA = Nn = N/NA练习:1,物质的量相同的甲烷和氨气具有不同的( )
A电子数目 B质子数目
C分子数目 D原子数目D2,相同物质的量的SO2和SO3,
所含的分子的数目比为( )
所含原子的数目比为( )
所含O的数目比为( )
1:1 3:42:3 1.00 16.00 18.00 27.01 16 18 27 观察表格
微粒 C H O H2O相对原子
(分子)质量12 1 16 181mol的质量12克1克16克18克1mol 物质的质量(g)在数值上
等于其相对原子(分子)质量结论:1mol任何粒子的质量都是以克为单位
数值上等于该物质化学式的式量三、物质的摩尔质量(M)1、定义:单位物质的量的物质的质量叫物质的摩尔质量。2、单位:g/mol或g · mol-1 , kg/mol 以 g/mol 为单位,数值上等于相对原子(分子)质量总结:物质的质量m、物质的量n、粒子数N之间的关系如下:mN(÷M)(×M)(×NA)(÷NA)n微观宏观练习:
3.01×1022个OH- 的物质的量为0.05mol,
质量为 ,
含有质子的物质的量为 ,
含有电子的物质的量为 ,
这些 OH- 与 NH3的质量相同,
这些 OH- 和 Na+含有的离子数相同。0.85g0.45mol0.5mol0.05mol1.15g
第一课时2H2 + O2 = 2 H2O 2个氢气分子 1个氧气分子 2个水分子 ----→微观粒子 4g32g36g-----→宏观质量
什么关系?2*6.02*1023
个氢气分子 1*6.02*1023
个氧气分子
2*6.02*1023
个水分子
约:2“碗”氢气分子 1“碗”氧气分子2“碗”水分子
1971年第14次国际计量大会规定了七个基本物理量及其单位和符号一、物质的量(n)
1.定义:物质的量是以0.012kg12C所含的碳原子数为标准来衡量其他微粒数目多少的物理量。
符号为n3.表示含有一定数目粒子的集体
符号用n表示4.物质的量是一个物理量,专用名词,不能增减2.单位: 摩尔 (符号:mol)
练习:
判断下列说法是否正确:
A.1摩尔氧 B.1摩尔O C.2摩尔大米
D.3摩尔H2O E.0.5molNa+
思考:1mol微粒到底有多少?
国际上规定,1mol任何微粒所含微粒数与12g12C所含的碳原子数相等
二、阿伏加德罗常数(NA)1、定义:用12g12C所含的碳原子数叫
阿伏加德罗常数。用NA表示2、阿伏加德罗常数数值是:
6.02×1023mol-1 3.物质的量(n)、阿伏加德罗常数(NA)、微观粒子数之间(N)的关系
物质的量 =N
注:
1.1mol粒子含有粒子数约为6.02×1023个
2.粒子──可以是分子、原子、离子,
电子、中子、质子等基本的粒子,也可
以是特定粒子的组合,但是一定要说明确。
6.02×10233 mol H2SO4 中有( )个H2SO4 ,可以电离出( )mol H+
4 mol O2含有( )mol O原子,( )mol质子
1.204×1024个 Na+中约含有( )molNa+
N个C的物质的量是( )mol
填空3NA68642N/NAO2的物质的量 阿伏加德罗常数 粒子数
1mol × 6.02×1023 mol-1 = 6.02×1023
2mol × 6.02×1023 mol-1 = 1.204×1024
n ×NA = Nn = N/NA练习:1,物质的量相同的甲烷和氨气具有不同的( )
A电子数目 B质子数目
C分子数目 D原子数目D2,相同物质的量的SO2和SO3,
所含的分子的数目比为( )
所含原子的数目比为( )
所含O的数目比为( )
1:1 3:42:3 1.00 16.00 18.00 27.01 16 18 27 观察表格
微粒 C H O H2O相对原子
(分子)质量12 1 16 181mol的质量12克1克16克18克1mol 物质的质量(g)在数值上
等于其相对原子(分子)质量结论:1mol任何粒子的质量都是以克为单位
数值上等于该物质化学式的式量三、物质的摩尔质量(M)1、定义:单位物质的量的物质的质量叫物质的摩尔质量。2、单位:g/mol或g · mol-1 , kg/mol 以 g/mol 为单位,数值上等于相对原子(分子)质量总结:物质的质量m、物质的量n、粒子数N之间的关系如下:mN(÷M)(×M)(×NA)(÷NA)n微观宏观练习:
3.01×1022个OH- 的物质的量为0.05mol,
质量为 ,
含有质子的物质的量为 ,
含有电子的物质的量为 ,
这些 OH- 与 NH3的质量相同,
这些 OH- 和 Na+含有的离子数相同。0.85g0.45mol0.5mol0.05mol1.15g
