物质的量浓度1
图片预览







文档简介
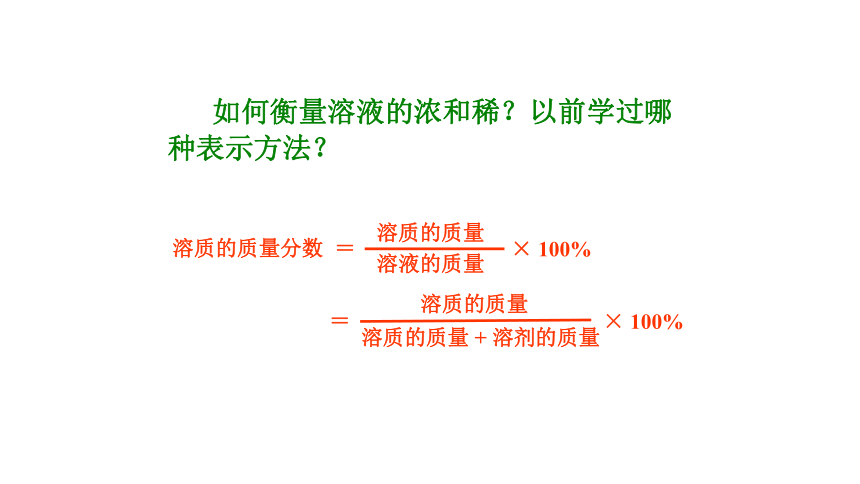
课件26张PPT。1-3-3 物质的量浓度 如何衡量溶液的浓和稀?以前学过哪种表示方法?但是,很多化学反应都在溶液中进行,对于溶液我们通常不称其质量,而是量它的体积。
【学习目标】
1、理解物质的量浓度的基本涵义。
2、初步学会配制一定物质的量浓度溶液的方法和技能。
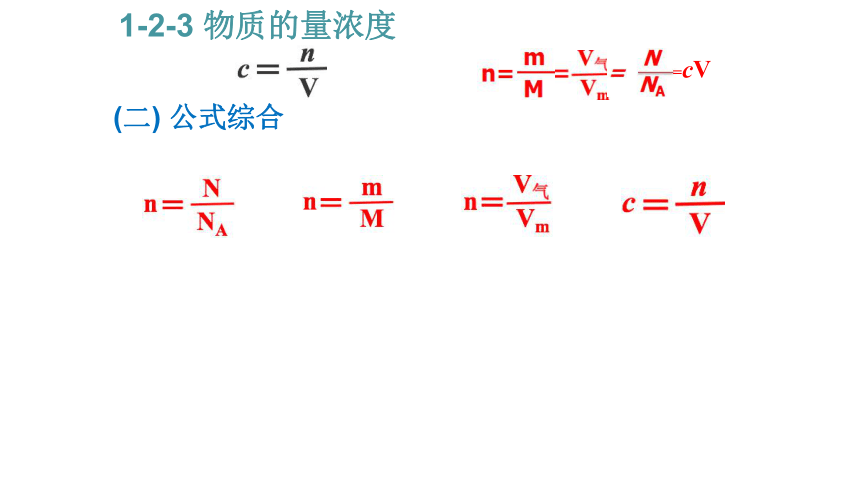
3、掌握物质的量相关公式的综合计算。 1-2-3 物质的量浓度(一) 物质的量浓度 1-2-3 物质的量浓度 定义:表示单位体积溶液里所含溶质B的________,
符号cB,单位 mol/L。
1.(1) 单位体积溶液:单位体积,通常以L做单位,
指的是______体积而非溶剂的体积。
(2)反应物与生成物的物质的量之比等于方程式中
________之比,所以物质的量浓度方便计算使用。 物质的量 溶液 化学计量数 (一) 物质的量浓度 1-2-3 物质的量浓度 定义:表示单位体积溶液里所含溶质B的________,
符号cB,单位 mol/L 或 mol-1 。
(3) 将 1mol NaOH溶解并加水至500 mL,则c(NaOH)= ?
(4) 100 mL 2 mol/L的NaCl溶液,
含有NaCl的物质的量为多少?c(NaOH)=n(NaOH)/V= 1 mol ÷ 0.5 L = 2 mol/L n(NaCl)=c(NaCl)V= 2 mol/L × 0.1 L = 0.2 mol 物质的量 (一) 物质的量浓度 1-2-3 物质的量浓度 定义:表示单位体积溶液里所含溶质B的________,
符号cB,单位 mol/L 或 mol-1 。
2.判断下列说法是否正确
(1) 4 mol·L-1 NaCl溶液含有NaCl 4 mol;
(2) 100 mL 4 mol·L-1 NaCl溶液用去90 mL,
剩余10 mL的浓度为0.4 mol·L-1。 错×,没有说明体积 错×,
浓度处处相等 物质的量 =cV(一) 物质的量浓度 1-2-3 物质的量浓度 定义:表示单位体积溶液里所含溶质B的________,
符号cB,单位 mol/L 或 mol-1 。
3、物质的量浓度中的溶质,也可以是电离后的离子:
(1) 2 mol·L-1 Na2SO4溶液中,
Na+的物质的量浓度为_________,
SO42-的物质的量浓度为________; 物质的量 4 mol·L-1 2 mol·L-1 =cV(二) 公式综合 1-2-3 物质的量浓度=cV(二) 公式综合运算 1-2-3 物质的量浓度0.1 mol 5.85 g 0.04 mol·L-1 0.01 mol 0.05 mol 2 g 0.005 mol 0.005 mol·L-1 =cV=cV(三)【活动探究】P24
配制一定物质的量浓度的溶液 1-2-3 物质的量浓度1、配0.1LNaCl溶液,其中溶质NaCl的物质的量 0.04 mol
该如何量取0.04 mol NaCl晶体?
m(NaCl) = nM = 0.04mol × 58.5 g/mol = 2.34g
再称量2.34 g NaCl晶体
2、能否直接将0.04 mol NaCl晶体溶于100 ml蒸馏水?
不能,
0.10 mol NaCl溶于100 ml水后总体积不一定为100 ml=cV容量瓶3. 使用范围:用来配制一定体积
浓度准确的溶液
(容量瓶是量器不是容器)规格:100mL、250mL、500mL、1000mL①使用前要检查是否漏水往瓶内加一定量的水,塞好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围是否有水漏出。如果不漏水,将瓶正立并将瓶塞旋转180°后塞紧,仍把瓶倒立过来,再检查是否漏水。 使用容量瓶应注意:②溶解或稀释的操作不能在容量瓶中进行④不能长期存放溶液,配制好的溶液要转移到试剂瓶中 使用容量瓶应注意:③ 不能加热,也不能直接在容量瓶中进行
化学反应
(三)【活动探究】P24 1-2-3 物质的量浓度=cV(三)【实验1-5】P16
配制一定物质的量浓度的溶液 1-2-3 物质的量浓度3、能否配制95 mL 1.00 mol/L NaCl溶液?
不能,容量瓶有特定规格,没有95 mL的容量瓶。
如果实验需要95 mL 1.00 mol/L NaCl溶液,
配制该溶液时,需要称量的NaCl的质量是多少?
可以配制100 mL NaCl溶液,再取出95 mL使用。
需要NaCl的物质的量应为n=cV= 1.00 mol/L × 0.1 L = 0.1 mol
需要称量NaCl的质量是m=nM= 0.1 mol × 58.5 g/mol = 5.85 g
=cV(三)【实验1-5】P16
配制一定物质的量浓度的溶液 1-2-3 物质的量浓度4、胶头滴管如何使用?为什么一定要用到胶头滴管?
将蒸馏水注入容量瓶至刻度线下1~2 cm,
改用胶头滴管逐滴滴加至液面与刻度线相切。
胶头滴管用于逐滴滴加试液,定容时要求非常精确,
多一滴或少一滴都不行,所以只能用胶头滴管实现
液面正好与刻度线相切的操作。
=cV1-2-3 物质的量浓度6、【思考与交流】
物质的量浓度c是否与溶质的质量分数w之间存在一定的联系呢?如果有他们符合什么关系式?
1-2-3 物质的量浓度5、【学与问】
课本16页:误差分析
=cV【学习目标】
1、理解物质的量浓度的基本涵义。
2、初步学会配制一定物质的量浓度溶液的方法和技能。
3、掌握物质的量相关公式的综合计算。 1-2-3 物质的量浓度=cV【合作运用】1-2-3 物质的量浓度1、(1分) 配制0.5 mol·L-1的NaOH溶液250 mL,
在下列仪器中:
①托盘天平 ②量筒 ③烧杯 ④玻璃棒
⑤漏斗 ⑥500 mL容量瓶 ⑦药匙
⑧250 mL容量瓶 ⑨胶头滴管 ⑩坩埚。
需要用到的仪器有
A.①③④⑥⑨⑩ B.①④⑦⑧⑨⑩
C.①②③④⑦⑧⑨ D.①②④⑤⑧⑨ C 【合作运用】1-2-3 物质的量浓度2、(1分) 实验需要2.0 mol·L-1 NaCl溶液80 mL,
下列操作方法中正确的是
A.称取9.36 g NaCl,使其溶于80 mL水中制成溶液
B.称取11.7 g NaCl,使其溶于100 mL水中,
再取出80 mL溶液
C.称取 11.7 g NaCl,溶于适量水后,转移至100 mL
容量瓶中加水稀释至刻度线,再取出80 mL溶液
D.称取11.7 g NaCl,溶于68.3 mL水中水中制成溶液 C 【合作运用】1-2-3 物质的量浓度3、(3分) 欲配制1 mol/L的NaOH溶液250 mL:
(1) 用天平称取NaOH固体_____ g。
(2) 将称好NaOH固体放入____中加____蒸馏水将其溶解,
待冷却至室温后,将溶液沿____移入 ___mL 容量瓶。
(3) 用少量蒸馏水冲洗____次,将冲洗液移入容量瓶中,
在操作中不能损失液体,否则溶液的浓度偏____。
(4) 向容量瓶内加水至离刻度线_____时,改用_______
小心加水至溶液凹液面与刻度线相切,若加水超过
刻度线,会造成溶液浓度偏___,应该__________。
(5) 最后盖好瓶盖____,将配好的溶液移入______保存。 10 烧杯 适量 玻棒 250 2~3 低 1~2cm 胶头滴管 低 重新配制 摇匀 试剂瓶 1-2-3 物质的量浓度4、用 98%硫酸(ρ=1.84 g/cm3)配制0.5 mol·L-1硫酸500 ml
(1) (1分) 选用的主要仪器有_________________________
____________________________________________ 。
(2) (1分) 请将下列各操作按正确的步骤排序:________
A.用量筒量取浓硫酸
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线
D.洗净所用仪器
E.稀释浓硫酸
F.将浓液转入容量瓶 【当堂作业】量筒、烧杯、玻璃棒、
500 mL容量瓶、胶头滴管 AEFDCB 【当堂作业】1-2-3 物质的量浓度5、用 98%硫酸(ρ=1.84 g/cm3)配0.5 mol·L-1硫酸500 ml
① 所需硫酸的物质的量为____ mol,即____ g;
所以需量取浓硫酸____ g,折算体积为____ mL;
② 应选用_____mL的量筒最好;
③ 量筒用水洗后直接量取将使浓度偏_____
④ 将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,
并不断搅拌的目的是__________________________,
若搅拌过程中有液体溅出结果会使浓度偏________。
⑤ 转入容量瓶的液体未冷却,会使浓度偏______;
⑥ 洗涤液也要转入容量瓶 ,否则会使浓度偏____。
⑦ 定容时俯视会使浓度偏____,仰视则使浓度偏____。 0.25 24.5 25 13.6 15 低 使溶液冷却及散热均匀 低 高低 高低 作业:名师学案物质的量浓度相关练习
【学习目标】
1、理解物质的量浓度的基本涵义。
2、初步学会配制一定物质的量浓度溶液的方法和技能。
3、掌握物质的量相关公式的综合计算。 1-2-3 物质的量浓度(一) 物质的量浓度 1-2-3 物质的量浓度 定义:表示单位体积溶液里所含溶质B的________,
符号cB,单位 mol/L。
1.(1) 单位体积溶液:单位体积,通常以L做单位,
指的是______体积而非溶剂的体积。
(2)反应物与生成物的物质的量之比等于方程式中
________之比,所以物质的量浓度方便计算使用。 物质的量 溶液 化学计量数 (一) 物质的量浓度 1-2-3 物质的量浓度 定义:表示单位体积溶液里所含溶质B的________,
符号cB,单位 mol/L 或 mol-1 。
(3) 将 1mol NaOH溶解并加水至500 mL,则c(NaOH)= ?
(4) 100 mL 2 mol/L的NaCl溶液,
含有NaCl的物质的量为多少?c(NaOH)=n(NaOH)/V= 1 mol ÷ 0.5 L = 2 mol/L n(NaCl)=c(NaCl)V= 2 mol/L × 0.1 L = 0.2 mol 物质的量 (一) 物质的量浓度 1-2-3 物质的量浓度 定义:表示单位体积溶液里所含溶质B的________,
符号cB,单位 mol/L 或 mol-1 。
2.判断下列说法是否正确
(1) 4 mol·L-1 NaCl溶液含有NaCl 4 mol;
(2) 100 mL 4 mol·L-1 NaCl溶液用去90 mL,
剩余10 mL的浓度为0.4 mol·L-1。 错×,没有说明体积 错×,
浓度处处相等 物质的量 =cV(一) 物质的量浓度 1-2-3 物质的量浓度 定义:表示单位体积溶液里所含溶质B的________,
符号cB,单位 mol/L 或 mol-1 。
3、物质的量浓度中的溶质,也可以是电离后的离子:
(1) 2 mol·L-1 Na2SO4溶液中,
Na+的物质的量浓度为_________,
SO42-的物质的量浓度为________; 物质的量 4 mol·L-1 2 mol·L-1 =cV(二) 公式综合 1-2-3 物质的量浓度=cV(二) 公式综合运算 1-2-3 物质的量浓度0.1 mol 5.85 g 0.04 mol·L-1 0.01 mol 0.05 mol 2 g 0.005 mol 0.005 mol·L-1 =cV=cV(三)【活动探究】P24
配制一定物质的量浓度的溶液 1-2-3 物质的量浓度1、配0.1LNaCl溶液,其中溶质NaCl的物质的量 0.04 mol
该如何量取0.04 mol NaCl晶体?
m(NaCl) = nM = 0.04mol × 58.5 g/mol = 2.34g
再称量2.34 g NaCl晶体
2、能否直接将0.04 mol NaCl晶体溶于100 ml蒸馏水?
不能,
0.10 mol NaCl溶于100 ml水后总体积不一定为100 ml=cV容量瓶3. 使用范围:用来配制一定体积
浓度准确的溶液
(容量瓶是量器不是容器)规格:100mL、250mL、500mL、1000mL①使用前要检查是否漏水往瓶内加一定量的水,塞好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立过来,观察瓶塞周围是否有水漏出。如果不漏水,将瓶正立并将瓶塞旋转180°后塞紧,仍把瓶倒立过来,再检查是否漏水。 使用容量瓶应注意:②溶解或稀释的操作不能在容量瓶中进行④不能长期存放溶液,配制好的溶液要转移到试剂瓶中 使用容量瓶应注意:③ 不能加热,也不能直接在容量瓶中进行
化学反应
(三)【活动探究】P24 1-2-3 物质的量浓度=cV(三)【实验1-5】P16
配制一定物质的量浓度的溶液 1-2-3 物质的量浓度3、能否配制95 mL 1.00 mol/L NaCl溶液?
不能,容量瓶有特定规格,没有95 mL的容量瓶。
如果实验需要95 mL 1.00 mol/L NaCl溶液,
配制该溶液时,需要称量的NaCl的质量是多少?
可以配制100 mL NaCl溶液,再取出95 mL使用。
需要NaCl的物质的量应为n=cV= 1.00 mol/L × 0.1 L = 0.1 mol
需要称量NaCl的质量是m=nM= 0.1 mol × 58.5 g/mol = 5.85 g
=cV(三)【实验1-5】P16
配制一定物质的量浓度的溶液 1-2-3 物质的量浓度4、胶头滴管如何使用?为什么一定要用到胶头滴管?
将蒸馏水注入容量瓶至刻度线下1~2 cm,
改用胶头滴管逐滴滴加至液面与刻度线相切。
胶头滴管用于逐滴滴加试液,定容时要求非常精确,
多一滴或少一滴都不行,所以只能用胶头滴管实现
液面正好与刻度线相切的操作。
=cV1-2-3 物质的量浓度6、【思考与交流】
物质的量浓度c是否与溶质的质量分数w之间存在一定的联系呢?如果有他们符合什么关系式?
1-2-3 物质的量浓度5、【学与问】
课本16页:误差分析
=cV【学习目标】
1、理解物质的量浓度的基本涵义。
2、初步学会配制一定物质的量浓度溶液的方法和技能。
3、掌握物质的量相关公式的综合计算。 1-2-3 物质的量浓度=cV【合作运用】1-2-3 物质的量浓度1、(1分) 配制0.5 mol·L-1的NaOH溶液250 mL,
在下列仪器中:
①托盘天平 ②量筒 ③烧杯 ④玻璃棒
⑤漏斗 ⑥500 mL容量瓶 ⑦药匙
⑧250 mL容量瓶 ⑨胶头滴管 ⑩坩埚。
需要用到的仪器有
A.①③④⑥⑨⑩ B.①④⑦⑧⑨⑩
C.①②③④⑦⑧⑨ D.①②④⑤⑧⑨ C 【合作运用】1-2-3 物质的量浓度2、(1分) 实验需要2.0 mol·L-1 NaCl溶液80 mL,
下列操作方法中正确的是
A.称取9.36 g NaCl,使其溶于80 mL水中制成溶液
B.称取11.7 g NaCl,使其溶于100 mL水中,
再取出80 mL溶液
C.称取 11.7 g NaCl,溶于适量水后,转移至100 mL
容量瓶中加水稀释至刻度线,再取出80 mL溶液
D.称取11.7 g NaCl,溶于68.3 mL水中水中制成溶液 C 【合作运用】1-2-3 物质的量浓度3、(3分) 欲配制1 mol/L的NaOH溶液250 mL:
(1) 用天平称取NaOH固体_____ g。
(2) 将称好NaOH固体放入____中加____蒸馏水将其溶解,
待冷却至室温后,将溶液沿____移入 ___mL 容量瓶。
(3) 用少量蒸馏水冲洗____次,将冲洗液移入容量瓶中,
在操作中不能损失液体,否则溶液的浓度偏____。
(4) 向容量瓶内加水至离刻度线_____时,改用_______
小心加水至溶液凹液面与刻度线相切,若加水超过
刻度线,会造成溶液浓度偏___,应该__________。
(5) 最后盖好瓶盖____,将配好的溶液移入______保存。 10 烧杯 适量 玻棒 250 2~3 低 1~2cm 胶头滴管 低 重新配制 摇匀 试剂瓶 1-2-3 物质的量浓度4、用 98%硫酸(ρ=1.84 g/cm3)配制0.5 mol·L-1硫酸500 ml
(1) (1分) 选用的主要仪器有_________________________
____________________________________________ 。
(2) (1分) 请将下列各操作按正确的步骤排序:________
A.用量筒量取浓硫酸
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线
D.洗净所用仪器
E.稀释浓硫酸
F.将浓液转入容量瓶 【当堂作业】量筒、烧杯、玻璃棒、
500 mL容量瓶、胶头滴管 AEFDCB 【当堂作业】1-2-3 物质的量浓度5、用 98%硫酸(ρ=1.84 g/cm3)配0.5 mol·L-1硫酸500 ml
① 所需硫酸的物质的量为____ mol,即____ g;
所以需量取浓硫酸____ g,折算体积为____ mL;
② 应选用_____mL的量筒最好;
③ 量筒用水洗后直接量取将使浓度偏_____
④ 将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,
并不断搅拌的目的是__________________________,
若搅拌过程中有液体溅出结果会使浓度偏________。
⑤ 转入容量瓶的液体未冷却,会使浓度偏______;
⑥ 洗涤液也要转入容量瓶 ,否则会使浓度偏____。
⑦ 定容时俯视会使浓度偏____,仰视则使浓度偏____。 0.25 24.5 25 13.6 15 低 使溶液冷却及散热均匀 低 高低 高低 作业:名师学案物质的量浓度相关练习
