《第2章 阶段复习课》课件
图片预览





文档简介
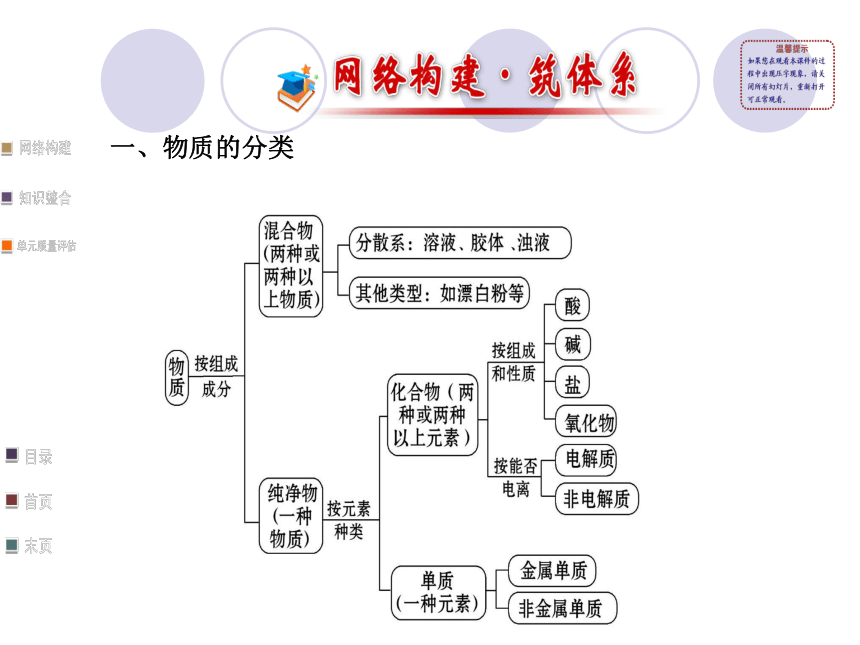
课件39张PPT。第2章 阶段复习课一、物质的分类二、分散系、胶体
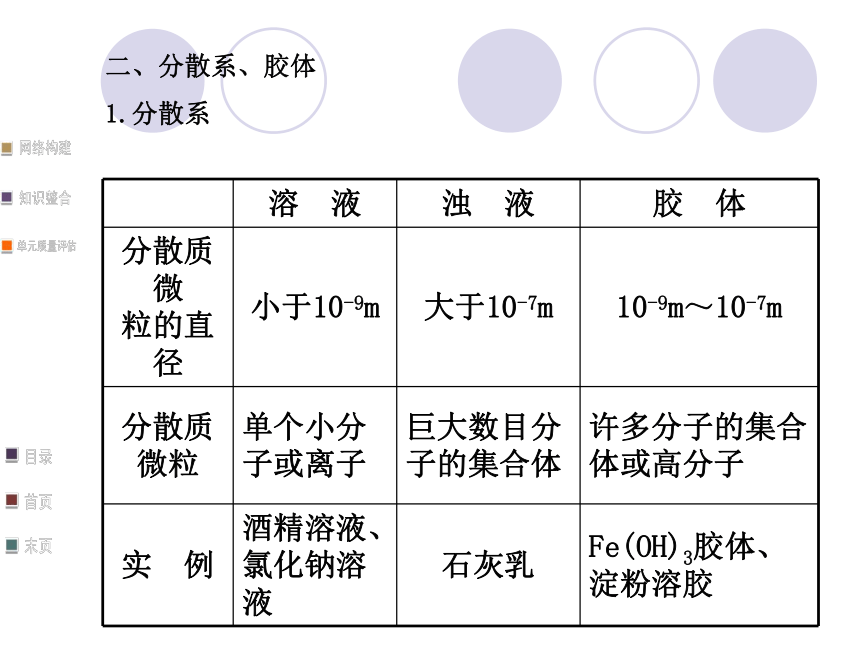
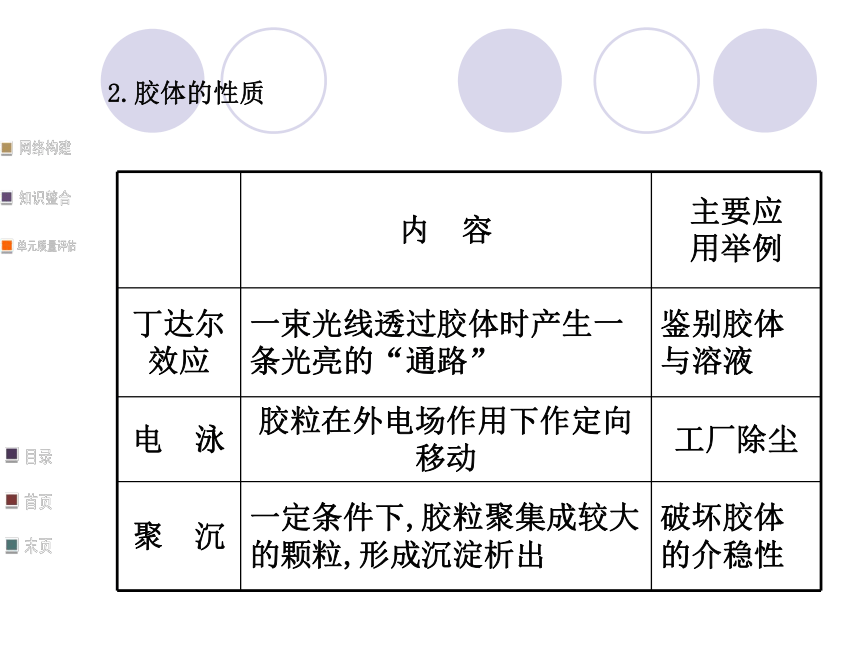
1.分散系2.胶体的性质三、电解质和非电解质说明:(1)单质、混合物既不是电解质,也不是非电解质。
(2)CO2、SO2、NH3等化合物溶于水能导电,但不是本身电离所致,属于非电解质。四、离子反应、离子方程式
1.离子反应发生的条件
(1)生成难溶物;
(2)生成难电离的物质;
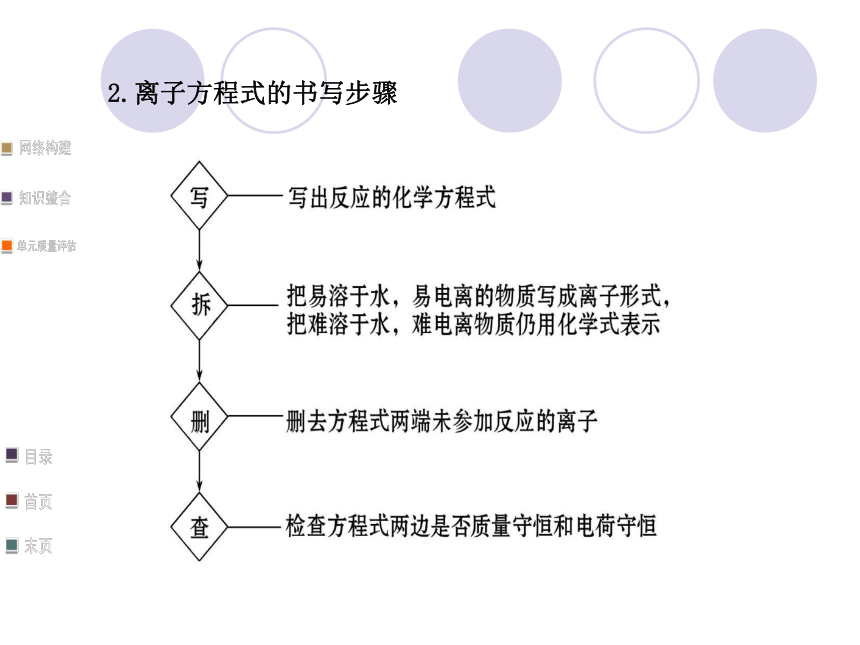
(3)生成易挥发的物质。2.离子方程式的书写步骤3.离子方程式的意义
离子方程式不仅可以表示一个化学反应,还可以表示一类化学反应,并可以揭示这一类反应的反应实质。五、氧化还原反应
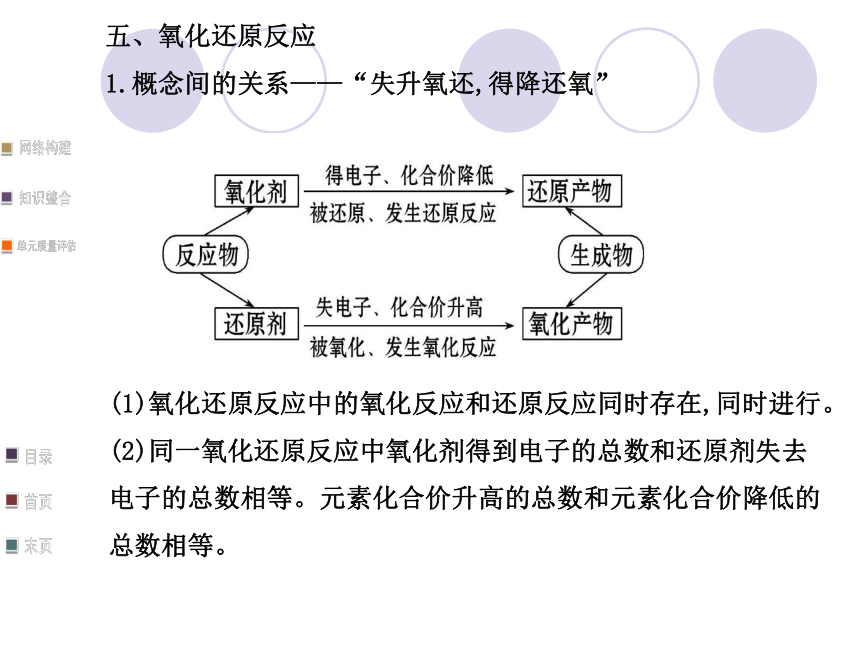
1.概念间的关系——“失升氧还,得降还氧”(1)氧化还原反应中的氧化反应和还原反应同时存在,同时进行。
(2)同一氧化还原反应中氧化剂得到电子的总数和还原剂失去
电子的总数相等。元素化合价升高的总数和元素化合价降低的
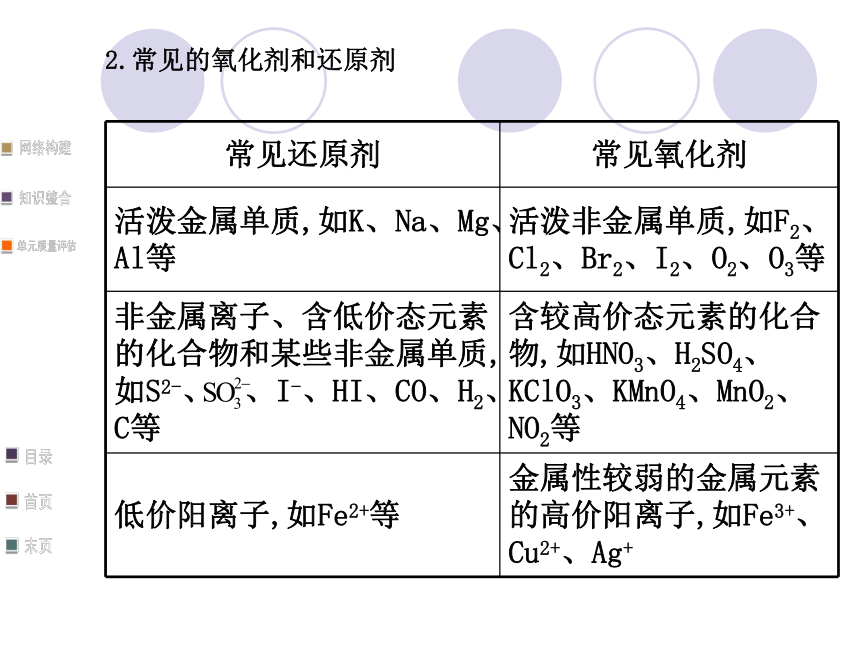
总数相等。2.常见的氧化剂和还原剂六、铁
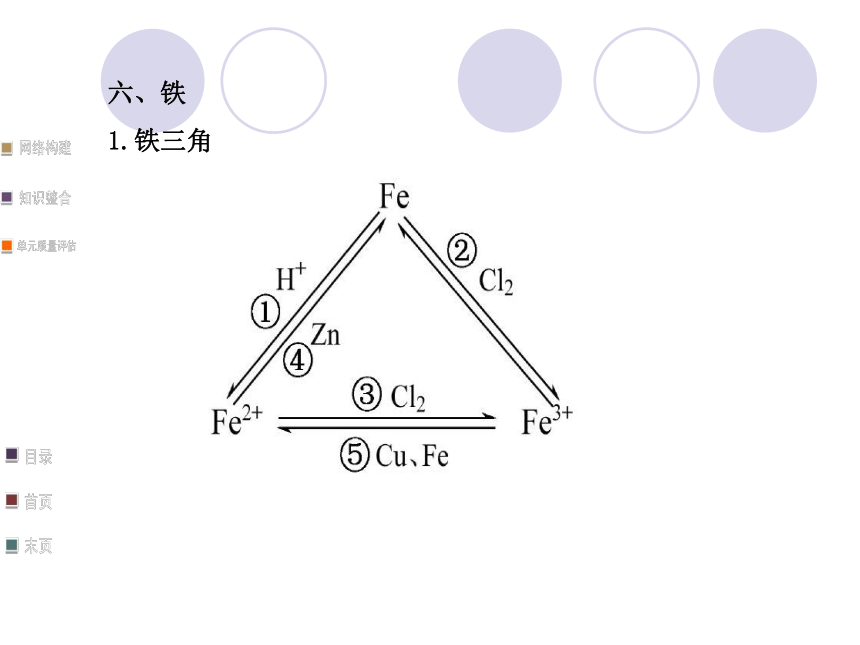
1.铁三角上述序号对应的离子(或化学)方程式为:
①离子方程式:Fe+2H+====Fe2++H2↑
②化学方程式:2Fe+3Cl2 2FeCl3
③离子方程式:2Fe2++Cl2====2Fe3++2Cl-
④离子方程式:Fe2++Zn====Zn2++Fe
⑤离子方程式:2Fe3++Fe====3Fe2+、
2Fe3++Cu====2Fe2++Cu2+2.Fe2+、Fe3+的检验及鉴别方法考点一 分类方法及其在化学学习中的应用
【例题】某化学兴趣小组欲研究H2SO4、BaCl2、Na2CO3、NaCl、NaOH的性质,对于如何研究,他们设计了两种研究方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案Ⅱ:将它们按照钠盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。(1)根据方案Ⅰ进行分类时,某同学发现Na2CO3溶液也显碱性,于是将Na2CO3与NaOH都划分为碱类,是否合理? _______。
(2)请写出方案Ⅱ两组物质间任一反应的离子方程式:_____。
(3)该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述五种物质分为Na2CO3、NaCl、NaOH和H2SO4、BaCl2两类。在用H2SO4鉴别三种含钠元素的物质时,Na2CO3很容易得到了区分,但鉴别NaCl和NaOH时却陷入了困境,你能帮忙解决这一难题吗?【解析】(1)碱在水溶液中电离出的阴离子全部是OH-,显然
Na2CO3不是碱,它是由金属离子和酸根离子组成的化合物,属于
盐。
(2)方案Ⅱ的两组物质分别为H2SO4、BaCl2、NaOH和Na2CO3、
NaCl,两组物质间能够发生两个反应。
①H2SO4和Na2CO3反应的离子方程式为
+2H+====CO2↑+H2O。
②BaCl2和Na2CO3反应的离子方程式为
+Ba2+====BaCO3↓。(3)可在两支试管中分别加入等量的H2SO4溶液,再分别加入稍过量的两种未知物质的溶液,由于加NaCl溶液的试管中硫酸不参与反应,再加Na2CO3溶液会产生CO2气体;而加NaOH溶液的试管中的H2SO4已经被完全反应,再加Na2CO3溶液不会产生CO2气体。答案:(1)不合理。虽然Na2CO3溶液呈碱性,但它在水溶液中不
能电离出OH-,不符合碱的定义
(2) +2H+====CO2↑+H2O(或 +Ba2+====BaCO3↓)
(3)在两支试管中分别加入少许H2SO4溶液,分别加入稍过量的
两种未知物质的溶液,充分混合后,再向混合溶液中分别滴加
Na2CO3溶液,若有气泡生成,则加入的未知物质的溶液为NaCl溶
液;若无气泡生成,则加入的未知物质的溶液为NaOH溶液。【知识扫描】分类方法的应用
(1)用分类法判断或预测物质的性质:
例如锌和铁都是金属单质,已知它们均能跟某些非金属单质反应、跟某些酸反应、跟某些盐反应等。又知铝也是金属单质,则铝也应具有锌、铁等金属单质的一般性质。
(2)用分类法寻找具有相同或相似性质的物质:
例如盐酸(HCl)、硫酸(H2SO4)都是酸,具有酸的通性。(3)应用分类法对物质进行鉴别:
例如选择化学试剂鉴别稀硫酸、稀盐酸、NaOH、BaCl2、KNO3、Ca(OH)2等六种溶液时,可先按酸、碱性的差异利用石蕊试液将它们分为三类,然后再分组鉴别。
①能使石蕊试液变红(显酸性)的是稀硫酸、稀盐酸。
②能使石蕊试液变蓝(显碱性)的是NaOH溶液、Ca(OH)2溶液。
③遇石蕊试液无明显现象(显中性)的是BaCl2溶液、KNO3溶液。考点二 电解质与非电解质的判断
【例题】下列物质中
①CO2 ②HNO3 ③KOH ④石墨 ⑤Fe
⑥葡萄糖 ⑦Na2CO3 ⑧酒精 ⑨食盐水
(1)属于电解质的是______________________
(2)属于非电解质的是_____________________【解析】电解质是指溶于水或熔融状态下,自身能电离成离子的化合物。非电解质是指在上述两种情况下都不能电离的化合物。单质和混合物既不是电解质,也不是非电解质,属于电解质的是②③⑦;属于非电解质的是①⑥⑧。
答案:(1)②③⑦ (2)①⑥⑧【知识扫描】电解质和非电解质的判断方法——“三看”
1.一看物质类别
先将所给物质按照单质、混合物、化合物的类别进行分类。
2.二看化合物的类别
将化合物分成酸、碱、盐、氧化物以及其他类别。
3.三看特殊物质
在进行分类之前先明确酸、碱、盐是电解质,然后对于剩余的物质看一下有没有金属氧化物,大部分金属氧化物都是电解质,最后剩下的化合物一般是非电解质。考点三 离子方程式正误的判断
【例1】下列反应的离子方程式书写正确的是( )
A.钠与水反应:Na+2H2O====Na++2OH-+H2↑
B.FeCl3溶液与Fe反应:Fe+Fe3+====2Fe2+
C.Cl2氧化Fe2+:Fe2++Cl2====Fe3++2Cl-
D.Al与稀硫酸反应:2Al+6H+====2Al3++3H2↑
【解析】选D。A、B、C三项中反应元素都守恒,但反应前后电荷不守恒。根据电荷守恒原理即可判断只有D项正确。【例2】能正确表示下列反应的离子方程式的是( )
A.将铁粉加入稀硫酸中:
2Fe+6H+====2Fe3++3H2↑
B.将磁性氧化铁溶于盐酸:
Fe3O4+8H+====3Fe3++4H2O
C.将氯化亚铁溶液和稀硝酸混合:
Fe2++4H++ ====Fe3++2H2O+NO↑
D.将铜屑加入含Fe3+的溶液中:
2Fe3++Cu====2Fe2++Cu2+【解析】选D。本题考查离子方程式的正误判断,意在考查元素
化合物知识。将铁粉加入稀硫酸中,发生反应的离子方程式为
Fe+2H+====Fe2++H2↑,A项错误;磁性氧化铁可以看作FeO·Fe2O3,
溶于盐酸时发生反应的离子方程式为Fe3O4+8H+====Fe2++
2Fe3++4H2O,B项错误;氯化亚铁和稀硝酸反应,离子方程式为
3Fe2++4H++ ====3Fe3++NO↑+2H2O,C项错误;将铜屑加入
含Fe3+的溶液中发生氧化还原反应:2Fe3++Cu====2Fe2++Cu2+,
D项正确。【知识扫描】
离子方程式正误判断的方法
(1)看离子反应是否符合客观事实,不主观臆造产物及反应。
(2)看“====”“ ? ”“↓”“↑”等符号是否正确。
(3)看表示各物质的化学式是否正确。如 不能写成
+H+, 通常写成 +H+。
(4)看是否漏掉离子反应。如Ba(OH)2溶液与CuSO4溶液反应,
既要写Ba2+与 的离子反应,又要写Cu2+与OH-的离子反应。(5)看电荷是否守恒。如FeCl2溶液与Cl2反应,不能写成
Fe2++Cl2====2Fe3++2Cl-,应写成2Fe2++Cl2====2Fe3++2Cl-,同
时两边的各原子数也应相等。
(6)看反应物与产物的配比是否正确。如稀硫酸与Ba(OH)2溶液
反应不能写成 H++OH-+ +Ba2+====BaSO4↓+H2O ,应写成
2H++2OH-+ +Ba2+====BaSO4↓+2H2O 。
(7)看是否符合题设条件及要求。如“过量” “少量” “等
物质的量” “适量” “任意量” “滴加顺序”对反应方式
或产物的影响。考点四 氧化还原反应
【例1】ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4====2ClO2↑+K2SO4+2CO2↑+2H2O。
试回答下列问题:
(1)该反应中还原剂的化学式是________;被还原元素的元素符
号是________;
(2)试比较KClO3和CO2的氧化性强弱_______;
(3)当转移0.5 mol电子时,消耗氧化剂的物质的量为______。【解析】分析元素化合价可知,反应中电子转移的方向和数目可以表示为分析可知:
(1)该反应中还原剂的化学式是H2C2O4;被还原元素的元素符号是Cl;
(2)反应中氧化剂为KClO3,氧化产物为CO2,所以氧化性KClO3>CO2;
(3)当转移0.5 mol电子时,消耗0.5 mol KClO3。
答案:(1)H2C2O4 Cl (2)KClO3>CO2 (3)0.5 mol【例2】在一定条件下,NO跟NH3可以发生反应:NO+NH3 N2+H2O(未配平),该反应中被氧化和被还
原的氮元素的质量比是( )
A.3∶2 B.2∶1
C.1∶1 D.2∶3
【解析】选D。分析化合价变化可知,NO中氮元素化合价由+2降
低到0,得到2个电子,被还原;NH3中氮元素化合价由-3升高到0,
失去3个电子,被氧化。根据氧化还原反应中得失电子总数相等,
可以得如下关系式:n(NO)×2=n(NH3)×3,被氧化和被还原的氮
元素的质量比等于物质的量之比,即n(NH3)∶n(NO)=2∶3。【知识扫描】
1.氧化还原反应基本概念之间的关系其中:还原性:还原剂>还原产物;
氧化性:氧化剂>氧化产物。2.电子得失守恒原理及应用
(1)电子得失守恒:
氧化剂得电子总数与还原剂失电子总数相等。
(2)利用得失电子守恒原理解决有关计算问题——先“找”后“列”:
利用守恒思想,可以抛开繁琐的反应过程,不必写出反应的化学方程式,从而更快、更便捷地解决有关问题。计算步骤为
①找:首先找出氧化剂、还原剂及其物质的量以及每摩尔氧化剂、还原剂得失电子的物质的量。②“列”:然后根据电子守恒列出等式进行计算,即:
氧化剂的物质的量×每摩尔氧化剂得电子数=还原剂的物质的量×每摩尔还原剂失电子数。考点五 铁及其化合物的氧化性、还原性
【例题】金属单质A与盐酸反应生成浅绿色溶液B,同时放出气体C。如果在B溶液中通入氯气,则B转变成棕黄色溶液D,将溶液D分为两份,一份加入几滴KSCN溶液,生成红色物质,另一份加入A,则棕黄色溶液D重新变成浅绿色溶液B,在溶液B中滴加NaOH溶液生成白色沉淀E,露置在空气中,会逐渐变成红褐色沉淀F。(1)则各物质的化学式分别是:
A________、B________、C________、D________、
E________、F________。
(2)有关反应的离子方程式(或化学反应方程式)为
①B转变为D________________;
②D加A____________________;
③B生成E__________________;
④E生成F__________________。【解析】本题的突破口较多,如B——浅绿色溶液,可知B中含
Fe2+;D——棕黄色溶液,可知D中含Fe3+;D+KSCN 红色,验
证D中含Fe3+;F——红褐色沉淀,可知F为Fe(OH)3。
答案:(1)Fe FeCl2 H2 FeCl3 Fe(OH)2 Fe(OH)3
(2)①2Fe2++Cl2====2Fe3++2Cl-
②2Fe3++Fe====3Fe2+
③Fe2++2OH-====Fe(OH)2↓
④4Fe(OH)2+O2+2H2O====4Fe(OH)3【知识扫描】铁元素的氧化性、还原性及铁的不同价态间的转化关系
(1)Fe只具有还原性,可以被氧化成Fe2+和Fe3+;
(2)Fe2+既具有氧化性又具有还原性,但主要表现为还原性;
(3)Fe3+具有较强的氧化性,可被具有较强还原性的物质还原为Fe2+或Fe。(4)铁及其化合物之间的相互转变关系:①是指H+、S、I2、Cu2+、Fe3+等氧化剂;
②④是指Cl2、O2、HNO3、KMnO4等氧化剂;
③⑥是指Zn、Al等还原剂;
⑤一般是指Fe、Cu、HI、H2S等还原剂。
1.分散系2.胶体的性质三、电解质和非电解质说明:(1)单质、混合物既不是电解质,也不是非电解质。
(2)CO2、SO2、NH3等化合物溶于水能导电,但不是本身电离所致,属于非电解质。四、离子反应、离子方程式
1.离子反应发生的条件
(1)生成难溶物;
(2)生成难电离的物质;
(3)生成易挥发的物质。2.离子方程式的书写步骤3.离子方程式的意义
离子方程式不仅可以表示一个化学反应,还可以表示一类化学反应,并可以揭示这一类反应的反应实质。五、氧化还原反应
1.概念间的关系——“失升氧还,得降还氧”(1)氧化还原反应中的氧化反应和还原反应同时存在,同时进行。
(2)同一氧化还原反应中氧化剂得到电子的总数和还原剂失去
电子的总数相等。元素化合价升高的总数和元素化合价降低的
总数相等。2.常见的氧化剂和还原剂六、铁
1.铁三角上述序号对应的离子(或化学)方程式为:
①离子方程式:Fe+2H+====Fe2++H2↑
②化学方程式:2Fe+3Cl2 2FeCl3
③离子方程式:2Fe2++Cl2====2Fe3++2Cl-
④离子方程式:Fe2++Zn====Zn2++Fe
⑤离子方程式:2Fe3++Fe====3Fe2+、
2Fe3++Cu====2Fe2++Cu2+2.Fe2+、Fe3+的检验及鉴别方法考点一 分类方法及其在化学学习中的应用
【例题】某化学兴趣小组欲研究H2SO4、BaCl2、Na2CO3、NaCl、NaOH的性质,对于如何研究,他们设计了两种研究方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案Ⅱ:将它们按照钠盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。(1)根据方案Ⅰ进行分类时,某同学发现Na2CO3溶液也显碱性,于是将Na2CO3与NaOH都划分为碱类,是否合理? _______。
(2)请写出方案Ⅱ两组物质间任一反应的离子方程式:_____。
(3)该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述五种物质分为Na2CO3、NaCl、NaOH和H2SO4、BaCl2两类。在用H2SO4鉴别三种含钠元素的物质时,Na2CO3很容易得到了区分,但鉴别NaCl和NaOH时却陷入了困境,你能帮忙解决这一难题吗?【解析】(1)碱在水溶液中电离出的阴离子全部是OH-,显然
Na2CO3不是碱,它是由金属离子和酸根离子组成的化合物,属于
盐。
(2)方案Ⅱ的两组物质分别为H2SO4、BaCl2、NaOH和Na2CO3、
NaCl,两组物质间能够发生两个反应。
①H2SO4和Na2CO3反应的离子方程式为
+2H+====CO2↑+H2O。
②BaCl2和Na2CO3反应的离子方程式为
+Ba2+====BaCO3↓。(3)可在两支试管中分别加入等量的H2SO4溶液,再分别加入稍过量的两种未知物质的溶液,由于加NaCl溶液的试管中硫酸不参与反应,再加Na2CO3溶液会产生CO2气体;而加NaOH溶液的试管中的H2SO4已经被完全反应,再加Na2CO3溶液不会产生CO2气体。答案:(1)不合理。虽然Na2CO3溶液呈碱性,但它在水溶液中不
能电离出OH-,不符合碱的定义
(2) +2H+====CO2↑+H2O(或 +Ba2+====BaCO3↓)
(3)在两支试管中分别加入少许H2SO4溶液,分别加入稍过量的
两种未知物质的溶液,充分混合后,再向混合溶液中分别滴加
Na2CO3溶液,若有气泡生成,则加入的未知物质的溶液为NaCl溶
液;若无气泡生成,则加入的未知物质的溶液为NaOH溶液。【知识扫描】分类方法的应用
(1)用分类法判断或预测物质的性质:
例如锌和铁都是金属单质,已知它们均能跟某些非金属单质反应、跟某些酸反应、跟某些盐反应等。又知铝也是金属单质,则铝也应具有锌、铁等金属单质的一般性质。
(2)用分类法寻找具有相同或相似性质的物质:
例如盐酸(HCl)、硫酸(H2SO4)都是酸,具有酸的通性。(3)应用分类法对物质进行鉴别:
例如选择化学试剂鉴别稀硫酸、稀盐酸、NaOH、BaCl2、KNO3、Ca(OH)2等六种溶液时,可先按酸、碱性的差异利用石蕊试液将它们分为三类,然后再分组鉴别。
①能使石蕊试液变红(显酸性)的是稀硫酸、稀盐酸。
②能使石蕊试液变蓝(显碱性)的是NaOH溶液、Ca(OH)2溶液。
③遇石蕊试液无明显现象(显中性)的是BaCl2溶液、KNO3溶液。考点二 电解质与非电解质的判断
【例题】下列物质中
①CO2 ②HNO3 ③KOH ④石墨 ⑤Fe
⑥葡萄糖 ⑦Na2CO3 ⑧酒精 ⑨食盐水
(1)属于电解质的是______________________
(2)属于非电解质的是_____________________【解析】电解质是指溶于水或熔融状态下,自身能电离成离子的化合物。非电解质是指在上述两种情况下都不能电离的化合物。单质和混合物既不是电解质,也不是非电解质,属于电解质的是②③⑦;属于非电解质的是①⑥⑧。
答案:(1)②③⑦ (2)①⑥⑧【知识扫描】电解质和非电解质的判断方法——“三看”
1.一看物质类别
先将所给物质按照单质、混合物、化合物的类别进行分类。
2.二看化合物的类别
将化合物分成酸、碱、盐、氧化物以及其他类别。
3.三看特殊物质
在进行分类之前先明确酸、碱、盐是电解质,然后对于剩余的物质看一下有没有金属氧化物,大部分金属氧化物都是电解质,最后剩下的化合物一般是非电解质。考点三 离子方程式正误的判断
【例1】下列反应的离子方程式书写正确的是( )
A.钠与水反应:Na+2H2O====Na++2OH-+H2↑
B.FeCl3溶液与Fe反应:Fe+Fe3+====2Fe2+
C.Cl2氧化Fe2+:Fe2++Cl2====Fe3++2Cl-
D.Al与稀硫酸反应:2Al+6H+====2Al3++3H2↑
【解析】选D。A、B、C三项中反应元素都守恒,但反应前后电荷不守恒。根据电荷守恒原理即可判断只有D项正确。【例2】能正确表示下列反应的离子方程式的是( )
A.将铁粉加入稀硫酸中:
2Fe+6H+====2Fe3++3H2↑
B.将磁性氧化铁溶于盐酸:
Fe3O4+8H+====3Fe3++4H2O
C.将氯化亚铁溶液和稀硝酸混合:
Fe2++4H++ ====Fe3++2H2O+NO↑
D.将铜屑加入含Fe3+的溶液中:
2Fe3++Cu====2Fe2++Cu2+【解析】选D。本题考查离子方程式的正误判断,意在考查元素
化合物知识。将铁粉加入稀硫酸中,发生反应的离子方程式为
Fe+2H+====Fe2++H2↑,A项错误;磁性氧化铁可以看作FeO·Fe2O3,
溶于盐酸时发生反应的离子方程式为Fe3O4+8H+====Fe2++
2Fe3++4H2O,B项错误;氯化亚铁和稀硝酸反应,离子方程式为
3Fe2++4H++ ====3Fe3++NO↑+2H2O,C项错误;将铜屑加入
含Fe3+的溶液中发生氧化还原反应:2Fe3++Cu====2Fe2++Cu2+,
D项正确。【知识扫描】
离子方程式正误判断的方法
(1)看离子反应是否符合客观事实,不主观臆造产物及反应。
(2)看“====”“ ? ”“↓”“↑”等符号是否正确。
(3)看表示各物质的化学式是否正确。如 不能写成
+H+, 通常写成 +H+。
(4)看是否漏掉离子反应。如Ba(OH)2溶液与CuSO4溶液反应,
既要写Ba2+与 的离子反应,又要写Cu2+与OH-的离子反应。(5)看电荷是否守恒。如FeCl2溶液与Cl2反应,不能写成
Fe2++Cl2====2Fe3++2Cl-,应写成2Fe2++Cl2====2Fe3++2Cl-,同
时两边的各原子数也应相等。
(6)看反应物与产物的配比是否正确。如稀硫酸与Ba(OH)2溶液
反应不能写成 H++OH-+ +Ba2+====BaSO4↓+H2O ,应写成
2H++2OH-+ +Ba2+====BaSO4↓+2H2O 。
(7)看是否符合题设条件及要求。如“过量” “少量” “等
物质的量” “适量” “任意量” “滴加顺序”对反应方式
或产物的影响。考点四 氧化还原反应
【例1】ClO2是一种消毒、杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4====2ClO2↑+K2SO4+2CO2↑+2H2O。
试回答下列问题:
(1)该反应中还原剂的化学式是________;被还原元素的元素符
号是________;
(2)试比较KClO3和CO2的氧化性强弱_______;
(3)当转移0.5 mol电子时,消耗氧化剂的物质的量为______。【解析】分析元素化合价可知,反应中电子转移的方向和数目可以表示为分析可知:
(1)该反应中还原剂的化学式是H2C2O4;被还原元素的元素符号是Cl;
(2)反应中氧化剂为KClO3,氧化产物为CO2,所以氧化性KClO3>CO2;
(3)当转移0.5 mol电子时,消耗0.5 mol KClO3。
答案:(1)H2C2O4 Cl (2)KClO3>CO2 (3)0.5 mol【例2】在一定条件下,NO跟NH3可以发生反应:NO+NH3 N2+H2O(未配平),该反应中被氧化和被还
原的氮元素的质量比是( )
A.3∶2 B.2∶1
C.1∶1 D.2∶3
【解析】选D。分析化合价变化可知,NO中氮元素化合价由+2降
低到0,得到2个电子,被还原;NH3中氮元素化合价由-3升高到0,
失去3个电子,被氧化。根据氧化还原反应中得失电子总数相等,
可以得如下关系式:n(NO)×2=n(NH3)×3,被氧化和被还原的氮
元素的质量比等于物质的量之比,即n(NH3)∶n(NO)=2∶3。【知识扫描】
1.氧化还原反应基本概念之间的关系其中:还原性:还原剂>还原产物;
氧化性:氧化剂>氧化产物。2.电子得失守恒原理及应用
(1)电子得失守恒:
氧化剂得电子总数与还原剂失电子总数相等。
(2)利用得失电子守恒原理解决有关计算问题——先“找”后“列”:
利用守恒思想,可以抛开繁琐的反应过程,不必写出反应的化学方程式,从而更快、更便捷地解决有关问题。计算步骤为
①找:首先找出氧化剂、还原剂及其物质的量以及每摩尔氧化剂、还原剂得失电子的物质的量。②“列”:然后根据电子守恒列出等式进行计算,即:
氧化剂的物质的量×每摩尔氧化剂得电子数=还原剂的物质的量×每摩尔还原剂失电子数。考点五 铁及其化合物的氧化性、还原性
【例题】金属单质A与盐酸反应生成浅绿色溶液B,同时放出气体C。如果在B溶液中通入氯气,则B转变成棕黄色溶液D,将溶液D分为两份,一份加入几滴KSCN溶液,生成红色物质,另一份加入A,则棕黄色溶液D重新变成浅绿色溶液B,在溶液B中滴加NaOH溶液生成白色沉淀E,露置在空气中,会逐渐变成红褐色沉淀F。(1)则各物质的化学式分别是:
A________、B________、C________、D________、
E________、F________。
(2)有关反应的离子方程式(或化学反应方程式)为
①B转变为D________________;
②D加A____________________;
③B生成E__________________;
④E生成F__________________。【解析】本题的突破口较多,如B——浅绿色溶液,可知B中含
Fe2+;D——棕黄色溶液,可知D中含Fe3+;D+KSCN 红色,验
证D中含Fe3+;F——红褐色沉淀,可知F为Fe(OH)3。
答案:(1)Fe FeCl2 H2 FeCl3 Fe(OH)2 Fe(OH)3
(2)①2Fe2++Cl2====2Fe3++2Cl-
②2Fe3++Fe====3Fe2+
③Fe2++2OH-====Fe(OH)2↓
④4Fe(OH)2+O2+2H2O====4Fe(OH)3【知识扫描】铁元素的氧化性、还原性及铁的不同价态间的转化关系
(1)Fe只具有还原性,可以被氧化成Fe2+和Fe3+;
(2)Fe2+既具有氧化性又具有还原性,但主要表现为还原性;
(3)Fe3+具有较强的氧化性,可被具有较强还原性的物质还原为Fe2+或Fe。(4)铁及其化合物之间的相互转变关系:①是指H+、S、I2、Cu2+、Fe3+等氧化剂;
②④是指Cl2、O2、HNO3、KMnO4等氧化剂;
③⑥是指Zn、Al等还原剂;
⑤一般是指Fe、Cu、HI、H2S等还原剂。
