碳的多样性2
图片预览





文档简介
课件27张PPT。第3章 自然界中的元素
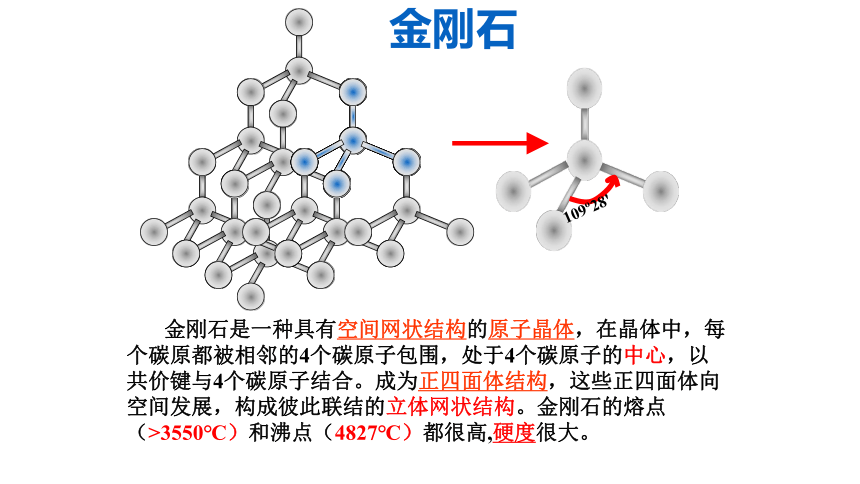
第1节 碳的多样性C60金刚石石墨无色透明、坚硬的晶体深灰色、质软、不透明、导电的片状固体灰黑色固体一、多种多样的碳单质由同一种元素组成的性质不同的单质,叫做该元素的同素异形体。109o28' 金刚石是一种具有空间网状结构的原子晶体,在晶体中,每个碳原都被相邻的4个碳原子包围,处于4个碳原子的中心,以共价键与4个碳原子结合。成为正四面体结构,这些正四面体向空间发展,构成彼此联结的立体网状结构。金刚石的熔点(>3550℃)和沸点(4827℃)都很高,硬度很大。
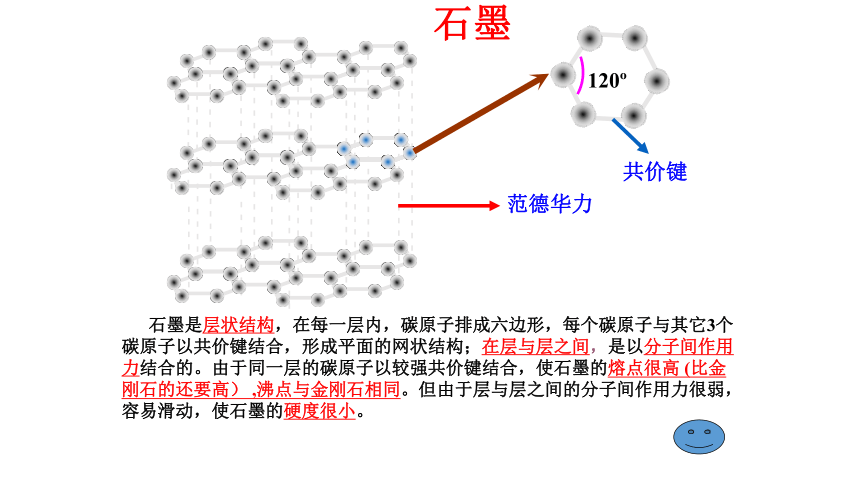
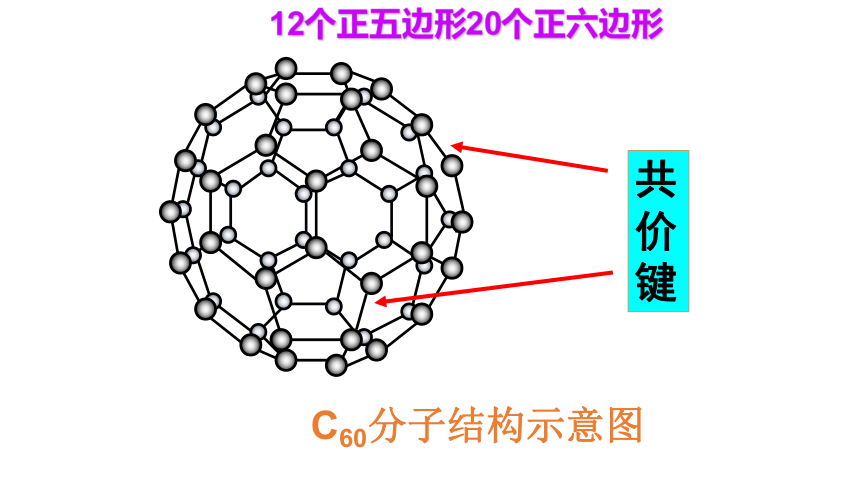
金刚石120o共价键范德华力 石墨是层状结构,在每一层内,碳原子排成六边形,每个碳原子与其它3个碳原子以共价键结合,形成平面的网状结构;在层与层之间,是以分子间作用力结合的。由于同一层的碳原子以较强共价键结合,使石墨的熔点很高 (比金刚石的还要高) ,沸点与金刚石相同。但由于层与层之间的分子间作用力很弱,容易滑动,使石墨的硬度很小。石墨C60分子结构示意图共价键12个正五边形20个正六边形二、含碳化合物的多样性含碳化合物无机物:
有机物:CO、CO2、H2CO3、碳酸盐等除了以上物质,含碳的化合物。三、碳单质的化学性质还原性
1、二氧化碳的性质② 酸性氧化物:
CO2 + Ca(OH)2 ==== CaCO3 ? + H2O
CaCO3 + CO2 + H2O ==== Ca(HCO3)2Na2CO3(饱和) + CO2 + H2O ==== 2NaHCO3?
四、碳氧化物注意:不能用CO2扑灭Mg、Na火
2CO2 + 2Na = Na2CO3 + CONa2SiO3 + CO2 +H2O==== H2SiO3?+ Na2CO3
将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是D1.CO2可与碱性氧化物
CaO+CO2====CaCO3
与碱反应
2NaOH+CO2====Na2CO3+H2O 1. CO属不成盐氧化物,一般不与酸、碱、盐反应;4.CO有剧毒
是大气污染物2.不可燃烧,但支持某些物质燃烧
2Mg+CO2=点燃=C+2MgO4.CO2无毒,会造成温室效应2、碳氧化物的比较3、CO、CO2的制取方法实验室制
CO装置实验室制CO2装置白色晶体,易溶于水白色晶体,溶于水(小)Na2CO3受热难分解CO32- +2H+=CO2↑+H2OHCO3- + H+ = CO2↑+ H2O相同条件下放出CO2的速度NaHCO3比Na2CO3快Na2CO3+Ca(OH)2=CaCO3↓+2NaOHNaHCO3 + NaOH = Na2CO3+H2O2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2ONa2CO3NaHCO3CO2+H2O加热或加NaOH碳酸钠和碳酸氢钠的化学性质纯碱、苏打小苏打五、碳酸盐的热稳定性规律
①Na2CO3、K2CO3的热稳定性极强,在高温熔化下也难分解。
②CaCO3、BaCO3 、MgCO3、CuCO3等热稳定性很强,但在高温下能分解,生成金属氧化物和二氧化碳。
③NaHCO3、KHCO3 、NH4 HCO3、 (NH4 )2CO3、 Ca( HCO3)2的热稳定性较差,在固态时加热易分解:
2NaHCO3 Na2CO3+ CO2↑+ H2O
2KHCO3 K2CO3+ CO2↑+ H2O
NH4 HCO3 NH3↑+ CO2↑+ H2O
(NH4 )2CO3 2NH3↑+ CO2↑+ H2O
Ca( HCO3)2 CaCO3+ CO2↑+ H2O
六、硅酸根离子、碳酸根离子离子检验 CO32-
原理:CO32-+Ca2+ === CaCO3↓
CaCO3为白色固体,不溶于水但溶于盐酸或硝酸,且生成无色、无味的气味。
CaCO3+2H+ ===Ca 2++CO2↑+ H2O
方法:向待检溶液中加入过量的CaCl2溶液,若生成白色沉淀,再加入稀盐酸或稀硝酸,若白色 沉淀又溶解,且生成无色、无味气体,则待检溶液中有CO32-。注意:试剂CaCl2溶液也可用Ca(NO3)2、BaCl2、Ba(NO3)2等的溶液代之,但不能用Ca(OH)2溶液或Ba(OH)2溶液,原因是无法排除HCO3-的干扰;
对白色沉淀要加入稀盐酸或稀硝酸溶之以排除Ag+的干扰。但不可用硫酸溶液,原因是H2 SO4溶解CaCO3 或BaCO3的效果不佳;
HCO3-
原理:HCO3-的盐易溶于水,易与H+反应;
HCO3-+H+ === CO2↑+ H2O
CO2为无色无味气味。
方法:向待检溶液中加入足量的Ca2+或Ba2+的可溶性盐溶液。若无明显现象,再向溶液中加入足量的酸(如盐酸、硝酸、醋酸等)溶液,若溶液中逸出无色、无味的气体,则待检溶液中有HCO3-。
注意:Ca2+或Ba2+的溶液不可用Ca(OH)2溶液或Ba(OH)2溶液,原因是OH-将HCO3-转化为CO32-;加酸后要通过气体的气味排除HSO3-的干扰。作业:写出下列反应的化学方程式CCO2Na2CO3NaHCO3COCaCO3Ca(HCO3)2注:不能重复5. CO2 + 2NaOH == Na2CO3 + H2O6. CO2 + Ca(OH)2 == CaCO3↓ + H2O8. CO2+ H2O + Na2CO3 == 2NaHCO313. 2NaHCO3+ Ca(OH)2= CaCO3↓+ Na2CO3 + 2H2O 9. 2HCl + Na2CO3 == 2NaCl + CO2↑+ H2O10. CaCl2 + Na2CO3 == 2NaCl + CaCO3↓12. NaHCO3 + HCl == NaCl + CO2↑+ H2O14. CO2 + H2O + CaCO3 == Ca(HCO3)215. CaCO3 + 2HCl == CaCl2 + CO2↑+ H2O1、下列各溶液中,分别通入过量的CO2气体后,有沉淀生成的是
A.漂白粉溶液 B.石灰水
C.CaCl2溶液 D.硅酸钠溶液
2、下列对碳的同素异形体:金刚石、石墨、和C60的说法中,错误的是
A. C60的摩尔质量是720
B. 硬度金刚石比石墨大
C. 在一定条件下与O2反应生成CO2
D. 在一定条件下它们可能相互转化DA3、下列关于Na2CO3和NaHCO3说法中不正确的是
A. Na2CO3更易溶于水
B. Na2CO3比NaHCO3稳定
C. 跟酸反应Na2CO3比NaHCO3更剧烈
D. 都能跟石灰水反应得到白色沉淀
4、除去混在碳酸钠粉末中的少量碳酸氢钠,最合理的方法是
A. 加热 B. 加NaOH溶液
C. 加盐酸 D. 加CaCl2溶液CA5、等体积等物质的量浓度的NaHCO3和Ba?OH?2溶液混合离子方程式正确的是
A? HCO3-+OH- = H2O + CO32-
B? 2 HCO3-+Ba?OH?2=BaCO3?+2H2O+HCO32-
C? HCO3-+Ba2+ +OH- =BaCO3?+H2O
D? 2 HCO3-+Ba2+ +2OH- =BaCO3?+2H2O+ CO32-C6、COX中气体杂质的除去方法:
(1)CO中混有CO2
通过盛有澄清石灰水的洗气瓶。
(2)CO2中混有CO
通过硬质玻璃管中灼热的CuO。
(3)CO2中混有HCl
通过盛饱和NaHCO3溶液的洗气瓶。7、锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡和+4价铅的化合物是不稳定的,+2价锡离子有强还原性,+4价铅化合物有强氧化性。如Sn2+比Fe2+还原性强,PbO2比Cl2氧化性强,写出下列反应的化学方程式。
(1)FeCl3溶液滴入SnCl2溶液;
(2)PbO2遇浓盐酸。
(1)2 FeCl3+SnCl2=2 FeCl2+ SnCl4
(2)PbO2+4HCl=PbCl2+2H2O+ Cl2↑ 已知:还原性Sn2+>Fe2+,氧化性PbO2>Cl2。试写出下列化学方程式:
①氯气与锡共热:___________________
②氯气与铅共热:___________________
③PbO2浓盐酸共热__________________
④能说明Sn2+还原性比Fe2+还原性强的离子方程式是_______________________.
⑤把棕色的PbO2投入亚硫酸溶液中充分反应,可观察到把棕色的PbO2逐渐变成白色固体物质
_________________________Sn+2Cl2=▲=SnCl4Pb+Cl2=▲= PbCl2PbO2+4HCl=▲= PbCl2+Cl2↑+2H2OPbO2+H2SO3=PbSO4+H2OSn2++2Fe3+=Sn4++2Fe2+例题评讲:
第1节 碳的多样性C60金刚石石墨无色透明、坚硬的晶体深灰色、质软、不透明、导电的片状固体灰黑色固体一、多种多样的碳单质由同一种元素组成的性质不同的单质,叫做该元素的同素异形体。109o28' 金刚石是一种具有空间网状结构的原子晶体,在晶体中,每个碳原都被相邻的4个碳原子包围,处于4个碳原子的中心,以共价键与4个碳原子结合。成为正四面体结构,这些正四面体向空间发展,构成彼此联结的立体网状结构。金刚石的熔点(>3550℃)和沸点(4827℃)都很高,硬度很大。
金刚石120o共价键范德华力 石墨是层状结构,在每一层内,碳原子排成六边形,每个碳原子与其它3个碳原子以共价键结合,形成平面的网状结构;在层与层之间,是以分子间作用力结合的。由于同一层的碳原子以较强共价键结合,使石墨的熔点很高 (比金刚石的还要高) ,沸点与金刚石相同。但由于层与层之间的分子间作用力很弱,容易滑动,使石墨的硬度很小。石墨C60分子结构示意图共价键12个正五边形20个正六边形二、含碳化合物的多样性含碳化合物无机物:
有机物:CO、CO2、H2CO3、碳酸盐等除了以上物质,含碳的化合物。三、碳单质的化学性质还原性
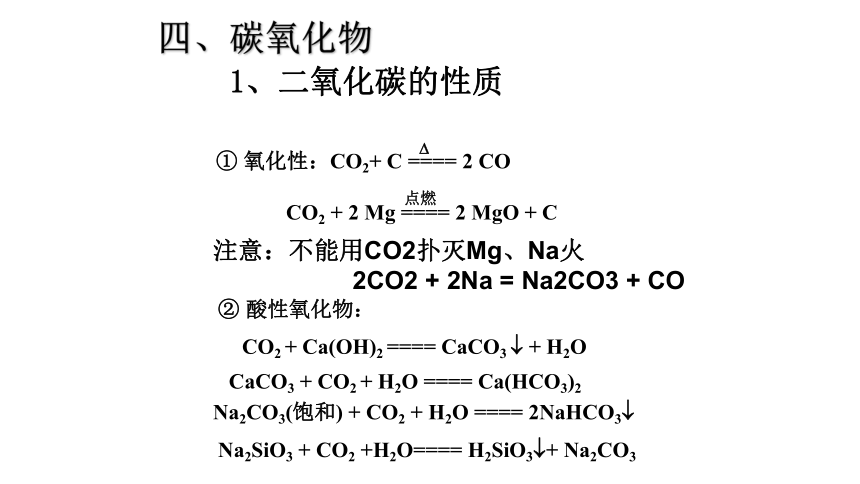
1、二氧化碳的性质② 酸性氧化物:
CO2 + Ca(OH)2 ==== CaCO3 ? + H2O
CaCO3 + CO2 + H2O ==== Ca(HCO3)2Na2CO3(饱和) + CO2 + H2O ==== 2NaHCO3?
四、碳氧化物注意:不能用CO2扑灭Mg、Na火
2CO2 + 2Na = Na2CO3 + CONa2SiO3 + CO2 +H2O==== H2SiO3?+ Na2CO3
将足量CO2通人KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是D1.CO2可与碱性氧化物
CaO+CO2====CaCO3
与碱反应
2NaOH+CO2====Na2CO3+H2O 1. CO属不成盐氧化物,一般不与酸、碱、盐反应;4.CO有剧毒
是大气污染物2.不可燃烧,但支持某些物质燃烧
2Mg+CO2=点燃=C+2MgO4.CO2无毒,会造成温室效应2、碳氧化物的比较3、CO、CO2的制取方法实验室制
CO装置实验室制CO2装置白色晶体,易溶于水白色晶体,溶于水(小)Na2CO3受热难分解CO32- +2H+=CO2↑+H2OHCO3- + H+ = CO2↑+ H2O相同条件下放出CO2的速度NaHCO3比Na2CO3快Na2CO3+Ca(OH)2=CaCO3↓+2NaOHNaHCO3 + NaOH = Na2CO3+H2O2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2ONa2CO3NaHCO3CO2+H2O加热或加NaOH碳酸钠和碳酸氢钠的化学性质纯碱、苏打小苏打五、碳酸盐的热稳定性规律
①Na2CO3、K2CO3的热稳定性极强,在高温熔化下也难分解。
②CaCO3、BaCO3 、MgCO3、CuCO3等热稳定性很强,但在高温下能分解,生成金属氧化物和二氧化碳。
③NaHCO3、KHCO3 、NH4 HCO3、 (NH4 )2CO3、 Ca( HCO3)2的热稳定性较差,在固态时加热易分解:
2NaHCO3 Na2CO3+ CO2↑+ H2O
2KHCO3 K2CO3+ CO2↑+ H2O
NH4 HCO3 NH3↑+ CO2↑+ H2O
(NH4 )2CO3 2NH3↑+ CO2↑+ H2O
Ca( HCO3)2 CaCO3+ CO2↑+ H2O
六、硅酸根离子、碳酸根离子离子检验 CO32-
原理:CO32-+Ca2+ === CaCO3↓
CaCO3为白色固体,不溶于水但溶于盐酸或硝酸,且生成无色、无味的气味。
CaCO3+2H+ ===Ca 2++CO2↑+ H2O
方法:向待检溶液中加入过量的CaCl2溶液,若生成白色沉淀,再加入稀盐酸或稀硝酸,若白色 沉淀又溶解,且生成无色、无味气体,则待检溶液中有CO32-。注意:试剂CaCl2溶液也可用Ca(NO3)2、BaCl2、Ba(NO3)2等的溶液代之,但不能用Ca(OH)2溶液或Ba(OH)2溶液,原因是无法排除HCO3-的干扰;
对白色沉淀要加入稀盐酸或稀硝酸溶之以排除Ag+的干扰。但不可用硫酸溶液,原因是H2 SO4溶解CaCO3 或BaCO3的效果不佳;
HCO3-
原理:HCO3-的盐易溶于水,易与H+反应;
HCO3-+H+ === CO2↑+ H2O
CO2为无色无味气味。
方法:向待检溶液中加入足量的Ca2+或Ba2+的可溶性盐溶液。若无明显现象,再向溶液中加入足量的酸(如盐酸、硝酸、醋酸等)溶液,若溶液中逸出无色、无味的气体,则待检溶液中有HCO3-。
注意:Ca2+或Ba2+的溶液不可用Ca(OH)2溶液或Ba(OH)2溶液,原因是OH-将HCO3-转化为CO32-;加酸后要通过气体的气味排除HSO3-的干扰。作业:写出下列反应的化学方程式CCO2Na2CO3NaHCO3COCaCO3Ca(HCO3)2注:不能重复5. CO2 + 2NaOH == Na2CO3 + H2O6. CO2 + Ca(OH)2 == CaCO3↓ + H2O8. CO2+ H2O + Na2CO3 == 2NaHCO313. 2NaHCO3+ Ca(OH)2= CaCO3↓+ Na2CO3 + 2H2O 9. 2HCl + Na2CO3 == 2NaCl + CO2↑+ H2O10. CaCl2 + Na2CO3 == 2NaCl + CaCO3↓12. NaHCO3 + HCl == NaCl + CO2↑+ H2O14. CO2 + H2O + CaCO3 == Ca(HCO3)215. CaCO3 + 2HCl == CaCl2 + CO2↑+ H2O1、下列各溶液中,分别通入过量的CO2气体后,有沉淀生成的是
A.漂白粉溶液 B.石灰水
C.CaCl2溶液 D.硅酸钠溶液
2、下列对碳的同素异形体:金刚石、石墨、和C60的说法中,错误的是
A. C60的摩尔质量是720
B. 硬度金刚石比石墨大
C. 在一定条件下与O2反应生成CO2
D. 在一定条件下它们可能相互转化DA3、下列关于Na2CO3和NaHCO3说法中不正确的是
A. Na2CO3更易溶于水
B. Na2CO3比NaHCO3稳定
C. 跟酸反应Na2CO3比NaHCO3更剧烈
D. 都能跟石灰水反应得到白色沉淀
4、除去混在碳酸钠粉末中的少量碳酸氢钠,最合理的方法是
A. 加热 B. 加NaOH溶液
C. 加盐酸 D. 加CaCl2溶液CA5、等体积等物质的量浓度的NaHCO3和Ba?OH?2溶液混合离子方程式正确的是
A? HCO3-+OH- = H2O + CO32-
B? 2 HCO3-+Ba?OH?2=BaCO3?+2H2O+HCO32-
C? HCO3-+Ba2+ +OH- =BaCO3?+H2O
D? 2 HCO3-+Ba2+ +2OH- =BaCO3?+2H2O+ CO32-C6、COX中气体杂质的除去方法:
(1)CO中混有CO2
通过盛有澄清石灰水的洗气瓶。
(2)CO2中混有CO
通过硬质玻璃管中灼热的CuO。
(3)CO2中混有HCl
通过盛饱和NaHCO3溶液的洗气瓶。7、锡、铅两种元素的主要化合价是+2价和+4价,其中+2价锡和+4价铅的化合物是不稳定的,+2价锡离子有强还原性,+4价铅化合物有强氧化性。如Sn2+比Fe2+还原性强,PbO2比Cl2氧化性强,写出下列反应的化学方程式。
(1)FeCl3溶液滴入SnCl2溶液;
(2)PbO2遇浓盐酸。
(1)2 FeCl3+SnCl2=2 FeCl2+ SnCl4
(2)PbO2+4HCl=PbCl2+2H2O+ Cl2↑ 已知:还原性Sn2+>Fe2+,氧化性PbO2>Cl2。试写出下列化学方程式:
①氯气与锡共热:___________________
②氯气与铅共热:___________________
③PbO2浓盐酸共热__________________
④能说明Sn2+还原性比Fe2+还原性强的离子方程式是_______________________.
⑤把棕色的PbO2投入亚硫酸溶液中充分反应,可观察到把棕色的PbO2逐渐变成白色固体物质
_________________________Sn+2Cl2=▲=SnCl4Pb+Cl2=▲= PbCl2PbO2+4HCl=▲= PbCl2+Cl2↑+2H2OPbO2+H2SO3=PbSO4+H2OSn2++2Fe3+=Sn4++2Fe2+例题评讲:
