氧化剂和还原剂4
图片预览





文档简介
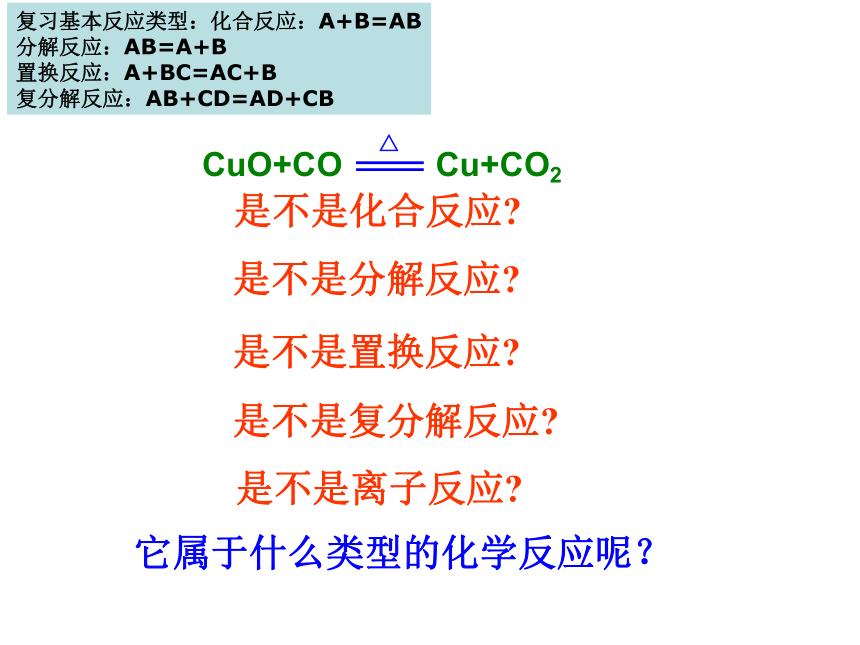
课件32张PPT。第三节 氧化剂与还原剂 是不是化合反应?
是不是分解反应?是不是置换反应?是不是复分解反应?是不是离子反应?它属于什么类型的化学反应呢?复习基本反应类型:化合反应:A+B=AB
分解反应:AB=A+B
置换反应:A+BC=AC+B
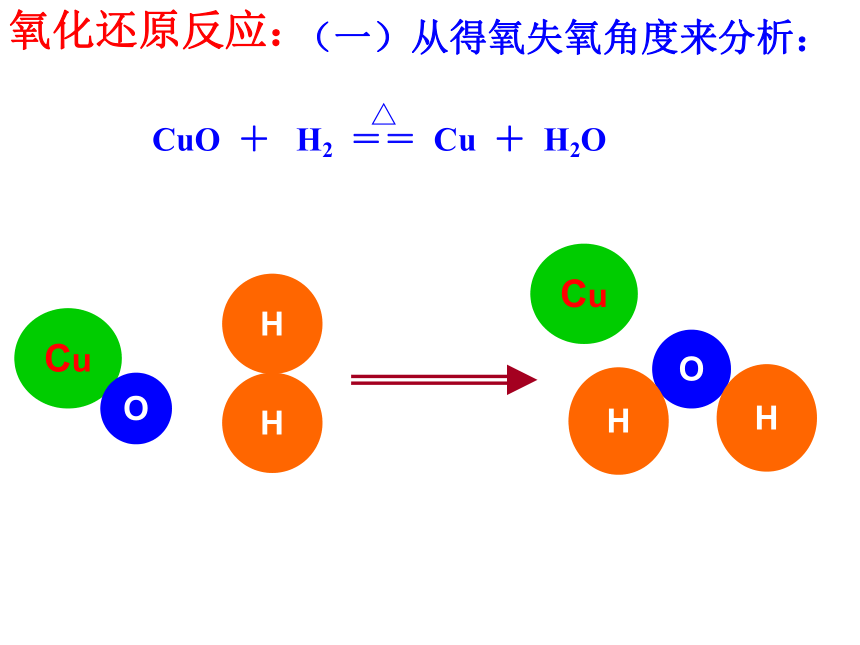
复分解反应:AB+CD=AD+CB(一)从得氧失氧角度来分析:CuO + H2 == Cu + H2O △CuHOHCuOHH氧化还原反应:得到氧,被氧化(氧化反应) CuO + H2 == Cu + H2O 失去氧,被还原(还原反应)△氧化反应:物质得到氧的反应,如氢气得到氧的反应。 还原反应:物质失去氧的反应,如氧化铜失去氧的反应。 氧化剂:失去氧的物质,如CuO。
还原剂:得到氧的物质,如H2。
(氧化剂)(还原剂)(还原产物)(氧化产物)氧化产物:还原剂被氧化所得的产物,如H2O
还原产物:氧化剂被还原所得的产物,如Cu分类标准:得氧失氧同
时
进
行
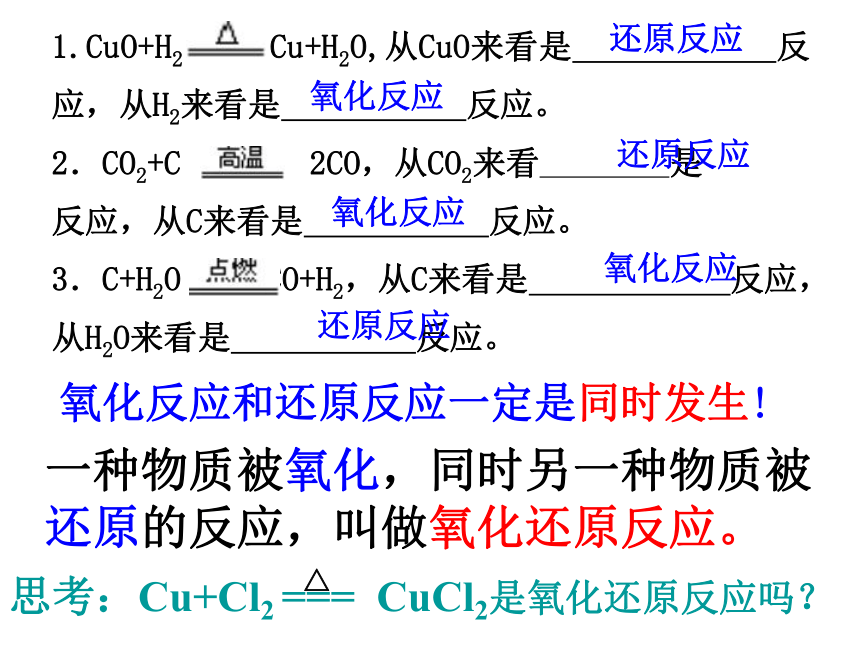
氧化反应和还原反应是分别独立进行的吗?思考与交流1.CuO+H2 Cu+H2O,从CuO来看是 反应,从H2来看是 反应。
2.CO2+C 2CO,从CO2来看 是 反应,从C来看是 反应。
3.C+H2O CO+H2,从C来看是 反应,从H2O来看是 反应。
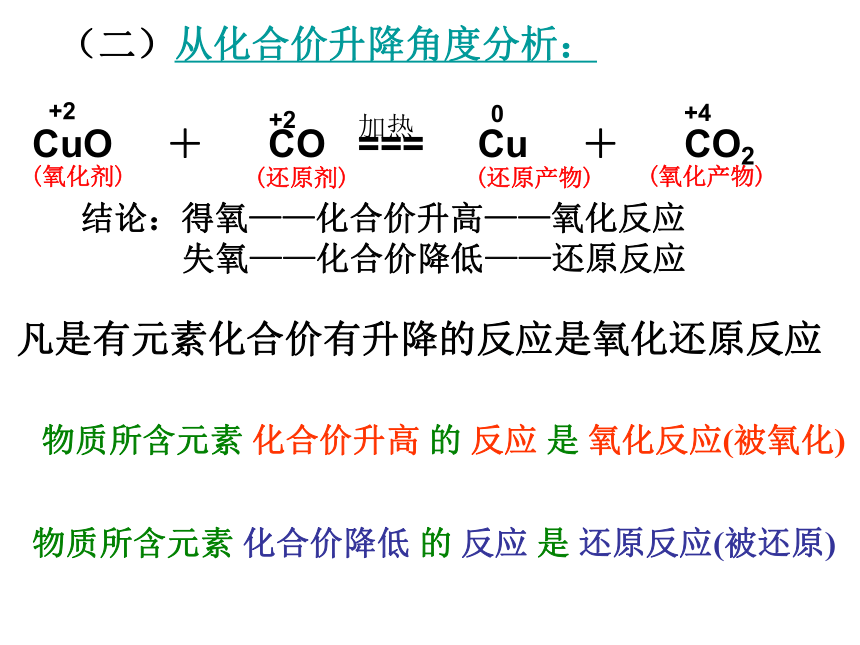
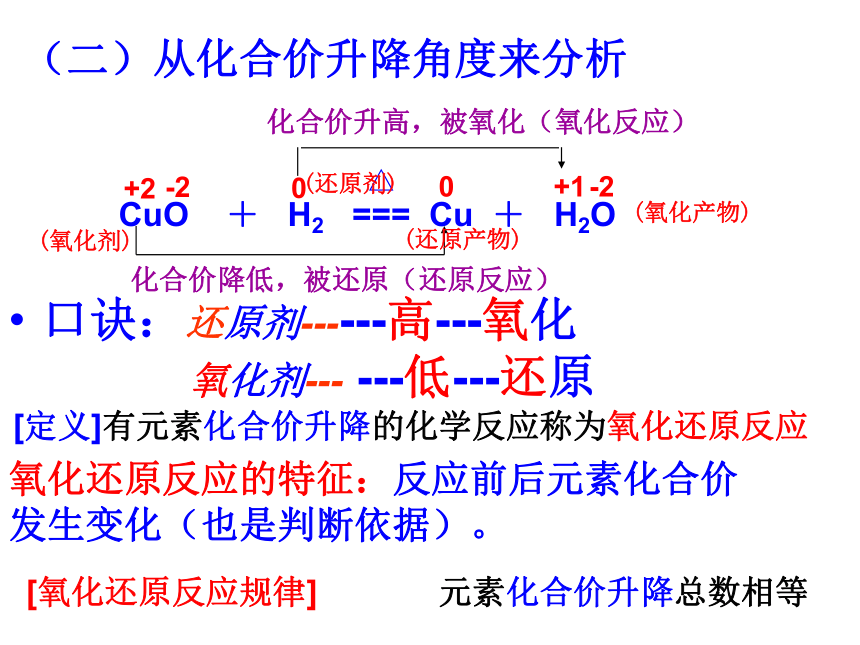
还原反应氧化反应氧化反应还原反应还原反应氧化反应氧化反应和还原反应一定是同时发生!一种物质被氧化,同时另一种物质被还原的反应,叫做氧化还原反应。 思考:Cu+Cl2 === CuCl2是氧化还原反应吗?△+2+20+4CuO + CO === Cu + CO2(二)从化合价升降角度分析:凡是有元素化合价有升降的反应是氧化还原反应结论:得氧——化合价升高——氧化反应
失氧——化合价降低——还原反应 物质所含元素 化合价升高 的 反应 是 氧化反应(被氧化)物质所含元素 化合价降低 的 反应 是 还原反应(被还原)加热(氧化剂)(还原剂)(还原产物)(氧化产物)(二)从化合价升降角度来分析化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应) CuO + H2 === Cu + H2O+2-200+1-2△[定义]有元素化合价升降的化学反应称为氧化还原反应氧化还原反应的特征:反应前后元素化合价发生变化(也是判断依据)。 (氧化剂)(还原剂)(还原产物)(氧化产物)口诀:还原剂------高---氧化
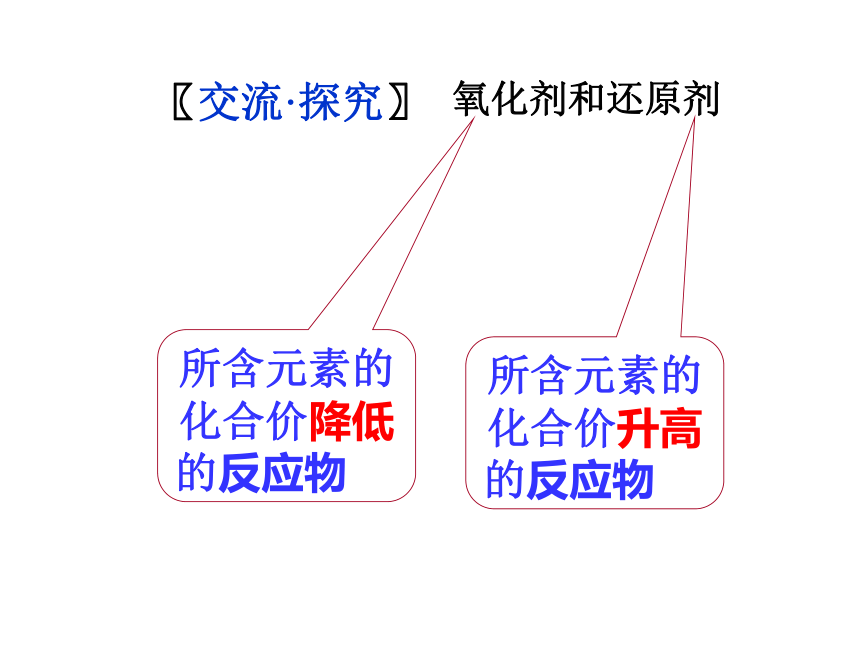
氧化剂--- ---低---还原[氧化还原反应规律] 元素化合价升降总数相等〖交流·探究〗氧化剂和还原剂 所含元素的
化合价降低
的反应物 所含元素的
化合价升高
的反应物 Cu + Cl2 == CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl ==CaCl2+H2O+CO2↑
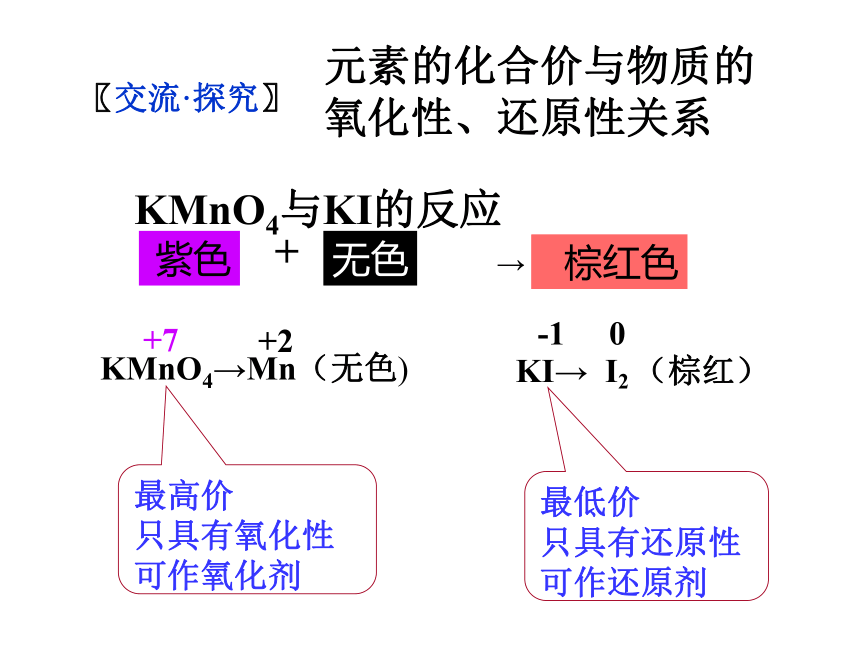
Cl2 + H2O== HCl + HClO 下列反应中,哪些是氧化剂?哪些是还原剂? 〖做一做〗氧化剂 还原剂 氧化剂 还原剂 既是氧化剂又是还原剂 非氧化还原反应〖交流·探究〗元素的化合价与物质的
氧化性、还原性关系 KMnO4与KI的反应 最高价
只具有氧化性 可作氧化剂最低价
只具有还原性 可作还原剂〖小结〗含有最高价态的元素的物质具有氧化性;
含有最低价态的元素的物质具有还原性;
含有中间价态的元素的物质既有氧化性
又有还原性。 〖做一做〗O2、Cl2、 HNO3、浓H2SO4、Fe3+
Na、Cu、C、 H2、 S2-
HCl 、SO2、H2O2在一般情况下,下列物质在化学反应中
是氧化剂,还是还原剂?〖迁移·应用〗常见的氧化剂和还原剂 活泼金属单质
某些非金属单质
含有较低价态元素的氧化物和盐活泼非金属单质
含有较高价态无素的含氧酸
含有较高价态元素的盐(二)从化合价升降角度来分析化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应)氧化剂 + 还原剂 === 还原产物 + 氧化产物[定义]有元素化合价升降的化学反应称为氧化还原反应氧化还原反应的特征:反应前后元素化合价发生变化(也是判断依据)。 口诀:还原剂------高---氧化
氧化剂--- ---低---还原[氧化还原反应规律] 元素化合价升降总数相等复习:写出下列常见元素的化合价。
H ,O ,C ,
N , Na , K ,
Ag ,Ca ,Mg ,
Zn ,Cu ,Fe ,
Al , S__________ -2,+4,+6+1,-1-1,-2+2,+4-3, +1 , +2,+4,+5 +1+1+2,+3+3+1+2+2+2+1 , +2练习:从化合价升降的角度分析并判断下列反应是否属于氧化还原反应,
1.NH4HCO3 NH3↑+CO2↑+H2O↑
2.CaCl2+Na2CO3 = CaCO3↓+2NaCl
3.2Na+2H2O = 2NaOH+H2 ↑
4.2Na+Cl2 2NaCl
5.2H2+Cl2 2HCl学生活动探究实验: 按要求组装实验,探究氧化还原反应的本质
Zn + CuSO4?= Cu + ZnSO4
1.电流计指针偏转,为什么电流表指针发生偏转,指针偏转说明什么?
2.这是化学反应,为什么会有电流产生,电流产生的原因是什么?引导学生讨论并得出结论
(1)Zn表面有红色物质产生,说明Zn将Cu置换出来。
(2)电流计的指针发生偏转,说明有电流产生,说明反应过程中电子发生定向运动。
(3)氧化还原反应的实质是电子转移。
(4)反应物失去电子,所含元素化合价升高,反应过程称为氧化反应。反应物得到电子,所含元素化合价降低,反应过程称为还原反应。?在氧化还原反应中,为什么发生元素化合价的升降? (即元素化合价变化的实质是什么?) (三)氧化还原反应的实质是什么?在氧化还原反应中,为什么发生元素化合价的升降? (即元素化合价变化的实质是什么?) 分析钠在氯气中燃烧的实验,运用物质的结构观点分析反应过程
2Na+Cl2 2NaCl
2H2 +Cl2 2HCl
化合价的升降是什么原因引起的?如何在上述两个反应中表达出来?(三)氧化还原反应的实质是什么?[问题]化合价的升降是什么原因引起的?NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+ 从电子得失角度分析:(三)从电子得失角度来分析得到2 e-,化合价降低,被还原(还原反应)失去2 ×e-,化合价升高,被氧化(氧化反应) CuO + H2 === Cu + H2O+2-200+1-2△氧化还原反应的本质:电子转移(得失或偏移)(氧化剂)(还原剂)(还原产物)(氧化产物)口诀:还原剂---失---高---氧化
氧化剂--- 得---低---还原 本质定义:有电子转移(得失或偏移)的化学反应都是 氧化还原反应。[氧化还原反应原则] 得失电子总数守恒(相等)〖交流·探究〗从电子转移的观点说明氧化剂、还原剂的实质是什么? 失e-的反应物 → 所含元素化合价升高→
发生氧化反应→是还原剂→具有还原性得e-的反应物 → 所含元素化合价降低→
发生还原反应→是氧化剂→具有氧化性使氧化剂发生还原反应的性质 使还原剂发生氧化反应的性质
学会比较,学会总结失电子化合价升高被氧化还原剂得电子化合价降低被还原氧化剂(实质) ( 特征)(变化)(反应物)还原性氧化性(性质)口诀:还原剂---失---高---氧化
氧化剂--- 得---低---还原氧化反应(反应)还原反应生成氧化产物生成还原产物(产物)〖小结〗⑴化合价升降是氧化还原反应的标志;
⑵氧化还原反应的实质是电子转移 ;
(3)氧化还原反应的规律之一:得失电子总数守恒、 化合价升降总数相等
(4)还原剂→失e- → 化合价升高 → 发生氧化反应
氧化剂→得e- → 化合价降低 → 发生 还原反应口诀:还原剂---失---高---氧化
氧化剂--- 得---低---还原得到氧的反应失去氧的反应得氧失氧同时发生有氧得失的反应化合价升高的反应化合价降低的反应化合价升高降低同时发生且总数相等有化合价升降的反应失去电子的反应(或电子对偏离)得到电子的反应(或电子对偏向)得失电子同时发生(且得失电子总数相等)有电子转移的反应不完善有一定局限性特征(表现) 本质总 结练习:
1、下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡是有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的转移(得失或偏移)
BDCaO + H2O === Ca(OH) 2Fe+CuSO4 == Cu+FeSO4〖练习〗判断下列哪些是氧化还原反应?NaOH+HCl==NaCl+H2O√ × × √ √ × 复习基本反应类型:化合反应:A+B=AB
分解反应:AB=A+B
置换反应:A+BC=AC+B
复分解反应:AB+CD=AD+CB有单质参加的化合反应有单质生成的分解反应所有的置换反应氧化还原反应所有的复分解反应都不是氧化还原反应氧化—还原反应与化学基本反应类型的关系化学反应 氧化还原反应与四种
基本反应类型的关系〖小结〗复分解反应分解反应化合反应置换反应〖做一做〗 Cu + Cl2 CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
Cl2 + H2O== HCl + HClO 下列化学反应中,哪些属
于氧化还原反应?为什么?√
√
×
√哪些元素的化合价升高了?哪些元素的化合价
降低了?指出含有这些元素的具体物质。〖概括·整合〗实质 元素(判断依据) 反应过程 反应物 反应物性质
失e- → 化合价升高 → 氧化反应 → 还原剂 → 还原性
得e- → 化合价降低 → 还原反应 → 氧化剂 → 氧化性 作业:
写出下列反应化学方程式,判断下列反应哪些是氧化还原反应,是氧化还原反应的请标出氧化剂和还原剂
1、铜与氧气反应
2、氧化铜与氢气反应
3、碳酸钙高温分解
4、铁与硫酸铜溶液反应
5、NaCl溶液与AgNO3溶液反应
是不是分解反应?是不是置换反应?是不是复分解反应?是不是离子反应?它属于什么类型的化学反应呢?复习基本反应类型:化合反应:A+B=AB
分解反应:AB=A+B
置换反应:A+BC=AC+B
复分解反应:AB+CD=AD+CB(一)从得氧失氧角度来分析:CuO + H2 == Cu + H2O △CuHOHCuOHH氧化还原反应:得到氧,被氧化(氧化反应) CuO + H2 == Cu + H2O 失去氧,被还原(还原反应)△氧化反应:物质得到氧的反应,如氢气得到氧的反应。 还原反应:物质失去氧的反应,如氧化铜失去氧的反应。 氧化剂:失去氧的物质,如CuO。
还原剂:得到氧的物质,如H2。
(氧化剂)(还原剂)(还原产物)(氧化产物)氧化产物:还原剂被氧化所得的产物,如H2O
还原产物:氧化剂被还原所得的产物,如Cu分类标准:得氧失氧同
时
进
行
氧化反应和还原反应是分别独立进行的吗?思考与交流1.CuO+H2 Cu+H2O,从CuO来看是 反应,从H2来看是 反应。
2.CO2+C 2CO,从CO2来看 是 反应,从C来看是 反应。
3.C+H2O CO+H2,从C来看是 反应,从H2O来看是 反应。
还原反应氧化反应氧化反应还原反应还原反应氧化反应氧化反应和还原反应一定是同时发生!一种物质被氧化,同时另一种物质被还原的反应,叫做氧化还原反应。 思考:Cu+Cl2 === CuCl2是氧化还原反应吗?△+2+20+4CuO + CO === Cu + CO2(二)从化合价升降角度分析:凡是有元素化合价有升降的反应是氧化还原反应结论:得氧——化合价升高——氧化反应
失氧——化合价降低——还原反应 物质所含元素 化合价升高 的 反应 是 氧化反应(被氧化)物质所含元素 化合价降低 的 反应 是 还原反应(被还原)加热(氧化剂)(还原剂)(还原产物)(氧化产物)(二)从化合价升降角度来分析化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应) CuO + H2 === Cu + H2O+2-200+1-2△[定义]有元素化合价升降的化学反应称为氧化还原反应氧化还原反应的特征:反应前后元素化合价发生变化(也是判断依据)。 (氧化剂)(还原剂)(还原产物)(氧化产物)口诀:还原剂------高---氧化
氧化剂--- ---低---还原[氧化还原反应规律] 元素化合价升降总数相等〖交流·探究〗氧化剂和还原剂 所含元素的
化合价降低
的反应物 所含元素的
化合价升高
的反应物 Cu + Cl2 == CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl ==CaCl2+H2O+CO2↑
Cl2 + H2O== HCl + HClO 下列反应中,哪些是氧化剂?哪些是还原剂? 〖做一做〗氧化剂 还原剂 氧化剂 还原剂 既是氧化剂又是还原剂 非氧化还原反应〖交流·探究〗元素的化合价与物质的
氧化性、还原性关系 KMnO4与KI的反应 最高价
只具有氧化性 可作氧化剂最低价
只具有还原性 可作还原剂〖小结〗含有最高价态的元素的物质具有氧化性;
含有最低价态的元素的物质具有还原性;
含有中间价态的元素的物质既有氧化性
又有还原性。 〖做一做〗O2、Cl2、 HNO3、浓H2SO4、Fe3+
Na、Cu、C、 H2、 S2-
HCl 、SO2、H2O2在一般情况下,下列物质在化学反应中
是氧化剂,还是还原剂?〖迁移·应用〗常见的氧化剂和还原剂 活泼金属单质
某些非金属单质
含有较低价态元素的氧化物和盐活泼非金属单质
含有较高价态无素的含氧酸
含有较高价态元素的盐(二)从化合价升降角度来分析化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应)氧化剂 + 还原剂 === 还原产物 + 氧化产物[定义]有元素化合价升降的化学反应称为氧化还原反应氧化还原反应的特征:反应前后元素化合价发生变化(也是判断依据)。 口诀:还原剂------高---氧化
氧化剂--- ---低---还原[氧化还原反应规律] 元素化合价升降总数相等复习:写出下列常见元素的化合价。
H ,O ,C ,
N , Na , K ,
Ag ,Ca ,Mg ,
Zn ,Cu ,Fe ,
Al , S__________ -2,+4,+6+1,-1-1,-2+2,+4-3, +1 , +2,+4,+5 +1+1+2,+3+3+1+2+2+2+1 , +2练习:从化合价升降的角度分析并判断下列反应是否属于氧化还原反应,
1.NH4HCO3 NH3↑+CO2↑+H2O↑
2.CaCl2+Na2CO3 = CaCO3↓+2NaCl
3.2Na+2H2O = 2NaOH+H2 ↑
4.2Na+Cl2 2NaCl
5.2H2+Cl2 2HCl学生活动探究实验: 按要求组装实验,探究氧化还原反应的本质
Zn + CuSO4?= Cu + ZnSO4
1.电流计指针偏转,为什么电流表指针发生偏转,指针偏转说明什么?
2.这是化学反应,为什么会有电流产生,电流产生的原因是什么?引导学生讨论并得出结论
(1)Zn表面有红色物质产生,说明Zn将Cu置换出来。
(2)电流计的指针发生偏转,说明有电流产生,说明反应过程中电子发生定向运动。
(3)氧化还原反应的实质是电子转移。
(4)反应物失去电子,所含元素化合价升高,反应过程称为氧化反应。反应物得到电子,所含元素化合价降低,反应过程称为还原反应。?在氧化还原反应中,为什么发生元素化合价的升降? (即元素化合价变化的实质是什么?) (三)氧化还原反应的实质是什么?在氧化还原反应中,为什么发生元素化合价的升降? (即元素化合价变化的实质是什么?) 分析钠在氯气中燃烧的实验,运用物质的结构观点分析反应过程
2Na+Cl2 2NaCl
2H2 +Cl2 2HCl
化合价的升降是什么原因引起的?如何在上述两个反应中表达出来?(三)氧化还原反应的实质是什么?[问题]化合价的升降是什么原因引起的?NaCl 的形成过程化合价升降的原因:
电子的得失失去e-失去e-后得到e-后Na+ 从电子得失角度分析:(三)从电子得失角度来分析得到2 e-,化合价降低,被还原(还原反应)失去2 ×e-,化合价升高,被氧化(氧化反应) CuO + H2 === Cu + H2O+2-200+1-2△氧化还原反应的本质:电子转移(得失或偏移)(氧化剂)(还原剂)(还原产物)(氧化产物)口诀:还原剂---失---高---氧化
氧化剂--- 得---低---还原 本质定义:有电子转移(得失或偏移)的化学反应都是 氧化还原反应。[氧化还原反应原则] 得失电子总数守恒(相等)〖交流·探究〗从电子转移的观点说明氧化剂、还原剂的实质是什么? 失e-的反应物 → 所含元素化合价升高→
发生氧化反应→是还原剂→具有还原性得e-的反应物 → 所含元素化合价降低→
发生还原反应→是氧化剂→具有氧化性使氧化剂发生还原反应的性质 使还原剂发生氧化反应的性质
学会比较,学会总结失电子化合价升高被氧化还原剂得电子化合价降低被还原氧化剂(实质) ( 特征)(变化)(反应物)还原性氧化性(性质)口诀:还原剂---失---高---氧化
氧化剂--- 得---低---还原氧化反应(反应)还原反应生成氧化产物生成还原产物(产物)〖小结〗⑴化合价升降是氧化还原反应的标志;
⑵氧化还原反应的实质是电子转移 ;
(3)氧化还原反应的规律之一:得失电子总数守恒、 化合价升降总数相等
(4)还原剂→失e- → 化合价升高 → 发生氧化反应
氧化剂→得e- → 化合价降低 → 发生 还原反应口诀:还原剂---失---高---氧化
氧化剂--- 得---低---还原得到氧的反应失去氧的反应得氧失氧同时发生有氧得失的反应化合价升高的反应化合价降低的反应化合价升高降低同时发生且总数相等有化合价升降的反应失去电子的反应(或电子对偏离)得到电子的反应(或电子对偏向)得失电子同时发生(且得失电子总数相等)有电子转移的反应不完善有一定局限性特征(表现) 本质总 结练习:
1、下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡是有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的转移(得失或偏移)
BDCaO + H2O === Ca(OH) 2Fe+CuSO4 == Cu+FeSO4〖练习〗判断下列哪些是氧化还原反应?NaOH+HCl==NaCl+H2O√ × × √ √ × 复习基本反应类型:化合反应:A+B=AB
分解反应:AB=A+B
置换反应:A+BC=AC+B
复分解反应:AB+CD=AD+CB有单质参加的化合反应有单质生成的分解反应所有的置换反应氧化还原反应所有的复分解反应都不是氧化还原反应氧化—还原反应与化学基本反应类型的关系化学反应 氧化还原反应与四种
基本反应类型的关系〖小结〗复分解反应分解反应化合反应置换反应〖做一做〗 Cu + Cl2 CuCl2
Zn + H2SO4 == ZnSO4 + H2↑
CaCO3+ 2HCl == CaCl2+H2O+CO2↑
Cl2 + H2O== HCl + HClO 下列化学反应中,哪些属
于氧化还原反应?为什么?√
√
×
√哪些元素的化合价升高了?哪些元素的化合价
降低了?指出含有这些元素的具体物质。〖概括·整合〗实质 元素(判断依据) 反应过程 反应物 反应物性质
失e- → 化合价升高 → 氧化反应 → 还原剂 → 还原性
得e- → 化合价降低 → 还原反应 → 氧化剂 → 氧化性 作业:
写出下列反应化学方程式,判断下列反应哪些是氧化还原反应,是氧化还原反应的请标出氧化剂和还原剂
1、铜与氧气反应
2、氧化铜与氢气反应
3、碳酸钙高温分解
4、铁与硫酸铜溶液反应
5、NaCl溶液与AgNO3溶液反应
