2017春人教版九年级化学下册同步教学课件:第8单元 实验活动4 金属的物理性质和某些化学性质
文档属性
| 名称 | 2017春人教版九年级化学下册同步教学课件:第8单元 实验活动4 金属的物理性质和某些化学性质 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-03-03 00:00:00 | ||
图片预览





文档简介
课件17张PPT。铁锈蚀的条件铁同时与空气中的氧气、水蒸气接触生成的铁锈不阻碍继续反应防止锈蚀
的建议1.保持铁制品表面洁净干燥2.涂上一层保护膜3.镀上其它金属或生成氧化膜 讨论自行车的支架、链条、钢圈等分别采取了
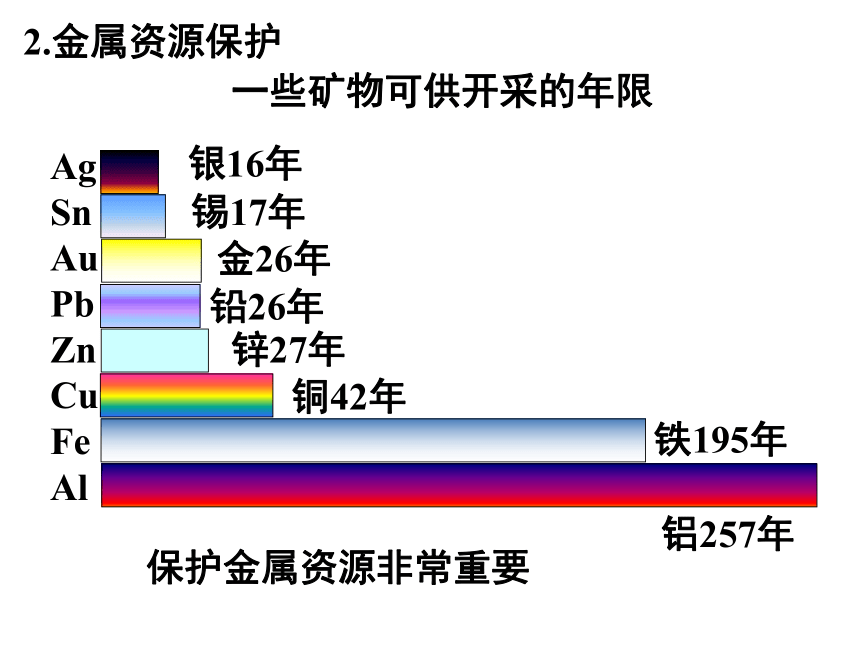
什么防锈措施?涂油漆、涂润滑油、镀镍或铬复习回顾:2.金属资源保护一些矿物可供开采的年限Ag
Sn
Au
Pb
Zn
Cu
Fe
Al保护金属资源非常重要保护金属资源1.防止金属腐蚀2.回收利用废旧金属3.合理有效地开采矿物4.寻找金属的代替品实验活动4
金属的物理性质和某些化学性质【实验目的】
1. 巩固和加深对金属性质的认识。
2. 培养实验设计能力。【实验用品】
试管、试管夹、酒精灯、电池、导线、小灯泡、火柴。
镁条、锌粒、铝片、铁片、铁粉、铜片、黄铜片(或白铜片)、稀盐酸、稀硫酸、硫酸铜溶液、硝酸银溶液。
你还需要的实验用品: . 【实验步骤】
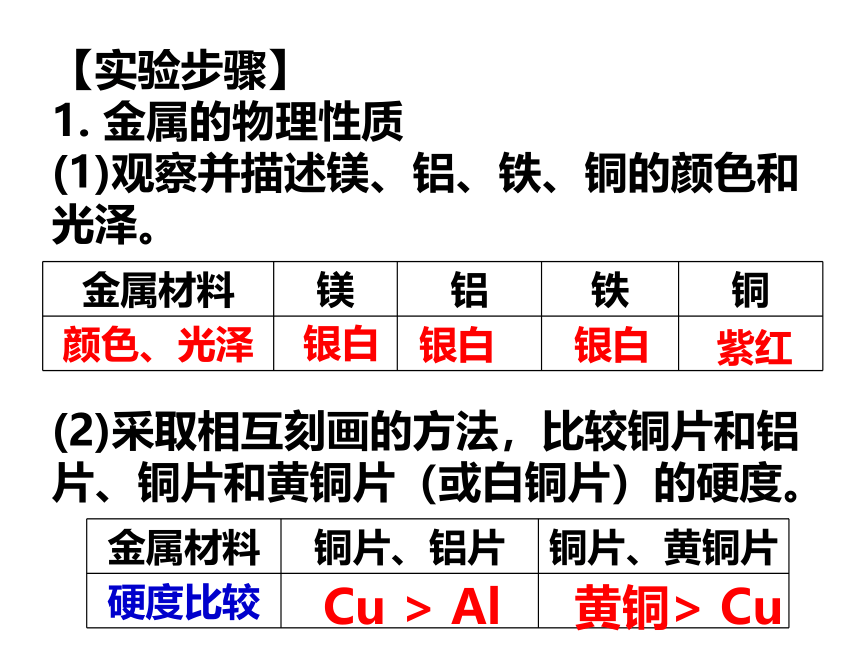
1. 金属的物理性质
(1)观察并描述镁、铝、铁、铜的颜色和光泽。
(2)采取相互刻画的方法,比较铜片和铝片、铜片和黄铜片(或白铜片)的硬度。银白银白银白紫红Cu > Al黄铜> Cu(3)请你设计并进行实验,证明金属具有导电性(或导热性、延展性)。热和电的良导体,具有延展性2. 金属的化学性质
(1)用坩埚钳夹取一块铜片,放在酒精灯火焰上加热,观察铜片表面的变化。铜片表面变黑(2)向5支试管中分别放入少量镁条、铝片、锌粒、铁片、铜片,然后分别加入5mL稀盐酸(或稀硫酸),观察现象。如果有气体生成,判断生成的气体是什么。缓慢反应,有极少量气泡产生没有明显变化很快反应,产生大量的气泡迅速剧烈反应,产生大量的气泡剧烈反应,产生大量的气泡【问题与交流】
铁是银白色金属。在上述实验中,你观察到的铁片和铁粉是什么颜色的?你有什么问题?查阅资料,与同学交流。铁粉:灰黑色
铁片:银白色因为铁粉比较细,光学原因造成漫反射,有很少的光可以进入我们的眼睛,所以铁粉显黑色。(3)请你设计并进行实验,比较铁、铜、银的金属活动性强弱。将铁片插入硫酸铜溶液中铁片表面有红色物质产生铁>铜将铜片插入硝酸银溶液中铜片表面有银白色物质产生铜>银结论:铁>铜>银课堂小结
1、金属材料包含金属和合金两大类;金属材料共同的物理性质:具有 ,是 和 的良导体,绝大多数金属呈 色,除 外,常温下是固体,熔点和沸点较 ,具有较好的延展性
2、合金与纯金属比较一般强度和硬度 ,熔点 ,抗腐蚀性 ,合金一般属于 物;3、金属的化学性质:
(1)能与氧气发生反应。
举例: 。
(写化学方程式,下同)
(2)能与酸(溶液中)发生置换反应。
规律:
金属+酸(稀盐酸、稀硫酸)→ 盐+氢气
(3)能与盐(溶液中)发生置换反应。
规律:金属甲+盐(溶液中)→ 新盐+金属乙(活动性:甲>乙)
举例: 。
(古代湿法冶铜)一、写出下列反应的化学方程式
1.天然气燃烧
2.乙醇燃烧
3.实验室制取氢气
4.生石灰放入水中
5.铁钉放入硫酸铜溶液中
6.铜丝放入硝酸银溶液中
7. 铝片放入稀盐酸中
8.铁矿石(赤铁矿)冶炼铁原理
二、常见金属的活动性顺序表(用符号表示)
1、某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相同的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如图表示。下列对该图象理解的叙述中,正确的是 ( )
A、金属的活动性由强到弱:X、Z、Y
B、金属的活动性由强到弱:X、Y、Z
C、X、Y、Z依次可能是Mg、Zn、Fe
D、相对原子质量的大小:Z > Y > X多选AD2、常温下,Fe、Cu、Zn、Mg四种金属分别放入相同浓度的稀盐酸中,如下图,金属在酸中减少的情况与时间关系,则四条线表示的四种金属依次为:Mg Zn Fe Cu应用:除去铜粉中混有铁粉的方法用磁铁将铁粉吸引出来加足量硫酸铜溶液,充分反应后过滤加足量稀盐酸,充分反应后过滤有气泡冒出,溶液变为浅绿色粉末全部变为红色,蓝色溶液变成浅绿色Fe+ 2HCl = FeCl2+H2↑Fe + CuSO4 =FeSO4+Cu
的建议1.保持铁制品表面洁净干燥2.涂上一层保护膜3.镀上其它金属或生成氧化膜 讨论自行车的支架、链条、钢圈等分别采取了
什么防锈措施?涂油漆、涂润滑油、镀镍或铬复习回顾:2.金属资源保护一些矿物可供开采的年限Ag
Sn
Au
Pb
Zn
Cu
Fe
Al保护金属资源非常重要保护金属资源1.防止金属腐蚀2.回收利用废旧金属3.合理有效地开采矿物4.寻找金属的代替品实验活动4
金属的物理性质和某些化学性质【实验目的】
1. 巩固和加深对金属性质的认识。
2. 培养实验设计能力。【实验用品】
试管、试管夹、酒精灯、电池、导线、小灯泡、火柴。
镁条、锌粒、铝片、铁片、铁粉、铜片、黄铜片(或白铜片)、稀盐酸、稀硫酸、硫酸铜溶液、硝酸银溶液。
你还需要的实验用品: . 【实验步骤】
1. 金属的物理性质
(1)观察并描述镁、铝、铁、铜的颜色和光泽。
(2)采取相互刻画的方法,比较铜片和铝片、铜片和黄铜片(或白铜片)的硬度。银白银白银白紫红Cu > Al黄铜> Cu(3)请你设计并进行实验,证明金属具有导电性(或导热性、延展性)。热和电的良导体,具有延展性2. 金属的化学性质
(1)用坩埚钳夹取一块铜片,放在酒精灯火焰上加热,观察铜片表面的变化。铜片表面变黑(2)向5支试管中分别放入少量镁条、铝片、锌粒、铁片、铜片,然后分别加入5mL稀盐酸(或稀硫酸),观察现象。如果有气体生成,判断生成的气体是什么。缓慢反应,有极少量气泡产生没有明显变化很快反应,产生大量的气泡迅速剧烈反应,产生大量的气泡剧烈反应,产生大量的气泡【问题与交流】
铁是银白色金属。在上述实验中,你观察到的铁片和铁粉是什么颜色的?你有什么问题?查阅资料,与同学交流。铁粉:灰黑色
铁片:银白色因为铁粉比较细,光学原因造成漫反射,有很少的光可以进入我们的眼睛,所以铁粉显黑色。(3)请你设计并进行实验,比较铁、铜、银的金属活动性强弱。将铁片插入硫酸铜溶液中铁片表面有红色物质产生铁>铜将铜片插入硝酸银溶液中铜片表面有银白色物质产生铜>银结论:铁>铜>银课堂小结
1、金属材料包含金属和合金两大类;金属材料共同的物理性质:具有 ,是 和 的良导体,绝大多数金属呈 色,除 外,常温下是固体,熔点和沸点较 ,具有较好的延展性
2、合金与纯金属比较一般强度和硬度 ,熔点 ,抗腐蚀性 ,合金一般属于 物;3、金属的化学性质:
(1)能与氧气发生反应。
举例: 。
(写化学方程式,下同)
(2)能与酸(溶液中)发生置换反应。
规律:
金属+酸(稀盐酸、稀硫酸)→ 盐+氢气
(3)能与盐(溶液中)发生置换反应。
规律:金属甲+盐(溶液中)→ 新盐+金属乙(活动性:甲>乙)
举例: 。
(古代湿法冶铜)一、写出下列反应的化学方程式
1.天然气燃烧
2.乙醇燃烧
3.实验室制取氢气
4.生石灰放入水中
5.铁钉放入硫酸铜溶液中
6.铜丝放入硝酸银溶液中
7. 铝片放入稀盐酸中
8.铁矿石(赤铁矿)冶炼铁原理
二、常见金属的活动性顺序表(用符号表示)
1、某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相同的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如图表示。下列对该图象理解的叙述中,正确的是 ( )
A、金属的活动性由强到弱:X、Z、Y
B、金属的活动性由强到弱:X、Y、Z
C、X、Y、Z依次可能是Mg、Zn、Fe
D、相对原子质量的大小:Z > Y > X多选AD2、常温下,Fe、Cu、Zn、Mg四种金属分别放入相同浓度的稀盐酸中,如下图,金属在酸中减少的情况与时间关系,则四条线表示的四种金属依次为:Mg Zn Fe Cu应用:除去铜粉中混有铁粉的方法用磁铁将铁粉吸引出来加足量硫酸铜溶液,充分反应后过滤加足量稀盐酸,充分反应后过滤有气泡冒出,溶液变为浅绿色粉末全部变为红色,蓝色溶液变成浅绿色Fe+ 2HCl = FeCl2+H2↑Fe + CuSO4 =FeSO4+Cu
同课章节目录
