第二章《化学反应与能量》检测试卷A
文档属性
| 名称 | 第二章《化学反应与能量》检测试卷A |
|
|
| 格式 | zip | ||
| 文件大小 | 221.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-03-06 00:00:00 | ||
图片预览


文档简介
第二章《化学反应与能量》检测试卷A
考试时间:90分钟 满分:100分
第Ⅰ卷(选择题,共48分)
一、选择题(每小题3分,共48分。每小题只有一个选项符合题意)
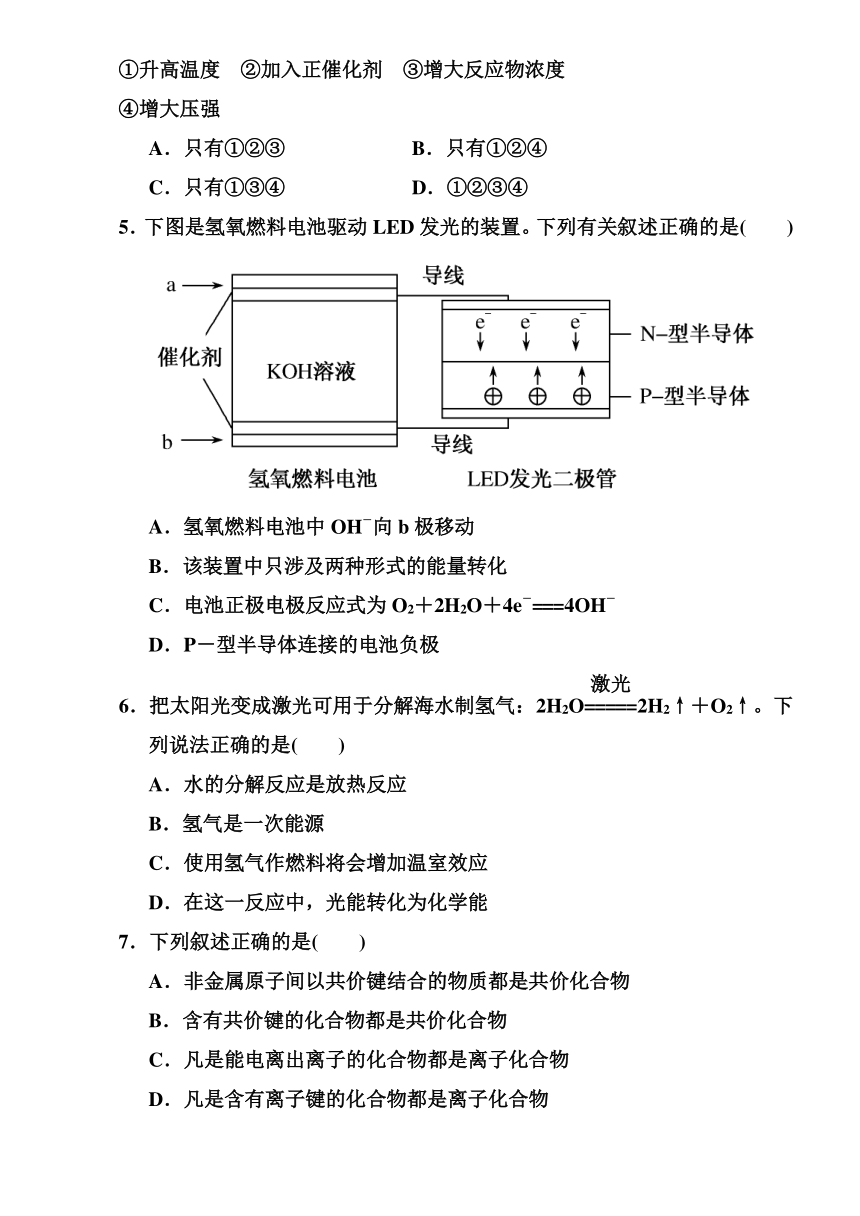
1.下列说法中不正确的是( )
A.吸热反应不一定需要加热条件
B.放热反应只有化学键的形成,没有化学键的断开
C.化学反应除了生成新物质外,还伴随着能量的转化
D.稀酸和稀碱发生中和反应生成1
mol水所释放的热量称为中和热
2.未来新能源的特点是来源丰富,在使用时对环境无污染或污染很小,且可以再生。下列满足未来新能源标准的是( )
①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能
⑥风能 ⑦氢
A.①②③④
B.④⑤⑥⑦
C.③⑤⑥⑦
D.③④⑤⑥⑦
3.下列图示变化为吸热反应的是( )
4.工业上用H2和N2直接合成氨:N2+3H2??2NH3,下列措施肯定能使合成氨反应速率加快的是( )
①升高温度 ②加入正催化剂 ③增大反应物浓度
④增大压强
A.只有①②③
B.只有①②④
C.只有①③④
D.①②③④
5.下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )
A.氢氧燃料电池中OH-向b极移动
B.该装置中只涉及两种形式的能量转化
C.电池正极电极反应式为O2+2H2O+4e-===4OH-
D.P-型半导体连接的电池负极
6.把太阳光变成激光可用于分解海水制氢气:2H2O2H2↑+O2↑。下列说法正确的是( )
A.水的分解反应是放热反应
B.氢气是一次能源
C.使用氢气作燃料将会增加温室效应
D.在这一反应中,光能转化为化学能
7.下列叙述正确的是( )
A.非金属原子间以共价键结合的物质都是共价化合物
B.含有共价键的化合物都是共价化合物
C.凡是能电离出离子的化合物都是离子化合物
D.凡是含有离子键的化合物都是离子化合物
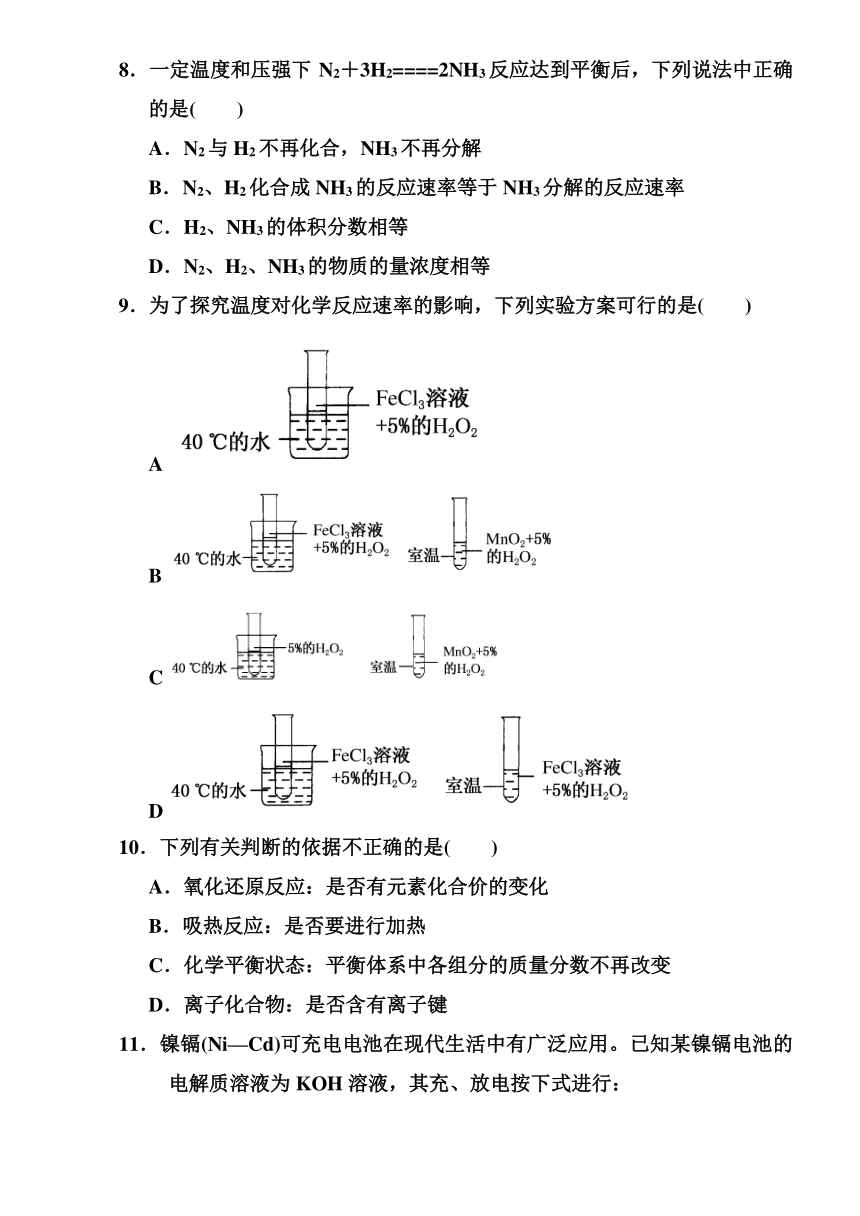
8.一定温度和压强下N2+3H2====2NH3反应达到平衡后,下列说法中正确的是( )
A.N2与H2不再化合,NH3不再分解
B.N2、H2化合成NH3的反应速率等于NH3分解的反应速率
C.H2、NH3的体积分数相等
D.N2、H2、NH3的物质的量浓度相等
9.为了探究温度对化学反应速率的影响,下列实验方案可行的是( )
A
B
C
D
10.下列有关判断的依据不正确的是( )
A.氧化还原反应:是否有元素化合价的变化
B.吸热反应:是否要进行加热
C.化学平衡状态:平衡体系中各组分的质量分数不再改变
D.离子化合物:是否含有离子键
11.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2
有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
12.根据下列事实:①A+B2+===A
( http: / / www.21cnjy.com )2++B ②D+2H2O===D(OH)2+H2↑ ③以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e-===E,B-2e-===B2+。由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是( )
A.D2+>A2+>B2+>E2+
B.A2+>B2+>D2+>E2+
C.D2+>E2+>A2+>B2+
D.E2+>B2+>A2+>D2+
13.对于反应A(g)+B(g)??3C(g)(正反应为放热反应),下述为平衡状态标志的是( )
①单位时间内A、B生成C的分子数与C分解的
( http: / / www.21cnjy.com )分子数相等 ②外界条件不变时,A、B、C浓度不随时间变化 ③体系温度不再变化 ④体系的压强不再变化 ⑤体系的分子总数不再变化
A.①②
B.①②③
C.①②③④
D.①②③④⑤
14.在恒温、恒容的密闭容器中进行反应A(
( http: / / www.21cnjy.com )g)??B(g)+C(g),若反应物的浓度由2
mol·L-1降到0.8
mol·L-1需要20
s,那么反应物浓度再由0.8
mol·L-1降到0.2
mol·L-1所需要的时间为( )
A.
10
s
B.大于10
s
C.小于10
s
D.无法判断
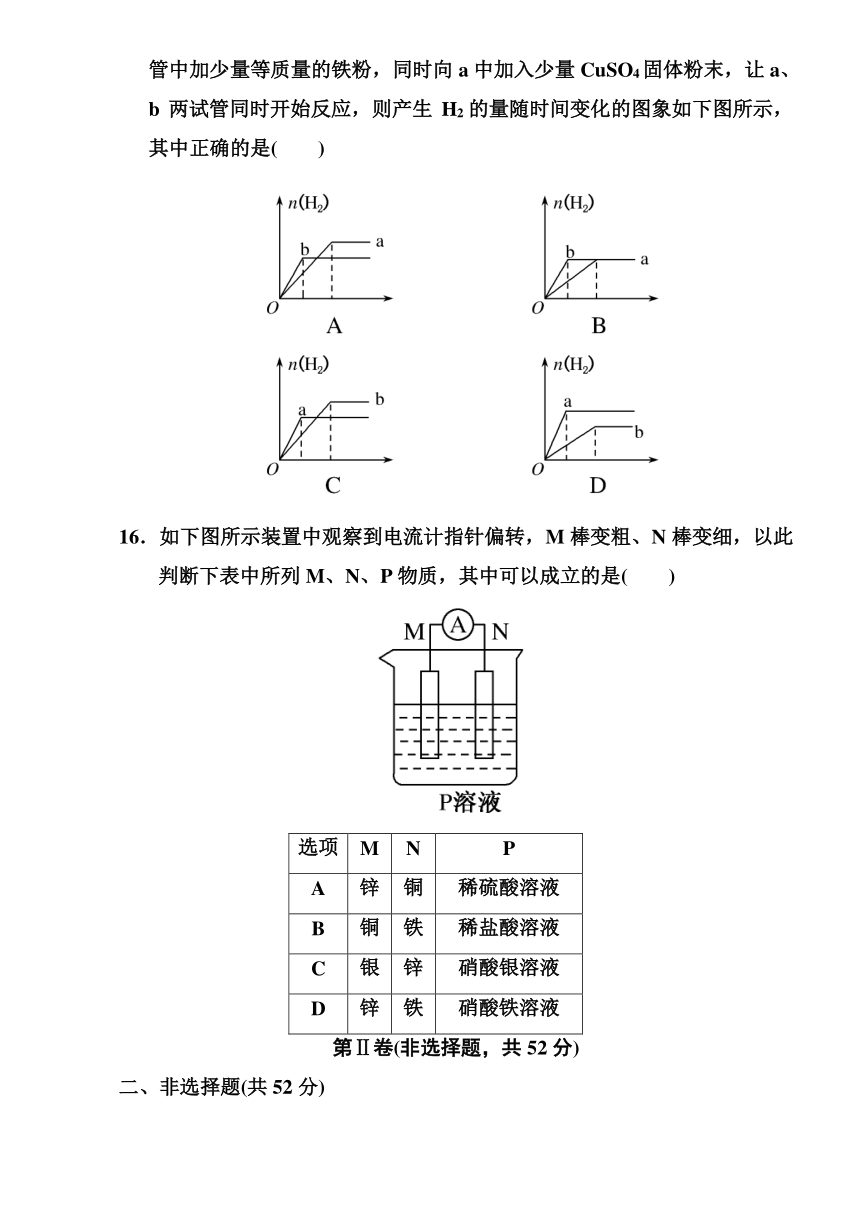
15.a、b两试管中分别盛
( http: / / www.21cnjy.com )装足量等体积、等浓度的盐酸溶液,向a、b两试管中加少量等质量的铁粉,同时向a中加入少量CuSO4固体粉末,让a、b两试管同时开始反应,则产生H2的量随时间变化的图象如下图所示,其中正确的是( )
16.如下图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是( )
选项
M
N
P
A
锌
铜
稀硫酸溶液
B
铜
铁
稀盐酸溶液
C
银
锌
硝酸银溶液
D
锌
铁
硝酸铁溶液
第Ⅱ卷(非选择题,共52分)
二、非选择题(共52分)
17.(8分)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
(1)Zn+Ag2O+H2OZn(OH)2+2Ag______________。
(2)2C2H2+5O24CO2+2H2O______________________。
(3)6H2O+6CO2C6H12O6+6O2____________________。
(4)CaCO3CaO+CO2↑_________________________。
18.(12分)给你提供纯锌、纯铜片和
( http: / / www.21cnjy.com )500
mL
0.4
mol·L-1的H2SO4溶液、导线、1
000
mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
(1)如图所示,装置气密性良好,且
( http: / / www.21cnjy.com )1
000
mL量筒中已充满了水,则开始实验时,首先要_____________________________。
(2)a电极材料为________,其电极反应式为_______________
b电极材料为________,其电极反应式为__________________。
(3)当量筒中收集672
mL气体时(已折算到标准状况下),通过导线的电子的物质的量为________。
19.(10分)士兵在野外加热食物
( http: / / www.21cnjy.com )时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠粉末。使用时加入水与其中的镁反应放出热量。下面是在室温下对本产品的两个探究实验。
实验1:向加有等量水的三个相同隔热容器中分别加入下列各组物质,结果见下图。
①1.0
mol镁条、0.10
mol铁粉、0.10
mol氯化钠粉末;
②将1.0
mol镁条剪成100份、0.10
mol铁粉、0.10
mol
氯化钠粉末;
③1.0
mol镁粉、0.10
mol
铁粉、0.10
mol氯化钠粉末;
实验2:向加有100
mL水的多个相同的隔热
( http: / / www.21cnjy.com )容器中分别加入由0.10
mol镁粉、0.50
mol铁粉及不同量的氯化钠粉末组成的混合物,不断搅拌,第15
min时记录温度升高的幅度,结果见图2。
请回答下列问题:
(1)实验1证实了该反应的反应速率与________有关。
(2)实验2中当NaCl的用量大于0.125
mol时,实验就无须再做的原因是________(填选项字母)。
A.加入更多的NaCl不再增加反应速率
B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化
D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入0.060
mol的NaCl,则第15
min时混合物的温度最接近于________(填字母)。
A.34
℃
B.42
℃
C.50
℃
D.62
℃
(4)加入铁粉和NaCl能
( http: / / www.21cnjy.com )使反应速率加快的原因是_________________________________________________________。
20.(12分)一定温度下,在容积为V
L的密闭容器中进行反应:aN(g)??bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中=________。
(2)t1到t2时刻,以
( http: / / www.21cnjy.com )M的浓度变化表示的平均反应速率为______________________________________________________。
(3)下列叙述中能说明上述反应达到平衡状态的是________。
A.反应中M与N的物质的量之比为1?1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a
mol
N,同时生成b
mol
M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
21.(10分)在一定温度、压强和催化
( http: / / www.21cnjy.com )剂条件下,把N2和H2按1:3(体积比)混合,当反应达到平衡时,混合气体中NH3占25%(体积比),求:
(1)N2的转化率
(2)反应前后体积之比
(3)平衡混合气的平均相对分子质量
第二章《化学反应与能量》检测试卷A答案
一、1.
B解析 无论是放热反应还是吸热反应,只要是化学反应就有化学键的断开和形成。
2.
B解析 天然气、煤、石油均为化石燃料,不可再生且燃烧时有污染。
3.
A解析 A项中反应物总能量低于生
( http: / / www.21cnjy.com )成物总能量,为吸热反应;B项中反应物能量高于生成物能量,为放热反应;C项中浓H2SO4溶于水,是物理过程,不是化学反应;D项中活泼金属与酸反应,为放热反应。
4.
D解析 升温、加入正催化剂,增大反应物浓度,加压均可使化学反应速率加快。
5.
C解析 由图中电子移动方向可
( http: / / www.21cnjy.com )判断a为负极,b为正极,在燃料电池中,阴离子移向负极,故OH-向a极移动,A项错;该装置中涉及化学能→电能→光能等形式的能量转化,B项错;P 型半导体连接的是电池的正极,D项错;只有C项正确。
6.
D解析 水的分解是吸热反应,H2是二次能源,也是清洁能源,不会增加温室效应。
7.
D解析 非金属双原子单质的原子间以
( http: / / www.21cnjy.com )共价键结合,A项错;离子化合物中也可能含有共价键,如NaOH、Na2O2中均含有共价键,B项错;共价化合物在水溶液中也可以电离出离子,如HCl溶于水电离出H+、Cl-,C项错;含离子键的化合物都是离子化合物,D项正确。
8.
B解析 化学平衡是动态平衡,其
( http: / / www.21cnjy.com )本质原因是v正=v逆≠0,在B项中NH3的正逆反应速率相等,故达到平衡;化学平衡状态表现为各物质的物质的量浓度等保持不变,而不是相等。
9.
D解析 探究温度对化学反应速率的影响,应控制其他条件相同,只改变温度这一条件。
10.
B解析 有些放热反应也要进行加热,如碳与O2的反应,判断反应是否吸热应比较反应物与生成物总能量的相对大小。
11.
A解析 充电时Cd(OH)2在
( http: / / www.21cnjy.com )阴极得电子,Ni(OH)2在阳极失电子,A项正确;充电过程是电能转化为化学能,B项错;放电时负极反应为Cd-2e-+2OH-===Cd(OH)2,消耗OH-,碱性减弱,C项错;放电时电解质溶液中OH-向负极移动,D项错。
12.
D解析 由①知氧化性:
( http: / / www.21cnjy.com )B2+>A2+,A能置换出B说明A不与H2O反应;由③知氧化性:E2+>B2+;由②知D比A还原性强,所以氧化性:A2+>D2+,综上所述,E2+>B2+>A2+>D2+。
13.
D解析 ①正、逆反应速率相等;
( http: / / www.21cnjy.com )②浓度不变,说明已达平衡;如果该反应没有达到平衡则反应要和外界有能量的交换,必然导致体系温度改变,③现在体系温度不变,说明已达平衡;由于该反应是一个体积改变的反应,没有达到平衡之前,压强是改变的,分子总数也是改变的,只有平衡了,二者才不再改变,故①②③④⑤均正确。
14.
B解析 当反应物浓度由2
mol/
( http: / / www.21cnjy.com )L降到0.8
mol·L-1时需20s,则反应速率为v=(2
mol/L-0.8
mol/L)÷20s=0.06
mol/(L·s),当由0.8
mol/L降低到0.2
mol/L时,减小0.6
mol/L所用时间=10s。但因随反应进行,反应速率减慢,因而所用时间大于10
s。
15.
C解析 铁和盐酸反应
( http: / / www.21cnjy.com )的离子方程式为Fe+2H+===Fe2++H2↑,加入CuSO4时,发生反应Cu2++Fe===Cu+Fe2+,反应掉少量的Fe,生成的Cu和Fe形成原电池,加快了反应速率,由于盐酸足量,Fe全部反应,a中少量的Fe跟Cu2+反应,减少了同盐酸反应的Fe的量,产生的氢气也就减少了。
16.
C解析 原电池中M棒变粗,N棒
( http: / / www.21cnjy.com )变细,说明N棒溶解作负极,溶液中有金属析出附着在M棒上,M棒作正极。A、B选项中电解质溶液分别为稀H2SO4和稀盐酸,原电池工作时不会析出金属,C项中正极反应式为Ag++e-===Ag,正极变粗,负极反应式Zn-2e-===Zn2+,负极溶解而变细,符合题意;D项中正极反应式为Fe3++e-===Fe2+,没有金属析出,M棒为锌,锌溶解,不会变粗。
二、17.答案 (1)放电时化学能转化为电能,充电时电能转化为化学能
(2)化学能转化为热能和光能
(3)太阳能(光能)转化为化学能
(4)热能转化为化学能
18.答案 (1)用导线把a、b两电极连接起来
(2)纯锌片 Zn-2e-===Zn2+ 纯铜片 2H++2e-===H2↑ (3)0.06
mol
解析 导线中电子的物质的量的测定可以通
( http: / / www.21cnjy.com )过测定反应产生H2的体积(物质的量)来实现。导线中有电子的流动必然形成原电池。因此只有用导线将a、b相连形成闭合回路才能实现。产生H2的电极应为b极,故b为纯铜片,做原电池正极,a极为负极。其电极反应式分别为a极:Zn-2e-===Zn2+;b极:2H++2e-===H2↑,则转移电子为×2=0.06
mol。
19.答案 (1)镁的表面积 (2)C (3)B (4)镁粉、铁粉与NaCl的水溶液构成了原电池,加快了反应速率
解析 (1)实验1中三组物质唯一不同的地
( http: / / www.21cnjy.com )方就是镁的状态,故实验1是研究固体的表面积与速率的关系。(2)由图2可知,NaCl用量达到0.125
mol时,溶液已经达到沸腾状态,当NaCl的用量再增加时,温度不再发生变化,所以无需再做。(3)由图2可见,当加入0.06
mol
NaCl时,第15
min记录的温度升高值在42
℃左右。(4)镁粉、铁粉与NaCl水溶液共同构成了原电池,促进了Mg的反应,加快了反应的速率。
20.答案 (1)2 (2)
mol·(L·min)-1 (3)CEF
解析 由图知,从反应开始到达平衡,N减少6
( http: / / www.21cnjy.com )mol,M增加3
mol,故a/b=2。根据速率的计算公式,用M的浓度的变化表示的平均反应速率为
mol·(L·min)-1,当混合气体的总物质的量、混合气体的压强都不随时间的变化而变化,各物质的质量分数在混合气体中保持不变时,上述反应达到平衡状态。
21.答案 (1)40% (2)5:4 (3)10.6
解析 设N2和H2初始反应时体积为1和3,N2转化的体积为x:
N2 + 3H2=====2NH3
初始:
1
3
0
变化:
x
3x
2x
平衡:
1-x
3-3x
2x
根据题意:×100%=25%,x=0.4,则N2的转化率为40%
反应前后体积之比为(1+3):(4-2×0.4)=5:4
混合气体平均相对分子质量==10.6。
考试时间:90分钟 满分:100分
第Ⅰ卷(选择题,共48分)
一、选择题(每小题3分,共48分。每小题只有一个选项符合题意)
1.下列说法中不正确的是( )
A.吸热反应不一定需要加热条件
B.放热反应只有化学键的形成,没有化学键的断开
C.化学反应除了生成新物质外,还伴随着能量的转化
D.稀酸和稀碱发生中和反应生成1
mol水所释放的热量称为中和热
2.未来新能源的特点是来源丰富,在使用时对环境无污染或污染很小,且可以再生。下列满足未来新能源标准的是( )
①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能
⑥风能 ⑦氢
A.①②③④
B.④⑤⑥⑦
C.③⑤⑥⑦
D.③④⑤⑥⑦
3.下列图示变化为吸热反应的是( )
4.工业上用H2和N2直接合成氨:N2+3H2??2NH3,下列措施肯定能使合成氨反应速率加快的是( )
①升高温度 ②加入正催化剂 ③增大反应物浓度
④增大压强
A.只有①②③
B.只有①②④
C.只有①③④
D.①②③④
5.下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )
A.氢氧燃料电池中OH-向b极移动
B.该装置中只涉及两种形式的能量转化
C.电池正极电极反应式为O2+2H2O+4e-===4OH-
D.P-型半导体连接的电池负极
6.把太阳光变成激光可用于分解海水制氢气:2H2O2H2↑+O2↑。下列说法正确的是( )
A.水的分解反应是放热反应
B.氢气是一次能源
C.使用氢气作燃料将会增加温室效应
D.在这一反应中,光能转化为化学能
7.下列叙述正确的是( )
A.非金属原子间以共价键结合的物质都是共价化合物
B.含有共价键的化合物都是共价化合物
C.凡是能电离出离子的化合物都是离子化合物
D.凡是含有离子键的化合物都是离子化合物
8.一定温度和压强下N2+3H2====2NH3反应达到平衡后,下列说法中正确的是( )
A.N2与H2不再化合,NH3不再分解
B.N2、H2化合成NH3的反应速率等于NH3分解的反应速率
C.H2、NH3的体积分数相等
D.N2、H2、NH3的物质的量浓度相等
9.为了探究温度对化学反应速率的影响,下列实验方案可行的是( )
A
B
C
D
10.下列有关判断的依据不正确的是( )
A.氧化还原反应:是否有元素化合价的变化
B.吸热反应:是否要进行加热
C.化学平衡状态:平衡体系中各组分的质量分数不再改变
D.离子化合物:是否含有离子键
11.镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2
有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
12.根据下列事实:①A+B2+===A
( http: / / www.21cnjy.com )2++B ②D+2H2O===D(OH)2+H2↑ ③以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e-===E,B-2e-===B2+。由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是( )
A.D2+>A2+>B2+>E2+
B.A2+>B2+>D2+>E2+
C.D2+>E2+>A2+>B2+
D.E2+>B2+>A2+>D2+
13.对于反应A(g)+B(g)??3C(g)(正反应为放热反应),下述为平衡状态标志的是( )
①单位时间内A、B生成C的分子数与C分解的
( http: / / www.21cnjy.com )分子数相等 ②外界条件不变时,A、B、C浓度不随时间变化 ③体系温度不再变化 ④体系的压强不再变化 ⑤体系的分子总数不再变化
A.①②
B.①②③
C.①②③④
D.①②③④⑤
14.在恒温、恒容的密闭容器中进行反应A(
( http: / / www.21cnjy.com )g)??B(g)+C(g),若反应物的浓度由2
mol·L-1降到0.8
mol·L-1需要20
s,那么反应物浓度再由0.8
mol·L-1降到0.2
mol·L-1所需要的时间为( )
A.
10
s
B.大于10
s
C.小于10
s
D.无法判断
15.a、b两试管中分别盛
( http: / / www.21cnjy.com )装足量等体积、等浓度的盐酸溶液,向a、b两试管中加少量等质量的铁粉,同时向a中加入少量CuSO4固体粉末,让a、b两试管同时开始反应,则产生H2的量随时间变化的图象如下图所示,其中正确的是( )
16.如下图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是( )
选项
M
N
P
A
锌
铜
稀硫酸溶液
B
铜
铁
稀盐酸溶液
C
银
锌
硝酸银溶液
D
锌
铁
硝酸铁溶液
第Ⅱ卷(非选择题,共52分)
二、非选择题(共52分)
17.(8分)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
(1)Zn+Ag2O+H2OZn(OH)2+2Ag______________。
(2)2C2H2+5O24CO2+2H2O______________________。
(3)6H2O+6CO2C6H12O6+6O2____________________。
(4)CaCO3CaO+CO2↑_________________________。
18.(12分)给你提供纯锌、纯铜片和
( http: / / www.21cnjy.com )500
mL
0.4
mol·L-1的H2SO4溶液、导线、1
000
mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
(1)如图所示,装置气密性良好,且
( http: / / www.21cnjy.com )1
000
mL量筒中已充满了水,则开始实验时,首先要_____________________________。
(2)a电极材料为________,其电极反应式为_______________
b电极材料为________,其电极反应式为__________________。
(3)当量筒中收集672
mL气体时(已折算到标准状况下),通过导线的电子的物质的量为________。
19.(10分)士兵在野外加热食物
( http: / / www.21cnjy.com )时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠粉末。使用时加入水与其中的镁反应放出热量。下面是在室温下对本产品的两个探究实验。
实验1:向加有等量水的三个相同隔热容器中分别加入下列各组物质,结果见下图。
①1.0
mol镁条、0.10
mol铁粉、0.10
mol氯化钠粉末;
②将1.0
mol镁条剪成100份、0.10
mol铁粉、0.10
mol
氯化钠粉末;
③1.0
mol镁粉、0.10
mol
铁粉、0.10
mol氯化钠粉末;
实验2:向加有100
mL水的多个相同的隔热
( http: / / www.21cnjy.com )容器中分别加入由0.10
mol镁粉、0.50
mol铁粉及不同量的氯化钠粉末组成的混合物,不断搅拌,第15
min时记录温度升高的幅度,结果见图2。
请回答下列问题:
(1)实验1证实了该反应的反应速率与________有关。
(2)实验2中当NaCl的用量大于0.125
mol时,实验就无须再做的原因是________(填选项字母)。
A.加入更多的NaCl不再增加反应速率
B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化
D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入0.060
mol的NaCl,则第15
min时混合物的温度最接近于________(填字母)。
A.34
℃
B.42
℃
C.50
℃
D.62
℃
(4)加入铁粉和NaCl能
( http: / / www.21cnjy.com )使反应速率加快的原因是_________________________________________________________。
20.(12分)一定温度下,在容积为V
L的密闭容器中进行反应:aN(g)??bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中=________。
(2)t1到t2时刻,以
( http: / / www.21cnjy.com )M的浓度变化表示的平均反应速率为______________________________________________________。
(3)下列叙述中能说明上述反应达到平衡状态的是________。
A.反应中M与N的物质的量之比为1?1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a
mol
N,同时生成b
mol
M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
21.(10分)在一定温度、压强和催化
( http: / / www.21cnjy.com )剂条件下,把N2和H2按1:3(体积比)混合,当反应达到平衡时,混合气体中NH3占25%(体积比),求:
(1)N2的转化率
(2)反应前后体积之比
(3)平衡混合气的平均相对分子质量
第二章《化学反应与能量》检测试卷A答案
一、1.
B解析 无论是放热反应还是吸热反应,只要是化学反应就有化学键的断开和形成。
2.
B解析 天然气、煤、石油均为化石燃料,不可再生且燃烧时有污染。
3.
A解析 A项中反应物总能量低于生
( http: / / www.21cnjy.com )成物总能量,为吸热反应;B项中反应物能量高于生成物能量,为放热反应;C项中浓H2SO4溶于水,是物理过程,不是化学反应;D项中活泼金属与酸反应,为放热反应。
4.
D解析 升温、加入正催化剂,增大反应物浓度,加压均可使化学反应速率加快。
5.
C解析 由图中电子移动方向可
( http: / / www.21cnjy.com )判断a为负极,b为正极,在燃料电池中,阴离子移向负极,故OH-向a极移动,A项错;该装置中涉及化学能→电能→光能等形式的能量转化,B项错;P 型半导体连接的是电池的正极,D项错;只有C项正确。
6.
D解析 水的分解是吸热反应,H2是二次能源,也是清洁能源,不会增加温室效应。
7.
D解析 非金属双原子单质的原子间以
( http: / / www.21cnjy.com )共价键结合,A项错;离子化合物中也可能含有共价键,如NaOH、Na2O2中均含有共价键,B项错;共价化合物在水溶液中也可以电离出离子,如HCl溶于水电离出H+、Cl-,C项错;含离子键的化合物都是离子化合物,D项正确。
8.
B解析 化学平衡是动态平衡,其
( http: / / www.21cnjy.com )本质原因是v正=v逆≠0,在B项中NH3的正逆反应速率相等,故达到平衡;化学平衡状态表现为各物质的物质的量浓度等保持不变,而不是相等。
9.
D解析 探究温度对化学反应速率的影响,应控制其他条件相同,只改变温度这一条件。
10.
B解析 有些放热反应也要进行加热,如碳与O2的反应,判断反应是否吸热应比较反应物与生成物总能量的相对大小。
11.
A解析 充电时Cd(OH)2在
( http: / / www.21cnjy.com )阴极得电子,Ni(OH)2在阳极失电子,A项正确;充电过程是电能转化为化学能,B项错;放电时负极反应为Cd-2e-+2OH-===Cd(OH)2,消耗OH-,碱性减弱,C项错;放电时电解质溶液中OH-向负极移动,D项错。
12.
D解析 由①知氧化性:
( http: / / www.21cnjy.com )B2+>A2+,A能置换出B说明A不与H2O反应;由③知氧化性:E2+>B2+;由②知D比A还原性强,所以氧化性:A2+>D2+,综上所述,E2+>B2+>A2+>D2+。
13.
D解析 ①正、逆反应速率相等;
( http: / / www.21cnjy.com )②浓度不变,说明已达平衡;如果该反应没有达到平衡则反应要和外界有能量的交换,必然导致体系温度改变,③现在体系温度不变,说明已达平衡;由于该反应是一个体积改变的反应,没有达到平衡之前,压强是改变的,分子总数也是改变的,只有平衡了,二者才不再改变,故①②③④⑤均正确。
14.
B解析 当反应物浓度由2
mol/
( http: / / www.21cnjy.com )L降到0.8
mol·L-1时需20s,则反应速率为v=(2
mol/L-0.8
mol/L)÷20s=0.06
mol/(L·s),当由0.8
mol/L降低到0.2
mol/L时,减小0.6
mol/L所用时间=10s。但因随反应进行,反应速率减慢,因而所用时间大于10
s。
15.
C解析 铁和盐酸反应
( http: / / www.21cnjy.com )的离子方程式为Fe+2H+===Fe2++H2↑,加入CuSO4时,发生反应Cu2++Fe===Cu+Fe2+,反应掉少量的Fe,生成的Cu和Fe形成原电池,加快了反应速率,由于盐酸足量,Fe全部反应,a中少量的Fe跟Cu2+反应,减少了同盐酸反应的Fe的量,产生的氢气也就减少了。
16.
C解析 原电池中M棒变粗,N棒
( http: / / www.21cnjy.com )变细,说明N棒溶解作负极,溶液中有金属析出附着在M棒上,M棒作正极。A、B选项中电解质溶液分别为稀H2SO4和稀盐酸,原电池工作时不会析出金属,C项中正极反应式为Ag++e-===Ag,正极变粗,负极反应式Zn-2e-===Zn2+,负极溶解而变细,符合题意;D项中正极反应式为Fe3++e-===Fe2+,没有金属析出,M棒为锌,锌溶解,不会变粗。
二、17.答案 (1)放电时化学能转化为电能,充电时电能转化为化学能
(2)化学能转化为热能和光能
(3)太阳能(光能)转化为化学能
(4)热能转化为化学能
18.答案 (1)用导线把a、b两电极连接起来
(2)纯锌片 Zn-2e-===Zn2+ 纯铜片 2H++2e-===H2↑ (3)0.06
mol
解析 导线中电子的物质的量的测定可以通
( http: / / www.21cnjy.com )过测定反应产生H2的体积(物质的量)来实现。导线中有电子的流动必然形成原电池。因此只有用导线将a、b相连形成闭合回路才能实现。产生H2的电极应为b极,故b为纯铜片,做原电池正极,a极为负极。其电极反应式分别为a极:Zn-2e-===Zn2+;b极:2H++2e-===H2↑,则转移电子为×2=0.06
mol。
19.答案 (1)镁的表面积 (2)C (3)B (4)镁粉、铁粉与NaCl的水溶液构成了原电池,加快了反应速率
解析 (1)实验1中三组物质唯一不同的地
( http: / / www.21cnjy.com )方就是镁的状态,故实验1是研究固体的表面积与速率的关系。(2)由图2可知,NaCl用量达到0.125
mol时,溶液已经达到沸腾状态,当NaCl的用量再增加时,温度不再发生变化,所以无需再做。(3)由图2可见,当加入0.06
mol
NaCl时,第15
min记录的温度升高值在42
℃左右。(4)镁粉、铁粉与NaCl水溶液共同构成了原电池,促进了Mg的反应,加快了反应的速率。
20.答案 (1)2 (2)
mol·(L·min)-1 (3)CEF
解析 由图知,从反应开始到达平衡,N减少6
( http: / / www.21cnjy.com )mol,M增加3
mol,故a/b=2。根据速率的计算公式,用M的浓度的变化表示的平均反应速率为
mol·(L·min)-1,当混合气体的总物质的量、混合气体的压强都不随时间的变化而变化,各物质的质量分数在混合气体中保持不变时,上述反应达到平衡状态。
21.答案 (1)40% (2)5:4 (3)10.6
解析 设N2和H2初始反应时体积为1和3,N2转化的体积为x:
N2 + 3H2=====2NH3
初始:
1
3
0
变化:
x
3x
2x
平衡:
1-x
3-3x
2x
根据题意:×100%=25%,x=0.4,则N2的转化率为40%
反应前后体积之比为(1+3):(4-2×0.4)=5:4
混合气体平均相对分子质量==10.6。
