课题3 溶液的浓度第2课时 溶质的质量分数的综合计算 (12张PPT)
文档属性
| 名称 | 课题3 溶液的浓度第2课时 溶质的质量分数的综合计算 (12张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1013.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-04-06 09:08:08 | ||
图片预览




文档简介
课件12张PPT。第2课时 溶质的质量
分数的综合计算9.3 溶液的浓度第九单元 溶液1课堂讲解溶质质量分数与化学方程式的基础计算、化学方程式与溶质质量分数的综合计算2课时流程课后作业逐点
导讲练课堂小结1知识点溶质质量分数与化学方程式的基础计算知1-导【例1】100g某硫酸溶液恰好与13g锌完全反应。这种硫酸
溶液中溶质的质量分数是多少?
【分析】解本题关键是利用化学方程式先求出溶质硫酸的
质量,然后再求溶液中溶质的质量分数。
解:设这种硫酸溶液中硫酸的质量为x。
Zn+H2SO4=ZnSO4+H2↑
65 98
13g x
x=19.6g
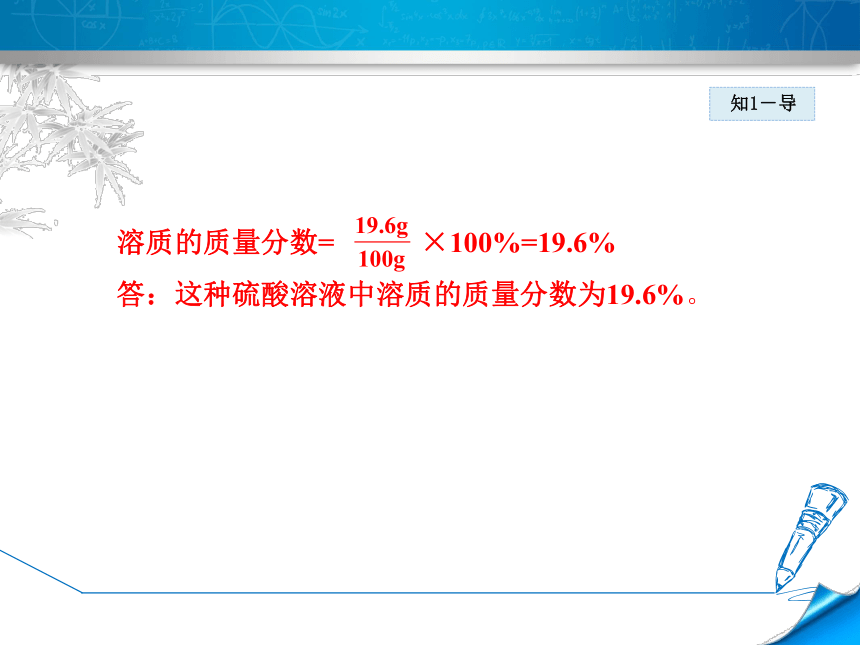
知1-导溶质的质量分数= ×100%=19.6%
答:这种硫酸溶液中溶质的质量分数为19.6%。知1-练1.73 g质量分数为20%的盐酸与足量大理石反应,生成
二氧化碳的质量是多少? 这些二氧化碳的体积(标准
状况)是多少?(在标准状况下,二氧化碳的密度为
1.977g/L。 )2知识点有关溶质的质量分数的简单计算知2-导【例2】25 g含杂质20%的石灰石与100 g一定溶质质量分数
的稀盐酸恰好反应(杂质不溶于水,也不参与反应)。
求:(1)生成的二氧化碳的质量;(2)稀盐酸的溶质质量分数;
(3)反应后所得溶液的溶质质量分数。
导引:根据化学方程式计算时必须将参加反应的纯
净物的质量代入计算。题中25 g、100 g均为混合物知2-讲的质量,不能直接代入计算,可先求出石灰石中碳酸钙的质
量:25 g×(1-20%)=20 g,再利用化学方程式求出生成的
二氧化碳的质量、稀盐酸中溶质的质量、生成的氯化钙的质
量。计算稀盐酸的溶质质量分数时,用稀盐酸中溶质的质量
除以稀盐酸的质量(100 g)再乘以100%即可;反应后所得的溶
液为氯化钙溶液,那么氯化钙溶液的溶质质量分数应该用生
成的氯化钙质量除以氯化钙溶液的质量再乘以100%,而氯
化钙溶液的质量可以用质量守恒定律求出。知2-讲解:设生成的CO2质量为x,参加反应的HCl质量为y,生成的氯
化钙质量为z。参加反应的CaCO3:25 g×80%=20 g。
CaCO3+2HCl===CaCl2+CO2↑+H2O
100 73 111 44
20g y z x
x=8.8 g,y=14.6 g,z=22.2 g
(1)生成CO28.8 g。
(2)稀盐酸中溶质质量分数为: ×100%=14.6%。
(3)反应后所得溶液的溶质质量分数为:
×100%≈20.0%。
答:(1)生成8.8 g CO2;(2)稀盐酸的溶质质量分数为14.6%;(3)反应后所得溶液的溶质质量分数为20.0%。知2-讲总 结求反应后溶液的质量的方法通常有两种:一是质量守恒
法。反应物的质量总和减去生成的气体或沉淀质量,但
要注意难溶于水的杂质也要减掉;二是定义法。即溶质
质量加溶剂质量,溶剂一般为反应前溶液中的溶剂,若
反应中有水生成,生成的水也是溶剂的一部分。知2-练1.(2016·长沙)实验室取68 g过氧化氢溶液和2 g二氧化锰混
合制取氧气,充分反应后,称量剩余溶液和滤渣为68.4 g。
求:
(1)充分反应后,生成氧气的质量为________g;
(2)参加反应的过氧化氢溶液中溶质的质量分数。 第2课时 溶质的质量分数的综合计算
一、溶质质量分数与化学方程式的基础计算
二、化学方程式与溶质质量分数的综合计算请完成练习册剩余习题
分数的综合计算9.3 溶液的浓度第九单元 溶液1课堂讲解溶质质量分数与化学方程式的基础计算、化学方程式与溶质质量分数的综合计算2课时流程课后作业逐点
导讲练课堂小结1知识点溶质质量分数与化学方程式的基础计算知1-导【例1】100g某硫酸溶液恰好与13g锌完全反应。这种硫酸
溶液中溶质的质量分数是多少?
【分析】解本题关键是利用化学方程式先求出溶质硫酸的
质量,然后再求溶液中溶质的质量分数。
解:设这种硫酸溶液中硫酸的质量为x。
Zn+H2SO4=ZnSO4+H2↑
65 98
13g x
x=19.6g
知1-导溶质的质量分数= ×100%=19.6%
答:这种硫酸溶液中溶质的质量分数为19.6%。知1-练1.73 g质量分数为20%的盐酸与足量大理石反应,生成
二氧化碳的质量是多少? 这些二氧化碳的体积(标准
状况)是多少?(在标准状况下,二氧化碳的密度为
1.977g/L。 )2知识点有关溶质的质量分数的简单计算知2-导【例2】25 g含杂质20%的石灰石与100 g一定溶质质量分数
的稀盐酸恰好反应(杂质不溶于水,也不参与反应)。
求:(1)生成的二氧化碳的质量;(2)稀盐酸的溶质质量分数;
(3)反应后所得溶液的溶质质量分数。
导引:根据化学方程式计算时必须将参加反应的纯
净物的质量代入计算。题中25 g、100 g均为混合物知2-讲的质量,不能直接代入计算,可先求出石灰石中碳酸钙的质
量:25 g×(1-20%)=20 g,再利用化学方程式求出生成的
二氧化碳的质量、稀盐酸中溶质的质量、生成的氯化钙的质
量。计算稀盐酸的溶质质量分数时,用稀盐酸中溶质的质量
除以稀盐酸的质量(100 g)再乘以100%即可;反应后所得的溶
液为氯化钙溶液,那么氯化钙溶液的溶质质量分数应该用生
成的氯化钙质量除以氯化钙溶液的质量再乘以100%,而氯
化钙溶液的质量可以用质量守恒定律求出。知2-讲解:设生成的CO2质量为x,参加反应的HCl质量为y,生成的氯
化钙质量为z。参加反应的CaCO3:25 g×80%=20 g。
CaCO3+2HCl===CaCl2+CO2↑+H2O
100 73 111 44
20g y z x
x=8.8 g,y=14.6 g,z=22.2 g
(1)生成CO28.8 g。
(2)稀盐酸中溶质质量分数为: ×100%=14.6%。
(3)反应后所得溶液的溶质质量分数为:
×100%≈20.0%。
答:(1)生成8.8 g CO2;(2)稀盐酸的溶质质量分数为14.6%;(3)反应后所得溶液的溶质质量分数为20.0%。知2-讲总 结求反应后溶液的质量的方法通常有两种:一是质量守恒
法。反应物的质量总和减去生成的气体或沉淀质量,但
要注意难溶于水的杂质也要减掉;二是定义法。即溶质
质量加溶剂质量,溶剂一般为反应前溶液中的溶剂,若
反应中有水生成,生成的水也是溶剂的一部分。知2-练1.(2016·长沙)实验室取68 g过氧化氢溶液和2 g二氧化锰混
合制取氧气,充分反应后,称量剩余溶液和滤渣为68.4 g。
求:
(1)充分反应后,生成氧气的质量为________g;
(2)参加反应的过氧化氢溶液中溶质的质量分数。 第2课时 溶质的质量分数的综合计算
一、溶质质量分数与化学方程式的基础计算
二、化学方程式与溶质质量分数的综合计算请完成练习册剩余习题
同课章节目录
