《物质的获取》单元检测 同步练习
文档属性
| 名称 | 《物质的获取》单元检测 同步练习 |

|
|
| 格式 | zip | ||
| 文件大小 | 294.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-04-07 20:58:20 | ||
图片预览


文档简介
课题2
物质的获取
单元检测
同步练习
(时间:90分钟 满分:100分)
第Ⅰ卷(选择题,共45分)
选择题
(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1.根据“相似相溶”原理,已知胡萝卜素易溶于石油,则可推出其易溶于
( )
A.水
B.苯
C.酒精
D.甘油
2.下列家庭实验中不涉及化学变化的是
( )
A.用熟苹果催熟青香蕉
B.用少量食醋除去水壶中的水垢
C.用糯米、酒曲和水制成甜酒
D.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐
3.某学生在实验室欲制备氧气,但仅有锥形
( http: / / www.21cnjy.com )瓶、普通漏斗、各种玻璃导管、橡皮管、集气瓶、药匙,据此他只能选用哪组试剂来制备氧气
( )
A.KMnO4
B.KClO3、MnO2
C.3%的H2O2和MnO2
D.KMnO4、KClO3
4.以下实验能获得成功的是
( )
A.乙醇和乙酸混合共热制取乙酸乙酯
B.将铁屑、溴水、苯混合制溴苯
C.在苯中滴入浓硝酸制硝基苯
D.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
5.下列除杂质的方法不可行的是
( )
A.用过量氨水除去Al3+溶液中的少量Fe3+
B.将混合气体通过灼热的铜网除去N2中的少量O2
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.用盐酸除去AgCl中少量的Ag2CO3
6.A是一种常见的单质,B、C为中学常见的化合物。A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去)
下列判断正确的是
( )
A.X元素可能为Al
B.X元素可能是金属,也可能是非金属
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
7.下列实验能达到预期目的的是
( )
A.向煮沸的1
mol·L-1
NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
B.向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸
C.称取19.0
g
SnCl2,用100
mL蒸馏水溶解,配制1.0
mol·L-1
SnCl2溶液
D.用氢氧化铜粉末检验尿糖
8.下列有关实验操作的叙述正确的是
( )
A.实验室常用如图所示的装置制取少量的乙酸乙酯
B.用50
mL酸式滴定管可准确量取25.00
mL
KMnO4溶液
C.用量筒量取5.0
mL
1.00
mol·L-1盐酸于50
mL容量瓶中,加水稀释至刻度,可配制0.100
mol·L-1盐酸
D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
9.将下列各组括号内的少量杂质除去的操作正确的是
( )
A.氢氧化铁胶体(氯化钠溶液):过滤
B.乙酸乙酯(乙酸):加入乙醇和浓硫酸,使乙酸转化为乙酸乙酯
C.O2(H2、H2O):通过浓硫酸洗气,再通过灼热的CuO粉末
D.FeCl2溶液
(FeCl3):加足量的铁粉,振荡、过滤
10.已知气体的摩尔质量越小,扩散速度越快
( http: / / www.21cnjy.com )。如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是
( )
A.甲是浓氨水,乙是浓硫酸
B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸
D.甲是浓硝酸,乙是浓氨水
11.物质的提纯是化学实验中的一项重要操作
( http: / / www.21cnjy.com ),也是化工生产及物质制备中的主要环节。下列有关叙述中不正确的是
( )
A.乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开
B.在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓(NH4)2SO4溶液,然后将所得
沉淀滤出,即得较纯的蛋白质
C.油脂的提纯中,可将油脂加入浓NaOH溶液中加热,然后过滤,滤出的溶液即为较
纯的油脂
D.甘蔗是制备蔗糖的主要原料,榨出的甘蔗汁因含色素而呈棕黄色,在制取蔗糖前应
先加入适量的活性炭,搅拌、过滤、蒸发结晶,即得较纯的蔗糖
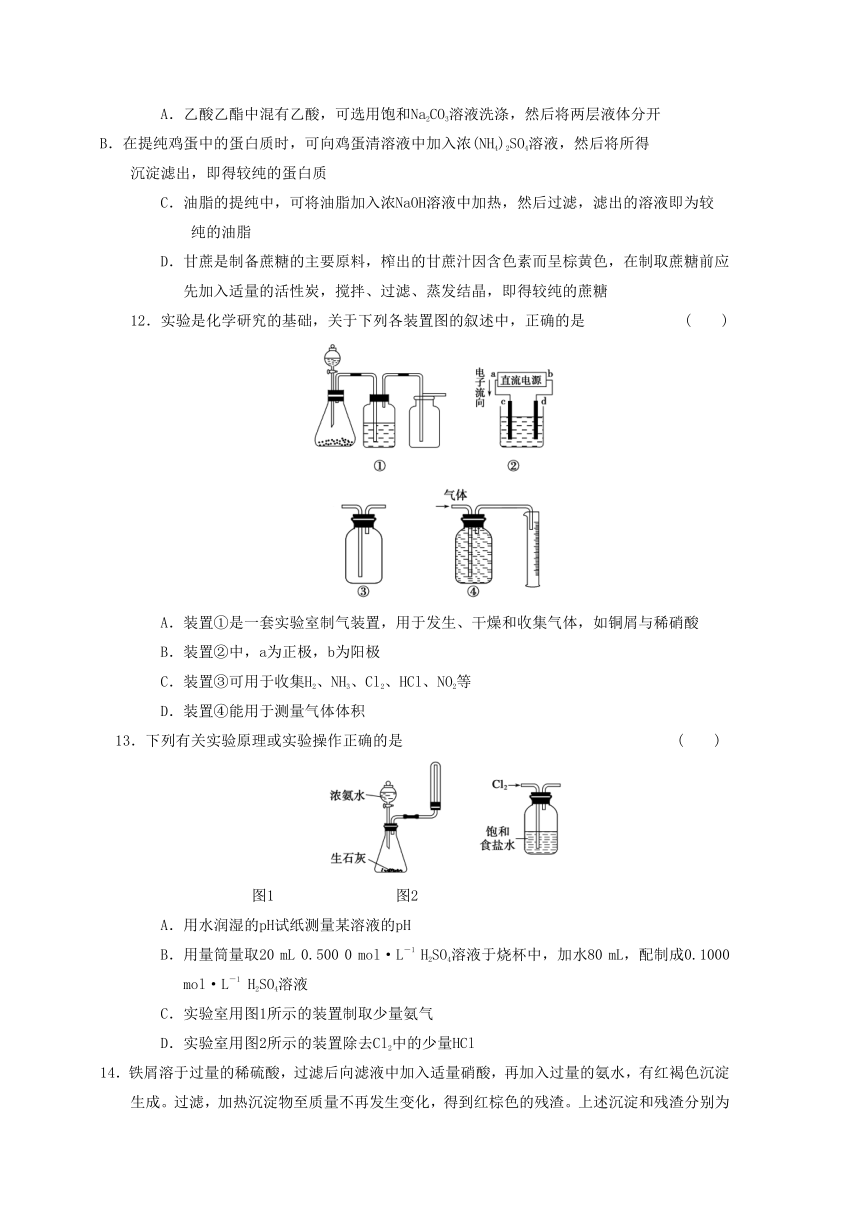
12.实验是化学研究的基础,关于下列各装置图的叙述中,正确的是
( )
A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸
B.装置②中,a为正极,b为阳极
C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等
D.装置④能用于测量气体体积
13.下列有关实验原理或实验操作正确的是
( )
图1 图2
A.用水润湿的pH试纸测量某溶液的pH
B.用量筒量取20
mL
0.500
0
mol·L-1
H2SO4溶液于烧杯中,加水80
mL,配制成0.1000
mol·L-1
H2SO4溶液
C.实验室用图1所示的装置制取少量氨气
D.实验室用图2所示的装置除去Cl2中的少量HCl
14.铁屑溶于过量的稀硫酸
( http: / / www.21cnjy.com ),过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为
( )
A.Fe(OH)3;Fe2O3
B.Fe(OH)2;FeO
C.Fe(OH)2、Fe(OH)3;Fe3O4
D.Fe2O3;Fe(OH)3
15.适量的铁粉放入三氯化铁溶液中,完
( http: / / www.21cnjy.com )全反应后,溶液中的Fe3+和Fe2+浓度相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比是
( )
A.2∶3
B.3∶2
C.1∶2
D.1∶1
非选择题
(本题包括3小题,共55分)
16.(15分)某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。
(1)该小组同学采用了以下操作制备Fe(OH)3胶体,请将空白处填写完整。
取一个烧杯,加入20
mL蒸馏水,
( http: / / www.21cnjy.com )加热至沸腾,然后向烧杯中滴加1~2
mL饱和____________溶液,继续煮沸,待________________________后,停止加热。
(2)将制得的胶体放入半透膜制成的
( http: / / www.21cnjy.com )袋内,如右图所示,放置2
min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察到__________(填“有”或“无”)丁达尔现象,再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为________________________________________________________________________。
(3)将半透膜内的液体倒入U型管中,如右图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是(填“阴”或“阳”)
________极附近颜色逐渐变深,其原因是
( http: / / www.21cnjy.com )________________________________________________________________________。
17.(18分)甲基橙和酚
( http: / / www.21cnjy.com )酞在水中和有机溶剂中的溶解度不同,当溶剂沿滤纸流经混合物点样时,甲基橙和酚酞会以不同的速率在滤纸上移动,从而达到分离的目的。某校化学兴趣小组拟通过该原理将甲基橙和酚酞从混合溶液A中分离开来:
步骤Ⅰ 把0.1
g甲基
( http: / / www.21cnjy.com )橙和0.1
g酚酞溶解在10
mL
60%的乙醇溶液里,配制混合溶液A;另将10
mL乙醇和4
mL浓氨水充分混合,配成混合溶液B;
步骤Ⅱ 在一张圆形滤纸中心扎一小孔,将细纸芯插入滤纸中央(如图)。
在距滤纸中心约1
cm的圆周上,选择三个点,分别用毛细管将A溶液在该三点处点样;
步骤Ⅲ 将滤纸覆盖在盛有B溶液的培养皿上,使滤纸芯与溶液接触,放置一段时间,点样逐渐向外扩散,形成黄环;
步骤Ⅳ 待黄环半径扩散到滤纸半径的二分之一时,取下滤纸,等滤纸稍干后,喷上饱和Na2CO3溶液,通过现象判断分离的效果。
试回答下列问题:
(1)本实验采用的分离方法叫______________,若分离淀粉胶体与氯化钠的混合液则可选用________法。
(2)步骤Ⅱ中若在滤纸上事先作点样位置标记,宜选用____笔(填“钢”或“铅”)。
(3)步骤Ⅳ中喷洒Na2CO3溶液后,
( http: / / www.21cnjy.com )能观察到的现象是内部为黄环,外部为红环,这说明实验中______在滤纸上移动速率更快(填“甲基橙”或“酚酞”)。
(4)他们可以通过______________________来判断分离的效果。
18.(22分)铁是与日常生活密切相关的元素。
(1)在生铁中含有一种铁、碳化合物X。
( http: / / www.21cnjy.com )已知X中铁、碳的元素质量比为14∶1。X的最简式为_________________________________________________________________。
(2)X有下列转化关系:(无关物质已经略去)
溶液甲中含有的大量阳离子是____
( http: / / www.21cnjy.com )____________;溶液甲中加入H2O2发生反应的离子方程式为__________________________________________________________________。
(3)X与过量浓硝酸反应生成气体Z和气体
( http: / / www.21cnjy.com )W,Z是一种无色无味能使澄清石灰水变浑浊的气体,气体Z和W分别是:Z________、W________。
(4)Fe(OH)3胶体外观与Fe(
( http: / / www.21cnjy.com )SCN)3溶液相似,用一种简单的方法将它们鉴别出来且不破坏它们:
_________________________________________________________________。
(5)某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜。活动过程如下:
①写出废铁屑与盐酸反应的离子方程式:
_______________________________________
__________________________________________________________________________。
②学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
实验内容
实验操作
预期现象和结论
检验黄色溶液A中
是否含有Fe2+
检验绿色溶液C
中是否含有Fe3+
答案
1.B 2.D
3.C 4.D 5.A 6.D 7.B 8.B 9.D 10.C 11.C
12.C 13.D 14.A 15.A
16.(1)氯化铁或FeCl3 液体呈红褐色
(2)无 有白色沉淀生成
(3)阴 Fe(OH)3胶体粒子带正电荷,在电场作用下向阴极移动
17.(1)(纸上)层析法(或色层法或色谱法) 渗析
(2)铅 (3)酚酞
(4)色斑间的距离大小
18.(1)Fe3C
(2)Fe2+、Fe3+、H+ 2Fe2++H2O2+2H+===2Fe3++2H2O
(3)CO2 NO2
(4)利用丁达尔效应鉴别
(5)①Fe2O3+6H+==
( http: / / www.21cnjy.com )=2Fe3++3H2O、2Fe3++Fe===3Fe2+(或Fe+Fe2O3+6H+===3Fe2++3H2O)
②
实验内容
实验操作
预期现象和结论
检验黄色溶液A中是否含有Fe2+
取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液
酸性高锰酸钾溶液褪色,则黄色溶液A中含有Fe2+
检验绿色溶液C中是否含有Fe3+
取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液
溶液出现血红色,则绿色溶液C中含有Fe3+
物质的获取
单元检测
同步练习
(时间:90分钟 满分:100分)
第Ⅰ卷(选择题,共45分)
选择题
(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1.根据“相似相溶”原理,已知胡萝卜素易溶于石油,则可推出其易溶于
( )
A.水
B.苯
C.酒精
D.甘油
2.下列家庭实验中不涉及化学变化的是
( )
A.用熟苹果催熟青香蕉
B.用少量食醋除去水壶中的水垢
C.用糯米、酒曲和水制成甜酒
D.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐
3.某学生在实验室欲制备氧气,但仅有锥形
( http: / / www.21cnjy.com )瓶、普通漏斗、各种玻璃导管、橡皮管、集气瓶、药匙,据此他只能选用哪组试剂来制备氧气
( )
A.KMnO4
B.KClO3、MnO2
C.3%的H2O2和MnO2
D.KMnO4、KClO3
4.以下实验能获得成功的是
( )
A.乙醇和乙酸混合共热制取乙酸乙酯
B.将铁屑、溴水、苯混合制溴苯
C.在苯中滴入浓硝酸制硝基苯
D.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
5.下列除杂质的方法不可行的是
( )
A.用过量氨水除去Al3+溶液中的少量Fe3+
B.将混合气体通过灼热的铜网除去N2中的少量O2
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.用盐酸除去AgCl中少量的Ag2CO3
6.A是一种常见的单质,B、C为中学常见的化合物。A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去)
下列判断正确的是
( )
A.X元素可能为Al
B.X元素可能是金属,也可能是非金属
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
7.下列实验能达到预期目的的是
( )
A.向煮沸的1
mol·L-1
NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
B.向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量乙酸
C.称取19.0
g
SnCl2,用100
mL蒸馏水溶解,配制1.0
mol·L-1
SnCl2溶液
D.用氢氧化铜粉末检验尿糖
8.下列有关实验操作的叙述正确的是
( )
A.实验室常用如图所示的装置制取少量的乙酸乙酯
B.用50
mL酸式滴定管可准确量取25.00
mL
KMnO4溶液
C.用量筒量取5.0
mL
1.00
mol·L-1盐酸于50
mL容量瓶中,加水稀释至刻度,可配制0.100
mol·L-1盐酸
D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
9.将下列各组括号内的少量杂质除去的操作正确的是
( )
A.氢氧化铁胶体(氯化钠溶液):过滤
B.乙酸乙酯(乙酸):加入乙醇和浓硫酸,使乙酸转化为乙酸乙酯
C.O2(H2、H2O):通过浓硫酸洗气,再通过灼热的CuO粉末
D.FeCl2溶液
(FeCl3):加足量的铁粉,振荡、过滤
10.已知气体的摩尔质量越小,扩散速度越快
( http: / / www.21cnjy.com )。如图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是
( )
A.甲是浓氨水,乙是浓硫酸
B.甲是浓盐酸,乙是浓氨水
C.甲是浓氨水,乙是浓盐酸
D.甲是浓硝酸,乙是浓氨水
11.物质的提纯是化学实验中的一项重要操作
( http: / / www.21cnjy.com ),也是化工生产及物质制备中的主要环节。下列有关叙述中不正确的是
( )
A.乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开
B.在提纯鸡蛋中的蛋白质时,可向鸡蛋清溶液中加入浓(NH4)2SO4溶液,然后将所得
沉淀滤出,即得较纯的蛋白质
C.油脂的提纯中,可将油脂加入浓NaOH溶液中加热,然后过滤,滤出的溶液即为较
纯的油脂
D.甘蔗是制备蔗糖的主要原料,榨出的甘蔗汁因含色素而呈棕黄色,在制取蔗糖前应
先加入适量的活性炭,搅拌、过滤、蒸发结晶,即得较纯的蔗糖
12.实验是化学研究的基础,关于下列各装置图的叙述中,正确的是
( )
A.装置①是一套实验室制气装置,用于发生、干燥和收集气体,如铜屑与稀硝酸
B.装置②中,a为正极,b为阳极
C.装置③可用于收集H2、NH3、Cl2、HCl、NO2等
D.装置④能用于测量气体体积
13.下列有关实验原理或实验操作正确的是
( )
图1 图2
A.用水润湿的pH试纸测量某溶液的pH
B.用量筒量取20
mL
0.500
0
mol·L-1
H2SO4溶液于烧杯中,加水80
mL,配制成0.1000
mol·L-1
H2SO4溶液
C.实验室用图1所示的装置制取少量氨气
D.实验室用图2所示的装置除去Cl2中的少量HCl
14.铁屑溶于过量的稀硫酸
( http: / / www.21cnjy.com ),过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为
( )
A.Fe(OH)3;Fe2O3
B.Fe(OH)2;FeO
C.Fe(OH)2、Fe(OH)3;Fe3O4
D.Fe2O3;Fe(OH)3
15.适量的铁粉放入三氯化铁溶液中,完
( http: / / www.21cnjy.com )全反应后,溶液中的Fe3+和Fe2+浓度相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比是
( )
A.2∶3
B.3∶2
C.1∶2
D.1∶1
非选择题
(本题包括3小题,共55分)
16.(15分)某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。
(1)该小组同学采用了以下操作制备Fe(OH)3胶体,请将空白处填写完整。
取一个烧杯,加入20
mL蒸馏水,
( http: / / www.21cnjy.com )加热至沸腾,然后向烧杯中滴加1~2
mL饱和____________溶液,继续煮沸,待________________________后,停止加热。
(2)将制得的胶体放入半透膜制成的
( http: / / www.21cnjy.com )袋内,如右图所示,放置2
min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察到__________(填“有”或“无”)丁达尔现象,再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为________________________________________________________________________。
(3)将半透膜内的液体倒入U型管中,如右图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是(填“阴”或“阳”)
________极附近颜色逐渐变深,其原因是
( http: / / www.21cnjy.com )________________________________________________________________________。
17.(18分)甲基橙和酚
( http: / / www.21cnjy.com )酞在水中和有机溶剂中的溶解度不同,当溶剂沿滤纸流经混合物点样时,甲基橙和酚酞会以不同的速率在滤纸上移动,从而达到分离的目的。某校化学兴趣小组拟通过该原理将甲基橙和酚酞从混合溶液A中分离开来:
步骤Ⅰ 把0.1
g甲基
( http: / / www.21cnjy.com )橙和0.1
g酚酞溶解在10
mL
60%的乙醇溶液里,配制混合溶液A;另将10
mL乙醇和4
mL浓氨水充分混合,配成混合溶液B;
步骤Ⅱ 在一张圆形滤纸中心扎一小孔,将细纸芯插入滤纸中央(如图)。
在距滤纸中心约1
cm的圆周上,选择三个点,分别用毛细管将A溶液在该三点处点样;
步骤Ⅲ 将滤纸覆盖在盛有B溶液的培养皿上,使滤纸芯与溶液接触,放置一段时间,点样逐渐向外扩散,形成黄环;
步骤Ⅳ 待黄环半径扩散到滤纸半径的二分之一时,取下滤纸,等滤纸稍干后,喷上饱和Na2CO3溶液,通过现象判断分离的效果。
试回答下列问题:
(1)本实验采用的分离方法叫______________,若分离淀粉胶体与氯化钠的混合液则可选用________法。
(2)步骤Ⅱ中若在滤纸上事先作点样位置标记,宜选用____笔(填“钢”或“铅”)。
(3)步骤Ⅳ中喷洒Na2CO3溶液后,
( http: / / www.21cnjy.com )能观察到的现象是内部为黄环,外部为红环,这说明实验中______在滤纸上移动速率更快(填“甲基橙”或“酚酞”)。
(4)他们可以通过______________________来判断分离的效果。
18.(22分)铁是与日常生活密切相关的元素。
(1)在生铁中含有一种铁、碳化合物X。
( http: / / www.21cnjy.com )已知X中铁、碳的元素质量比为14∶1。X的最简式为_________________________________________________________________。
(2)X有下列转化关系:(无关物质已经略去)
溶液甲中含有的大量阳离子是____
( http: / / www.21cnjy.com )____________;溶液甲中加入H2O2发生反应的离子方程式为__________________________________________________________________。
(3)X与过量浓硝酸反应生成气体Z和气体
( http: / / www.21cnjy.com )W,Z是一种无色无味能使澄清石灰水变浑浊的气体,气体Z和W分别是:Z________、W________。
(4)Fe(OH)3胶体外观与Fe(
( http: / / www.21cnjy.com )SCN)3溶液相似,用一种简单的方法将它们鉴别出来且不破坏它们:
_________________________________________________________________。
(5)某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜。活动过程如下:
①写出废铁屑与盐酸反应的离子方程式:
_______________________________________
__________________________________________________________________________。
②学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
实验内容
实验操作
预期现象和结论
检验黄色溶液A中
是否含有Fe2+
检验绿色溶液C
中是否含有Fe3+
答案
1.B 2.D
3.C 4.D 5.A 6.D 7.B 8.B 9.D 10.C 11.C
12.C 13.D 14.A 15.A
16.(1)氯化铁或FeCl3 液体呈红褐色
(2)无 有白色沉淀生成
(3)阴 Fe(OH)3胶体粒子带正电荷,在电场作用下向阴极移动
17.(1)(纸上)层析法(或色层法或色谱法) 渗析
(2)铅 (3)酚酞
(4)色斑间的距离大小
18.(1)Fe3C
(2)Fe2+、Fe3+、H+ 2Fe2++H2O2+2H+===2Fe3++2H2O
(3)CO2 NO2
(4)利用丁达尔效应鉴别
(5)①Fe2O3+6H+==
( http: / / www.21cnjy.com )=2Fe3++3H2O、2Fe3++Fe===3Fe2+(或Fe+Fe2O3+6H+===3Fe2++3H2O)
②
实验内容
实验操作
预期现象和结论
检验黄色溶液A中是否含有Fe2+
取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液
酸性高锰酸钾溶液褪色,则黄色溶液A中含有Fe2+
检验绿色溶液C中是否含有Fe3+
取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液
溶液出现血红色,则绿色溶液C中含有Fe3+
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
