《物质的检测》单元检测 同步练习
文档属性
| 名称 | 《物质的检测》单元检测 同步练习 |

|
|
| 格式 | zip | ||
| 文件大小 | 265.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-04-07 00:00:00 | ||
图片预览



文档简介
课题3
物质的检测
单元检测
同步练习
(时间:90分钟 满分:100分)
第Ⅰ卷(选择题,共45分)
选择题
(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1.下列有关实验的叙述,正确的是
( )
A.用规格为10
mL的量筒量取8.50
mL稀盐酸
B.用碱式滴定管量取20.00
mL
KMnO4溶液
C.为测定某溶液的pH,将pH试纸润湿后浸入待测溶液,取出后与标准比色卡进行对比
D.用渗析法除去淀粉中混有的NaCl
2.某校学生用化学知识解决生活中的问题,下列家庭小实验中不合理的是
( )
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验含碘盐中的碘酸钾(KIO3)
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
3.下列有关实验原理、方法和结论都正确的是
( )
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变血红,说明X溶液中一定含有Fe2+
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中的少量苯酚
D.已知I??I2+I-,向盛有KI3
( http: / / www.21cnjy.com )溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
4.向某晶体的水溶液中加入Fe2+的溶液后
( http: / / www.21cnjy.com ),无明显变化,当滴加几滴溴水后,混合液出现血红色,那么由此得出的下列结论,错误的是
( )
A.该晶体中一定含有SCN-
B.Fe3+的氧化性比Br2的氧化性强
C.Fe2+被Br2氧化为Fe3+
D.Fe2+与SCN-不能形成血红色的化合物
5.亚硝酸钠俗称“工业盐”,有很强的毒性,
( http: / / www.21cnjy.com )因“外观与口感和食盐相似,而常常被误用、误食,为了区分亚硝酸钠与食盐,某研究性小组通过查阅资料后得知:亚硝酸钠具有强氧化性,可与硝酸银溶液产生沉淀,亚硝酸是一种弱酸,不稳定,易分解为两种气体,据此设计了如下方案:①分别向盛有两种溶液的试管中加入稀硫酸,如试管中有红棕色气体产生的为亚硝酸钠;②用洁净的玻璃棒分别蘸取两种无色溶液滴在淀粉 碘化钾试纸上,出现蓝色的是亚硝酸钠;③向两支盛有硫酸亚铁溶液的试管中分别加入氯化钠和亚硝酸钠,溶液变棕黄色的是亚硝酸钠;④分别向盛有两种溶液的试管中加入硝酸银,有白色沉淀产生的是氯化钠,另一支试管内是亚硝酸钠。其中能够区分亚硝酸钠与食盐的操作及结论正确的是
( )
A.①②③④
B.①②④
C.①②③
D.①③④
6.下列有关实验操作、现象和解释或结论都正确的是
( )
选项
实验操作
现象
解释或结论
A
过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液
溶液呈血红色
稀HNO3将Fe氧化为Fe3+
B
AgI沉淀中滴入稀KCl溶液
有白色沉淀出现
AgCl比AgI更难溶
C
Al箔插入稀HNO3中
无现象
Al箔表面被HNO3氧化,形成致密的氧化膜
D
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
7.
有Na2CO3、Ag
( http: / / www.21cnjy.com )NO3、BaCl2、HCl及NH4NO3
5瓶无标签溶液,为鉴别它们,取4支试管分别装入一种溶液,再向上述4支试管中加入少许剩下的一种溶液,下列表达中错误的是
( )
A.若3支试管出现沉淀时,则后加入的是AgNO3溶液
B.全部没有什么现象变化时,后加入的是NH4NO3溶液
C.1支试管出现气体,2支试管出现沉淀时,最后加入的是HCl溶液
D.若只有2支试管出现沉淀时,则后加入的是BaCl2溶液
8.下列实验能获得成功的是
( )
A.用溴水可鉴别苯、乙醇、苯乙烯
B.加浓溴水,然后过滤可除去苯中少量己烯
C.苯、溴水、铁粉混合制成溴苯
D.可用分液漏斗分离二溴乙烷和二甲苯
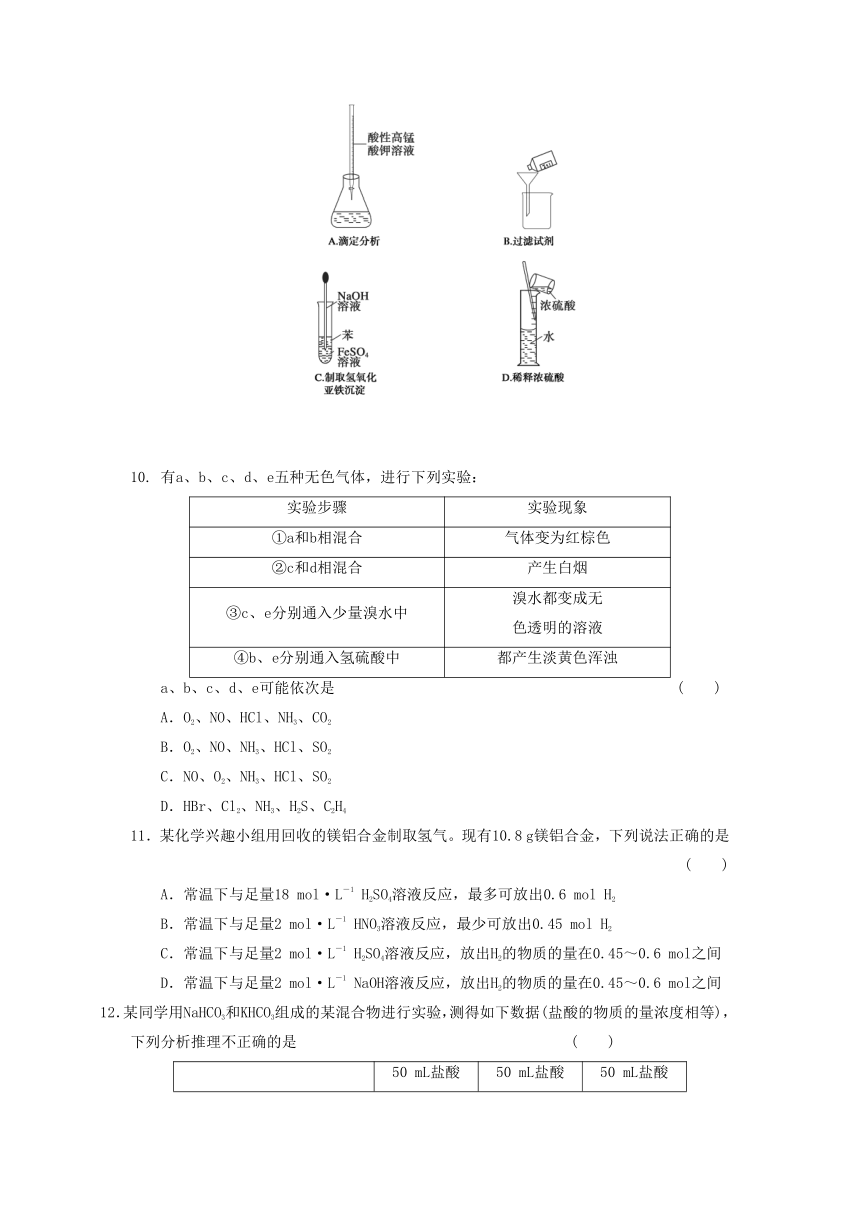
9.下列操作或仪器的选用正确的是
( )
10.
有a、b、c、d、e五种无色气体,进行下列实验:
实验步骤
实验现象
①a和b相混合
气体变为红棕色
②c和d相混合
产生白烟
③c、e分别通入少量溴水中
溴水都变成无色透明的溶液
④b、e分别通入氢硫酸中
都产生淡黄色浑浊
a、b、c、d、e可能依次是
( )
A.O2、NO、HCl、NH3、CO2
B.O2、NO、NH3、HCl、SO2
C.NO、O2、NH3、HCl、SO2
D.HBr、Cl2、NH3、H2S、C2H4
11.某化学兴趣小组用回收的镁铝合金制取氢气。现有10.8
g镁铝合金,下列说法正确的是
( )
A.常温下与足量18
mol·L-1
H2SO4溶液反应,最多可放出0.6
mol
H2
B.常温下与足量2
mol·L-1
HNO3溶液反应,最少可放出0.45
mol
H2
C.常温下与足量2
mol·L-1
H2SO4溶液反应,放出H2的物质的量在0.45~0.6
mol之间
D.常温下与足量2
mol·L-1
NaOH溶液反应,放出H2的物质的量在0.45~0.6
mol之间
12.某同学用NaHCO3和KHCO3
( http: / / www.21cnjy.com )组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是
( )
50
mL盐酸
50
mL盐酸
50
mL盐酸
m(混合物质量)
9.2
g
15.7
g
27.6
g
V(CO2)(标准状况)
2.24
L
3.36
L
3.36
L
A.盐酸的物质的量浓度为3.0
mol·L-1
B.根据表中数据能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2
g时盐酸过量
D.15.7
g混合物恰好与盐酸完全反应
13.下列实验操作完全正确的是( )
编号
实验
操作
A
钠与水的反应
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中
B
配制一定浓度的氯化钾溶液1
000
mL
准确称取氯化钾固体,放入到1
000
mL的容量瓶中,加水溶解,振荡摇匀,定容
C
排除碱式滴定管尖嘴部分的气泡
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出
D
取出分液漏斗中所需的上层液体
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
14.
由等体积、等pH的Ba(O
( http: / / www.21cnjy.com )H)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
( )
A.V3>V2>V1
B.V3=V2=V1
C.V3>V2=V1
D.V1=V2>V3
15.下列制取、检验、提纯或保存物质的方法可行的是
( )
①向某溶液中加入KSCN溶液检验该溶液是否含有Fe+
②用植物油、NaOH溶液制取肥皂
③向FeCl3饱和溶液中滴加NaOH溶液制取Fe(OH)3胶体
④用焰色反应检验K+时须透过蓝色钴玻璃观察
⑤液溴用水液封后密封保存在棕色试剂瓶中
⑥向混有乙酸的乙酸乙酯中加入NaOH溶液再分液,提纯乙酸乙酯
A.①③⑤⑥
B.②④⑤⑥
C.①②④⑤
D.①③④⑥
非选择题
(本题包括5小题,共55分)
16.(12分)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01
mol·L-1、0.008
mol·L-1等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液。
②样品处理:
③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10
mL。
④比色,直到与选取的标准颜色一致或相近即可。
试回答下列问题:
(1)配制100
mL
0.01
mol·L-1溶液,需要的玻璃仪器有:烧杯、玻璃棒,还需要:__________、__________。
(2)步骤②脱色过程包括加入:________(填脱有机色素的吸附剂名称)→搅拌煮沸→冷却→____________(填操作)。
(3)比色法确定待测液的浓度的原理是__________________________________________
__________________________________________________________________________。
(4)若其补铁剂是由乳酸[CH3CH(OH)
( http: / / www.21cnjy.com )COOH]与铁粉作用生成的,请写出该反应的化学方程式:
____________________________________________________________________
________________________________________________________________________。
17.(10分)金矿开采
( http: / / www.21cnjy.com )、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子[M(CN)n]m-的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
终点时,溶液由黄色变成橙红色。Ag++2CN-===[Ag(CN)2]-
根据以上知识回答下列问题:
(1)水样预处理的目的是_____________________________________________________。
(2)水样预处理的装置如图,细导管插入吸收液中是为了_________________________。
(3)蒸馏瓶比吸收液面要高出很多,其目的是__________________________________。
(4)如果用盐酸代替磷酸进行预处理,实验结果将________(填“偏高”、“无影响”或“偏低”)。
(5)准确移取某工厂污水100
mL,
( http: / / www.21cnjy.com )经处理后用浓度为0.010
00
mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00
mL。此水样中含氰化合物的含量为________mg·L-1(以CN-计,计算结果保留一位小数)。
18.(10分)某学生欲测定味精中食盐的含量。
(1)下面是该学生所做的有关实验步骤,请填写所缺的实验步骤②和④。
①称取某牌号的袋装味精样品5.0
g,并溶于蒸馏水中。
②________________________________________________________________________。
③过滤。
④________________________________________________________________________。
⑤将沉淀烘干、称量,测得固体质量为2.9
g。
(2)根据上述实验步骤回答下列有关问题:
①过滤操作所需要的仪器有__________________________________________________。
②检验沉淀是否洗净的方法是________________________________________________
_________________________________________________________________________。
③烘干沉淀应采取的方法是________。(填序号)
A.低温烘干 B.高温烘干 C.利用太阳能烘干
④若味精包装上标注:“谷氨酸钠含量≥
( http: / / www.21cnjy.com )80%,NaCl含量≤20%”,则此样品是否符合产品标示的质量分数?________(填“符合”或“不符合”)。
(3)若有甲、乙两学生分别做了这个实验
( http: / / www.21cnjy.com ),甲学生认真地做了一次实验,就取得了实验数据;而乙学生认真地做了两次实验,取两次数据的平均值作为实验的测定数据,你认为哪一位学生的方法更合理?请简述你的理由。
19.(13分)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度。
(1)滴定
①用______式滴定管盛c
( http: / / www.21cnjy.com )mol·L-1盐酸标准液。下图表示某次滴定时50
mL滴定管中滴定前后液面所处的刻度。请将消耗的盐酸标准液的体积填入③表空格中,此时滴定管中剩余液体的体积为________
mL。
②下表是4种常见指示剂的变色范围
指示剂
石蕊
甲基橙
甲基红
酚酞
pH变色范围
5.0~8.0
3.1~4.4
4.4~6.2
8.2~10.0
该实验应选用________作指示剂。
③有关数据记录如下:
滴定序号
待测液体积(mL)
所消耗盐酸标准液的体积(mL)
滴定前
滴定后
消耗的体积
1
V
0.50
25.80
25.30
2
V
3
V
6.00
31.35
25.35
(2)根据所给数据,写出计算烧碱溶液的物质的量浓度的表达式(不必化简)
c′=___________________________________________________________________。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”或“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果________;
b.读数时,若滴定前仰视读数,滴定后俯视读数,则会使测定结果________;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果________;
d.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果________。
20.(10分)孔雀石主要含Cu2(OH)
( http: / / www.21cnjy.com )2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
请回答下列问题:
(1)溶液A中的金属离子有C
( http: / / www.21cnjy.com )u2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为__________(填代号),检验溶液A中Fe3+的最佳试剂为__________(填代号)。
a.KMnO4
b.(NH4)2S
c.H2O2
d.
KSCN
(2)由溶液C获得CuSO4·5H2O
( http: / / www.21cnjy.com ),需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是________________________________________________________________________。
(3)制备CaCO3时,应向CaCl2
( http: / / www.21cnjy.com )溶液中先加入(或先通入)________(填化学式)。若实验过程中有氨气逸出,应选用下列__________装置回收(填代号)。
(4)欲测定溶液A中Fe2+的浓度,需要
( http: / / www.21cnjy.com )用容量瓶配制某标准溶液,定容时视线应________________________________________________________________________,
直到____________________________________________________________________。
用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
答案
1.D 2.B 3.C 4.B 5.C 6.D 7.C 8.A 9.C 10.C
11.C 12.D 13.C 14.C 15.C
16.(1)100
mL容量瓶 胶头滴管
(2)活性炭 过滤
(3)溶液颜色的深浅与浓度的大小成正比
( http: / / www.21cnjy.com )
17.(1)将含氰化合物全部转化为CN-
(2)完全吸收HCN,防止气体放出
(3)防止倒吸 (4)偏高 (5)109.2
18.(1)②加入足量用稀硝酸酸化的硝酸银溶液,使沉淀完全
④用蒸馏水反复洗涤沉淀多次
(2)①烧杯、漏斗、铁架台(带铁圈)、玻璃棒、滤纸
②取最后一次洗涤少许洗涤液,向其中加入稀盐酸,若无沉淀或浑浊出现,证明沉淀已洗净
③A ④不符合
(3)乙;类似于中和滴定实验,定量测
( http: / / www.21cnjy.com )定实验都应重复测定2~3次,再计算出平均值,以排除偶然因素造成的实验误差,使实验误差保持在允许范围之内。所以,乙学生的方法更合理。
19.(1)①酸 大于25.10
②酚酞 ③24.60
(2)
(3)a.无影响 b.偏低 c.偏高
d.偏低
20.(1)c d
(2)冷却结晶 引流
(3)
NH3·H2O(或NH3) b
(4)平视凹液面(或平视刻度线) 凹液面的最低处与刻度线相切 酸式
物质的检测
单元检测
同步练习
(时间:90分钟 满分:100分)
第Ⅰ卷(选择题,共45分)
选择题
(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1.下列有关实验的叙述,正确的是
( )
A.用规格为10
mL的量筒量取8.50
mL稀盐酸
B.用碱式滴定管量取20.00
mL
KMnO4溶液
C.为测定某溶液的pH,将pH试纸润湿后浸入待测溶液,取出后与标准比色卡进行对比
D.用渗析法除去淀粉中混有的NaCl
2.某校学生用化学知识解决生活中的问题,下列家庭小实验中不合理的是
( )
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验含碘盐中的碘酸钾(KIO3)
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
3.下列有关实验原理、方法和结论都正确的是
( )
A.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体
B.取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变血红,说明X溶液中一定含有Fe2+
C.室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中的少量苯酚
D.已知I??I2+I-,向盛有KI3
( http: / / www.21cnjy.com )溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
4.向某晶体的水溶液中加入Fe2+的溶液后
( http: / / www.21cnjy.com ),无明显变化,当滴加几滴溴水后,混合液出现血红色,那么由此得出的下列结论,错误的是
( )
A.该晶体中一定含有SCN-
B.Fe3+的氧化性比Br2的氧化性强
C.Fe2+被Br2氧化为Fe3+
D.Fe2+与SCN-不能形成血红色的化合物
5.亚硝酸钠俗称“工业盐”,有很强的毒性,
( http: / / www.21cnjy.com )因“外观与口感和食盐相似,而常常被误用、误食,为了区分亚硝酸钠与食盐,某研究性小组通过查阅资料后得知:亚硝酸钠具有强氧化性,可与硝酸银溶液产生沉淀,亚硝酸是一种弱酸,不稳定,易分解为两种气体,据此设计了如下方案:①分别向盛有两种溶液的试管中加入稀硫酸,如试管中有红棕色气体产生的为亚硝酸钠;②用洁净的玻璃棒分别蘸取两种无色溶液滴在淀粉 碘化钾试纸上,出现蓝色的是亚硝酸钠;③向两支盛有硫酸亚铁溶液的试管中分别加入氯化钠和亚硝酸钠,溶液变棕黄色的是亚硝酸钠;④分别向盛有两种溶液的试管中加入硝酸银,有白色沉淀产生的是氯化钠,另一支试管内是亚硝酸钠。其中能够区分亚硝酸钠与食盐的操作及结论正确的是
( )
A.①②③④
B.①②④
C.①②③
D.①③④
6.下列有关实验操作、现象和解释或结论都正确的是
( )
选项
实验操作
现象
解释或结论
A
过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液
溶液呈血红色
稀HNO3将Fe氧化为Fe3+
B
AgI沉淀中滴入稀KCl溶液
有白色沉淀出现
AgCl比AgI更难溶
C
Al箔插入稀HNO3中
无现象
Al箔表面被HNO3氧化,形成致密的氧化膜
D
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
7.
有Na2CO3、Ag
( http: / / www.21cnjy.com )NO3、BaCl2、HCl及NH4NO3
5瓶无标签溶液,为鉴别它们,取4支试管分别装入一种溶液,再向上述4支试管中加入少许剩下的一种溶液,下列表达中错误的是
( )
A.若3支试管出现沉淀时,则后加入的是AgNO3溶液
B.全部没有什么现象变化时,后加入的是NH4NO3溶液
C.1支试管出现气体,2支试管出现沉淀时,最后加入的是HCl溶液
D.若只有2支试管出现沉淀时,则后加入的是BaCl2溶液
8.下列实验能获得成功的是
( )
A.用溴水可鉴别苯、乙醇、苯乙烯
B.加浓溴水,然后过滤可除去苯中少量己烯
C.苯、溴水、铁粉混合制成溴苯
D.可用分液漏斗分离二溴乙烷和二甲苯
9.下列操作或仪器的选用正确的是
( )
10.
有a、b、c、d、e五种无色气体,进行下列实验:
实验步骤
实验现象
①a和b相混合
气体变为红棕色
②c和d相混合
产生白烟
③c、e分别通入少量溴水中
溴水都变成无色透明的溶液
④b、e分别通入氢硫酸中
都产生淡黄色浑浊
a、b、c、d、e可能依次是
( )
A.O2、NO、HCl、NH3、CO2
B.O2、NO、NH3、HCl、SO2
C.NO、O2、NH3、HCl、SO2
D.HBr、Cl2、NH3、H2S、C2H4
11.某化学兴趣小组用回收的镁铝合金制取氢气。现有10.8
g镁铝合金,下列说法正确的是
( )
A.常温下与足量18
mol·L-1
H2SO4溶液反应,最多可放出0.6
mol
H2
B.常温下与足量2
mol·L-1
HNO3溶液反应,最少可放出0.45
mol
H2
C.常温下与足量2
mol·L-1
H2SO4溶液反应,放出H2的物质的量在0.45~0.6
mol之间
D.常温下与足量2
mol·L-1
NaOH溶液反应,放出H2的物质的量在0.45~0.6
mol之间
12.某同学用NaHCO3和KHCO3
( http: / / www.21cnjy.com )组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是
( )
50
mL盐酸
50
mL盐酸
50
mL盐酸
m(混合物质量)
9.2
g
15.7
g
27.6
g
V(CO2)(标准状况)
2.24
L
3.36
L
3.36
L
A.盐酸的物质的量浓度为3.0
mol·L-1
B.根据表中数据能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2
g时盐酸过量
D.15.7
g混合物恰好与盐酸完全反应
13.下列实验操作完全正确的是( )
编号
实验
操作
A
钠与水的反应
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中
B
配制一定浓度的氯化钾溶液1
000
mL
准确称取氯化钾固体,放入到1
000
mL的容量瓶中,加水溶解,振荡摇匀,定容
C
排除碱式滴定管尖嘴部分的气泡
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出
D
取出分液漏斗中所需的上层液体
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
14.
由等体积、等pH的Ba(O
( http: / / www.21cnjy.com )H)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
( )
A.V3>V2>V1
B.V3=V2=V1
C.V3>V2=V1
D.V1=V2>V3
15.下列制取、检验、提纯或保存物质的方法可行的是
( )
①向某溶液中加入KSCN溶液检验该溶液是否含有Fe+
②用植物油、NaOH溶液制取肥皂
③向FeCl3饱和溶液中滴加NaOH溶液制取Fe(OH)3胶体
④用焰色反应检验K+时须透过蓝色钴玻璃观察
⑤液溴用水液封后密封保存在棕色试剂瓶中
⑥向混有乙酸的乙酸乙酯中加入NaOH溶液再分液,提纯乙酸乙酯
A.①③⑤⑥
B.②④⑤⑥
C.①②④⑤
D.①③④⑥
非选择题
(本题包括5小题,共55分)
16.(12分)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01
mol·L-1、0.008
mol·L-1等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液。
②样品处理:
③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10
mL。
④比色,直到与选取的标准颜色一致或相近即可。
试回答下列问题:
(1)配制100
mL
0.01
mol·L-1溶液,需要的玻璃仪器有:烧杯、玻璃棒,还需要:__________、__________。
(2)步骤②脱色过程包括加入:________(填脱有机色素的吸附剂名称)→搅拌煮沸→冷却→____________(填操作)。
(3)比色法确定待测液的浓度的原理是__________________________________________
__________________________________________________________________________。
(4)若其补铁剂是由乳酸[CH3CH(OH)
( http: / / www.21cnjy.com )COOH]与铁粉作用生成的,请写出该反应的化学方程式:
____________________________________________________________________
________________________________________________________________________。
17.(10分)金矿开采
( http: / / www.21cnjy.com )、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子[M(CN)n]m-的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
终点时,溶液由黄色变成橙红色。Ag++2CN-===[Ag(CN)2]-
根据以上知识回答下列问题:
(1)水样预处理的目的是_____________________________________________________。
(2)水样预处理的装置如图,细导管插入吸收液中是为了_________________________。
(3)蒸馏瓶比吸收液面要高出很多,其目的是__________________________________。
(4)如果用盐酸代替磷酸进行预处理,实验结果将________(填“偏高”、“无影响”或“偏低”)。
(5)准确移取某工厂污水100
mL,
( http: / / www.21cnjy.com )经处理后用浓度为0.010
00
mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00
mL。此水样中含氰化合物的含量为________mg·L-1(以CN-计,计算结果保留一位小数)。
18.(10分)某学生欲测定味精中食盐的含量。
(1)下面是该学生所做的有关实验步骤,请填写所缺的实验步骤②和④。
①称取某牌号的袋装味精样品5.0
g,并溶于蒸馏水中。
②________________________________________________________________________。
③过滤。
④________________________________________________________________________。
⑤将沉淀烘干、称量,测得固体质量为2.9
g。
(2)根据上述实验步骤回答下列有关问题:
①过滤操作所需要的仪器有__________________________________________________。
②检验沉淀是否洗净的方法是________________________________________________
_________________________________________________________________________。
③烘干沉淀应采取的方法是________。(填序号)
A.低温烘干 B.高温烘干 C.利用太阳能烘干
④若味精包装上标注:“谷氨酸钠含量≥
( http: / / www.21cnjy.com )80%,NaCl含量≤20%”,则此样品是否符合产品标示的质量分数?________(填“符合”或“不符合”)。
(3)若有甲、乙两学生分别做了这个实验
( http: / / www.21cnjy.com ),甲学生认真地做了一次实验,就取得了实验数据;而乙学生认真地做了两次实验,取两次数据的平均值作为实验的测定数据,你认为哪一位学生的方法更合理?请简述你的理由。
19.(13分)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定法测定其浓度。
(1)滴定
①用______式滴定管盛c
( http: / / www.21cnjy.com )mol·L-1盐酸标准液。下图表示某次滴定时50
mL滴定管中滴定前后液面所处的刻度。请将消耗的盐酸标准液的体积填入③表空格中,此时滴定管中剩余液体的体积为________
mL。
②下表是4种常见指示剂的变色范围
指示剂
石蕊
甲基橙
甲基红
酚酞
pH变色范围
5.0~8.0
3.1~4.4
4.4~6.2
8.2~10.0
该实验应选用________作指示剂。
③有关数据记录如下:
滴定序号
待测液体积(mL)
所消耗盐酸标准液的体积(mL)
滴定前
滴定后
消耗的体积
1
V
0.50
25.80
25.30
2
V
3
V
6.00
31.35
25.35
(2)根据所给数据,写出计算烧碱溶液的物质的量浓度的表达式(不必化简)
c′=___________________________________________________________________。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”或“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果________;
b.读数时,若滴定前仰视读数,滴定后俯视读数,则会使测定结果________;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果________;
d.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果________。
20.(10分)孔雀石主要含Cu2(OH)
( http: / / www.21cnjy.com )2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
请回答下列问题:
(1)溶液A中的金属离子有C
( http: / / www.21cnjy.com )u2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为__________(填代号),检验溶液A中Fe3+的最佳试剂为__________(填代号)。
a.KMnO4
b.(NH4)2S
c.H2O2
d.
KSCN
(2)由溶液C获得CuSO4·5H2O
( http: / / www.21cnjy.com ),需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是________________________________________________________________________。
(3)制备CaCO3时,应向CaCl2
( http: / / www.21cnjy.com )溶液中先加入(或先通入)________(填化学式)。若实验过程中有氨气逸出,应选用下列__________装置回收(填代号)。
(4)欲测定溶液A中Fe2+的浓度,需要
( http: / / www.21cnjy.com )用容量瓶配制某标准溶液,定容时视线应________________________________________________________________________,
直到____________________________________________________________________。
用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
答案
1.D 2.B 3.C 4.B 5.C 6.D 7.C 8.A 9.C 10.C
11.C 12.D 13.C 14.C 15.C
16.(1)100
mL容量瓶 胶头滴管
(2)活性炭 过滤
(3)溶液颜色的深浅与浓度的大小成正比
( http: / / www.21cnjy.com )
17.(1)将含氰化合物全部转化为CN-
(2)完全吸收HCN,防止气体放出
(3)防止倒吸 (4)偏高 (5)109.2
18.(1)②加入足量用稀硝酸酸化的硝酸银溶液,使沉淀完全
④用蒸馏水反复洗涤沉淀多次
(2)①烧杯、漏斗、铁架台(带铁圈)、玻璃棒、滤纸
②取最后一次洗涤少许洗涤液,向其中加入稀盐酸,若无沉淀或浑浊出现,证明沉淀已洗净
③A ④不符合
(3)乙;类似于中和滴定实验,定量测
( http: / / www.21cnjy.com )定实验都应重复测定2~3次,再计算出平均值,以排除偶然因素造成的实验误差,使实验误差保持在允许范围之内。所以,乙学生的方法更合理。
19.(1)①酸 大于25.10
②酚酞 ③24.60
(2)
(3)a.无影响 b.偏低 c.偏高
d.偏低
20.(1)c d
(2)冷却结晶 引流
(3)
NH3·H2O(或NH3) b
(4)平视凹液面(或平视刻度线) 凹液面的最低处与刻度线相切 酸式
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
