9.3 溶液的浓度 同步练习(含答案)
文档属性
| 名称 | 9.3 溶液的浓度 同步练习(含答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 375.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-04-06 00:00:00 | ||
图片预览

文档简介
课题3
溶液的浓度
一、选择题(每小题只有一个选项符合题意)
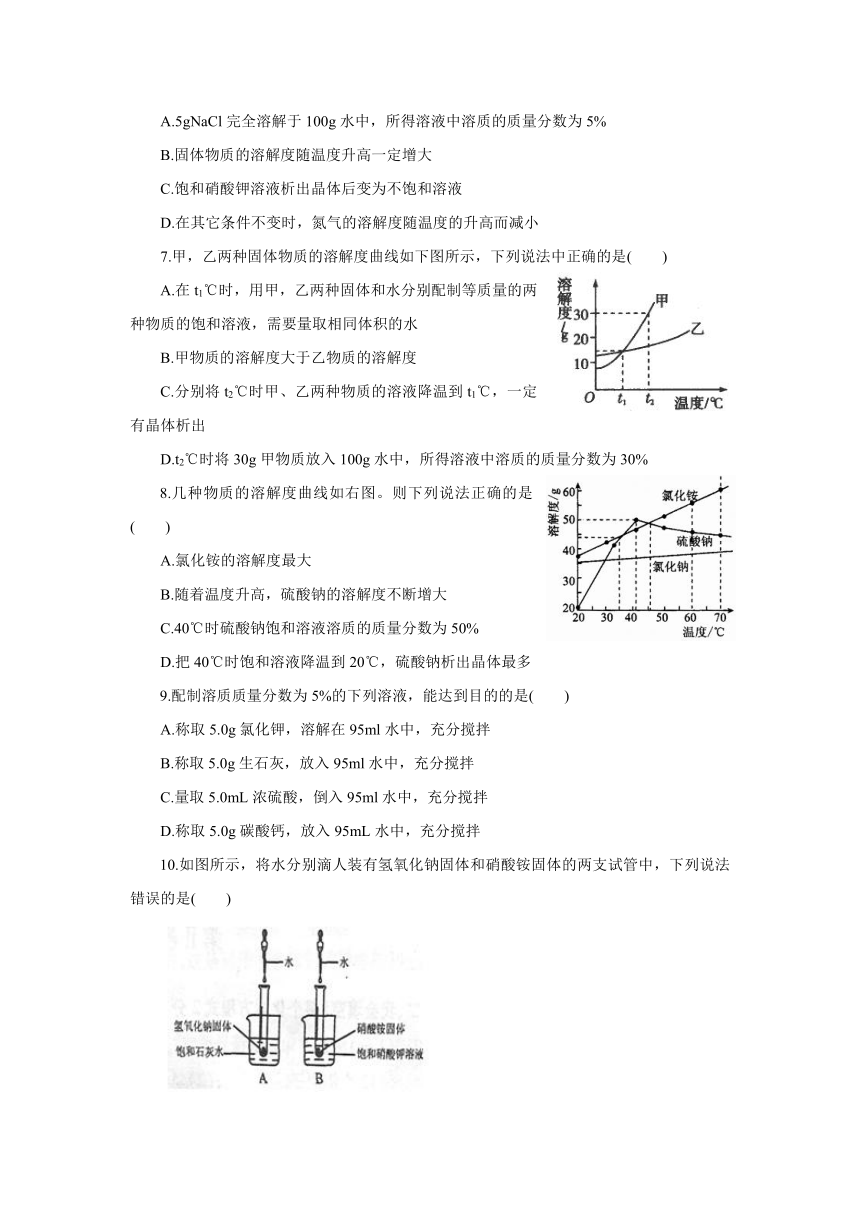
1.下列说法正确的是(
)
A.降低温度能使任何不饱和溶液转化为饱和溶液
B.升高温度或增大压强均可以增大气体在水中的溶解度
C.将200g质量分数为10%的氯化钠溶液稀释到5%,需要加水250g
D.在溶液中加入KNO3晶体和蒸发溶液中的水分这两种方法,都能把8%的KNO3溶液变成15%的KNO3溶液
2.用氯化钠固体配置一定质量分数的氯化钠溶液,不需要用的仪器是(
)
A.烧杯
B.量筒
C.托盘天平
D.蒸发皿
3.根据右图溶解度曲线,判断下列说法正确的是(
)
A.t1℃时,在甲的饱和溶液中加入甲,溶液的质量增大
B.t2℃时,甲、乙两溶液的质量分数一定相等
C.t3℃时,将甲、乙的饱和溶液都蒸发掉10g水,甲析出的晶体质量大
D.把t1℃时甲、乙的饱和溶液升温至t3℃时,两溶液的质量分数都会增大
4.在温度不变的条件下,下列欲使溶质的质量分数变为原来2倍的方法,最可行的是(
)
A.将20g硝酸钾饱和溶液蒸发掉10g水
B.将20g硝酸钾不饱和溶液蒸发掉10g水
C.在10g
10﹪的硝酸钾溶液中,加入5g
40﹪的硝酸钾溶液
D.将10g硝酸钾不饱和溶液中加入10g硝酸钾固体
5.右图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述错误的是(
)
A.t1℃时,甲、乙两种物质的溶解度都是50g
B.t2℃时,在两种饱和溶液中,溶质的质量甲一定大于乙
C.t2℃时,将甲的饱和溶液降温至t1℃,其溶质的质量分数减小
D.甲溶液中含有少量乙,可以用冷却热饱和溶液的方法提纯甲
6.溶液与生产、生活密切相关,下列有关溶液的说法正确的是(
)
A.5gNaCl完全溶解于100g水中,所得溶液中溶质的质量分数为5%
B.固体物质的溶解度随温度升高一定增大
C.饱和硝酸钾溶液析出晶体后变为不饱和溶液
D.在其它条件不变时,氮气的溶解度随温度的升高而减小
7.甲,乙两种固体物质的溶解度曲线如下图所示,下列说法中正确的是(
)
A.在t1℃时,用甲,乙两种固体和水分别配制等质量的两种物质的饱和溶液,需要量取相同体积的水
B.甲物质的溶解度大于乙物质的溶解度
C.分别将t2℃时甲、乙两种物质的溶液降温到t1℃,一定有晶体析出
D.t2℃时将30g甲物质放入100g水中,所得溶液中溶质的质量分数为30%
8.几种物质的溶解度曲线如右图。则下列说法正确的是(
)
A.氯化铵的溶解度最大
B.随着温度升高,硫酸钠的溶解度不断增大
C.40℃时硫酸钠饱和溶液溶质的质量分数为50%
D.把40℃时饱和溶液降温到20℃,硫酸钠析出晶体最多
9.配制溶质质量分数为5%的下列溶液,能达到目的的是(
)
A.称取5.0g氯化钾,溶解在95ml水中,充分搅拌
B.称取5.0g生石灰,放入95ml水中,充分搅拌
C.量取5.0mL浓硫酸,倒入95ml水中,充分搅拌
D.称取5.0g碳酸钙,放入95mL水中,充分搅拌
10.如图所示,将水分别滴人装有氢氧化钠固体和硝酸铵固体的两支试管中,下列说法错误的是(
)
A.硝酸铵固体溶解时会吸收热量
B.氢氧化钠固体溶解时会放出热量
C.A、B两只烧杯的溶液中都有固体析出
D.A、B两只烧杯中溶液的溶质质量分数都保持不变
二、填空题
11.右图为A、B、C三种物质的溶解度曲线,据图回答:
(1)t1℃时A、B、C三种物质的溶解度大小关系是_______________。
(2)a点的含义是_______________。
(3)t1℃时将A物质40g加入到50g水中充分搅拌,形成溶液的质量是_______________g。
(4)将t1℃时A、B、C三种物质饱和溶液的温度升高到t3℃,三种溶液的溶质质量分数大小关系是_______________。
12.请根据图中A、B两种固体物质的溶解度曲线,回答下列问题。
(l)在____℃时,A、B两种物质溶解度相同。
(2)t2℃时,100g水中溶解_________g
A物质恰好达到饱和,该饱和溶液中溶质的质量分数为_________,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水_________g。
(3)将t2℃时A、B两种物质的饱和溶液降温至t1℃(其它条件不变),溶质的质量分数保持不变的是__________。
13.向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示。
(1)烧杯中的溶液一定属于饱和溶液的是_________(填序号);
(2)图二能表示NaNO3溶解度曲线的是_________(填“甲”或“乙”);
(3)要使B烧杯中剩余固体继续溶解,可采用的方法是_________;
(4)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的_________(填序号)。
A.甲、乙都是饱和溶液
B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙
D.溶质质量分数:甲>乙
14.小华同学配制50g溶质质量分数为20%的NaCl溶液,操作流程如图:
(1)小华同学应称取氯化钠的质量是___________________。
(2)指出图中的一处错误:___________________。
(3)在用托盘天平称取食盐的过程中,发现指针已偏向分度盘左侧,他接下来的操作是______________________________________。
(4)在用量简量取水的过程巾,当液面接近刻度线时,他的操作如图所示,其中规范的是___________(填序号)。
(5)如果小华配制的氯化钠溶液的溶质质量分数小于20%,则造成此误差的可能原因有___________(填序号)。
A.称量前天平没有调平
B.称量纸上残留少量食盐
C.向烧杯中加水时,有少量水溅出烧杯外
三、计算题
15.为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,洋洋同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
第一次
第二次
第三次
第四次
加入稀盐酸质量(g)
10
10
10
10
剩余固体的质量(g)
9.10
8.45
7.80
7.80
(1)上述反应的化学方程式为________________________;
(2)根据锌的质量列出求解第二次生成氢气质量(x)的比例式________________;
(3)所用稀盐酸中溶质的质量分数为________________;
(4)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量为________________;
(5)黄铜样品中铜的质量分数为________________。
答案
1.D2.D3.C4.C5.B6.D7.A8.D9.A10.D
11.(1)A=B>C
(2)t
2℃时,A、C的溶解度相等
(3)70
(4)B>C>A
12.(1)t1 (2)25
20%
125 (3)B
13.(1)B
(2)甲
(3)加水(或升温)
(4)B、D
14.(1)10g
(2)瓶塞正放了
(3)在左盘上减少氯化钠,直至天枰平衡
(4)C
(5)AB
15.(1)Zn+2HCl=ZnCl2+H2↑
(2)65/2=0.65g/x
(3)7.3%
(4)8g
(5)80%
溶液的浓度
一、选择题(每小题只有一个选项符合题意)
1.下列说法正确的是(
)
A.降低温度能使任何不饱和溶液转化为饱和溶液
B.升高温度或增大压强均可以增大气体在水中的溶解度
C.将200g质量分数为10%的氯化钠溶液稀释到5%,需要加水250g
D.在溶液中加入KNO3晶体和蒸发溶液中的水分这两种方法,都能把8%的KNO3溶液变成15%的KNO3溶液
2.用氯化钠固体配置一定质量分数的氯化钠溶液,不需要用的仪器是(
)
A.烧杯
B.量筒
C.托盘天平
D.蒸发皿
3.根据右图溶解度曲线,判断下列说法正确的是(
)
A.t1℃时,在甲的饱和溶液中加入甲,溶液的质量增大
B.t2℃时,甲、乙两溶液的质量分数一定相等
C.t3℃时,将甲、乙的饱和溶液都蒸发掉10g水,甲析出的晶体质量大
D.把t1℃时甲、乙的饱和溶液升温至t3℃时,两溶液的质量分数都会增大
4.在温度不变的条件下,下列欲使溶质的质量分数变为原来2倍的方法,最可行的是(
)
A.将20g硝酸钾饱和溶液蒸发掉10g水
B.将20g硝酸钾不饱和溶液蒸发掉10g水
C.在10g
10﹪的硝酸钾溶液中,加入5g
40﹪的硝酸钾溶液
D.将10g硝酸钾不饱和溶液中加入10g硝酸钾固体
5.右图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述错误的是(
)
A.t1℃时,甲、乙两种物质的溶解度都是50g
B.t2℃时,在两种饱和溶液中,溶质的质量甲一定大于乙
C.t2℃时,将甲的饱和溶液降温至t1℃,其溶质的质量分数减小
D.甲溶液中含有少量乙,可以用冷却热饱和溶液的方法提纯甲
6.溶液与生产、生活密切相关,下列有关溶液的说法正确的是(
)
A.5gNaCl完全溶解于100g水中,所得溶液中溶质的质量分数为5%
B.固体物质的溶解度随温度升高一定增大
C.饱和硝酸钾溶液析出晶体后变为不饱和溶液
D.在其它条件不变时,氮气的溶解度随温度的升高而减小
7.甲,乙两种固体物质的溶解度曲线如下图所示,下列说法中正确的是(
)
A.在t1℃时,用甲,乙两种固体和水分别配制等质量的两种物质的饱和溶液,需要量取相同体积的水
B.甲物质的溶解度大于乙物质的溶解度
C.分别将t2℃时甲、乙两种物质的溶液降温到t1℃,一定有晶体析出
D.t2℃时将30g甲物质放入100g水中,所得溶液中溶质的质量分数为30%
8.几种物质的溶解度曲线如右图。则下列说法正确的是(
)
A.氯化铵的溶解度最大
B.随着温度升高,硫酸钠的溶解度不断增大
C.40℃时硫酸钠饱和溶液溶质的质量分数为50%
D.把40℃时饱和溶液降温到20℃,硫酸钠析出晶体最多
9.配制溶质质量分数为5%的下列溶液,能达到目的的是(
)
A.称取5.0g氯化钾,溶解在95ml水中,充分搅拌
B.称取5.0g生石灰,放入95ml水中,充分搅拌
C.量取5.0mL浓硫酸,倒入95ml水中,充分搅拌
D.称取5.0g碳酸钙,放入95mL水中,充分搅拌
10.如图所示,将水分别滴人装有氢氧化钠固体和硝酸铵固体的两支试管中,下列说法错误的是(
)
A.硝酸铵固体溶解时会吸收热量
B.氢氧化钠固体溶解时会放出热量
C.A、B两只烧杯的溶液中都有固体析出
D.A、B两只烧杯中溶液的溶质质量分数都保持不变
二、填空题
11.右图为A、B、C三种物质的溶解度曲线,据图回答:
(1)t1℃时A、B、C三种物质的溶解度大小关系是_______________。
(2)a点的含义是_______________。
(3)t1℃时将A物质40g加入到50g水中充分搅拌,形成溶液的质量是_______________g。
(4)将t1℃时A、B、C三种物质饱和溶液的温度升高到t3℃,三种溶液的溶质质量分数大小关系是_______________。
12.请根据图中A、B两种固体物质的溶解度曲线,回答下列问题。
(l)在____℃时,A、B两种物质溶解度相同。
(2)t2℃时,100g水中溶解_________g
A物质恰好达到饱和,该饱和溶液中溶质的质量分数为_________,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水_________g。
(3)将t2℃时A、B两种物质的饱和溶液降温至t1℃(其它条件不变),溶质的质量分数保持不变的是__________。
13.向装有等量水的A、B、C烧杯中分别加入10g、25g、25gNaNO3固体,充分溶解后,现象如图一所示。
(1)烧杯中的溶液一定属于饱和溶液的是_________(填序号);
(2)图二能表示NaNO3溶解度曲线的是_________(填“甲”或“乙”);
(3)要使B烧杯中剩余固体继续溶解,可采用的方法是_________;
(4)由图二分析,若分别将100g甲、乙的饱和溶液从t2℃降温到t1℃,对所得溶液的叙述正确的_________(填序号)。
A.甲、乙都是饱和溶液
B.所含溶剂质量:甲<乙
C.溶液质量:甲>乙
D.溶质质量分数:甲>乙
14.小华同学配制50g溶质质量分数为20%的NaCl溶液,操作流程如图:
(1)小华同学应称取氯化钠的质量是___________________。
(2)指出图中的一处错误:___________________。
(3)在用托盘天平称取食盐的过程中,发现指针已偏向分度盘左侧,他接下来的操作是______________________________________。
(4)在用量简量取水的过程巾,当液面接近刻度线时,他的操作如图所示,其中规范的是___________(填序号)。
(5)如果小华配制的氯化钠溶液的溶质质量分数小于20%,则造成此误差的可能原因有___________(填序号)。
A.称量前天平没有调平
B.称量纸上残留少量食盐
C.向烧杯中加水时,有少量水溅出烧杯外
三、计算题
15.为了测定某粉末状黄铜(铜、锌合金)样品中铜的质量分数,洋洋同学取一定质量的黄铜样品放入烧杯中,再取40g稀盐酸分四次加入烧杯中,均充分反应,实验数据如下:
第一次
第二次
第三次
第四次
加入稀盐酸质量(g)
10
10
10
10
剩余固体的质量(g)
9.10
8.45
7.80
7.80
(1)上述反应的化学方程式为________________________;
(2)根据锌的质量列出求解第二次生成氢气质量(x)的比例式________________;
(3)所用稀盐酸中溶质的质量分数为________________;
(4)用36.5%的浓盐酸配制40g上述稀盐酸,需要浓盐酸的质量为________________;
(5)黄铜样品中铜的质量分数为________________。
答案
1.D2.D3.C4.C5.B6.D7.A8.D9.A10.D
11.(1)A=B>C
(2)t
2℃时,A、C的溶解度相等
(3)70
(4)B>C>A
12.(1)t1 (2)25
20%
125 (3)B
13.(1)B
(2)甲
(3)加水(或升温)
(4)B、D
14.(1)10g
(2)瓶塞正放了
(3)在左盘上减少氯化钠,直至天枰平衡
(4)C
(5)AB
15.(1)Zn+2HCl=ZnCl2+H2↑
(2)65/2=0.65g/x
(3)7.3%
(4)8g
(5)80%
同课章节目录
