硫代硫酸钠与硫酸反应影响因素【课件】
图片预览









文档简介
课件31张PPT。硫代硫酸钠与酸
反应速率的影响因素衡量化学反应进行快慢的物理量。
通常以单位时间内反应物或生成物浓度的变化来表示。V=△C/△ t (mol·L-1·s-1)
平均速率任何化学反应都存在着化学反应速率决定因素:
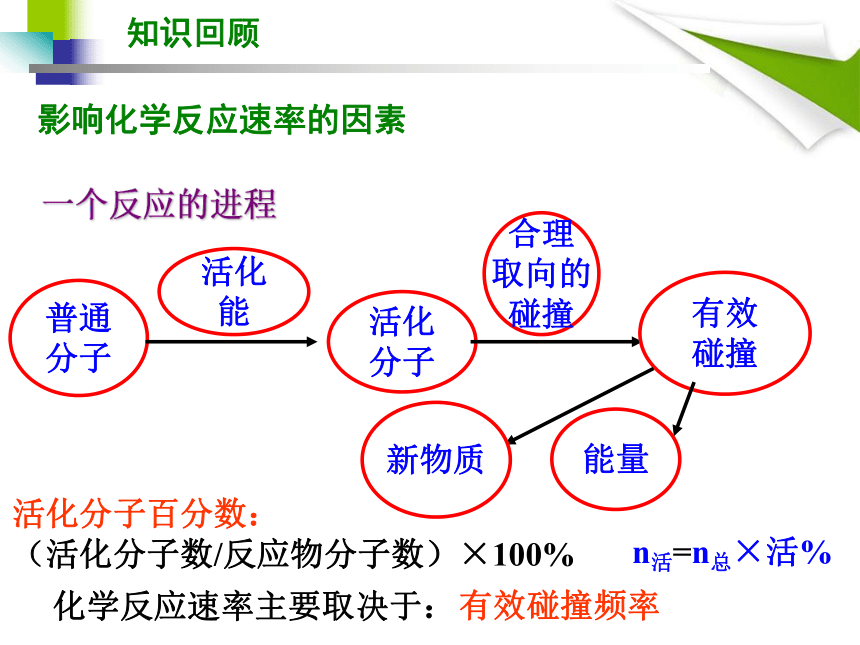
影响因素:反应物的性质(不同反应)温度、压强、浓度、催化剂等(同一反应)知识回顾化学反应速率n活=n总×活%活化分子百分数: (活化分子数/反应物分子数)×100%化学反应速率主要取决于:普通
分子活化
能活化
分子合理
取向的
碰撞有效
碰撞新物质能量有效碰撞频率知识回顾影响化学反应速率的因素一个反应的进程 硫代硫酸钠溶液与稀硫酸混合后会生成不溶于水的硫,使溶液出现浑浊,同时生成二氧化硫气体。
S2O32- + 2H+ = SO2 ↑ + S↓ + H2ONa2S2O3+H2SO4=SO2↑+ S↓+H2O+Na2SO4实验原理1、SO2的体积或压强
2、生成硫的质量
3、溶液浑浊出现的快慢
4、 Na2S2O3浓度的变化
5、 H+(pH)浓度的变化√提示:
能否同时研究浓度和温度两个变量?
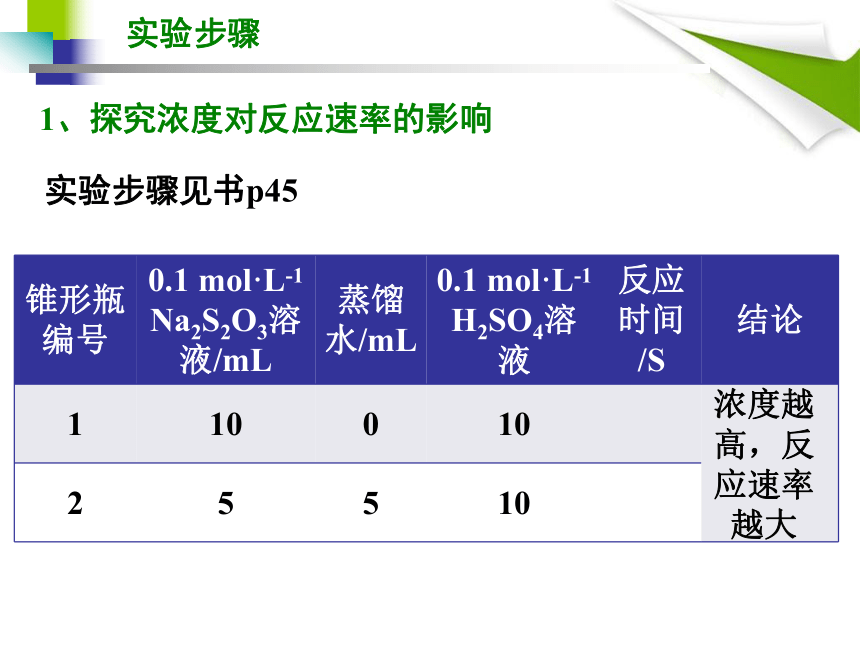
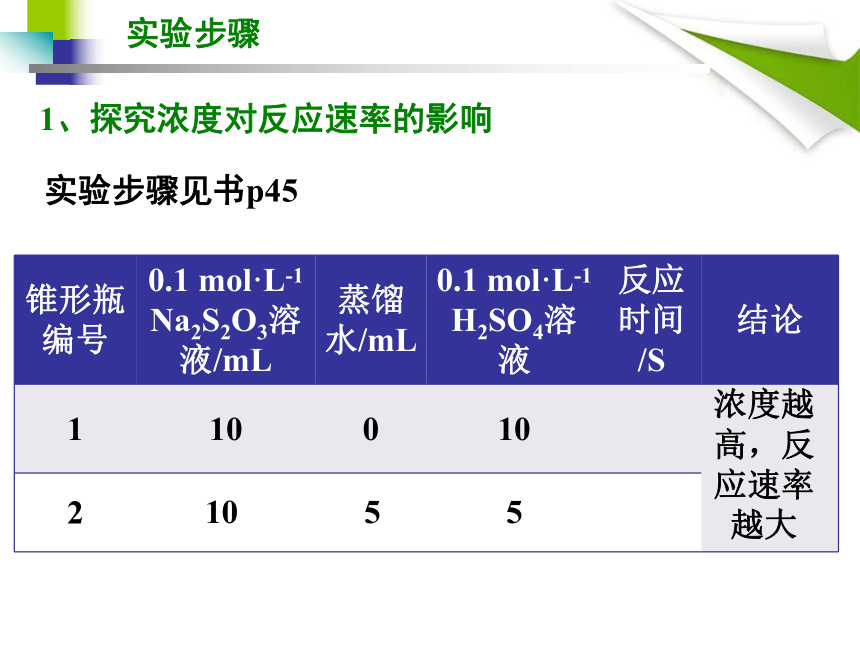
有无必要用V=△C/ △ t ,测出速率再比较?1.探究浓度和温度对该反应速率的影响,具体如何实施?2.实验中如何表征浑浊出现的快慢?实验原理思考在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即保证其他因素相同。 为了比较实验中溶液出现浑浊的快慢,可以先在一张白纸上用黑色记号笔在合适的位置画上粗细、深浅一致的“+”字,衬在反应容器(锥形瓶)的底部。实验以 Na2S2O3溶液与稀H2SO4两溶液相混合时开始计时,到溶液出现的浑浊将锥形瓶底部的“+”字完全遮盖时结束。通过比较记录的反应所需时间,可以判断反应速率的大小。溶液中出现浑浊的快慢来比较反应速率的大小。 实验原理实验步骤实验步骤见书p451、探究浓度对反应速率的影响浓度越高,反应速率越大实验步骤实验步骤见书p451、探究浓度对反应速率的影响10 5 5浓度越高,反应速率越大实验步骤实验步骤见书p45-461、探究温度对反应速率的影响温度越高,反应速率越大硫代硫酸钠的性质 单斜晶系白色结晶粉末,易溶于水。化学式:Na2S2O3 ,通常结合5个结晶水,即Na2S2O3·5H2O
俗名:大苏打 海波
用途:主要用于照相业作定影剂。 1、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A. 加热 B. 不用稀硫酸,改用98%浓硫酸
C. 增大稀硫酸的用量 D. 不用铁片,改用铁粉2、100ml 6mol/L H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A. Na2SO4(s) B. H2O
C. K2SO4溶液 D. (NH4)2SO4(s)?BCBC练习3.在下列过程中,需要加快化学反应速率的是( )
A.钢铁腐蚀 B.食物腐烂
C.工业炼钢 D.塑料老化
解析:选C。改变化学反应速率在实践中有很重要的意义,在实际生产和生活中,有的需要加快某些生产过程, 如加快炼钢过程,加速合成树脂等,有的需要减慢某些反应速率,如钢铁生锈、塑料和橡胶的老化等。练习4.下列不同条件下的化学反应A+B===C+D,反应速率由大到小的顺序正确的一组是( )
①常温下20 mL含A和B各0.001 mol的溶液;②常温下100 mL含A和B各0.01 mol的溶液;③常温下0.05 mol·L-1A和B溶液各10 mL,加到20 mL蒸馏水中;④常温下80 mL含A 0.01 mol的溶液和20 mL含B 0.005 mol的溶液。(注:不考虑液体混合时的体积变化)
A.①②③④ B.④③②①
C.②④①③ D.②①④③练习解析:选C。根据题意可知,其他条件相同,只有A、B的浓度不同。根据浓度对反应速率的影响,浓度越大,反应速率越快。将题目给出的A、B不同的量转化为物质的量浓度进行比较。①中A、B物质的量浓度均为0.05 mol·L-1;②中A、B物质的量浓度均为0.1 mol·L-1;③中A、B物质的量浓度均为0.0125 mol·L-1;④中A物质的量浓度为0.1 mol·L-1,B物质的量浓度为0.05 mol·L-1;即浓度大小顺序为②>④>①>③。为验证浓度对化学反应速率的影响,使用Na2S2O3和盐酸反应,通过观察产生浑浊的快慢来判断其反应速率的大小,反应原理为Na2S2O3+2HCl===2NaCl+S↓+SO2↑+H2O。
一同学在下午的活动课中,配制0.2 mol/L的盐酸置于大烧杯中,并取了3 mL 0.1 mol/L Na2S2O3溶液与3 mL该盐酸反应,产生明显的浑浊约需时间t s。由于时间另有安排,停止了实验。第二天又用了3 mL 0.2 mol/L Na2S2O3溶液与3 mL原盐酸反应,产生明显浑浊也需时间t s左右。于是他得出结论:浓度对该反应速率的影响不大。(1)请你评价该同学的这次实验________。
A.所得结论是可靠的
B.所得结论是不可靠的
C.其结论基本正确,但是有疑点
D.可能正确,也可能不正确
(2)一般说来,对比实验应控制相同的实验条件,具有良好的再现性。
①请你评价该同学的实验控制条件:
________________________________________________________________________。②请你评价他的实验现象的对比方法:________________________________________________________________________
________________________________________________________________________。
(3)若他的对比方法不好,请你给出合理的对比方法(若他的对比方法可行,此问可不答)。【解析】 当验证某一条件对化学反应速率的影响时,应在其他条件不变的情况下进行。该同学的实验中存在许多问题:
①将配制好的0.2 mol/L的盐酸在大烧杯中放置了较长的时间,其浓度会发生变化。
②两次对比实验分别在两天进行,这样,外界条件可能不同(如温度)。
③实验时,对实验现象的观察,没有明确的对比标准,“明显浑浊”缺乏标准,无法保证两天的实验标准基本一致,故该同学得出的结论是不可靠的。由于上述原因,显然该同学的控制条件是不好的。【答案】 (1)B
(2)①该同学的实验控制条件是不好的 ②其实验现象的对比方法中,“明显浑浊”缺乏统一标准,不能进行严密对比
(3)在对两次实验进行对比时,可在进行实验的两支试管的侧面或两个烧杯的底部贴上同一大小标准的“十”字,并分别记下“十”字看不见时所需的时间。变式训练1 结合以下表中信息,回答有关问题。(1)实验比较法是人们研究各类问题常用的方法,但在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件。上述表中可以比较的组合有________________________________________
________________________________。(2)上述反应的离子方程式为________________________________________________________________________。
(3)上述反应速率最快的是________,最慢的是______。
(4)判断上述反应速率快慢的实验现象可以是
________________________________________________________________________。解析:实验比较法在比较某一因素对实验产生的影响时,必须是在其它条件不变的情况下进行,不难看出A和B、B和C、C和D符合。下表是稀硫酸与某金属反应的实验数据:分析上述数据,回答下列问题:
(1)实验4和5表明,______________对反应速率有影响,______________,反应速率越快,能表明同一规律的实验还有________(填实验序号)。
(2)仅表明反应物浓度对反应速率产生影响的实验有______________(填实验序号)。
(3)本实验中影响反应速率的其他因素还有________,其实验序号是________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:________________________________________________________________________。【解析】 比较表中实验1和2、实验4和5,其他条件都一样,只是金属状态由丝变成了粉末,金属消失的时间就少了很多,反应速率变快很多,也就是说明金属固体的表面积越大,反应速率就越快。同理,比较表中各项数据进行分析不难得出正确答案。
【答案】 (1)固体反应物的表面积 表面积越大 1和2
(2)3和4
(3)反应前溶液温度 6和7
(4)一定量的金属跟足量的硫酸反应放出的热量相同变式训练2 某探究小组同学用金属铝分别与稀盐酸和稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素。
实验药品:2.0 mol/L盐酸、4.0 mol/L盐酸、2.0 mol/L硫酸、4.0 mol/L硫酸,相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0 mL,金属用量均为9.0 g。甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:请回答:
(1)写出铝与盐酸反应的离子方程式______________。
(2)反应1 min~15 min内,铝与盐酸的反应速率逐渐加快,其原因是________________________________________________________________________。
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出一种即可)_________________
___________________________。(4)乙同学设计了如下影响反应速率因素的实验。请你根据实验目的帮助该同学完成以下实验设计表。
通常以单位时间内反应物或生成物浓度的变化来表示。V=△C/△ t (mol·L-1·s-1)
平均速率任何化学反应都存在着化学反应速率决定因素:
影响因素:反应物的性质(不同反应)温度、压强、浓度、催化剂等(同一反应)知识回顾化学反应速率n活=n总×活%活化分子百分数: (活化分子数/反应物分子数)×100%化学反应速率主要取决于:普通
分子活化
能活化
分子合理
取向的
碰撞有效
碰撞新物质能量有效碰撞频率知识回顾影响化学反应速率的因素一个反应的进程 硫代硫酸钠溶液与稀硫酸混合后会生成不溶于水的硫,使溶液出现浑浊,同时生成二氧化硫气体。
S2O32- + 2H+ = SO2 ↑ + S↓ + H2ONa2S2O3+H2SO4=SO2↑+ S↓+H2O+Na2SO4实验原理1、SO2的体积或压强
2、生成硫的质量
3、溶液浑浊出现的快慢
4、 Na2S2O3浓度的变化
5、 H+(pH)浓度的变化√提示:
能否同时研究浓度和温度两个变量?
有无必要用V=△C/ △ t ,测出速率再比较?1.探究浓度和温度对该反应速率的影响,具体如何实施?2.实验中如何表征浑浊出现的快慢?实验原理思考在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即保证其他因素相同。 为了比较实验中溶液出现浑浊的快慢,可以先在一张白纸上用黑色记号笔在合适的位置画上粗细、深浅一致的“+”字,衬在反应容器(锥形瓶)的底部。实验以 Na2S2O3溶液与稀H2SO4两溶液相混合时开始计时,到溶液出现的浑浊将锥形瓶底部的“+”字完全遮盖时结束。通过比较记录的反应所需时间,可以判断反应速率的大小。溶液中出现浑浊的快慢来比较反应速率的大小。 实验原理实验步骤实验步骤见书p451、探究浓度对反应速率的影响浓度越高,反应速率越大实验步骤实验步骤见书p451、探究浓度对反应速率的影响10 5 5浓度越高,反应速率越大实验步骤实验步骤见书p45-461、探究温度对反应速率的影响温度越高,反应速率越大硫代硫酸钠的性质 单斜晶系白色结晶粉末,易溶于水。化学式:Na2S2O3 ,通常结合5个结晶水,即Na2S2O3·5H2O
俗名:大苏打 海波
用途:主要用于照相业作定影剂。 1、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A. 加热 B. 不用稀硫酸,改用98%浓硫酸
C. 增大稀硫酸的用量 D. 不用铁片,改用铁粉2、100ml 6mol/L H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A. Na2SO4(s) B. H2O
C. K2SO4溶液 D. (NH4)2SO4(s)?BCBC练习3.在下列过程中,需要加快化学反应速率的是( )
A.钢铁腐蚀 B.食物腐烂
C.工业炼钢 D.塑料老化
解析:选C。改变化学反应速率在实践中有很重要的意义,在实际生产和生活中,有的需要加快某些生产过程, 如加快炼钢过程,加速合成树脂等,有的需要减慢某些反应速率,如钢铁生锈、塑料和橡胶的老化等。练习4.下列不同条件下的化学反应A+B===C+D,反应速率由大到小的顺序正确的一组是( )
①常温下20 mL含A和B各0.001 mol的溶液;②常温下100 mL含A和B各0.01 mol的溶液;③常温下0.05 mol·L-1A和B溶液各10 mL,加到20 mL蒸馏水中;④常温下80 mL含A 0.01 mol的溶液和20 mL含B 0.005 mol的溶液。(注:不考虑液体混合时的体积变化)
A.①②③④ B.④③②①
C.②④①③ D.②①④③练习解析:选C。根据题意可知,其他条件相同,只有A、B的浓度不同。根据浓度对反应速率的影响,浓度越大,反应速率越快。将题目给出的A、B不同的量转化为物质的量浓度进行比较。①中A、B物质的量浓度均为0.05 mol·L-1;②中A、B物质的量浓度均为0.1 mol·L-1;③中A、B物质的量浓度均为0.0125 mol·L-1;④中A物质的量浓度为0.1 mol·L-1,B物质的量浓度为0.05 mol·L-1;即浓度大小顺序为②>④>①>③。为验证浓度对化学反应速率的影响,使用Na2S2O3和盐酸反应,通过观察产生浑浊的快慢来判断其反应速率的大小,反应原理为Na2S2O3+2HCl===2NaCl+S↓+SO2↑+H2O。
一同学在下午的活动课中,配制0.2 mol/L的盐酸置于大烧杯中,并取了3 mL 0.1 mol/L Na2S2O3溶液与3 mL该盐酸反应,产生明显的浑浊约需时间t s。由于时间另有安排,停止了实验。第二天又用了3 mL 0.2 mol/L Na2S2O3溶液与3 mL原盐酸反应,产生明显浑浊也需时间t s左右。于是他得出结论:浓度对该反应速率的影响不大。(1)请你评价该同学的这次实验________。
A.所得结论是可靠的
B.所得结论是不可靠的
C.其结论基本正确,但是有疑点
D.可能正确,也可能不正确
(2)一般说来,对比实验应控制相同的实验条件,具有良好的再现性。
①请你评价该同学的实验控制条件:
________________________________________________________________________。②请你评价他的实验现象的对比方法:________________________________________________________________________
________________________________________________________________________。
(3)若他的对比方法不好,请你给出合理的对比方法(若他的对比方法可行,此问可不答)。【解析】 当验证某一条件对化学反应速率的影响时,应在其他条件不变的情况下进行。该同学的实验中存在许多问题:
①将配制好的0.2 mol/L的盐酸在大烧杯中放置了较长的时间,其浓度会发生变化。
②两次对比实验分别在两天进行,这样,外界条件可能不同(如温度)。
③实验时,对实验现象的观察,没有明确的对比标准,“明显浑浊”缺乏标准,无法保证两天的实验标准基本一致,故该同学得出的结论是不可靠的。由于上述原因,显然该同学的控制条件是不好的。【答案】 (1)B
(2)①该同学的实验控制条件是不好的 ②其实验现象的对比方法中,“明显浑浊”缺乏统一标准,不能进行严密对比
(3)在对两次实验进行对比时,可在进行实验的两支试管的侧面或两个烧杯的底部贴上同一大小标准的“十”字,并分别记下“十”字看不见时所需的时间。变式训练1 结合以下表中信息,回答有关问题。(1)实验比较法是人们研究各类问题常用的方法,但在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件。上述表中可以比较的组合有________________________________________
________________________________。(2)上述反应的离子方程式为________________________________________________________________________。
(3)上述反应速率最快的是________,最慢的是______。
(4)判断上述反应速率快慢的实验现象可以是
________________________________________________________________________。解析:实验比较法在比较某一因素对实验产生的影响时,必须是在其它条件不变的情况下进行,不难看出A和B、B和C、C和D符合。下表是稀硫酸与某金属反应的实验数据:分析上述数据,回答下列问题:
(1)实验4和5表明,______________对反应速率有影响,______________,反应速率越快,能表明同一规律的实验还有________(填实验序号)。
(2)仅表明反应物浓度对反应速率产生影响的实验有______________(填实验序号)。
(3)本实验中影响反应速率的其他因素还有________,其实验序号是________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:________________________________________________________________________。【解析】 比较表中实验1和2、实验4和5,其他条件都一样,只是金属状态由丝变成了粉末,金属消失的时间就少了很多,反应速率变快很多,也就是说明金属固体的表面积越大,反应速率就越快。同理,比较表中各项数据进行分析不难得出正确答案。
【答案】 (1)固体反应物的表面积 表面积越大 1和2
(2)3和4
(3)反应前溶液温度 6和7
(4)一定量的金属跟足量的硫酸反应放出的热量相同变式训练2 某探究小组同学用金属铝分别与稀盐酸和稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素。
实验药品:2.0 mol/L盐酸、4.0 mol/L盐酸、2.0 mol/L硫酸、4.0 mol/L硫酸,相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0 mL,金属用量均为9.0 g。甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:请回答:
(1)写出铝与盐酸反应的离子方程式______________。
(2)反应1 min~15 min内,铝与盐酸的反应速率逐渐加快,其原因是________________________________________________________________________。
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出一种即可)_________________
___________________________。(4)乙同学设计了如下影响反应速率因素的实验。请你根据实验目的帮助该同学完成以下实验设计表。
同课章节目录
- 专题一 物质的分离与提纯
- 课题1 海带中碘元素的分离及检验
- 拓展课题1-1 茶叶中某些元素的鉴定
- 课题2 用纸层析法分离铁离子和铜离子
- 拓展课题1-2 菠菜的叶绿体中色素的提取和分离
- 拓展课题1-3 用粉笔进行层析分离
- 课题3 硝酸钾晶体的制备
- 拓展课题1-4 粗盐提纯
- 专题二 物质性质的研究
- 课题1 铝及其化合物的性质
- 拓展课题2-1 铝热反应
- 课题2 乙醇和苯酚的性质
- 拓展课题2-2 苯酚与甲醛的反应
- 专题三 物质的检验与鉴别
- 课题1 牙膏和火柴中某些成分的检验
- 拓展课题3-1 新装修居室内空气中甲醛浓度的检测
- 拓展课题3-2 汽车尾气成分的检验
- 课题2 亚硝酸钠和食盐的鉴别
- 拓展课题3-3 真假碘盐的鉴别
- 专题四 化学反应条件的控制
- 课题1 硫代硫酸钠与酸反应速率的影响因素
- 拓展课题4-1 “蓝瓶子”实验
- 课题2 催化剂对过氧化氢分解反应速率的影响
- 拓展课题4-2 过氧化氢酶的催化作用
- 拓展课题4-3 蔗糖的燃烧
- 课题3 反应条件对化学平衡的影响
- 拓展课题4-4 淀粉与碘显色现象的探究
- 拓展课题4-5 压强对化学平衡的影响
- 专题五 电化学问题研究
- 课题1 原电池
- 拓展课题5-1 干电池模拟实验
- 课题2 电解与电镀
- 拓展课题5-2 阿伏加德罗常数的测定
- 专题六 物质的定量分析
- 课题1 食醋总酸含量的测定
- 拓展课题6-1 配制并标定氢氧化钠溶液
- 课题2 镀锌铁皮锌镀层厚度的测定
- 拓展课题6-2 水果中维生素C含量的测定
- 专题七 物质的制备与合成
- 课题1 硫酸亚铁铵的制备
- 拓展课题7-1 用制氢废液制备硫酸锌晶体
- 课题2 阿司匹林的合成
- 拓展课题7-2 对氨基苯磺酸的合成
